人参茎叶提取物对刺参生长、免疫及抗病力的影响
2015-03-01陈永亮杨先乐曹海鹏
郭 珺 俞 军 陈永亮 杨先乐 胡 鲲 曹海鹏
(上海海洋大学, 上海 201306)
人参茎叶提取物对刺参生长、免疫及抗病力的影响
郭 珺 俞 军 陈永亮 杨先乐 胡 鲲 曹海鹏
(上海海洋大学, 上海 201306)
以初始体重为(4.91±0.17) g的刺参(Apostichopus japonicas)为研究对象, 研究投喂不同剂量人参茎叶提取物对刺参生长、免疫及抗病力的影响, 探讨人参茎叶提取物在刺参养殖中的应用。在每千克基础饲料中分别添加10、20、40和80 g人参茎叶提取物作为实验组, 并以基础饲料为对照进行为期30d的饲喂养殖。结果显示, 投喂人参茎叶提取物对刺参的生长并无显著影响, 刺参特定生长率不随人参茎叶提取物添加量的增加而提高。当人参茎叶提取物添加量为80 g/kg时, 刺参体腔细胞总数、呼吸暴发强度、细胞吞噬活性、超氧化物歧化酶活力、总一氧化氮合酶活力均显著高于对照组(P<0.05); 当人参茎叶提取物添加量为40 g/kg 时, 细胞吞噬活性也显著高于对照组(P<0.05), 但其余免疫指标与对照组相比无显著差异(P>0.05); 当人参茎叶提取物的添加量不大于20 g/kg时, 各项免疫指标与对照组之间均无显著差异(P>0.05)。攻毒实验表明, 20、40和80 g/kg人参茎叶提取物组的健康率要高于对照组, 其中80 g/kg人参茎叶提取物组健康率为80.56%要显著高于对照组和10 g/kg人参茎叶提取物组(P<0.05)。人参茎叶提取物可作为免疫增强剂应用于刺参的养殖中来提高刺参的免疫和抗病能力。
刺参; 人参茎叶提取物; 生长; 免疫; 抗病
全世界约有1200多种海参[1], 而能够为人类食用的大约40种。海参含有丰富的蛋白质, 较低的脂肪和糖含量[2], 同时还具有钙、镁、铁、锌、硒、锰等微量元素[3]。现代医学研究表明, 海参含有多种生物活性成分: 海参神经节苷脂具有协同神经生长因子(NGF)的作用从而诱发神经轴突生长[4], 从而为治疗老年痴呆等神经退化病提供了可能; 从海参中分离得到的不同海参皂苷分别具有抑制肿瘤细胞生长、抗菌、调节机体免疫、促进骨髓红细胞生长等作用[5—9]; 此外, 海参多糖有着抑制血管栓塞、治疗慢性肝炎等特殊功效[10, 11]。在我国, 人们常说的海参通常指北方环渤海域的刺参(Apostichopus japonicas), 是所有海参中品质最好的。
我国刺参养殖业在20世纪90年代得到快速发展, 各种病害问题也日益严重, 其中以腐皮综合症(又称皮肤溃烂病、化皮病)危害最大, 造成了重大的经济损失, 严重制约刺参产业的持续健康发展[12]。传统抗生素和化学消毒剂的应用虽然能起到防治病害的作用, 但同时也会带来药残和耐药性等问题。中草药是天然药物, 具有毒性低、易降解、安全环保等特点, 王印庚等[13]发现穿心莲、大青叶、金银花和川芎4种中草药对海参腐皮综合症4种重要病原菌灿烂弧菌、假交替单胞菌、哈维氏弧菌和恶臭假单胞菌有较好的抑菌效果; 侯文久等[14]发现诃子、五倍子、牡丹皮、石榴皮等8种草药对海参腐皮综合症病原菌黄海希瓦氏菌有较好的抑菌活性。
人参(Panax ginseng C.A.Mey.)是一种名贵的药用植物, 自古以来都有“百草之王”的美誉, 是闻名遐迩的“东北三宝”之一。研究表明人参具有提高哺乳动物机体免疫、增强机体适应性、调节内分泌和抗肿瘤等效果[15—17]。人参的药用价值主要体现在其根中, 需6、7年才能收获取得, 而茎叶中其有效成分较少[18], 但也含有皂苷类、黄酮类、有机酸类、多糖类等多种化学有效成分[19, 20], 每年均可采摘价格也有很大优势, 因此同样具有较好的药用价值。许多研究表明人参茎叶中所含有的药用有效成分可通过某种方法提取分离出来, 使得人参的价值可以得到最大的利用[19—22]。人参茎叶的有效成分本对水产动物、低等动物的影响暂无报道, 但对畜禽、哺乳动物的影响有相关研究。目前在水产中还没有关于人参茎叶应用的报道, 本实验通过不同剂量的人参茎叶提取物与饲料预混投喂, 以探讨不同剂量人参茎叶提取物对刺参生长、免疫及抗病的影响, 为刺参新型中草药免疫增强剂的研究和临床应用提供依据。
1 材料与方法
1.1 实验材料
实验刺参购于辽宁大连獐子岛集团有限公司,初始重量(4.91±0.17) g。人参茎叶提取物由北京中农劲腾生物技术有限公司提供。实验基础饲料的配方见表1。将人参茎叶提取物干燥并碾磨成粉状, 然后在每千克基础饲料中分别添加10、20、40和80 g, 对照组不添加, 将实验饲料混合均匀100目过筛, 30℃风干并储存于–20℃冰箱备用。
1.2 养殖实验
养殖实验分 4个实验组和1个对照组, 每组 3个重复, 分别饲养在 120 L容量的塑料桶中, 每个塑料桶加水量为 100 L, 并投入两张聚乙烯网片供刺参栖息和摄食, 每个水桶放20只刺参。正式实验前, 对刺参进行暂养, 投喂基础饲料, 使刺参逐渐适应新的环境。实验前饥饿刺参24h, 并称重记录。实验期间溶氧≥6 mg/L, 盐度 28‰—32‰, pH 8.0±0.3, 每天早上全量换水并吸除粪便及残饵, 新水为经砂石过滤的新鲜海水, 每天投喂一次实验饲料, 投喂量为刺参体重的5%, 养殖周期为30d。
1.3 样品的采集与处理
在养殖实验结束后, 每桶随机选取 5只刺参, 用 1 mL无菌注射器分别于各刺参体腔中抽取等量体腔液并混合均匀, 取 300 μL体腔液与抗凝剂(0.02 mol/L EGTA, 0.48 mol/L NaCl, 0.019 mol/L KCl, 0.068 mol/L Tris-HCl, pH 7.6)[23]按体积比为 1∶1混匀制成抗凝体腔液, 用于总细胞计数、吞噬活性和呼吸暴发的测定; 700 μL体腔液经离心 10min (3000×g, 4℃), 上清液即无细胞体腔液, 用于体液溶菌酶、酚氧化酶、超氧化物歧化酶、过氧化氢酶、酸性磷酸酶、总一氧化氮合酶活性的测定。若不能及时测定将待测样本于–80℃下保存, 测定时需将在–80℃保存的样本先转移到冰块中解冻, 再用于其他免疫指标的测定。

表1 基础饲料配方及营养组成(干物质基础)Tab. 1 The nutritional composition of the dry matter in the basal diet
1.4 测定方法
特定生长率 在养殖实验结束后, 对刺参饥饿24h后计数并称重, 计算特定生长率。

Wt为刺参终末体重, W0为刺参初始体重, t为养殖实验的天数。
体腔总细胞计数 体腔液总细胞计数采用血球计数板, 在 40×10倍光学显微镜下稀释一倍后直接计数, 计算出每毫升体腔液中体腔细胞数目。
细胞吞噬活性测定 吞噬活性的测定采用中性红法[24, 25]。结果用全波长酶标仪在540 nm波长处测吸光值, 以试验条件下每 106个体腔细胞对应的吸光值来表示吞噬活性。
细胞呼吸暴发活力(O2–)测定 超氧阴离子(O2–)的测定采用四氮唑蓝测定法[26]。以KOH/DMSO作为空白对照, 利用酶标仪于波长630 nm处测定吸光值A630, 其定义为在试验条件下每l06个体腔细胞对应的吸光度值。
溶菌酶活性测定 溶菌酶活力通过浊度比色法测定[27, 28]。反应底物为用磷酸缓冲液 PBS (0.05 mol/L、pH=6.2)配制的0.2 mg/mL溶壁微球菌粉(Sigma)悬液。100 μL无细胞体腔液与1.9 mL菌悬液混合, 在25℃下反应。在530 nm波长下, 分别在0.5min和4.5min测定吸光值(OD)。以每毫升反应液每分钟使含菌酶液吸光值减少 0.001定义为一个酶活力单位(U/mL)。
酚氧化酶活性测定 酚氧化酶的测定使用左旋多巴(L-DOPA)作为底物, 与酚氧化酶反应后以光密度来检测酚氧化酶活性[29]。取50 μL无细胞体腔液、50 μL磷酸缓冲液PBS (0.1 mol/L, pH 6.0) 和100 μL左旋多巴(L-DOPA, 0.01 mol/L)加入到96孔板中, 于 25℃下反应 10min, 立即放入酶标仪, 在490 nm处进行吸光度测定, 每分钟测定一次吸光度,连续测定10min, 以试验条件下每毫升体腔液每分钟吸光度值每增加0.001定义为一个酶活力单位(U/mL)。
超氧化物歧化酶(SOD)的活性测定 超氧化物歧化酶(SOD)的活性测定是根据羟胺法来测定。SOD能通过抑制黄嘌呤与黄嘌呤氧化酶反应体系中产生的超氧阴离子自由基来判断, 产生的超氧阴离子自由基可与其他物质颜色反应, 可以通过光密度来测定[30], 采用 SOD检测试剂盒(南京建成生物工程研究所)和 96孔板检测, 结果使用酶标仪在550 nm处测吸光值。以每毫升体腔液中每分钟抑制率达50%的酶量定义为一个活力单位(U/mL)。具体表示为每毫升体腔液中SOD的活力单位。
过氧化氢酶(CAT)的活性测定 过氧化氢酶的活性测定采用钼酸铵比色法[31, 32]。CAT可催化H2O2释放出氧气, 迅速加入钼酸铵可终止反应, 而多余的 H2O2与钼酸铵作用生产黄色络合物, 其在410 nm处有最大吸收峰, 因此可以通过钼酸铵比色法来测定过氧化氢酶的活性。采用CAT检测试剂盒(南京建成生物工程研究所)和96孔板测定, 以每毫升体腔液每秒分解1 μmol H2O2的量为一个活力单位(U/mL)。
酸性磷酸酶(ACP)活性测定 酸性磷酸酶(ACP)的测定采用磷酸苯二钠法, ACP在酸性条件下可以分解磷酸苯二钠产生游离酚和磷酸, 产生的酚与 4-氨基安替吡啉以及铁氰化钾反应生成红色醌衍生物, 利用光密度法在520 nm处测吸光值来确定酶活。采用酸性磷酸酶检测试剂盒(南京建成生物工程研究所)和 96孔板进行检测, 依据试剂盒的操作手册要求进行实验。酶活定义为37℃时, 每100 mL体腔液在30min内产生1 mg硝基酚为l个酶活单位(U/100mL)。
总一氧化氮合酶(T-NOS)活性测定 一氧化氮合酶(NOS)可以催化L-精氨酸生产一氧化氮(NO),一氧化氮(NO)再被氧化成亚硝酸盐(NO2–)和硝酸盐(NO3–), 硝酸盐(NO3–)在硝酸还原酶的作用下生产亚硝酸盐(NO2–), 通过加入 Griess试剂将所有的亚硝酸盐(NO2–)转变成有色化合物, 可以通过530 nm处的吸光值来确定酶活[33, 34]。采用一氧化氮合酶检测试剂盒(南京建成生物工程研究所)和96孔板测定,酶活定义为在试验条件下每毫升体腔液每min生成1 μmol NO 为1个酶活性单位(U/mL)
1.5 攻毒实验
攻毒实验使用病原菌灿烂弧菌, 方法参照 Liu[35]和孙永欣等[36]的方法。做适当修改。在养殖实验结束后, 每个实验桶随机选取12只刺参放入20 L含灿烂弧菌(107cells/mL)的海水中不间断充气养殖 7d,攻毒实验期间不进行投喂。观察刺参的发病情况,并对刺参的健康率(刺参中未出现发病症状和死亡的比例)进行统计。发病表现为体壁溃烂和肿嘴, 体壁溃烂症状为出现白蓝色溃疡表面, 并伴有大量黏液; 肿嘴症状表现为嘴部肌肉呈透明松弛状, 并无法闭合[37]。
1.6 统计分析
数据结果采用SPSS 19.0软件进行单因素方差分析(ANOVA)以及邓肯(Duncan)多重比较, 当P<0.05时结果存在显著差异。
2 结果
2.1 人参茎叶提取物对刺参特定生长率的影响
与对照组(0 g/kg)相比, 基础饲料中加入人参茎叶提取物能不同程度地促进刺参的生长。数据表明刺参特定生长率的提高与人参茎叶提取物的添加量不成正比, 特定生长率最低的为对照组的 0.66%,最高为40 g/kg人参茎叶提取物添加组的0.88%, 但各添加组与对照组之间均无显著性差异(P>0.05)(表2)。
2.2 人参茎叶提取物对刺参体腔总细胞数、细胞吞噬、呼吸暴发的影响
与对照组(0 g/kg)相比, 在基础饲料中添加高剂量的人参茎叶提取物时, 对刺参体腔总细胞数、细胞吞噬活性和呼吸暴发强度有增强作用。其中80 g/kg人参茎叶提取物添加组刺参的体腔细胞总数、呼吸暴发强度都显著高于对照组(P<0.05), 细胞吞噬活性显著高于对照组和其余人参茎叶提取物添加组(P<0.05); 40 g/kg人参茎叶提取物添加组的细胞吞噬活性要显著高于 20 g/kg人参茎叶提取物添加组、10 g/kg人参茎叶提取物添加组和对照组(P<0.05), 体腔细胞总数和呼吸暴发强度相比对照组有不同程度提高, 但无显著差异(P>0.05); 20 g/kg人参茎叶提取物添加组与 10 g/kg人参茎叶提取物添加组的体腔细胞总数、细胞吞噬活性和呼吸暴发强度与对照组相比均无显著差异(P>0.05)(表3)。
2.3 人参茎叶提取物对刺参体液免疫指标的影响
与对照组(0 g/kg)相比, 人参茎叶提取物高剂量添加组均能不同程度提高刺参体液免疫指标各酶活力, 而人参茎叶提取物中低剂量组引起刺参部分体液免疫指标的降低。其中, 80 g/kg人参茎叶提取物添加组刺参的超氧化物歧化酶活力、总一氧化氮合酶的活力都显著高于对照组及其余各添加组(P<0.05), 酚氧化酶活力和过氧化氢酶活力显著高于10 g/kg人参茎叶提取物组(P<0.05)但与其余各组无显著差异(P>0.05); 40 g/kg人参茎叶提取物添加组与对照组相比, 各体液免疫指标均有提高, 但均无显著差异(P>0.05); 20 g/kg人参茎叶提取物添加组和 10 g/kg人参茎叶提取物添加组的部分体液免疫指标要低于对照组, 但无显著差异(P>0.05); 在本实验条件下, 对照组与其余人参茎叶提取物不同剂量添加组在溶菌酶和酸性磷酸酶活力上无显著差异(P>0.05)。
2.4 攻毒实验
人工感染刺参腐皮综合症病原菌-灿烂弧菌 7d,刺参的健康率随人参茎叶提取物添加量增加而提高。80 g/kg人参茎叶提取物添加组在为期7d的感染试验后的健康率为 80.56%, 要显著高于对照组(0 g/kg)的58.33%和10 g/kg人参茎叶提取物添加组的55.56%(P<0.05), 但与20 g/kg人参茎叶提取物添加组(66.67%)和 40 g/kg人参茎叶提取物添加组(69.44%)无显著差异(P>0.05); 40 g/kg人参茎叶提取物添加组和 20 g/kg人参茎叶提取物添加组刺参经7d感染试验后的健康率不同程度高于对照组和10 g/kg人参茎叶提取物添加组, 但与其余各组均无显著差异(P>0.05)(图1)。

表2 人参茎叶提取物对刺参特定生长率的影响(平均值±标准误, n=3)Tab. 2 Effects of the extracts from the stem and leaf of ginseng on the specific growth rate of Apostichopus japonicus (SGR, %/d, means± SE, n=3)
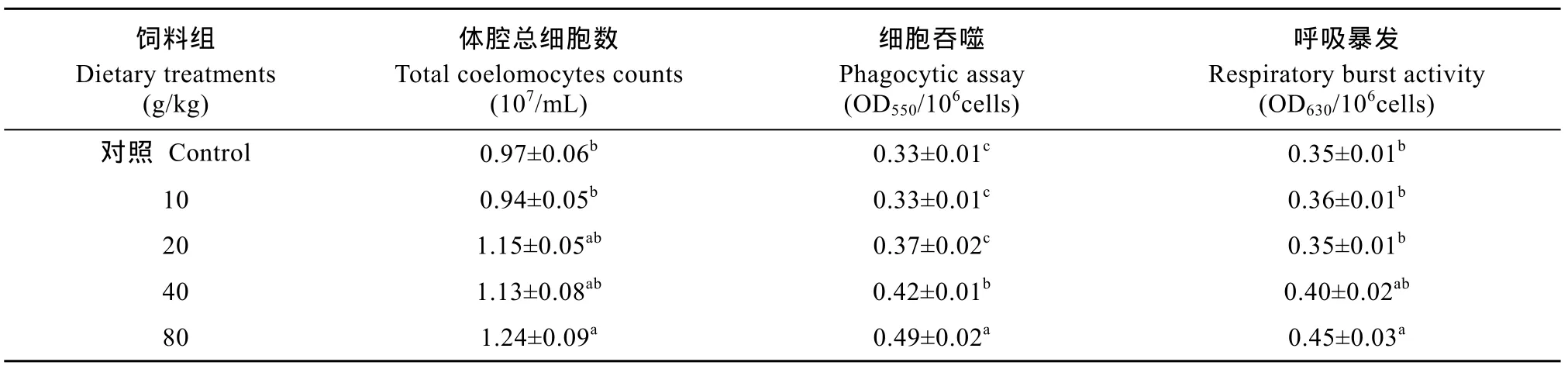
表3 人参茎叶提取物对刺参体腔总细胞数、细胞吞噬、呼吸暴发的影响(平均值±标准误, n=3)Tab. 3 Effects of the extracts from the stem and leaf of ginseng on the total coelomocytes counts, the phagocytic assay and the respiratory burst activity in Apostichopus japonicas (means±SE, n=3)

表4 人参茎叶提取物对刺参体液免疫指标的影响(平均值±标准误, n=3)Tab. 4 Effects of the extracts from the stem and leaf of ginseng on the humoral immunity of Apostichopus japonicas (means±SE, n=3)
3 讨论
3.1 人参茎叶提取物对刺参生长的影响
王本祥等[38]发现人参茎叶皂苷可促进未成年小鼠、大鼠及猪的生长, 这可能与其促进RNA和蛋白质合成作用有关, 其他研究也表明人参茎叶皂苷也能促进雏鸡的生长[39]。在本实验的30d投喂养殖周期内, 投喂人参茎叶提取物组较对照组的生长率有一定提高, 但效果不明显, 这可能使由于人参茎叶提取物种人参皂苷含量较低所致。生长率最高的人参茎叶提取物投喂量是在40 g/kg, 而再增加投喂量至80 g/kg时, 生长率反而下降, 具体原因尚不明确,有待进一步研究人参茎叶提取物添加量与饲料利用率的关系。
3.2 人参茎叶提取物对刺参免疫细胞的影响
刺参体腔中含有大量参与免疫防御过程的细胞,包括吞噬变性细胞、有色和无色球形细胞、祖原细胞、晶体细胞、振颤细胞和血细胞[40], 它们具有吞噬和消化异物等功能, 细胞在吞噬异物或病原的过程中也会产生具有强烈杀伤能力的超氧阴离子自由基O–, 它的强弱直接反应细胞的杀伤效能[41]。赵萧萧等[42]研究发现人参茎叶多糖能提高小鼠巨噬细胞的吞噬和淋巴细胞的增殖, 人参茎叶提取物由于含有人参茎叶多糖, 对刺参细胞免疫也有着显著影响,当投喂人参茎叶提取物添加量达到20 g/kg时, 刺参体腔总细胞数较对照有提高, 而当添加量达到 80 g/kg时能显著提高刺参体腔细胞总数; 同样, 人参茎叶提取物添加量大于等于 40 g/kg时能显著提高刺参体腔细胞的吞噬能力; 超氧阴离子的含量在大于等于40 g/kg时才有提高, 并且80 g/kg的添加量能显著提高刺参体腔细胞呼吸暴发的活力。这表明低剂量的人参茎叶提取物不能有效提高刺参的细胞免疫能力, 但随着剂量的增加, 刺参细胞免疫力也逐步上升。3.3 人参茎叶提取物对刺参体液免疫指标的影响

图1 人参茎叶提取物对刺参抗灿烂弧菌的影响Fig. 1 Effects of the extracts from the stem and leaf of ginseng on the resistance to V. splendidus in Apostichopus japonicus
刺参除了细胞免疫外还有着多种对抗外界病原及异物的体液免疫, 由于刺参只具有非特异性免疫,因此这些免疫指标在刺参体液免疫中起着不可替代的重要作用。人参茎叶皂苷已被证明可以提高小鼠超氧化物歧化酶的活性[43], 在本实验中, 投喂人参茎叶提取物不同添加量的饲料在4周的实验周期内,与对照组相比体液溶菌酶(LSZ)、酚氧化酶(PO)、过氧化氢酶(CAT)和酸性磷酸酶(ACP)的活性都无显著性提高, 但40 g/kg和80 g/kg添加量组刺参体液中的这四种酶与对照组相比都有提高; 当人参茎叶提取物添加量达到80 g/kg时, 刺参体液中的超氧化物歧化酶(SOD)和总一氧化氮合酶(T-NOS)相比对照组具有显著提高, 而其余各处理组与对照组酶活性相差不大。对刺参体液免疫指标而言, 在实验条件下最高添加量组对免疫指标影响最大, 大部分实验组对刺参免疫指标的影响不够显著, 有待做时间与药效之间关系的进一步研究。
3.4 人参茎叶提取物对刺参抗病能力的影响
目前还未见有报道人参茎叶提取物对水产动物抗病力影响的研究, 实验结果表明人参茎叶提取物在20 g/kg以上时可以提高刺参的健康率, 其中投喂含 80 g/kg的人参茎叶提取物饲料组与空白对照组相比, 效果最好, 这与提升刺参免疫力效果的结果相一致, 这可能是人参茎叶提取物通过提高刺参的非特异性免疫进而提升其对灿烂弧菌病原感染的抵抗力的结果。
在本实验中, 人参茎叶提取物的添加量达到最高的80 g/kg时, 刺参的免疫和抗病能力均显著最高,这表明人参茎叶提取物可作为一种高价值的水产免疫增强剂得到应用。与此同时, 人参茎叶提取物是否能提高刺参的营养、药用价值以及更高添加量能否进一步提高刺参的生长、免疫和抗病力有待进一步的研究。
4 结论
本实验首次将人参茎叶提取物用于水产中, 作为高价值水产养殖动物的免疫增强剂, 其对刺参的生长、免疫和抗病具有一定的影响。结合本次实验所有数据, 表明饲料中添加人参茎叶提取物可以提高刺参的免疫能力, 同时也能减低刺参感染腐皮综合症的几率, 但对促进刺参生长效果不明显, 本次试验的最佳添加量为80 g/kg。
[1] McElroy S. Beche-de-mer species of commercial value-an update [J]. SPC Bêche-de-mer Information Bulletin, 1990, 2: 2—7
[2] Wang Y H, Wang C, Guo L P, et al. Analysis of the nutritional components in four kinds of holothuroidea [J]. Periodical of Ocean University of China, 2010, 40(7): 111—114 [王远红, 王聪, 郭丽萍, 等. 海参科 (Holothuriidae) 中 4 种海参的营养成分分析. 中国海洋大学学报: 自然科学版, 2010, 40(7): 111—114]
[3] Fan H Z. Ginseng of the sea-- Research and development on medical efficacy of sea cucumber and its ingredient [J]. Chinese Journal of Marine Drugs, 2001, 20(4): 37—44 [樊绘曾. 海参: 海中人参——关于海参及其成分保健医疗功能的研究与开发. 中国海洋药物, 2001, 20(4): 37—44]
[4] Kaneko M, Kisa F, Yamada K, et al. Structure of neuritogenic active ganglioside from the sea cucumber Stichopus japonicus [J]. European Journal of Organic Chemistry, 1999, (11): 3171—3174
[5] Tian F, Zhang X, Tong Y, et al. Research Paper PE, A new sulfated saponin from sea cucumber, exhibits anti-angiogenic and anti-tumor activities in vitro and in vivo [J]. Cancer Biology & Therapy, 2005, 4(8): 874—882
[6] Miyamoto T, Togawa K, Higuchi R, et al. Six newly identified biologically active triterpenoid glycoside sulfates from the sea cucumber cucumaria echinata [J]. Liebig’s Annalen der Chemie, 1990, (5): 453—460
[7] Shimada S. Antifungal steroid glycoside from sea cucumber [J]. Science, 1969, 163(3874): 1462
[8] Aminin D L, Koy C, Dmitrenok P S, et al. Immunomodulatory effects of holothurian triterpene glycosides on mammalian splenocytes determined by mass spectrometric proteome analysis [J]. Journal of Proteomics, 2009, 72(5): 886—906
[9] Brekhman, HW Y. A review of pharmacological and clinical research of biologically active substances of marine origin in the soviet far east (1949~1969) [J]. Food—Drug from the Sea (Youngken HW ed).Marine Technology Society, 1970, 359
[10] Li Z, Wang H, Li J, et al. Basic and clinical study on the antithrombotic mechanism of glycosaminoglycan extracted from sea cucumber [J]. Chinese Medical Journal, 2000, 113(8): 706—711
[11] Li L F, Xiang D Z, Gao B. Research of Stichopus japonicus acid mucopolysaccharide (SJAMP) in treatment of chronic viral hepatitis B [A]. Fourth Symposium on Chinese Oceanology and Limnology Drugs [C]. Qingdao, 1994, 174[李丽芬, 相大峥, 高斌. 刺参酸性黏多糖治疗慢性乙型病毒性肝炎的研究. 第四次中国海洋湖沼药物学术研讨会论文集. 青岛. 1994, 174].
[12] Wang Y G, Fang B, Zhang C Y, et al. Etiology of skin ulcer syndrome in cultured juveniles of Apostichopus japonicus and analysis of reservoir of the pathogens [J]. Journal of Fishery Sciences of China, 2006, 13(4): 610—616 [王印庚,方波, 张春云, 等. 养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析. 中国水产科学, 2006, 13(4): 610—616]
[13] Wang Y G, Leng M, Chen X, et al. In vitro bacteriostatic effect of Chinese herbs against causative pathogens of skin ulcer syndrome in sea cucumber Apostichopus japonicus [J]. Progress in Fishery Sciences, 2009, 30(2): 1—7 [王印庚,冷敏, 陈霞, 等. 中草药对刺参腐皮综合征病原菌的体外抑菌试验. 渔业科学进展, 2009, 30(2): 1—7]
[14] Hou W J, Yang F Y, Wang W X. In vitro Bacteriostatic effect of Chinese herbs against causative pathogens of skin ulcer syndrome in sea cucumber Apostichopus japonica [J]. Chinese Agricultural Science Bulletin, 2013, 29(5): 76—80[侯文久, 杨凤影, 王维新. 中草药对刺参腐皮综合症病原菌的抑菌试验. 中国农学通报, 2013, 29(5): 76—80]
[15] Coon J T, Ernst E. Panax ginseng [J]. Drug Safety, 2002, 25(5): 323—344
[16] Scaglione F, Ferrara F, Dugnani S, et al. Immunomodulatory effects of two extracts of panax ginseng C.A. Meyer [J]. Drugs Under Experimental and Clinical Research, 1989, 16(10): 537—542
[17] Shin H R, Kim J Y, Yun T K, et al. The cancer-preventive potential of panax ginseng: a review of human and experimental evidence [J]. Cancer Causes & Control, 2000, 11(6): 565—576
[18] Huang X S. Determination of ginsenoside in ginseng stem&leaf extracts and ginseng root by HPLC [J]. China Journal of Chinese Materia Medica, 2001, 26(3): 173—175[黄新生. 高效液相色谱法测定人参茎叶浸膏及人参根中的人参皂苷含量. 中国中药杂志, 2001, 26(3): 173—175]
[19] Shen S C, Sun X J, Tang X H, et al. Chemical constituents of stems and leaves of panax ginseng C.A. Meyer [J]. Journal of Qiqihar University (Natural Science Edition), 2008(03): 43—46 [申书昌, 孙秀佳, 唐晓慧, 等. 人参茎叶的化学成分研究. 齐齐哈尔大学学报, 2008(03): 43—46]
[20] Li K K, Yang X W. Advances of studies on chemical constituents in stems and leaves of ginseng [J]. Modern Chinese Medicine, 2012, 14(1): 47—50 [李珂珂, 杨秀伟.人参茎叶化学成分的研究进展. 中国现代中药, 2012, 14(1): 47—50]
[21] Yu J, Bai Z C, Fu C M. Research on the technology of extraction and purification of total saponin from the stem and leaf of panax ginseng [J]. Journal of Southwest Agricultural University, 2004, 26(4): 479—482 [于杰, 白志川, 付超美.人参茎叶总皂甙提取精制工艺研究. 西南农业大学学报, 2004, 26(4): 479—482]
[22] Zhang X, Guo L P, Liu Y J, et al. Study on the extraction process of saponins in stems and Leaves of panax ginseng by different methods [J]. Journal of Jilin Agricultural Science and Technology College, 2013, 22(3): 21—24 [张旭, 郭丽萍, 刘亚杰, 等. 不同方法提取人参茎叶皂苷工艺研究.吉林农业科技学院学报, 2013, 22(3): 21—24]
[23] Xing J, Leung M, Chia F. Quantitative analysis of phagocytosis by amebocytes of a sea cucumber, Holothuria leucospilota [J]. Invertebrate Biology, 1998: 67—74
[24] Cao Q, Lin Z. Antitumor and anti-angiogenic activity of ganoderma lucidum polysaccharides peptide [J]. Acta Pharmacologica Sinica, 2004, 25: 833—838
[25] Zhang Q, Ma H, Mai K, et al. Interaction of dietary bacillus subtilis and fructooligosaccharide on the growth performance, non-specific immunity of sea cucumber, Apostichopus japonicus [J]. Fish & Shellfish Immunology, 2010, 29(2): 204—211
[26] Song Y, Hsieh Y. Immunostimulation of tiger shrimp (penaeus monodon) hemocytes for generation of microbicidal substances: analysis of reactive oxygen species [J]. Developmental & Comparative Immunology, 1994, 18(3): 201—209
[27] Chen X R, Zhang W B, Mai K S, et al. Effects of dietary glycyrrhizin on growth, immunity of sea cucumber and its resistance against Vibrio splendidus [J]. Acta Hydrobiologica Sinica, 2010, 34(4): 731—738 [陈效儒, 张文兵, 麦康森, 等. 饲料中添加甘草酸对刺参生长、免疫及抗病力的影响.水生生物学报, 2010, 34(4): 731—738]
[28] Lin S, Mao S, Guan Y, et al. Effects of dietary chitosan oligosaccharides and bacillus coagulans on the growth, innate immunity and resistance of koi (Cyprinus carpio koi) [J]. Aquaculture, 2012, 342—343: 36—41
[29] Ashida M, Söderhäll K. The prophenoloxidase activating system in crayfish [J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1984, 77(1): 21—26
[30] Wang S, Chen J. The protective effect of chitin and chitosan against vibrio alginolyticus in white shrimp Litopenaeus vannamei [J]. Fish & Shellfish Immunology, 2005, 19(3): 191—204
[31] Cheng L J, Meng Z. Molybdate colorimetric method for determination of catalase in serum [J]. Chinese Journal of Clinical Laboratory Science, 1994, 12(1): 6—8 [程鲁京, 孟泽. 钼酸铵显色法测定血清过氧化氢酶. 临床检验杂志, 1994, 12(1): 6—8]
[32] Goth L. A simple method for determination of serum catalase activity and revision of reference range [J]. Clinica Chimica Acta, 1991, 196(2): 143—151
[33] Green L C, Wagner D A, Glogowski J, et al. Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids [J]. Analytical Biochemistry, 1982, 126(1): 131—138
[34] Marzinzig M, Nussler A K, Stadler J, et al. Improved methods to measure end products of nitric oxide in biological fluids: nitrite, nitrate, and S-nitrosothiols [J]. Nitric Oxide,1997, 1(2): 177—189
[35] Liu Z, Ma Y, Yang Z, et al. Immune responses and disease resistance of the juvenile sea cucumber Apostichopus japonicus induced by metschnikowia sp. C14 [J]. Aquaculture, 2012, 368—369: 10—18
[36] Sun Y X. Improving effects of astragalus polysaccharides (APS) on non-specific immune responses and productive performance of sea cucumber (Apostichopus joponicus) [D]. Dalian University of Technology, 2008 [孙永欣. 黄芪多糖促进刺参免疫力和生长性能的研究. 博士学位论文, 大连理工大学, 2008]
[37] Ma Y X, Xu G R, Zhang E P, et al. The etiology of acute preistome edema disease in cultured juveniles of Apostichopus japonicus [J]. Journal of Fisheries of China, 2006, 30(3): 377—382 [马悦欣, 徐高蓉, 张恩鹏, 等. 仿刺参幼参急性口围肿胀症的细菌性病原. 水产学报, 2006, 30(3): 377—382]
[38] Wang B X, Cui J C, Liu A J. The action of ginsenosides extracted from the stems and leaves of panax ginseng in promoting animal growth [J]. Acta Pharmaceutica Sinica, 1982, (12): 899—904 [王本祥, 崔景朝, 刘爱晶. 人参茎叶皂甙促进动物生长的作用. 药学学报, 1982, (12): 899—904]
[39] Yang H M, Xun C Y, Wang J Y, et al. Effects of ginseng stems and leaves saponins (GSLS) on weight performance and blood parameters of Chicken [J]. Feed Research, 1994, (6): 19—20 [杨焕民, 徐长友, 王建勇, 等. 人参茎叶皂甙对雏鸡增重及血液的作用. 饲料研究, 1994, (6): 19—20]
[40] Ratcliffe N A, Rowley A F. Invertebrate blood cells [Z]. New York: Academic press New York. 1980, 513—526
[41] Wang S X, Ye H B, Yu X Q, et al. Analysis of sea cucumber immune mechanism [J]. Journal of Anhui Agricultural Sciences, 2012, (25): 12553—12555 [王淑娴, 叶海斌, 于晓清, 等. 海参的免疫机制研究. 安徽农业科学, 2012, (25): 12553—12555]
[42] Zhao X X, Wang J H, Ye S H, et al. Effects of the polysacchadde from ginseng leaves and stems on immunological function of mouse [J]. China Brewing, 2009, (3): 56—58 [赵萧萧, 王际辉, 叶淑红, 等. 人参茎叶多糖对小鼠免疫功能的影响. 中国酿造, 2009, (3): 56—58]
[43] Guo S, Chen M Q, Zhao J X, et al. Effects of panax ginseng saponin (PGS) on LPO and SOD in ADM-injuried mice [J]. Journal of Norman Bethune University of Medical Science, 1996, (3): 239—240 [郭颂, 陈满秋,赵节绪, 等. 人参茎叶皂甙对阿霉素中毒小鼠过氧化脂质和超氧化物歧化酶的影响. 白求恩医科大学学报, 1996, (3): 239—240]
EFFECTS OF GINSENG STEM AND LEAF EXTRACTS ON THE GROWTH, IMMUNITY AND THE RESISTANCE TO DISEASES IN SEA CUCUMBERS (APOSTICHOPUS JAPONICAS)
GUO Jun, YU Jun, CHEN Yong-Liang, YANG Xian-Le, HU Kun and CAO Hai-Peng
(Shanghai Ocean University, Shanghai 201306, China)
To investigate the actual effects of ginseng stem and leaf extracts in the farming of sea cucumbers (Apostichopus japonicas), we conducted experiments to study the growth, immunity and the resistance to diseases in sea cucumbers treated with ginseng extracts. The sea cucumbers had an initial body weight of (4.91±0.17) g, and were fed with ginseng stem-leaf extracts at the levels of 10, 20, 40 and 80 g per kg for 30 days. Basal diet without ginseng abstract served as the control treatment. The specific growth rates (SGR) of sea cucumbers showed no changes in response to the increase in ginseng stem-leaf extracts. Compared to the control, sea cucumbers fed with 80 g/kg ginseng stem-leaf extracts showed significantly higher levels in total coelomocytes count (TCC), respiratory burst (RB) activity, phagocytosis, superoxide dismutase (SOD), and total nitric oxide synthase (T-NOS) (P<0.05). Enhancement in phagocytosis was also observed in sea cucumbers fed with 40 g/kg ginseng stem-leaf extracts (P<0.05). However, there were no significant differences in other immune parameters between the 10 g/kg group, the 20 g/kg group, and the control group (P>0.05). Results of the challenge trial suggested that sea cucumbers fed with 20 g/kg, 40 g/kg and 80 g/kg ginseng stem-leaf extracts were healthier than the control. The health rate of sea cucumbers fed with 80 g/kg ginseng stem-leaf extracts was 80.56%, which was significantly higher than the control and the 10 g/kg group (P<0.05). Therefore, we concluded that the treatment with ginseng stem-leaf extracts might improve the immunity and the resistance to diseases in sea cucumbers and thus could be used as an immunity enhancer in the farming of the sea cucumbers.
Sea cucumber; Ginseng stem-leaf extracts; Growth; Immunity; Disease resistance
S968.9
A
1000-3207(2015)06-1085-08
10.7541/2015.143
2014-10-15;
2015-01-11
科技部863课题“新型环境友好型渔药的研制与渔药安全性评价”(2011AA10A216); 上海高校水产一级学科建设与上海高校知识服务平台项目(ZF1206)资助
珺郭 (1990—), 男, 湖南永州人; 硕士; 主要研究方向为水产动物医、药学。E-mail: 475579407@qq.com
杨先乐(1948—), 教授; E-mail: xlyang@shou.edu.cn
