乙炔基雌二醇(EE2)对雄性黄颡鱼GtH 3个亚基基因表达的影响
2015-03-01李英文饶剑军刘智皓
谭 号 李英文 饶剑军 刘智皓
(重庆师范大学生命科学学院, 重庆市高校生物活性物质工程研究中心, 重庆市高校动物生物学重点实验室, 重庆 401331)
乙炔基雌二醇(EE2)对雄性黄颡鱼GtH 3个亚基基因表达的影响
谭 号 李英文 饶剑军 刘智皓
(重庆师范大学生命科学学院, 重庆市高校生物活性物质工程研究中心, 重庆市高校动物生物学重点实验室, 重庆 401331)
为研究乙炔基雌二醇(EE2)是否能影响雄性黄颡鱼(Pelteobagrus fulvidraco)垂体中促性腺激素 3个亚基基因的表达, 从而干扰 FSH和 LH的分泌, 研究采用末端快速扩增(RACE)的方法在黄颡鱼垂体中克隆了促性腺激素的2个β亚基(FSHβ和LHβ)的全长cDNA, 对其组织表达模式和雌雄性垂体中的季节表达模式进行了研究; 另外, 研究还用100 ng/L的EE2对雄性黄颡鱼(2龄)进行了28d的暴露处理。结果发现, 黄颡鱼FSHβ cDNA全长528 bp, ORF为399 bp, 编码132个氨基酸; LHβ全长为870 bp, ORF为417 bp, 编码138个氨基酸。序列分析结果表明, 黄颡鱼FSHβ含有一个17氨基酸的信号肽, 2个保守的N-糖基化位点和13个半胱氨酸残基, 而LHβ含有一个18个氨基酸的信号肽, 1个N-糖基化位点和12个半胱氨酸残基, 与其他鲶形目鱼类极其相似。进化分析显示, 黄颡鱼FSHβ和LHβ与鲶形目的鱼类进化关系较近。组织分布结果发现, 黄颡鱼3亚基均仅在垂体中表达。季节表达模式结果表明, 雌雄黄颡鱼GtHα和LHβ表达水平在5月份左右达到最高, 随后降低; FSHβ在雌性的表达模式与GtHα和LHβ相同, 而在雄性, FSHβ的表达没有明显变化。半定量RT-PCR结果显示, 100 ng/L的EE2能显著抑制黄颡鱼促性腺激素3个亚基基因的表达。研究认为, EE2抑制黄颡鱼雄性垂体FSH和LH的分泌, 可能阻碍其正常的精子发生、精子成熟和排精过程, 从而影响其正常的繁殖和发育。
黄颡鱼; 促性腺激素β亚基; cDNA克隆; 基因表达; 乙炔基雌二醇
内分泌干扰物(EDC, Endocrine Disrupting Chemicals)能模拟动物内源激素的生理生化功能, 改变动物体 內源激素的合成、代谢或与激素受体的结合,从而干扰动物内分泌系统[1]。更多的研究表明, EDC不仅对高等动物影响巨大[2], 对低等脊椎动物(包括鱼类)同样危害极大。EDC暴露的鱼类会发生性腺发育异常、生殖能力下降、配子发生障碍等[3, 4]。因此, 对 EDC影响鱼类性腺发育和配子发生及其可能的分子机制逐渐成为鱼类生理学和生态毒理学研究的热点。
鱼类的性腺发育和配子发生不仅受到性腺局部因子的调节, 还受到垂体细胞合成与分泌的糖蛋白激素——促性腺激素(Gonadotropin hormone, GtH)的调节, 其功能包括促进生殖细胞(配子)的生长、发育、成熟、排精及排卵等[5]。在哺乳动物中促性腺激素有 2种: 促卵泡刺激素(Follicular stimulating hormone, FSH)和促黄体生成素(Luteinizing hormone, LH)。鱼类也有2种促性腺激素, 即GtHⅠ和GtHⅡ,分别对应于哺乳动物的FSH和LH[6]。这2种激素由相同的α亚基分别与不同的β亚基(FSHβ或LHβ)组成[7, 8]。尽管下丘脑-垂体-性腺轴对鱼类内分泌系统至关重要[9], 但相关研究集中在EDC对鱼类性腺发育的影响, 关于EDC对鱼类垂体的影响研究较少。
乙炔基雌二醇(EE2, 17α-ethynylestradiol), 是长江污染水体中的典型 EDC 之一[10], 浓度可达2.67 ng/L[11, 12]。由于EE2分布广泛且具有强烈的雌激素效应(比雌二醇(E2, 17β-estradiol)高1—5倍[13, 14]),能严重影响鱼类雄性的精巢发育和精子功能, 甚至导致精巢畸变和繁殖障碍[15—19]。黄颡鱼(Pelteobagrus fulvidraco)俗称黄腊丁, 属鲶形目(Siluriformes), 鲿科(Bagridae), 黄颡鱼属(Pelteobagrus), 是长江流域重要的养殖鱼类和捕捞对象。已有研究表明, EE2能严重影响黄颡鱼雄性幼鱼的精巢发育和精子发生[20], 但EE2是否能影响雄性黄颡鱼垂体中促性腺激素的分泌, 进而造成精巢发育和精子发生障碍, 尚不得而知。
本研究在黄颡鱼垂体中克隆了促性腺激素2个β亚基(FSHβ和 LHβ)的全长 cDNA(GtHα已克隆),对其组织表达模式和季节表达模式进行了研究。同时, 本研究用100 ng/L的EE2对雄性黄颡鱼(2龄)进行了28d的暴露处理, 并用半定量PCR的方法检测了EE2对促性腺激素3个亚基基因(GtHα、FSHβ 和LHβ)mRNA水平的影响, 以探讨EE2对垂体中促性腺激素分泌的影响。
1 材料与方法
1.1 样本采集与处理
实验所用黄颡鱼雌雄性成鱼购自重庆盘溪水产市场。解剖雌雄黄颡鱼成鱼各组织(T. 精巢、O. 卵巢、H. 心脏、S. 脾脏、HK. 头肾、K. 肾脏、I. 肠、P. 垂体、B. 脑、M. 肌肉、L. 肝脏), 迅速放入液氮中速冻, –80℃保存备用。
1.2 总RNA提取和第一链cDNA的合成
根据 Trizol(Invitrogen)说明书, 从黄颡鱼成鱼提取垂体总RNA, 并测定其浓度。取1 µg总RNA, 经 gDNA Eraser(TaKaRa)去除基因组 DNA后, 按PrimeScript RT reagent Kit(TaKaRa)说明书合成第一链cDNA。
1.3 引物设计
根据 GenBank(http://www.ncbi.nlm.nih.gov)上公布的斑点叉尾(Ietalurus punetaus)、革胡子鲶(Clarias gariepinus)、南方鲶(Silurus meridionalis)等FSHβ和LHβ的cDNA序列, 在其保守区域设计引物, 其中黄颡鱼GtHα序列号: ACX37700(本实验所用引物见表1、序列号见表2)。
1.4 FSHβ和LHβ亚基cDNA的克隆
利用已合成的第一链 cDNA在 PCR扩增仪(Bio-Rad IQ5)上扩增中间片段。扩增条件为: 94 ℃3min, 35个循环的94 30s℃ , 52 30s℃ , 72 30s℃ , 延伸7min。扩增片段在1% 的琼脂糖凝胶上电泳, 溴化乙锭(EB)染色后, 在凝胶成像系统上分析。目的片段用胶回收试剂盒(Geneview)纯化后亚克隆入pMD19-T载体(TaKaRa), 随后用 CaCl2法转化到大肠杆菌DH5α, 经蓝白斑筛选后, 将阳性克隆送上海英骏公司(Invitrogen)测序。
根据测序验证后的中间片段序列设计RACE引物, 扩增黄颡鱼FSHβ和LHβ cDNA的5′和3′末端,步骤参照SMARTTMRACE cDNA Amplification kit (Clontech)说明书进行。根据测序得到 5′序列和 3′序列进行拼接, 并进行End-to-End PCR扩增验证。引物见表1。

表1 引物序列Tab. 1 The primer sequences
1.5 FSHβ和LHβ亚基序列的同源性分析
根据已获得的FSHβ和LHβ全长 cDNA序列,应用DNAStar 和Clustal X 软件推导其氨基酸序列并进行多重序列对比分析。用Mega5.0软件构建系统进化树, 进化树中的数值表示随机进行1000次计算的重复率, 代表该进化树的可靠性。除澳洲鳗鲡(Anguilla australis)部分氨基酸序列由 EST推导外,其他物种FSHβ和LHβ氨基酸序列均从GenBank下载。序列号见表2。
1.6 黄颡鱼GtH 3个亚基的组织表达模式
根据 Trizol(Invitrogen)说明书, 用–80℃保存备用的各组织提取总RNA。取1 μg总RNA, 用gDNA Eraser (TaKaRa)去除基因组 DNA后, 合成第一链cDNA。用基因特异性引物(GtHα-F/R、FSHβ-F1/R1 和LHβ-F1/R1)研究3个亚基基因在黄颡鱼各组织中的表达模式, 并以β-actin (β-actin F/R) (252 bp)作为内参。含质粒和蒸馏水为模板扩增的产物分别作为阳性和阴性对照。扩增条件为: 为94 3min℃ , 25(目的基因)和 20(β-actin)个循环的 94 30s℃ , 55℃和52 30s℃ , 72 30s℃ , 延伸7min。PCR产物在1%的琼脂糖凝胶上电泳, EB染色后在凝胶成像系统上进行拍照、分析。
1.7 季节表达模式的研究
在2013年的2、5、8、9和 12月分别收集黄颡鱼雌雄成鱼各6尾, 作为6个平行样, 取其垂体,液氮速冻后, –80℃保存备用。PCR扩增检测方法见1.6。数据用 6尾鱼的平均值±标准误(Mean±SE)表示。结果用SPSS 13.0 (Chicago, USA)进行方差分析和差异比较, P<0.05, 差异显著。柱形图用GraphPad Prism 5(San Diego, CA)进行绘制。
1.8 雄性黄颡鱼的EE2暴露处理
2014年 10月, 于重庆盘溪水产市场购得雄性黄颡鱼(2龄)50尾, 选取体长[(15.20—17.80) cm]和体重[(62.20—70.51) g]相当的黄颡鱼共36尾。饲养水温(24±1)℃, 自然光周期, 每天喂食2次。驯养2周后, 将上述实验鱼随机分为 6组: 3个对照组(C, 0.05‰ DMSO)和3个EE2(100 ng/L)处理组, 每组6尾。在暴露处理的 7d、14d和 28d取材, 每组取 2尾鱼的垂体组织, 液氮速冻后, –80℃保存备用。实验方法和数据处理见方法1.7。
2 结果
2.1 FSHβ和LHβ克隆结果
采用RT-PCR和RACE的方法克隆得到黄颡鱼FSHβ (KP036408)和LHβ (KP036409)全长cDNA序列,其中 FSHβ长 528 bp, 包含 5′非编码区(Untranslated region, UTR)6 bp, 3′UTR 123 bp, ORF为399 bp, 编码132个氨基酸; LHβ长870 bp, 包含5′UTR 105 bp, 3′UTR 348 bp, ORF为417 bp, 编码138个氨基酸。

表2 物种及其序列号Tab. 2 The species and the corresponding accession numbers
2.2 序列及系统进化分析
、革胡子鲶和南方鲶的氨基酸序列高度保守。黄颡鱼FSHβ和LHβ分别有2个和1个糖基化位点,同时含有13个和12个半胱氨酸残基位点, 与其他鲶形目鱼类高度保守, 同时还发现, 黄颡鱼FSHβ和LHβ各自含有17和18个氨基酸组成的信号肽。
系统进化分析结果表明, 鱼类和四足类 FSHβ 和LHβ均明显分为两支。其中, 黄颡鱼FSHβ和LHβ在鱼类中与同为鲶形目的斑点叉尾、革胡子鲶、南方鲶的进化距离最近, 其次与鲤形目的斑马鱼较近, 与其他物种鱼类较远, 而与四足类最远(图1)。

图1 黄颡鱼与其他脊椎动物FSHβ(A)和LHβ(B)的系统进化树Fig. 1 The phylogenetic tree based on the sequences of FSHβ (A) and LHβ (B) of yellow catfish and other vertebrates
2.3 组织表达模式
组织表达模式的研究结果表明, 黄颡鱼促性腺激素三个亚基GtHα、FSHβ和LHβ仅在雌雄垂体中表达, 而在性腺等其他组织中没有表达(图2)。
2.4 季节表达模式
季节表达模式的研究结果表明, 黄颡鱼雌鱼GtHα、FSHβ和LHβ表达水平均在2到5月份达到最高, 而在8月、9月和12月不同程度上显著性下调(图3A、B、C)。与雌性的结果相似, 雄鱼GtHα、FSHβ和 LHβ表达水平在 2到 5月份也达到最高, GtHα和 LHβ表达水平开始呈上调趋势, 随后显著抑制(图3D、F); 不同的是, FSHβ的表达水平表现出逐月下调的变化趋势(图3E), 但差异不显著。
2.5 EE2对基因表达的影响
半定量RT-PCR结果显示, EE2在处理28d显著抑制黄颡鱼促性腺激素3个亚基的表达。在处理后7d, GtHα和LHβ的表达呈上升趋势, 且LHβ的表达显著上调; 处理14d后, GtHα和LHβ的表达和处理组和7d相比呈下调趋势, 其中LHβ的表达显著下调(图4A、C); 不同的是, EE2处理后7d, FSHβ的表达量没有变化, 处理后 14d, 表达量开始显著下调(图4B)。

图2 GtHα、FSHβ和LHβ在黄颡鱼各组织中的表达Fig. 2 The tissue-specific expression of GtHα, FSHβ and LHβ in Pelteobagrus fulvidraco
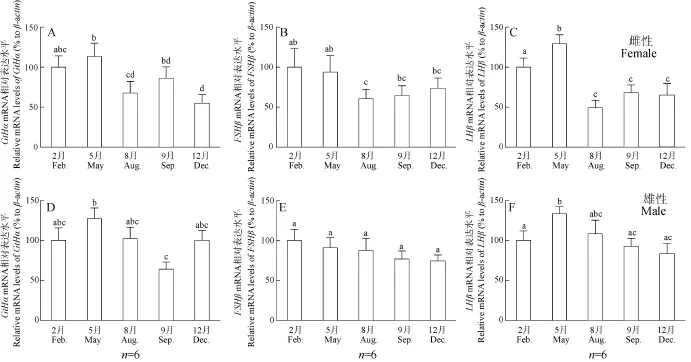
图3 GtHα(A、D)、FSHβ(B、E)和LHβ(C、F)在雌雄黄颡鱼垂体中的季节表达模式Fig. 3 The seasonal pattern of expression of GtHα (A, D), FSHβ (B, E) and LHβ (C, F) in the pituitary of Pelteobagrus fulvidraco

图4 EE2对黄颡鱼雄性幼鱼垂体GtHα(A)、FSHβ(B)和LHβ(C)表达的影响Fig. 4 The effects of EE2 on the expression of GtHα (A), FSHβ (B)和LHβ (C) mRNA in male Pelteobagrus fulvidraco
3 讨论
3.1 FSHβ和LHβ序列分析
本研究利用RT-PCR和RACE的方法从黄颡鱼垂体中扩增出了FSHβ和LHβ cDNA全长序列。推导的氨基酸多重序列分析发现, FSHβ和LHβ与同为鲶形目的斑点叉尾同源性最高, 其次革胡子鲶和南方鲶。黄颡鱼FSHβ成熟肽序列中含有2个N-糖基化位点, 13个保守的Cys和17个氨基酸组合成的信号肽, 而LHβ成熟肽含有1个N-糖基化位点, 12个保守的Cys和18个氨基酸组合成的信号肽。众所周知, 蛋白质的一级结构决定高级结构, 高级结构则决定蛋白质的功能, 而N-糖基化位点和Cys残基为FSHβ和LHβ蛋白折叠、特异性受体结合等功能所必需[21]。黄颡鱼FSHβ和LHβ保守的N-糖基化位点和Cys残基数量充分说明FSHβ和LHβ的结构和功能可能在鱼类进化中具有高度保守性, 与南方鲶的研究相似[22]。系统进化分析结果表明, 黄颡鱼的FSHβ和LHβ分别与鲶形目鱼类的FSHβ和LHβ聚为一小分支, 二者与硬骨鱼的鱼类聚为一大分支,与四足类再聚为一分支, 按照其分类地位严格聚类。
3.2 FSHβ和LHβ mRNA组织表达分析
组织表达模式的结果表明, GtHα、FSHβ和LHβ仅在垂体中表达, 而在其他已研究的组织中不表达,表明垂体是黄颡鱼FSH和LH是主要分泌器官。不同的是, 在南方鲶中, GtH 3个亚基不仅在垂体中表达, 还在卵巢中表达, 其中FSHβ在雌性南方鲶肠中也有微弱表达[22]。更有趣的是, 斑马鱼、斜带石斑鱼(Epinephelus coioides)和条石鲷(oplegnathidae fasciatus)的 FSHβ和 LHβ不仅垂体和卵巢中表达,在脑和肝等组织也有微弱表达[23—25], 表明GtH 3个亚基基因的组织表达模式具有显著的物种差异性。
3.3 季节表达模式的分析
有研究表明, 黄颡鱼为周年产卵性鱼类, 其繁殖季节主要集中在每年的5—7月, 此时黄颡鱼排卵和排精最为旺盛[26, 27]。在雌性中, FSH主要参与卵母细胞分化、发育和卵黄的积累, 而LH则参与卵母细胞的成熟与排卵, 因而鱼类FSH分泌量的峰值要早于 LH[9]。本研究的结果显示, 黄颡鱼雌性垂体LHβ表达的峰值出现在5月份, 略早于其繁殖季节; 而FSHβ的峰值出现在2月份左右, 早于LHβ的峰值, 与周年产卵性鱼类雌性卵母细胞发育的特点密切相关[28]。而在雄性, FSH主要参与精子发生和减数分裂, LH则主要参与精子的成熟和排精[9]。本研究的结果表明, 黄颡鱼雄性垂体LHβ的峰值也出现在5月, 与其在雌性的峰值出现时间完全相同。LHβ的表达在鱼类雌雄性同时出现峰值[26, 27], 为保证雌雄鱼能在相对固定的时间同时形成成熟的配子, 成功进行繁殖至关重要。然而, 与雌性FSHβ的峰值出现在2月份不同, 雄性FSHβ的表达相对稳定, 没有明显的季节差异。与之相对应的是, 黄颡鱼雄性比雌性多一次繁殖高峰[26, 27], 表明黄颡鱼雄性可能具有长时间持续产生精子的潜力, 暗示FSH在雄性的水平可能常年处于较高水平, 与本研究的结果一致。黄颡鱼雄性的繁殖高峰多于雌性, 很可能是黄颡鱼一种特殊的繁殖策略。
3.4 EE2对FSH和LH分泌的影响
黄颡鱼是我国长江流域重要的养殖对象和捕捞品种, 经济效益巨大。但近年来的研究表明, 长江流域逐渐成为EDC污染的重灾区, 且呈日趋恶化的态势, 严重威胁长江经济鱼类正常的生长和繁殖[11]。其中, EE2作为一种典型的内分泌干扰物, 能严重影响鱼类雄性的精巢发育和精子发生[29]。然而, 国内外学术界对EE2影响长江经济鱼类的报道很少。前期研究表明, EE2能导致黄颡鱼雄性幼鱼精子发生障碍, 出现生殖细胞凋亡甚至部分性反转的现象[20],但其影响是仅局限于精巢, 抑或作用于整个下丘脑—垂体—性腺轴, 有待进一步研究。本研究用EE2对雄性黄颡鱼进行了暴露处理, 结果显示, 处理 28d 后, EE2显著抑制黄颡鱼促性腺激素 3个亚基的表达。不同的是, EE2始终抑制 FSHβ的表达, 而对GtHα和LHβ的影响为先上升, 再下降。考虑到FSH 和LH各自的不同功能, 推测EE2首先抑制黄颡鱼精子发生的开始阶段, 然后抑制精子的成熟、排精等最后过程。与本研究结果类似, EE2能抑制稀有鲫(Gobiocypris rarus)和银大马哈鱼(Oncorhynchus kisutch)FSHβ和LHβ的表达[30, 31], 造成鱼类精巢发育和生殖障碍[32]。因此, 本研究认为, EE2对鱼类精巢发育和精子发生的影响, 不仅局限于精巢本身,还可能影响内分泌的高级中枢——垂体。综上所述, EE2可能通过抑制促性腺激素GtH 3个亚基基因的表达, 干扰黄颡鱼精子发生和成熟, 影响黄颡鱼正常的精巢发育和繁殖, 给我国长江流域经济鱼类的水产养殖带来潜在风险。
[1] Ropero A B, Alonso-Magdalena P, Ripoll C, et al. Rapid endocrine disruption: environmental estrogen actions triggered outside the nucleus [J]. The Journal of Steroid Biochemistry and Molecular Biology, 2006, 102(1): 163—169
[2] Zhang X, Li J H, Ma L, et al. Diethylstilbestrol impairs the morphology and function of mouse gubernaculum testis in culture [J]. Cell Biology and Toxicology, 2012, 28(6): 397—407
[3] Meng S L, Song C, Fan L M, et al. Pollution of environmental endocrine disrupting chemicals (EDCs) in water and its adverse reproductive effect on fish [J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(1): 202—208 [孟顺龙, 宋超, 范立民, 等. 水体中环境内分泌干扰物(EDCs)污染现状及其对鱼类的生殖危害. 江苏农业学报, 2013, 29(1): 202—208]
[4] Tan H, Li Y W, Yin P, et al. Mechanisms underlying diethylstilbestrol-induced inhibition of spermatogenesis in zebrafish (Danio rerio) [J]. Acta Hydrobiologica Sinica, 2015, 39(2): 331—338 [谭号, 李英文, 尹盼, 等. 己烯雌酚抑制斑马鱼精子发生及其可能的分子机制. 水生生物学报, 2015, 39(2): 331—338]
[5] Parhar I S, Soga T, Ogawa S, et al. FSH and LH-β subunits in the preoptic nucleus: ontogenic expression in teleost [J].General and Comparative Endocrinology, 2003, 132(3): 369—378
[6] Li M D, Ford J J. A comprehensive evolutionary analysis based on nucleotide and amino acid sequences of the α- and β-subunits of glycoprotein hormone gene family [J]. Journal of Endocrinology, 1998, 156(3): 529—542
[7] Sohn Y C, Suetake H, Yoshiura Y, et al. Structural and expression analyses of gonadotropin I β subunit genes in goldfish (Carassius auratus) [J]. Gene, 1998, 222(2): 257—267
[8] Vischer H F, Teves A C, Ackermans J C M, et al. Cloning and spatiotemporal expression of the follicle-stimulating hormone β subunit complementary DNA in the African Catfish (Clarias gariepinus) [J]. Biology of Reproduction, 2003, 68(4): 1324—1332
[9] Schulz R W, de França L R, Lareyre J J, et al. Spermatogenesis in fish [J]. General and Comparative Endocrinology, 2010, 165(3): 390—411
[10] Desbrow C, Routledge E J, Brighty G C, et al. Identification of estrogenic chemicals in STW effluent. 1. Chemical fractionation and in vitro biological screening [J]. Environmental Science & Technology, 1998, 32(11): 1549—1558 [11] Jiang W, Yan Y, Ma M, et al. Assessment of source water contamination by estrogenic disrupting compounds in China [J]. Journal of Environmental Sciences, 2012, 24(2): 320—328
[12] Stanback J. Perspectives on local manufacture of contraceptives in developing countries [J]. Family Health International, 1997, 40(3): 120—127
[13] Thorpe K L, Cummings R I, Hutchinson T H, et al. Relative potencies and combination effects of steroidal estrogens in fish [J]. Environmental Science & Technology, 2003, 37(6): 1142—1149
[14] Urbatzka R, Rocha E, Reis B, et al. Effects of ethinylestradiol and of an environmentally relevant mixture of xenoestrogens on steroidogenic gene expression and specific transcription factors in zebrafish [J]. Environmental Pollution, 2012, 164: 28—35
[15] Reyhanian Caspillo N, Volkova K, Hallgren S, et al. Short-term treatment of adult male zebrafish (Danio Rerio) with 17α-ethinylestradiol affects the transcription of genes involved in development and male sex differentiation [J].Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2014, 164: 35—42
[16] Lee P Y, Lin C Y, Chen T H. Environmentally relevant exposure of 17α-ethinylestradiol impairs spawning and reproductive behavior in the brackish medaka Oryzias melastigma [J]. Marine Pollution Bulletin, 2014, 86(2): 338—343
[17] Hill Jr R L, Janz D M. Developmental estrogenic exposure in zebrafish (Danio rerio): I. Effects on sex ratio and breeding success [J]. Aquatic Toxicology, 2003, 63(4): 417—429
[18] Weber L P, Hill Jr R L, Janz D M. Developmental estrogenic exposure in zebrafish (Danio rerio): II. Histological evaluation of gametogenesis and organ toxicity [J]. Aquatic Toxicology, 2003, 63(4): 431—446
[19] Xu H, Yang J, Wang Y, et al. Exposure to 17α-ethynylestradiol impairs reproductive functions of both male and female zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2008, 88(1): 1—8
[20] Zhu M. The influence of EE2 and DES on the gonad development and gametogenesis of yellow catfish [D]. Thesis for Master of Science, Chongqing Normal University, Chongqing. 2013 [朱敏. DES和EE2对黄颡鱼性腺发育和配子发生的影响. 硕士学位论文, 重庆师范大学, 重庆. 2013]
[21] Gharib S D, Wierman M E, Shupnik M A, et al. Molecular biology of the pituitary Gonadotropins [J]. Endocrine Reviews, 1990, 11(1): 177—199
[22] Wu F, Zhang X, Zhang W, et al. Expression of three gonadotropin subunits in Southern catfish gonad and their possible roles during early gonadal development [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2009, 153(1): 44—48
[23] Kwok HF, So WK, Wang Y, et al. Zebrafish gonadotropins and their receptors: I. Cloning and characterization of zebrafish follicle-stimulating hormone and luteinizing hormone receptors—evidence for their distinct functions in follicle development [J]. Biology of Reproduction, 2005, 72(6): 1370—1381
[24] Chen D L. mRNA expression nanlysis and protein expression of gonadotropinⅠand Ⅱfrom orange-spotted grouper Epinephelus coioides [D]. Thesis for Master of Science, Sun Yat-Sen University, Guangzhou. 2005 [陈德林.斜带石斑鱼促性腺激素Ⅰ和Ⅱ的组织表达分布和蛋白表达研究. 硕士学位论文, 中山大学, 广州. 2005]
[25] Chen S Y, Liu X Z, Shi B, et al. Cloning and expression patterns of gonadotropin hormone subunit in Oplegnathidae fasciatus [J]. Journal of Fisheries of China, 2014, 38(10): 1673—1686 [陈圣毅, 刘学周, 史宝, 等. 条石鲷促性腺激素亚基β(FSH, LH)cDNA克隆及表达特性分析. 水产学报, 2014, 38(10): 1673—1686]
[26] Liu W B, Zhang X J. Study on the Development and annual change in the ovary of Pelteobagrus fulvidraco [J]. Journal of Natural Science of Hunan Normal University, 2003, 26(2): 73—78 [刘文彬, 张轩杰. 黄颡鱼的卵巢发育和周年变化. 湖南师范大学自然科学学报, 2003, 26(2): 73—78]
[27] Liu W B, Zhang X J. Study on the Development and Annual Change of Testis, Spermatogenesis and Spermatoleosis in Pelteobagrus fulvidraco [J]. Journal of Natural Science of Hunan Normal University, 2004, 27(1): 66—70 [刘文彬, 张轩杰. 黄颡鱼精巢发育和周年变化及精子的发生与形成.湖南师范大学自然科学学报, 2004, 27(1): 66—70]
[28] Zhang X F. Study on the development and Annual change of Gonad in Pelteobagrus fulvidraco [D]. Thesis for Master of Science, Dalian Fisheries University, Dalian. 2005 [张晓芳.黄颡鱼性腺发育及周年变化的研究. 学士学位论文, 大连水产学院, 大连. 2005]
[29] Miller H D, Clark B W, Hinton D E, et al. Anchoring ethinylestradiol induced gene expression changes with testicular morphology and reproductive function in the medaka [J]. PLoS One, 2012, 7(12): e52479
[30] Qin F, Wang X, Liu S, et al. Gene expression profiling of key genes in hypothalamus-pituitary-gonad axis of rare minnow Gobiocypris rarus in response to EE2 [J]. Gene, 2014, 552(1): 8—17
[31] Harding L B, Schultz I R, Goetz G W, et al. High-throughput sequencing and pathway analysis reveal alteration of the pituitary transcriptome by 17α-ethynylestradiol (EE2) in female coho salmon, Oncorhynchus kisutch [J]. Aquatic Toxicology, 2013, 142—143: 146—163
[32] Oropesa A L, Jiménez B, Gil M C, et al. Histological alterations in the structure of the testis in tench (Tinca tinca) after exposure to 17 alpha-ethynylestradiol [J]. Environmental Toxicology, 2014, 29(10): 1182—1192
THE EXPRESSION OF THREE GONADOTROPIN SUBUNITS IN RESPONSE TO 17α-ETHYNYLESTRADIOL IN MALE PELTEOBAGRUS FULVIDRACO
TAN Hao, LI Ying-Wen, RAO Jan-Jun and LIU Zhi-Hao
(Chongqing Engineering Research Center of Bioactive Substances, Chongqing Key Laboratory of Animal Biology, College of Life Sciences, Chongqing Normal University, Chongqing 401331, China)
In this paper, we investigated how 17α-Ethynylestradiol (EE2) regulated the expression of three gonadotropin subunits in male Pelteobagrus fulvidraco. We cloned the full-length cDNA sequences of two subunits of gonadotropin hormone (FSHβ and LHβ) from the pituitary of Pelteobagrus fulvidraco by using RACE. We explored the tissue-specific and the seasonal pattern of expression of the genes. Male Pelteobagrus fulvidraco (2 years old) were exposed to EE2 (100 ng/L) for 28 days. We found that the length of FSHβ cDNA sequence was 528 bp and it contained a 399-bp open reading frame (ORF) which encoded a precursor protein of 132 amino acids (aa). The length of LHβ cDNA sequence was 870 bp and it contained a 417 bp ORF that encoded a precursor protein of 138 aa. The sequence analysis showed that FSHβ had a predicted signal peptide of 17 aa, 2 N-glycosylation sites, and 13 cysteine residues. LHβ had a predicted signal peptide of 18 aa, 1 N-glycosylation site, and 12 cysteine residues. The phylogenetic analysis showed that FSHβ and LHβ were closely related to other Siluriformes species. The tissue expression analysis suggested that all the gonadotropin subunits were expressed specifically in pituitary. The seasonal pattern of expression in both genders was that GtHα and LHβ mRNA peaked in May and then decreased gradually, and the expression of FSHβ in female also peaked in May but the expression in male remained unchanged. We applied semi-quantitative RT-PCR and demonstrated that the expression of the three gonadotropin subunits was dramatically suppressed by EE2. We speculated that EE2 might reduce the generation of FSH and LH in the pituitary of male Pelteobagrus fulvidraco, which would probably inhibit spermatogenesis and the maturation of sperm and spermiation, and consequently impair the testicular development and reproduction.
Yellow catfish; Gonadotropin hormone β subunits; cDNA cloning; Gene expression; 17α-Ethynylestradiol
X174
A
1000-3207(2015)06-1117-09
10.7541/2015.147
2014-11-24;
2015-03-02
重庆市科委项目(cstc2012jjA20006); 重庆市教委项目(KJ130622); 重庆师范大学校级项目(12 xlb005)资助
谭号(1989—), 男, 湖北利川人; 硕士研究生; 主要从事鱼类生殖生理和分子内分泌研究。E-mail: hardytam@163.com
刘智皓; E-mail: minenut@163.com
