超声诊断巨大隆突性皮肤纤维肉瘤1例
2015-02-24朱惠铭,宋军,郭建男等
超声诊断巨大隆突性皮肤纤维肉瘤1例
朱惠铭1,宋军1*,郭建男1,李闯1,杨迪2
(1.吉林大学中日联谊医院,吉林 长春130033;2.中国人民解放军第208医院)
1临床资料
患者女,76岁,10年前曾因腰背部一范围约15 cm×15 cm大小肿物在当地医院行手术治疗,术后未做病理。2个月前,原切口处发现一鸡蛋大小肿物,未治疗,肿块增大迅速,遂来我院求治。入院查体: 患者后背部见多个赘生性肿块,范围约20 cm×15 cm,质地不均匀,呈隆突结节状,部分表面破溃,可见脓性分泌物。
二维超声检查:肿物边界清楚、形态规则、内部呈不均匀性弱回声、周围未见淋巴结肿大,CDFI:内部血流丰富,见多支血管向病灶内延伸,呈树枝状(图1)。术后病理:大体见带皮组织一块,皮肤面积约19×14 cm2,皮肤表面见多个灰红、淡褐色突起,总体积8×8×2 cm3,切面灰红、灰白相间,质硬,镜下见肿瘤位于真皮层内,细胞呈梭形,形态较一致,排列成束状,车辐状,浸润皮下脂肪组织。诊断:隆突性皮肤纤维肉瘤。
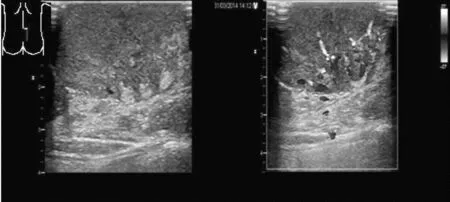
图1肿物边界清楚、形态规则、内部呈不均匀弱回声、周围未见淋巴结肿大,CDFI:内部血流丰富,见多支血管向病灶内延伸,呈树枝状
2讨论
隆突性皮肤纤维肉瘤(Dermatofibrosarcoma Protuberans,DFSP),是1890年由Taglor首次描述,1924年Darier和Ferrand把该病描述为“进行性复发性真皮纤维瘤”,最终由Hoffmann于1925年将其命名为DFSP沿用至今[1]。DFSP是一种发生于真皮层内的低度恶性纤维组织细胞肿瘤,该病多发生于20-50岁之间,男性发病率比女性高1.5-4倍,以躯干部、四肢近端为著。表现为暗红色隆起样肿块,多呈分叶状,质地较硬,可与皮肤粘连形成破溃,瘤体生长缓慢,具有侵袭性,局部易复发,但临床少见转移,预后较好[2]。因为DFSP的结构、形态常呈多样性,在早期瘤体活动度好,表皮完整,且不伴全身系统症状,因此早期诊断有一定难度,容易被误诊为良性肿瘤而做简单的局部切除,甚至在术后不做病理检查而导致漏诊[3]。如仅做局部简单切除术,往往易复发,有的甚至向恶性程度更高的纤维肉瘤、恶性纤维组织细胞瘤等转化[4]。
临床上DFSP发病率较低,且多活检确诊,因此影像学资料较少,据相关文献报道,CT及MRI对诊断DFSP缺乏特异性,CT平扫下,瘤体表现为等密度,边界清楚;增强后:瘤体强化明显,且不均匀,在MRI图像上表现为边界清楚的体表肿块,呈长T1长T2信号改变,有部分学者认为MRI可对DFSP做定位诊断,但MRI信号本身无特征性[5]。超声下表现为:肿体边界清楚、形态规则、内部呈现不均匀性弱回声、不伴局部淋巴结异常肿大、内部血流丰富[6]。本病例瘤体范围较大,临床较为少见。对比其它影像学检查,超声检查因其价格低廉、使用方便,可反复操作,且能够实时动态的观察瘤体内部组织及血流供应情况,特别是在术前,帮助外科医生了解肿瘤边界形态,对局部侵袭性进行客观评估,有助于手术完整切除瘤体,减少甚至避免复发。综上所述,超声检查应为首选的检查手段。超声对DFSP的评估或诊断,需紧密结合本病的临床特征,为治疗提供有意义的参考依据。
参考文献:
[1]杨连君,司小辉.隆突性皮肤纤维肉瘤的病理特点及其鉴别诊断[J].临床误诊误治,2005,18(12):904.
[2]郝永红,宋慧锋,许明火,等.隆突性皮肤纤维肉瘤诊断与治疗[J].中国美容医学,2013,22(20):2012.
[3]王配合,杨建民,孙志刚,等.误诊为瘢痕的皮肤隆突性纤维肉瘤[J].临床误诊误治,2005,18(6):453.
[4]冯先才,王荣,谢卫国.手术治愈巨大隆突性皮肤纤维肉瘤一例[J/CD].中华损伤与修复杂志:电子版,2012,7(2):206.
[5]朱熠,成官迅,高茜,等.隆突性皮肤纤维肉瘤的MRI和CT表现[J].中国介入影像与治疗学,2013,10(11):663.
[6]敬基刚,彭玉兰,罗燕,等. 超声诊断隆突性皮肤纤维肉瘤[J].中国医学影像技术,2009,25(10):1830.
(收稿日期:2014-08-21)
文章编号:1007-4287(2015)05-0847-02
*通讯作者
