miRNA在HPV相关肿瘤组织中的表达对比研究
2015-02-24丁建龙,吴文安,孟凡旭等
miRNA在HPV相关肿瘤组织中的表达对比研究
丁建龙1,吴文安2,孟凡旭3,邓萍3*
(1.陕西省汉中市3201医院 普外科,陕西 汉中723000;2.陕西省肿瘤医院 放疗科,陕西 西安710061;
3.吉林省肿瘤医院 妇瘤放疗科,吉林 长春130012)
人乳头瘤病毒(HPV)通过表达病毒癌基因,干扰机体正常信号转导、细胞因子活化及扰乱有效的细胞免疫应答形成了癌症发病的确切因素,但此过程需要经历长期且极其复杂的系列分子事件和多种编码基因与非编码基因的参与,并且在不同的感染部位,致癌的几率和病理过程差异很大[1,2];近年来,随着微小RNA(miRNA)的基因表达调控网络的逐渐发现,miRNA在肿瘤的发生、发展和转归过程的角色正成为基因调控领域的热点;目前已经明确许多miRNA在肿瘤发生发展等病理过程有表达水平的变化,并参与到病毒感染性疾病中与病毒的感染、清除、复制等过程,但miRNA是否参与HPV感染细胞免疫逃逸调控以及发挥的作用尚无定论。本研究应用实时定量PCR技术检测与HPV感染密切相关的宫颈癌、外阴癌和肛门癌中的miR21、miR29、miR31、miR101、miR143、miR126 、miR146和 miR155的表达量,并对比瘤体组织与癌旁正常组织中的表达差别,初步探讨HPV病毒感染致癌病理过程中不同miRNA的表达变化。
1材料与方法
1.1一般资料随机入组患者,签署知情同意书,收集门诊临床诊断为CA的组织样本,标本随即存放于高压灭菌的冻存管保存于液氮中。同时取洗体脱落细胞送检进行HPV杂交分型鉴定。收集和填写相关临床资料,包括性别、年龄、发病部位、病程、初发/复发、复发次数和基础疾病等信息。
1.2标本收集与处理①标本收集:收集本院妇外科、肛直肠外科2010年6月至2013年6月妇女子宫颈鳞癌30例、外阴鳞癌5例、肛门鳞癌2例;取样前均未经放疗、化疗、免疫治疗等治疗手段干预。年龄33~63岁,平均(47.26±7.32)岁。
②miRNA提取:提取和扩增应用miRNA提取试剂盒(Takara公司)抽提各组组织中的总mRNA。各个miRNA的特异性引物购自Takara公司。PCR扩增采用荧光定量PCR试剂盒(Takara公司)逆转录的反应体系为5 μl,反应条件为42℃ 60 min,70℃15 min, 4℃维持,将得到的5 μl cDNA加入20 μl荧光定量反应体系中,反应条件为预变性50℃ 2 min,95℃ 2 min,95 ℃15 s, 60 ℃30 s,72 ℃ 30 s; 40个PCR 循环,每次在延伸阶段读取吸光值,各样本检测重复3孔。以U6为内参照,利用其ΔCt值进行相对定量。即用同组中每个样本目的基因的Ct值减去的U6的Ct值得到ΔCt,再用观察组中目的基因的ΔCt减去对照组的△Ct得到ΔΔCt值,代入公式2-ΔΔCt计算即得到目的基因观察组/对照组的值,以对照组目的基因的值为1,计算各实验组miRNA的含量。

2结果
癌组织中miR15b、miR21、miR155表达量高于癌旁正常组织,差异具有统计学意义(P<0.05)。miR-145、miR34a、miR143、miR218表达量低于癌旁正常组,宫颈癌组miR145、miR218;外阴、肛门癌组miR143与癌旁组差异均有统计学意义(P<0.05)。miR146a仅在宫颈癌组显示出了明显的增高趋势,而外阴、肛门癌组miR146a未见明显的表达变化,且两癌性组组间表现出明显的差异(P<0.05)。miR218的表达明显降低,尤其在宫颈癌组更为显著,且宫颈癌组与外阴、肛门癌组组间表现出显著的差异(P<0.05)。见表1。
3讨论
HPV感染与宫颈癌、外阴癌、肛门癌的发生发展具有密切的关联,宿主受到高危亚型HPV感染后,其会整合宿主染色体,通过癌蛋白影响抑癌蛋白的活性,使其失活从而引起癌症的发生。但三种疾病的发病率有着巨大的差异,在发病率相对较高的宫颈癌患者中,也仅是由大约2%的HPV感染患者转变而来;而外阴癌和肛门癌更为罕见。这异味着一些重要的扳机点在病毒致癌的病理过程中起到关键作用,而miRNA是重要的研究方向。
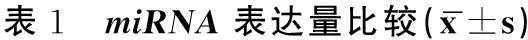

GroupmiR15bmiR21miR146amiR155miR145miR34amiR143miR218宫颈癌1.32±0.47*2.16±0.79*3.17±0.66*1.03±0.570.34±0.16*0.44±0.070.33±0.110.26±0.05*宫颈癌癌旁11111111外阴、肛门癌0.99±0.32*1.67±0.17*0.98±0.24△0.86±0.320.45±0.060.32±0.120.20±0.01*0.52±0.08△外阴、肛门癌癌旁11111111
*vs癌旁P<0.05,△vs宫颈癌P<0.05
目前关于HPV与miRNA之间的相关性还没有统一的认识,本实验的结果显示,在宫颈癌、外阴、肛门癌癌组织中miR15b、miR21表达量高于癌旁正常组织,差异具有统计学意义(P<0.05),这意味着所检测的具有原癌基因特性的微小RNA,可能在HPV感染致癌过程中发挥了作用;而值得注意的是,miR146a并没有在外阴、肛门癌组织中表达增高,这意味着miR146a可能具有宫颈癌特异性,且与HPV感染相关性较弱。目前关于miR-146a在肿瘤发生发展中的作用尚存争议,且miR-146a在不同类型肿瘤组织中的表达存在差异。研究表明子宫颈癌、Burkitts淋巴瘤等中其过表达,而miR-146a在前列腺癌等肿瘤组织中表达程下降趋势[3-6]。目前认为miR-146a靶基因较为复杂,包括了p53等抑癌基因及kit癌基因等。本实验结果标明其可能具有宫颈癌特异性,这可能由于miR-146a的靶基因是核因子κB依赖基因[7]。miR146a能否成为指示宫颈癌病理过程的特异性生物标志物,有待于进一步的深入探索。miR-21位于染色体脆弱区域,与HPV与宿主整合DNA的区域重合[8],可能对肿瘤的发生有重要作用。
目前miR-145、miR34a、miR143、miR218均被认为是抑癌基因[9-11],但其与HPV感染的关系尚未明确。本实验中,在宫颈癌、外阴、肛门癌癌组织中miR-145、miR34a、miR143、miR218表达量低于癌旁正常组织,其中宫颈癌组miR145、miR218;外阴、肛门癌组miR143与癌旁组差异均有统计学意义(P<0.05),在HPV感染致癌过程中体现出了抑癌基因的功能。而miR218的表达明显降低,尤其在宫颈癌组更为显著,且宫颈癌组与外阴、肛门癌组间间表现出显著的差异(P<0.05),这可能和HPV亚型相关,可能是不同亚型病毒miRNA相互作用的结果。而miR34a、miR143在两组癌组织中表达量并没有显示出差异,可能其与HPV感染关系较弱[12,13]。
目前的研究发现,HPV与宿主染色体的整合及相关miRNA在其中的调控作用的失衡,是细胞癌变过程的重要步骤。本文中三种疾病有着完全不同的发病过程及发病率,这也预示着癌症的发生发展经历了不同的分子机制及调控过程,而这一过程的深入探索,可能得到HPV致癌机理,并进一步让获取靶向性的癌症的发生发展的分子阻遏位点成为可能,并可通过借助于表达差异对肿瘤及其分化转归情况进行诊断、预测,针对性的进行反义阻抑或表观治疗,或者成为肿瘤患者预后的评估指标。
参考文献:
[1]Au Yeung CL,Tsang TY,Yau PL,et al.Human papillomavirus type 16 E6 induces cervical cancer cell migration through the p53/micro-RNA-23b/urokinase-type plasminogen activator pathway[J].Oncogene,2011,30(21):2401.
[2]Myklebust MP,Bruland O,Fluge O,et al.MicroRNA-15b is induced with E2F-controlled genes in HPV-related cancer[J].Br J Cancer,2011,105(11):1719.
[3]Igoucheva O,Alexeev V.MicroRNA-dependentregulationofcKitincutaneousmelanoma[J].Biochem Biophys Res Common,2009,379(3):790.
[4]Felicetti F,Errico MC,Bottero L,et al.Thepromyelocy ticleukemiazincfinger-microRNA-221/-222 pathway control smelanomapro-gression through multipleon cogenicme chanisms[J].Cancer Res,2008,68(8):2745.
[5]Lin SL,Chiang A,Chang D,et al.Loss of miR-146 function in hormone-refractory prostate cancer[J].RNA,2008,14(3):417.
[6]LI Y,Vandenboom TG,Wang Z,et al.miR-146 asuppressesin vasion of pancreatic cancer cells[J].Cancer Res,2010,70(4):1486.
[7]Cameron JE,Yin Q,Fewell C,et al.Epstein-Barrvirus latentmem-brane protein induces cellular Micro RNAmiR-146a,amodulatorofly mphocyte signaling pathways[J].Virol,2008,82(4):1946.
[8]Cheng AM,Byrom MW,Shelton J,et al.Antisense inhibitionofhuman miRNA sandindications for aninvolvement of miRNA incellgrowth and apoptosis[J].Nucleic Acids Res,2005,33(4):1290.
[9]Lui WO,Pourman DN,Patterson BK,et al.Pattern sofknownandnovel small RNA sinhuman cervical cancer[J].Cancer Res,2007,67(13):6031.
[10]Wang X,Tang S,Le SY,et al.Aberrantexpressionofoncogenicandtumor-suppressivemicro RNA sincervicalcancerisrequiredforcancercellgrowth[J].PLoS One,2008,3(7):2557.
[11]Martinez I,Gardiner AS,Board KF,et al.Human papillomavirus type 16reduces the expression of microRNA-218 in cervicalcarci-nomacells[J].Oncogene,2008,27(18):2575.
[12]Martinez I,Gardiner AS,Board KF,et al.Human papillomavirus type 16reduces the expression of microRNA-218 in cervicalcarci-nomacells[J].Oncogene,2008,27(18):2575.
[13]Wang X,Wang HK,McCoy JP,et al.Oncogenic HPV in fection interruptsthee xpression of tumor-suppressive miR-34 at hrough viralonco protein E6[J].RNA,2009,15(4):637.
(收稿日期:2014-09-11)
文章编号:1007-4287(2015)05-0803-03
*通讯作者
