IL-10、IL-17在子宫内膜癌中的表达及其与临床病理的关系
2015-02-24欧阳小明,史文静,冀天星等
IL-10、IL-17在子宫内膜癌中的表达及其与临床病理的关系
欧阳小明,史文静,冀天星,郝卓芳,廖德贵
(广州医科大学附属第二医院,广东 广州510260)
子宫内膜癌(endometrial carcinoma)作为临床常见的妇科恶性肿瘤,多发生于50岁及以上的绝经妇女,并且其发病率有呈逐渐升高的趋势,严重威胁患者的健康和生命质量。关于其发病机制,目前尚无统一结论,有研究证实多种细胞因子可能参与了子宫内膜癌的发生及发展过程[1]。白细胞介素10(interleukin-10,IL-10)主要由T调节细胞(regulatory T cells,Treg)分泌,具有抑制功能性T淋巴细胞活性和抗肿瘤免疫反应等功能。T辅助淋巴细胞(T helper 17 cells,Th17)作为可以诱导组织产生炎症反应的CD4+T细胞亚群,它通过分泌白细胞介素17(interleukin-17,IL-17)使中性粒细胞聚集而引起机体产生炎症性反应。有研究表明Treg和Th17保持平衡可维持机体的免疫稳态,失衡将导致机体发生癌变,而这种失衡与癌症的临床病理因素也有关[2]。本研究试图通过检测子宫内膜癌患者体内IL-10和IL-17的表达,以探讨其与临床病理特征之间的关系。
1资料与方法
1.1 一般资料
选择2012年1月-2014年1月我院收治的子宫内膜癌和良性子宫病变患者为研究对象。子宫内膜癌63例,年龄36-71岁,平均(55.0±6.3)岁,其中绝经45例,未绝经18例;内膜样腺癌39例,内膜样腺癌伴鳞化14例,内膜样腺癌伴黏液性腺癌10例;IA期43例,IB期15例,Ⅱ期5例;G1级32例,G2级24例,G3级7例;肿瘤大小≤1 cm者15例,1-2 cm者28例,≥2 cm者20例;未出现肌壁浸润者40例,浸润≤1/2肌壁者19例,浸润>1/2肌壁者4例。良性子宫病变患者175例,年龄33-75岁,平均(53.3±7.5)岁,其中绝经126例,未绝经者49例;子宫肌瘤者58例,子宫腺肌瘤73例,子宫内膜异位症者44例。 纳入标准:①所有的患者术后均经病理检查结果确诊;②子宫内膜癌的病理分期标准参照2009年国际妇产联盟(FIGO)子宫内膜癌手术-病理分期[3];③两组患者无自身免疫性疾病;④术前无放化疗史;⑤患者及家属知情同意,并签署知情同意书;⑥符合医学伦理学要求。子宫内膜癌手术的范围包括广泛子宫切除术及双附件切除术,如果出现恶性肿瘤浸润肌层、中或低分化或者特殊的组织类型时进行的是盆腔淋巴结清扫手术,单纯的子宫切除手术已经排除了恶性肿瘤。
1.2 方法
1.2.1标本采集手术前1天,分别抽取患者外周静脉血3 ml,并以255 r/min的速度进行离心5 min,将离心后的上清液置于EP试管中保存在-80℃环境下,留待后用。手术后半小时内切取小块子宫内膜组织并以10%的福尔马林进行固定,标本均采用苏木素-伊红(HE)和链霉亲和素-生物素-过氧化物酶复合物免疫组织化学(SABC-IHC)染色。
1.2.2检测方法采用双夹心酶联免疫吸附法(ELISA)测定患者的血清IL-10和IL-17水平,IL-10、IL-17的ELISA试剂盒均由美国R&D公司提供,吸光度值采用酶标仪为美国BIORAD680型测量,波长为450 nm,操作过程严格按照试剂盒说明书进行;将SABC-IHC染色的组织标本切厚度为4 μm的薄片并常规脱蜡脱水→1份3%的双氧水+10份蒸馏水→在室温下,灭活内源性过氧化物酶10 min,并以浓度为0.01 mol/L的枸橼酸盐进行抗原修复后再5%BSA室温下保存10 min→4℃下孵育1∶100兔抗人IL-10单抗(由北京博奥森公司提供)+1∶50兔抗人IL-17单抗(Abcam公司提供)→37℃下孵育30 min的1∶100羊抗兔IgG(武汉博士德公司提供)+37℃下孵育30 min的1∶100链霉亲和素-生物素-过氧化物酶复合物(武汉博士德公司提供)→室温下DAB(武汉博士德公司提供)显色5-30 min→显微镜下控制显色时间,并以苏木素复染色2 min+脱水+透明的中性树胶进行封片,并在显微镜下观察。其中阴性对照选用PBS代替一抗。最后通过IPP6.0图像软件以分析高倍镜视野(×200)的积分光密度值(integrated option density,IOD),而切片的IOD值为5个高倍镜视野下的IOD平均值。
1.3 统计学分析
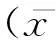
2结果
2.1 子宫内膜癌与良性子宫病变患者血清IL-10、IL-17的表达情况比较
子宫内膜癌患者与良性子宫病变患者的血清IL-10、IL-17水平比较,差异有统计学意义(P<0.05),子宫内膜癌患者的血清IL-10、IL-17水平均高于良性子宫病变。见表1。
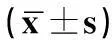
表1 子宫内膜癌及良性子宫病变患者血清IL-10、
2.2 子宫内膜癌与良性子宫病变患者组织中IL-10、IL-17表达的IOD值比较
SABC-IHC染色结果显示抗原阳性物在显微镜下呈现为棕黄色或者棕褐色的颗粒,在肿瘤细胞以及间质细胞的细胞质中可见IL-10、IL-17的表达,并且经定量分析发现,IL-10、IL-17在子宫内膜癌和良性子宫病变中的表达差异有统计学意义(P<0.05),子宫内膜癌组织中IL-10、IL-17的IOD值高于良性子宫病变。见表2。
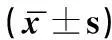
表2 子宫内膜癌与良性子宫病变患者组织中IL-10、
2.3 子宫内膜癌患者的血清IL-10、IL-17与临床病理特征之间的关系
子宫内膜癌患者血清IL-10、IL-17在不同分期、不同细胞分级、有无肌层浸润时,表达差异有统计学意义(P<0.05),FIGO IA期、G1级以及无肌层浸润的子宫内膜癌患者血清IL-10水平最低,而IL-17水平则最高;血清IL-10、IL-17的表达在不同组织学类型、肿瘤大小中的差异无统计学意义(P>0.05)。见表3。
3讨论
子宫内膜癌作为女性生殖系统常见的恶性肿瘤,常发生于绝经期以及绝经后女性的上皮组织,发病率仅次于卵巢癌和宫颈癌。由于子宫内膜癌发病早期无特异性的临床表现,因此很难通过临床表现进行筛查和诊断,而通过了解子宫内膜癌的发病机制,可为临床初步筛查子宫内膜癌作出重要指导。
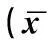
表3 子宫内膜癌患者的血清IL-10、IL-17与临床病理
有研究证实许多细胞因子参与了恶性肿瘤的免疫学机制,IL-10是由Treg分泌的细胞因子,在宫颈癌的相关研究中,IL-10在宫颈癌以及子宫颈上皮内瘤变中的表达高于健康对照组,提示IL-10参与了机体的抗肿瘤免疫反应[4]。Th-17作为CD4+T细胞亚群,它通过参与机体的自身免疫性疾病、肿瘤以及移植物抗宿主等的发生及发展过程而介导炎性反应,并且影响疾病的预后。IL-17作为一种含有多种功能的细胞因子,主要由Th-17所分泌,因此在机体的免疫反应中也具有重要作用。
作者查阅相关文献发现,关于IL-10、IL-17在子宫内膜癌发生机制中的作用的研究还相对较少,本研究试图从这一角度出发,对子宫内膜癌的发生机制展开研究。结果显示,子宫内膜癌患者的血清IL-10水平均高于良性子宫病变,差异有统计学意义。说明Treg细胞分泌的IL-10参与了机体对恶性肿瘤的免疫耐受过程,与有关研究结果一致[5]。并且子宫内膜癌患者的血清IL-17高于良性子宫病变,可能与子宫内膜癌时,可能诱导机体发生炎症性反应,从而引起机体的Th-17分泌IL-17来介导机体的免疫反应有关。SABC-IHC染色结果发现子宫内膜癌组织中IL-10、IL-17的IOD值均高于良性子宫病变,进一步说明了子宫内膜癌时,炎症因子参与了机体的免疫过程,从而增强机体的抗肿瘤免疫能力,与相关研究结果一致[5]。
有研究表明Treg/Th17保持平衡状态有利于机体维持免疫稳定,而失衡将导致机体产生各种恶性病变,并且临床研究证实Treg的水平可以评估宫颈癌的分化程度,Th-17的水平则与宫颈癌的临床病理特征如临床分期以及有无转移等,有明显的正相关关系[6]。本研究结果显示,子宫内膜癌患者血清IL-10、IL-17在不同分期、不同细胞分级、有无肌层浸润时表达差异有统计学意义,FIGO IA期、G1级以及无肌层浸润的子宫内膜癌患者血清IL-10水平最低,而IL-17水平最高。结果提示子宫内膜癌进展越快,IL-10水平越高,而IL-17越低,因此两者可作为评估子宫内膜癌进展情况的重要指标。而在不同组织学类型以及肿瘤大小中,血清IL-10,IL-17的表达无差异,与有关研究结果相似[7]。
综上所述,IL-10,IL-17可能参与了子宫内膜癌的发生及发展过程,而通过检测两者在子宫内膜癌中的表达可评估恶性肿瘤的进展情况,从而为临床治疗提供指导。
参考文献:
[1]Santacana M,Maiques O,Valls J,et al.A 9-protein biomarker molecular signature for predicting histologic type in endometrial carcinomaby immunohistochemistry[J].Hum Pathol,2014,45(12):2394.
[2]Maruyama T,Kono K,Mizukami Y,et al.Distribution of Th17 cells and FoxP3(+) regulatory T cells in tumor-infiltrating lymphocytes,tumor-draining lymph nodes and peripheral blood lymphocytes in patients with gastric cancer[J].Cancer Sci,2010,101(9):1947.
[3]Colombo N,Preti E,Landoni F,et al.Endometrial cancer:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2011,22(6):35.
[4]刘骥,黄明莉,王宝菊,等.子宫内膜癌血管生成相关因子的研究进展[J].现代生物医学进展,2014,14(9):1790.
[5]李林,程矗,段瑞岐,等.IL-10、IL-17在子宫内膜癌中的表达及意义[J].四川大学学报(医学版),2014,45(5):793.
[6]李林,程矗,段瑞岐,等.白细胞介素-10,-17及叉状/翼状螺旋转录因子,维甲酸相关孤儿受体-γt在子宫内膜癌中的表达及意义[J].中华妇幼临床医学杂志(电子版),2013,9(5):599.
[7]Yamagami W,Susumu N,Tanaka H,et al.Immunofluorescence-detected infiltration of CD4+FOXP3+ regulatory T cells is relevant to the prognosis of patients with endometrial cancer[J].Int J Gynecol Cancer,2011,21(9):1628.
(收稿日期:2014-06-09)
文章编号:1007-4287(2015)05-0791-03
