HSP65-PEAⅠ融合蛋白表达纯化及免疫效果研究
2015-02-24张国利岳玉环吴广谋侯天全
何 苗,张国利,陈 萍,田 园,岳玉环,吴广谋,于 佳,2,史 飞,2,侯天全
(1.吉林农业大学食品科学与工程学院,吉林 长春130118;2.军事医学科学院军事兽医研究所,吉林 长春130122;
3.吉林省人兽共患预防与控制重点实验室 省部共建重点实验室,吉林 长春130122)
HSP65-PEAⅠ融合蛋白表达纯化及免疫效果研究
何苗1,2,3,张国利2,3*,陈萍1,田园2,3,岳玉环2,3,吴广谋2,3,于佳1,2,史飞1,2,侯天全2,3
(1.吉林农业大学食品科学与工程学院,吉林 长春130118;2.军事医学科学院军事兽医研究所,吉林 长春130122;
3.吉林省人兽共患预防与控制重点实验室 省部共建重点实验室,吉林 长春130122)
摘要:目的通过基因工程手段在大肠杆菌中表达并纯化融合蛋白HSP65-PEAⅠ,建立小鼠实验模型,检测其抗体效价水平,初步评价免疫效果。方法扩增HSP65-PEAⅠ片段插入表达载体pET-28a中,转化E.coliBL21(DE3),IPTG诱导表达,优化纯化条件,以HSP65-PEAⅠ为免疫原对小鼠进行免疫接种。结果双酶切和测序鉴定结果证实HSP65-PEAⅠ成功克隆入pET-28a载体中,表达的重组蛋白相对分子量约为97 000,主要以包涵体形式表达,纯化后的重组蛋白纯度达90%,浓度为0.498 mg/ml。免疫小鼠均在首免1周后采集的血清中检测到特异性抗体,抗体效价水平持续增长且在42天均达到了210。结论成功在E.coli中表达并经过纯化得到重组蛋白HSP65-PEAⅠ,确定了动物免疫程序,为制备抗烧烫伤多器官衰竭疫苗奠定了基础。
(ChinJLabDiagn,2015,19:0700)
绿脓杆菌(Pseudomonasaeruginosa,PA)亦称铜绿假单胞菌,是革兰阴性杆菌,能够运动[1]。广泛存在于自然界中,绿脓杆菌能够引起伤口感染,人的角膜炎和关节炎等[2],其感染可使机体各个脏器组织病变,严重可致死。绿脓杆菌的毒素残留还能引起食物中毒[3]。1973年Liu等[4]提出了其主要致病因子是绿脓杆菌外毒素A(PseudomonasaeruginosaexotoxinA,PEA),并且约90%的临床分离株能产生PEA。成熟PEA为613个氨基酸组成的多肽链,分子量约为66000,含有三个不同的结构区域,其中区Ⅰ是氨基末端区(Ⅰa:第1-252位氨基酸和Ⅰb第365-404位氨基酸),Ⅰa亚基与靶细胞结合实现毒素分子发挥毒性作用,Ⅰb亚基的功能尚未明确,即使有大部分缺失也不会影响PEA的生物活性;区Ⅱ是中央区(第253-364位氨基酸)含有6个连续α螺旋,有助于毒素跨膜转位;区Ⅲ是羧基端区(第405-613位氨基酸),行使细胞结合功能和ADP-核糖基化作用[5]。PEA的作用机理为毒素分子通过Ⅰa亚基与靶细胞表面特异性受体相结合,形成毒素-受体-膜复合物后进入细胞,ADP-核糖基化转移酶发生作用导致肽链延长被终止,蛋白合成受到抑制,最终细胞死亡[6]。PEA是烧烫伤患者绿脓杆菌感染后引起多器官衰竭的最大危害因素。
热休克蛋白(heatshockprotein,HSP)是指生物在遭受高温或其他应激产生的一类高度保守的蛋白质。被认为是生物进化中比较保守的成分,不同种细胞产生的HSP分子序列绝大部分相同或类似[7]。在应激状态下,HSP可防止其他蛋白质发生变性或解聚,使其恢复活性,一般将HSP称为分子伴侣[8]。目前已发现的HSP有10多种,主要的分为HSP90家族,HSP70家族,HSP60以及小分子亮HSP家族[9]。其中热休克蛋白65属于HSP60家族,主要参与蛋白质的折叠、解折叠和组配,具有很强的免疫原性。在免疫中HSP通常可以作为佐剂、抗原和抗原载体,都能提高其免疫效果[10]。
本研究成功改造了重组基因HSP65-PEAⅠ,加入了HisTag标签便于重组蛋白的纯化。经诱导表达纯化最终得到了纯度较高的重组蛋白,研究了动物免疫程序,进一步为预防和治疗食源性绿脓杆菌感染、烧烫伤病人多器官衰竭综合症的研究奠定了基础。
1材料与方法
1.1 质粒及菌种
pET-28a载体、质粒pET-28a-HSP65-PEAⅠ(质粒pET-28a-HSP65由吉林大学王丽颖教师惠赠)、E.coliJM109及E.coliBL21(DE3)均为军事医学科学院军事兽医研究所六室保存。
1.2 试验动物
SPF级成年昆明鼠,购自长春生物制品研究所有限责任公司,动物合格证号:SCXKC(j)2011-003。
1.3 主要试剂
限制性内切酶HindⅢ和NotⅠ、T4DNA连接酶、DNA Marker DL5000 均购自宝生物工程(大连)有限公司;蛋白质彩虹Marker购自北京全式金生物技术公司;卡那霉素购自宝泰克生物技术有限责任公司;质粒提取试剂盒和DNA凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司;Chelating SepharoseTM Fast Flow,SephadexTMG-25 Fine,Q Sepharose High performance,DEAE Sepharose Fast Flow均购自美国GE公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;HRP 标记的羊抗鼠IgG均购自武汉博士德生物工程有限公司;LB培养基(10 g蛋白胨,5 g酵母提取物,10 g NaCl,定容到1 L,pH7.5);ELISA:包被液(2.93 g NaHCO3,1.95 g Na2CO3,定容到1 L,pH9.6);封闭液(3%奶粉, PBS溶液配制);洗涤液(8.0 g NaCl,0.2 g KH2PO4,2.9 g Na2HPO4·12H2O,0.2 g KCl,0.5 ml Tween-20,定容到1 L,pH7.4);底物溶液(51.4 ml 0.1 mol/L 柠檬酸,48.6 ml 0.2 mol/L Na2HPO4·12H2O,两者混合用时取100 ml,加40 mg 邻苯二胺,30% H202);终止液(2 mol/L H2SO4)。
1.4 引物设计及合成
为使重组蛋白便于纯化,在原有的重组质粒基础上添加了HisTag标签,故委托宝生物工程(大连)有限公司合成引物:
上游:5’-CCAAGCTTCCAAGACAATTGCGTACGACGAAG-3’
下游:3’-GAGTGCGGCCGCTTAGTCGACCTGGTTCCACG-5’
1.5 目的片段扩增
以pET28a-HSP65-PEAⅠ质粒为模版,PCR扩增目的基因片段。反应体系:dNTP mixture 2.0 μl;10×Buffer 2.0 μl;MgCl22.0 μl;酶0.2 μl;Template 1 μl;上下游引物各1 μl;无菌去离子水补足至25 μl。反应条件:95℃预变性5 min;94℃ 60 s、55℃ 80 s、72℃80 s,34个循环;72℃延伸10 min,4℃冷却,1%琼脂糖凝胶电泳鉴定。按试剂盒中使用说明书回收PCR产物。
1.6 重组质粒pET28a- HSP65-PEAⅠ的构建
用Hind Ⅲ和NotⅠ双酶切PCR产物及载体pET-28a,产物进行1%琼脂糖凝胶电泳后,用DNA凝胶回收试剂盒回收目的基因,以T4DNA连接酶16℃连接过夜。将连接产物转化感受态E.coliJM109,并涂布于含50 μg/ml Kan 的LB平板上,37℃恒温培养过夜。挑取转化菌落,扩大培养并提取质粒,用Hind Ⅲ和NotⅠ双酶切鉴定。阳性菌株质粒委托宝生物工程(大连)有限公司,利用T7 promotor引物测序鉴定。
1.7 重组质粒的转化与重组蛋白表达
将测序正确的重组质粒转化感受态E.coliBL21(DE3),挑取阳性单菌落,转接于含50 μg/mL Kan 的LB培养基,37℃培养至菌液OD600约为0.8时,加入IPTG至终浓度为1 mmol/L,32℃诱导4 h后,取1 ml菌液超声破碎(功率400 w,工作时间10 s,间歇20 s,共10 min),4℃,10 000×g离心20 min,沉淀以1 ml 25 mmol/L 的Tris-Cl(pH7.5)重悬。分别取20 μl上清和沉淀重悬液进行12% SDS-PAGE分析。
1.8 重组蛋白的纯化
1.8.1菌体发酵菌种经在LB培养基上划线培养进行复苏,37℃恒温培养过夜。挑取单菌落转接于含50 μg/ml Kan 的LB培养基,37℃培养至菌液OD600约为0.5时,继续转接于1L LB液体培养基,37℃培养至菌液OD600约为0.5后,接入发酵罐中,发酵参数为:灭菌温度121℃,发酵温度37℃,溶氧量30%,pH7.2,通气量2.5 MVV,罐压0.04 MPa。发酵过程当中加入:葡萄糖200 g/L,KH2PO43.0 g/L,补料培养基(蛋白胨48g,酵母粉 96 g,甘油32 ml,K2HPO4 65.5 g,定容至1 500 ml),Antifoam 204 2 ml,Kan 1 g。发酵至OD600≈9.9降温至30℃,加入诱导剂IPTG至终浓度1 mM,诱导5小时,当溶氧开始逐渐下降时,发酵结束,放罐4℃离心收集菌体。
1.8.2包涵体的洗涤、裂解以及复性取发酵菌10 g用100 ml 20 mmol/L Tris-Cl(pH 7.5)重悬,超声波破碎(功率1 200 W、工作时间10 S、间隔时间20 S、共60次),镜检确定菌体破碎完全,4℃,12 000×g离心10 min,收集沉淀。沉淀用100 ml 2%Triton-×100和2M Urea 20 mmol/L Tris-Cl(pH 7.5)依次充分洗涤后,4℃,12 000×g离心10 min,收集沉淀。用20 ml 8 M Urea 20 mmol/L Tris-Cl(pH 7.5)重悬沉淀30℃裂解30 min,12 000×g离心10 min后收集上清,加入20 ml 20 mmol/L Tris-Cl(pH 7.5)溶液,使Urea的终浓度为4M。依次用2L的3M Urea、2M Urea、1M Urea,20 mmol/L Tris-Cl(pH 7.5)溶液于4℃透析复性,复性液中同时加入GSH和GSSG,比例为5∶1。透析后于4℃,12 000×g离心10 min,收集上清液用于进一步纯化。
1.8.3重组蛋白HSP65-PEAⅠ层析纯化取粗制样品,进行Q Sepharose High performance阴离子交换层析(柱床体积为10 ml,柱型为XK16),用20 mmol/L Tris-Cl(pH 7.5)平衡约5倍柱床体积(流速:3 ml/min),以1.0 ml/min流速上样后,分别用20 mmol/L Tris-Cl(pH 7.5),0.25 mmol/L、0.5 mmol/L NaCl 进行阶段洗脱,收集目的蛋白峰。收集的目的蛋白部分用SephadexTM G-25 Fine层析柱(柱床体积50 ml)脱盐,脱盐后的样品进行金属螯合层析(Cu2+)(柱床体积为10 ml,柱型为XK16),用20 mmol/L Tris-Cl(pH 7.5)平衡约5倍柱床体积(流速:3 ml/min),以1.0 ml/min流速上样后,分别用20 mmol/L Tris-Cl(pH 7.5),50、200 mmol/L咪唑进行阶段洗脱,收集目的蛋白峰,进行12%SDS-PAGE分析,并用BCA试剂盒测定蛋白浓度。
1.9 免疫实验
将70只昆明小鼠随机分成7组,每组雌雄各半,分别为A、B、C、D、E、F、G组。A组为生理盐水对照组,皮下注射与免疫组相同体积的生理盐水;B、C、D、E组HSP65-PEAⅠ免疫蛋白组,给予实验鼠皮下注射免疫蛋白,其中B组免疫剂量为100 μg/只,C组免疫剂量为50 μg/只,D组免疫剂量为20 μg/只,E组免疫剂量为10 μg/只;F组为弗氏佐剂组,100 μg重组蛋白与弗氏佐剂等体积混合;G组为铝盐佐剂组,100 μg重组蛋白与铝盐佐剂等体积混合。免疫共4次,每次免疫间隔14天。
1.10 抗体效价测定
在免疫的第7、14、21、28、35、49天,对七组实验鼠分别进行尾静脉取血,利用间接法ELISA测定抗体效价。用1 μg/ml的HSP65-PEAⅠ(100 μl/孔)包板,4℃过夜,洗涤3次,同时做空白阴性对照,每份样品做复孔。2%的奶粉37℃封闭2 h,洗涤3次;加入梯度稀释的被检血清(100 μl/孔),37℃孵育1 h,洗涤3次;加入1∶2 500的HRP 标记的羊抗鼠IgG(100 μl/孔),37℃孵育1 h,洗涤3次;加入OPD显色液(100 μl/孔)室温避光20-30 min,然后加入终止液(50 μl/孔),490 nm波长下测定OD值,OD490≥1即为阳性结果。
2结果
2.1 重组表达质粒的鉴定
重组表达质粒pET28a-HSP65-PEAⅠ的双酶切(Hind Ⅲ/NotⅠ)产物经1%的琼脂糖凝胶电泳分析,可见2 500 bp的基因片段和pET-28a载体片段,见图1。测序结果显示,插入载体的基因片段与设计完全一致,未发现碱基突变或缺失等现象,表明HSP65-PEAⅠ基因片段以正确的阅读框架克隆至表达载体pET-28a中。
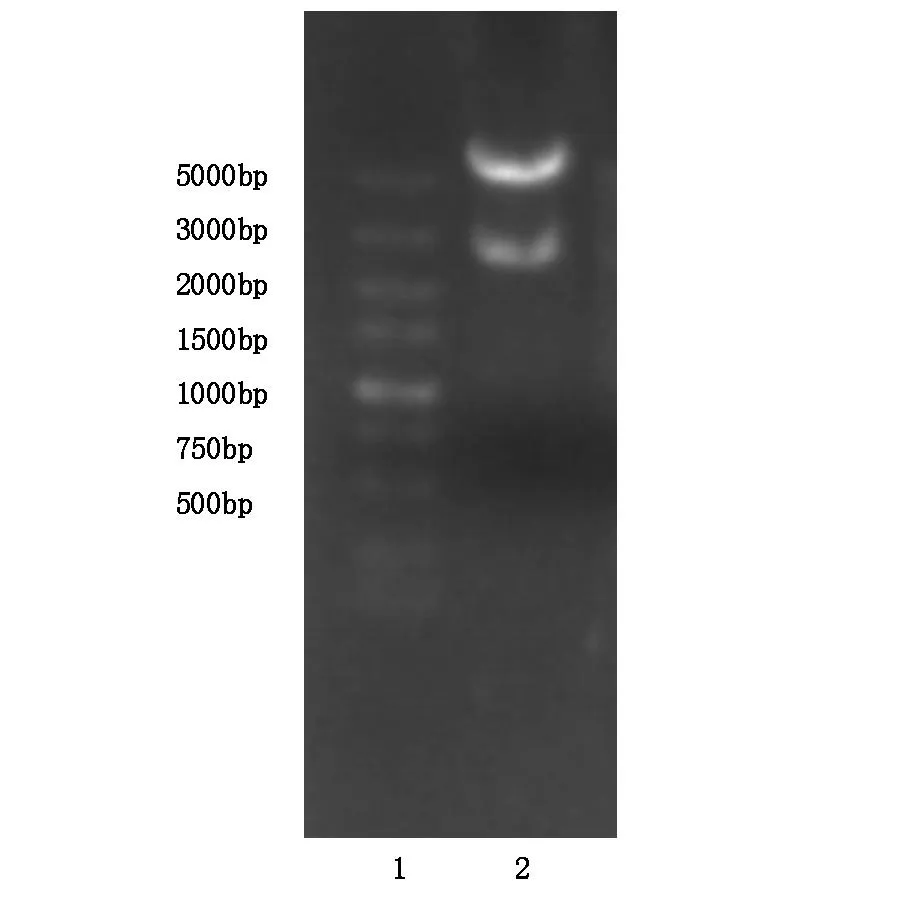
1:Maker;2:重组表达质粒pET28a-HSP65-PEAⅠ双酶切后
2.2 层析纯化结果
12%SDS-PAGE分析显示,粗制样品经阴离子交换层析和金属螯合层析后最终得到了较纯的目的蛋白,纯度达90%以上,见图2。得出样品蛋白浓度为0.498 mg/ml,蛋白收率为4.2 mg/g湿菌。
2.3 抗体滴度结果
间接ELISA法测定免疫第7、14、21、28、35、49天小鼠血清的抗体效价,见图3。测定结果显示,在免疫一周后效价水平开始持续增长,并且在免疫42天蛋白免疫组抗体效价均达到了210,佐剂免疫组明显高于蛋白免疫组,其中铝盐佐剂组免疫效果尤为显著,效价水平达到了216,弗氏佐剂组略微低达到了215。

M:蛋白质Marker;1:Q层析后样品;2:金属螯合层析后样品
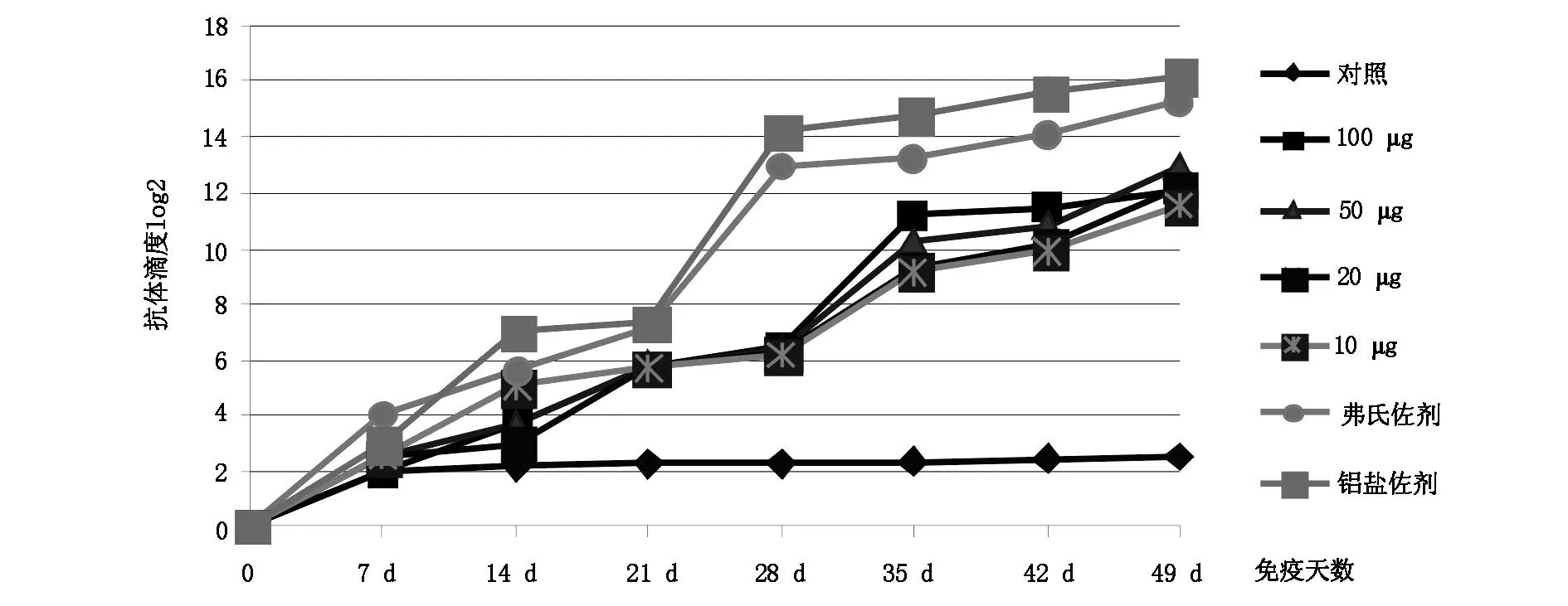
图3 抗体滴度曲线
3讨论
本实验将重组基因HSP65-PEAⅠ克隆到pET-28a载体中,构建了重组表达质粒pET-28a- HSP65-PEAⅠ,转化E.coliBL21(DE3)后,经诱导表达,蛋白在细菌的胞内以不可溶形式表达。由于重组蛋白相对分子量较大不利于纯化,所以设计增加了组氨酸标签,使得重组蛋白能与金属螯合层析介质相结合,提高了重组蛋白的纯化效率和纯度。包涵体经2%Triton-×100和2M Urea洗涤后,透析复性后,经Q Sepharose High performance阴离子交换层析、SephadexTM G-25 Fine层析柱和金属螯合层析(Cu2+),获得纯度达90%以上的HSP65-PEAⅠ。
PEA受体结合亚基的高度保守性能够诱发机体产生针对多血清的PEA抗体,热休克蛋白的免疫提呈增强、免疫原复性,体内蛋白保护,抗炎症扩散等作用刺激机体产生高效价抗体。本研究利用了PEAⅠ的高度保守性和HSP65的分子伴侣作用,制备的特异性抗PEA的免疫制剂,具有一体双效的作用。免疫试验结果显示注射疫苗7 d后即可检测到抗体,随着免疫时间延长抗体滴度呈现明显上升趋势,在免疫的第42天无佐剂组都达到了210,佐剂组达到了215,说明疫苗对绿脓毒素表现出较强的免疫保护性,在生产实践中具有十分广阔的应用前景,且该疫苗在动物免疫攻毒试验中继续做深入研究,为进一步开发应用于临床的抗绿脓杆菌感染的免疫制剂奠定坚实基础。
参考文献:
[1]韩青松,简永利,涂宜强,等.绿脓杆菌研究进展[J].畜牧与饲料科学,2012,33(1):122.
[2]李毅.绿脓杆菌角膜溃疡临床分析[J].张家口医学报,1999,16(3):51.
[3]艾启俊,于庆华,张红星,等.PCR技术检测编码绿脓杆菌外毒素A基因[J].中国食品学报,2006,6(6):117.
[4]Liu PV,Heish H.Exotoxins of Paeruginosa Ⅲ.Characteristic of antitoxin A[J].Infect Dis,1973,128:520.
[5]夏海华,于冲,曲晓军,等.绿脓杆菌外毒素A 的最新研究进展[J].生物技术,2012,22(2):81.
[6]D C Smith,et al.Internalized Pseudomonas exotoxin A can exploit multiple pathways to reach the endoplasmic reticulum[J].Traffic,2006,7(4):379.
[7]刘玲玉,孟玉强,杨学东.热休克蛋白生物学作用的研究进展[J].阴山学刊,2007,21(1):61.
[8]Burdon R H.Heat shock proteins in relation to medicine[J].Molecular aspects of medicine,1993,14:83.
[9]Morimoto RI,Tissieres A,Ceorgopoulos C.The stress response,ftmction of the protiens and perspectives[A].Cold Spring HaIbor,CSHL Press,1990:1-36.
[10]尚进才,王亚洲,高岩,等.热休克蛋白的研究进展[J].医学理论与实践,2010,23(5):527.
关键词:热休克蛋白65;绿脓杆菌外毒素A;基因克隆;表达;纯化
Study on the expression,purification and immune efficacy of fusion protein HSP65-PEA ⅠHEMiao,ZHANGGuo-li,CHENPing,etal.(CollegeofFoodScienceandEngineering,JilinAgriculturalUniversity,Changchun130118,China)
Abstract:ObjectiveExpress protein HSP65-PEAⅠin E.coli and obtain purified protein,establish mice model,preliminary evaluate the immune efficacy by detecting antibody titer levels.MethodsAmplify HSP65-PEAⅠand then inserted into expression vector pET-28a,transformE.coliBL21(DE3),express with the induction of IPTG,optimize the purification condition,then the protein was inoculated in mice as immunogen.ResultsDouble digestion and sequencing results proved that the HSP65-PEAⅠgene was cloned into vector pET-28a,the relative molecular mass of expressed recombinant protein was about 97000,mainly expressed as inclusion body.After purification,purity of recombinant protein was more than 90%,concentration was 0.498 mg/ml.The specific antibody was detected in the serum of mice in the first week after immunization,the titer level continued growing and rise to 210after 42 days.ConclusionRecombinant protein HSP65-PEAⅠwas successfully expressed inE.coliand purified.Animal immunization program was further established which laid a foundation for preparation of vaccine for multiple organ failure by burns.
Key words:HSP65;PEAⅠ;Gene clone;Expression;Purification
(收稿日期:2014-05-18)
文献标识码:A
中图分类号:R392
文章编号:1007-4287(2015)05-0700-05
*通讯作者
基金项目:军队后勤科研项目(CWS11J091)
