蜂斗菜素诱导骨髓瘤RPMI 8226细胞凋亡及其机制
2015-02-18岳海源任冬青王东萍雷栓虎汪玉良
岳海源,任冬青,王东萍,雷栓虎,齐 进,汪玉良
(1.兰州大学第二医院骨科,甘肃省骨关节疾病重点实验室,甘肃兰州 730030;2.甘肃省人民医院麻醉科,甘肃兰州 730000;3.甘肃省人民医院血液科,甘肃兰州 730000)
多发性骨髓瘤(multiple myeloma,MM)是血液系统常见的恶性肿瘤,尽管对骨髓瘤的生物学研究和临床治疗技术有了较大进展,但对MM的临床治疗仍是医学界一大难题。蜂斗菜素是药食两用植物蜂斗菜的提取物,研究表明蜂斗素能够诱导肿瘤细胞凋亡,发挥抗肿瘤活性[1-2]。蜂斗菜素是否能抑制骨髓瘤,通过何种途径起作用目前尚未见报道。为寻求新的能有效治疗MM的药物,我们采用骨髓瘤RPMI 8226细胞,研究了蜂斗菜素的抗MM作用及其相关的分子机制,以期为蜂斗菜素应用于临床抗骨髓瘤提供实验依据。
1 材料与方法
1.1 细胞系 骨髓瘤RPMI 8226细胞株购自中国科学院上海细胞库,实验前从液氮中取出培养。
1.2 药品试剂 蜂斗菜素(含量≥98%,批号:20130321,西安天瑞生物技术有限公司);RPMI-1640培养基,台盼蓝染色检测试剂盒,Caspase抑制剂Z-VAD-FMK购自碧云天生物研究所;TUNEL细胞凋亡检测试剂盒,Hoechst 33258染色液购自武汉博士德生物制品有限公司;p-ERK,p-MEK,p-p38抗体(鼠抗人)均购自美国 CST公司;Caspase-3、8、9(鼠抗人)抗体购自美国Santa Cruz公司。
1.3 主要仪器 二氧化碳培养箱(美国SIM公司);CJ-2F超净工作台(苏州冯氏实验动物设备有限公司);尼康80i荧光显微镜(日本尼康);FACS Calibur型流式细胞仪(美国BD公司)
1.4 方法
1.4.1 细胞培养 骨髓瘤 RPMI 8226细胞用含100 mL/L胎牛血清、100U/mL青霉素和100μg/mL链霉素的RPMI-1640培养基,于37℃、50mL/L CO2条件下培养,常规方法消化、传代。处于对数生长期细胞用于实验。
1.4.2 锥虫蓝拒染法检测蜂斗菜素对 RPMI 8226细胞的增殖抑制作用 实验分为加药组和对照组。取对数期细胞,重悬于新鲜培养基中,调整合适浓度,接种于12孔培养板,细胞孵育箱中培养24h。参考文献[2],加药组蜂斗菜素终浓度设定为1、5、10、20、40μmol/L,对照组加入同体积新鲜的培养基,分别培养24、48、72h。收集细胞,锥虫蓝染色3min左右,细胞计数板计数,计算抑制率。每个浓度设复孔3个,所有实验均重复3次。
1.4.3 TUNEL法检测蜂斗菜素对 RPMI 8226细胞凋亡的影响 实验分组及细胞接种同1.4.2。给予终浓度分别为5、10、20μmol/L的蜂斗菜素后,继续孵育24、48、72h。以2.5g/L的胰蛋白酶消化分散细胞,制成单细胞悬液,1 000r/s离心5min,收集细胞,根据TUNEL细胞凋亡检测试剂盒说明书操作,用流式细胞仪进行检测。
1.4.4 Hochest 33258荧光染色法观察细胞核的变化 实验分对照组、加药组、抑制剂组。取对数生长期细胞,调整合适细胞浓度接种于12孔板,细胞培养箱孵育24h后,弃旧培养基,加药组给予含5、10、20μmol/L蜂斗菜素的新鲜培养基;抑制剂组以10μmol/L caspase 抑 制 剂 Z-VAD-FMK 预 作 用30min,弃去培养基,PBS冲洗3次后,处理同加药组;对照组给予新鲜的空白培养基。各组细胞继续孵育72h,收集细胞,根据Hochest 33258荧光染色说明书操作,并采用荧光显微镜观察。
1.4.5 Western blot检测 实验分组同1.4.2。取对数期生长细胞,调整合适细胞浓度接种于6孔板,细胞培养箱孵育24h后,弃旧培养基,加药组给予含5、10、20μmol/L蜂斗菜素的新鲜培养基,对照组给予新鲜的空白培养基。各组细胞继续孵育72h,收集细胞,提取总蛋白质,BCA法测定蛋白质的含量。Western blot实验时,规定上样量为20~40μg,一抗(1∶1 000,鼠抗人 Caspase-3、Caspase-8、Caspase-9、p-MEK、p-ERK1/2、p-p38抗体)4℃过夜,加入二抗(1∶1 000,辣根过氧化物酶标记)于恒温30℃孵育2h,ECL显色法进行检测,应用Image pro plus V7.0软件分析条带的积分吸光度。
2 结 果
2.1 蜂斗菜素对RPMI 8226细胞的增殖抑制作用将不同浓度的蜂斗菜素(1、5、10、20、40μmol/L)作用于RPMI 8226细胞24、48、72h后,随时间的延长和浓度的增加,蜂斗菜素对细胞的抑制率逐渐增加,蜂斗菜素对RPMI 8226细胞的增殖抑制作用具有时间和浓度依赖性(P均<0.05)。分别作用24、48、72h后蜂斗菜素处理组细胞与空白对照组细胞抑制率均有统计学差异(P均<0.01)。蜂斗菜素作用24、48、72h的IC50值分别是21.47、14.29、9.23μmol/L(表1)。
2.2 蜂斗菜素对RPMI 8226细胞凋亡率的影响将不同浓度的蜂斗菜素(5、10、20μmol/L)作用于RP-MI 8226细胞24、48、72h后,随时间的延长和浓度的增加,细胞的凋亡率明显增加,蜂斗菜素诱导RPMI 8226细胞凋亡具有时间和浓度依赖性(P均<0.05)。各时段蜂斗菜素处理组细胞与空白对照组细胞凋亡率差异均有统计学意义(P均<0.01,表2)。
表1 蜂斗菜素对RPMI 8226细胞增殖的影响Tab.1 Effects of p on the proliferation of RPMI 8226cells(±s,n=3)
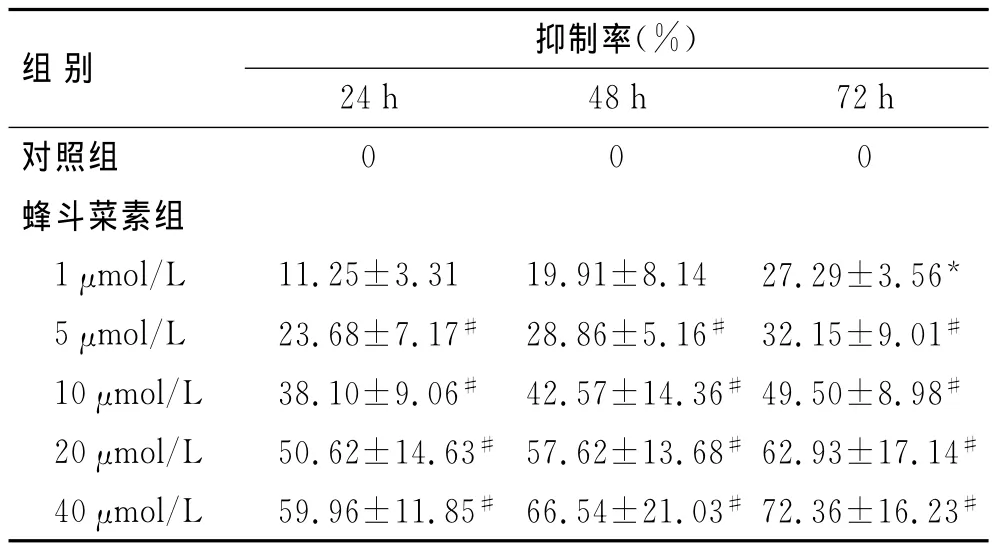
表1 蜂斗菜素对RPMI 8226细胞增殖的影响Tab.1 Effects of p on the proliferation of RPMI 8226cells(±s,n=3)
与对照组比较,*P<0.05,#P<0.01。
组别 抑制率(%)24h 48h 72h对照组000蜂斗菜素组1μmol/L 11.25±3.31 19.91±8.14 27.29±3.56*5μmol/L 23.68±7.17# 28.86±5.16# 32.15±9.01#10μmol/L 38.10±9.06# 42.57±14.36# 49.50±8.98#20μmol/L 50.62±14.63# 57.62±13.68# 62.93±17.14#40μmol/L 59.96±11.85# 66.54±21.03# 72.36±16.23#
2.3 蜂斗菜素对RPMI 8226细胞细胞核形态的影响 将不同浓度的蜂斗菜素(5、10、20μmol/L)作用于RPMI 8226细胞72h后,与对照组比较,随药物浓度增加,细胞核碎裂浓缩程度增加,蓝色荧光增强,出现大量凋亡小体,表明蜂斗菜素浓度依赖性地诱导RPMI8226细胞凋亡,验证了TUNEL法检测结果(图1)。给予Caspase抑制剂Z-VAD-FMK预作用30min后,发现细胞凋亡受到明显抑制,提示蜂斗菜素诱导的RPMI 8226细胞凋亡可能是通过Caspase激活来介导的。
表2 蜂斗菜素对RPMI 8226细胞凋亡率的影响Tab.2 Effects of petasin on the apoptosis rate of RPMI 8226 cells(±s,n=3)
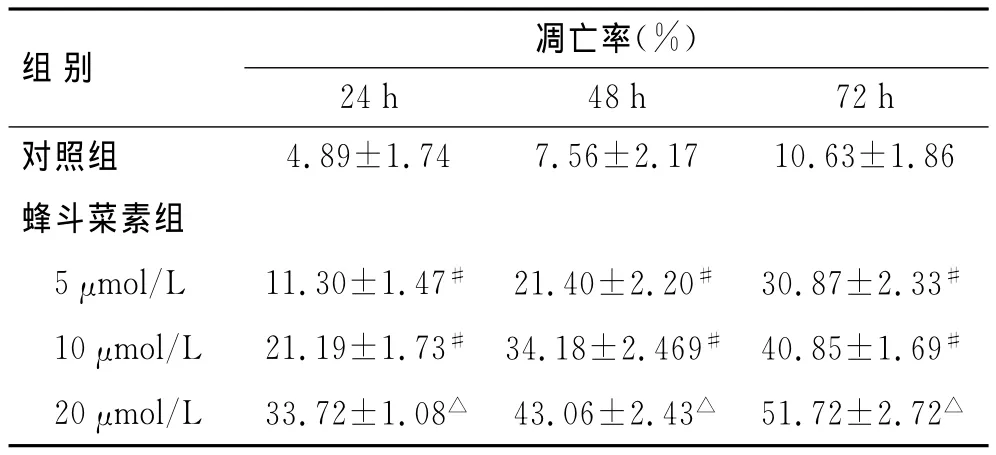
表2 蜂斗菜素对RPMI 8226细胞凋亡率的影响Tab.2 Effects of petasin on the apoptosis rate of RPMI 8226 cells(±s,n=3)
与对照组比较,#P<0.01,△P<0.001。
组别 凋亡率(%)24h 48h 72h对照组4.89±1.74 7.56±2.17 10.63±1.86蜂斗菜素组5μmol/L 11.30±1.47# 21.40±2.20# 30.87±2.33#10μmol/L 21.19±1.73# 34.18±2.469# 40.85±1.69#20μmol/L 33.72±1.08△ 43.06±2.43△ 51.72±2.72△
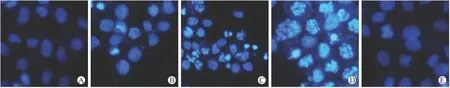
图1 蜂斗菜素对RPMI 8226细胞核形态的影响Fig.1 Effects of petasin on the morphology of RPMI 8226cell nuclei(×200)
2.4 蜂斗菜素对RPMI 8226细胞Caspase蛋白和MEK/ERK、p38MAPK蛋白磷酸化水平的影响 10~20μmol/L蜂斗菜素作用72h后,与对照组相比,Caspase-3、8、9蛋白表达显著性增加(P<0.05,P<0.01,P<0.05),其中低浓度蜂斗菜素(5μmol/L)能明显增加Caspase-8蛋白的表达(P<0.05),证实蜂斗菜素诱导的RPM I8226细胞凋亡是通过Caspase激活来介导的(图2)。10~20μmol/L蜂斗菜素作用72h后,ERK1/2及MEK蛋白磷酸化水平显著下降(P<0.01,P<0.05),p38MAPK蛋白磷酸化水平显著上升(P<0.01),提示 MAPKs参与了蜂斗菜素诱导的 RPMI 8226细胞凋亡(图3)。
3 讨 论
蜂斗菜素是药食两用植物蜂斗菜的提取物,在抗炎、抗过敏及治疗偏头痛领域已经进行了一定的研究[3]。近来研究发现,蜂斗菜酯类提取物具有潜在的抗癌活性[4-5]。硫蜂斗菜素可诱导前列腺癌细胞凋亡[6];也有报道显示蜂斗菜素具有显著的抗神经母细胞瘤细胞增殖作用[2]。本研究结果显示,蜂斗菜素对骨髓瘤RPMI 8226细胞具有显著的增殖抑制作用,能够诱导RPMI 8226细胞凋亡;进一步研究发现,蜂斗菜素能够激活Caspase蛋白并能够改变MEK/ERK及p38MAPK磷酸化水平。
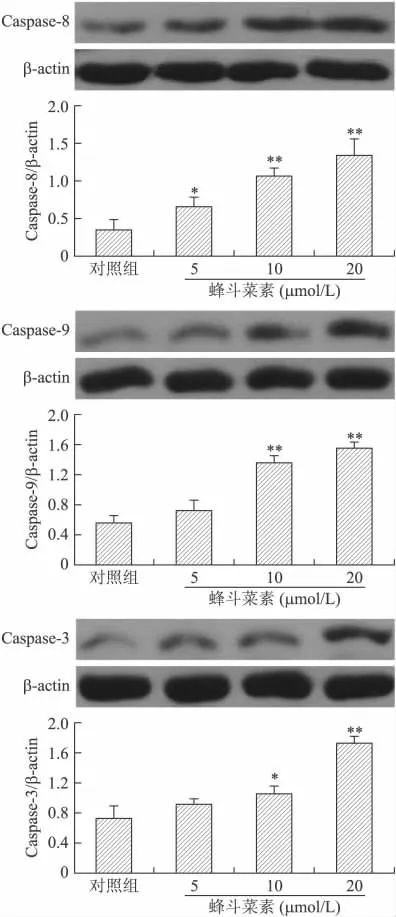
图2 蜂斗菜素对Caspase-3、8、9蛋白表达的影响Fig.2 Effects of petasin on Caspase 3,8and 9protein expressions(±s,n=3)
Caspase是半胱氨酸家族蛋白酶,广泛参与细胞凋亡过程[7]。Caspase的活化是有顺序的多步水解的过程。基本机制有两种,即同源活化和异源活化。发生同源活化的Caspase,包括Caspase-8、9、10,开启细胞内的死亡程序,通过异源活化方式水解下游Caspase,将凋亡信号放大,同时将死亡信号向下传递。被异源活化的Caspase,包括Caspase-3、6、7,执行死亡程序[8-9]。因此,干预Caspase家族促凋亡相关蛋白可以成为肿瘤治疗的靶点[10]。本研究结果表明,蜂斗菜素作用后,Caspase-3、8、9蛋白表达显著增加。为了进一步证实Caspase蛋白参与蜂斗菜素诱导的RPMI 8226细胞凋亡,本研究采用Caspase抑制剂Z-VAD-FMK预作用后,发现Z-VAD-FMK能够明显抑制蜂斗菜素诱导的RPMI 8226细胞存活率下降,同时细胞凋亡受到明显抑制。这就提示蜂斗菜素诱导的RPMI 8226细胞凋亡可能是通过Caspase激活来介导的。
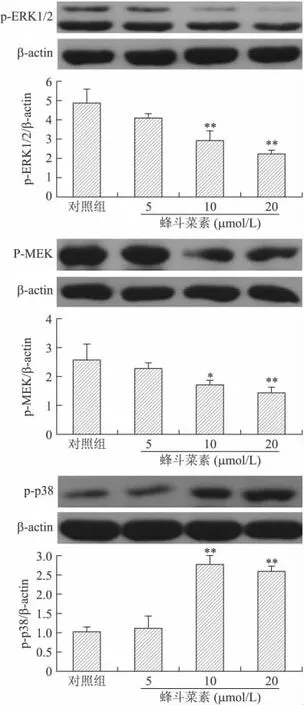
图3 蜂斗菜素对MEK/ERK、p38MAPK蛋白表达的影响Fig.3 Effects of petasin on MEK/ERK and p38MAPK protein expressions(±s,n=3)
丝裂原活化蛋白激酶(MAPK)途径是介导细胞增殖、分化、凋亡等生理过程的重要信号通路,分为ERK1/2通路、p38MAPK 通路等5个亚家族[11],其信号转导步骤遵循 MAPKs的三级酶促级联反应,即 Ras/Raf/MEK/ERK途径[12]。大量研究显示,在MAPK通路中,ERK的磷酸化激活与MM细胞增殖有关[13-14]。但是,MAPK通路的p38和JNK通路的激活则可以促进 MM细胞调亡[15-16]。程月芳等[2]证明,蜂斗菜素抗神经母细胞瘤细胞增殖的分子机制是下调ERK1/2蛋白的磷酸化水平。本实验发现,10~20μmol/L蜂斗菜素72h后,能显著下调ERK1/2及MEK蛋白磷酸化水平,同时我们发现蜂斗菜素能显著上调p38MAPK蛋白磷酸化水平,这与其他人的报道是一致的。提示蜂斗菜素的作用机制可能是通过影响MEK/ERK及p38MAPK信号转导发挥的。
总之,蜂斗菜素对骨髓瘤RPMI 8226细胞的增殖具有明显的抑制作用,能够诱导RPMI 8226细胞产生凋亡,其分子机制可能是通过活化Caspase蛋白从而开启细胞内的死亡程序,放大凋亡信号,并将死亡信号向下传递,同时改变MEK/ERK及p38MAPK磷酸化水平,影响细胞增殖、分化、凋亡等生理过程,最终导致细胞凋亡。另外,蜂斗菜素作为来源于蔬菜类的化合物,其低毒特点更为其应用于临床骨髓瘤的治疗提供了优势。
[1]KENNEDY MB.Signal-processing machines at the postsynaptic density[J].Science,2000,290(5492):750-754.
[2]程月芳,王彩芳,李文杰,等.蜂斗菜素抑制人神经母细胞瘤细胞SK-N-SH增殖作用机制研究[J].Acta Neuropharmacol,2011,1(3):1-6.
[3]HORAK S,KOSCHAK A,STUPPNER H,et al.Use-dependent block of voltage-gated Cav2.1 Ca2+channels by petasins and eudesmol isomers[J].J Pharmacol Exp Ther,2009,330(1):220-226.
[4]WU TS,KAO MS,WU PL,et al.The bakkenolides from the root of petasites formosanus and their cytotoxicity[J].Chem Pharm Bull,1999,47(3):375-382.
[5]张福金.毛裂蜂斗菜中蜂斗菜总内酯的制备及生物活性研究[D].上海:第二军医大学,2009.
[6]KAN SF,YU CH,WU CI,et al.Mechanism of S-petasin-induced apoptosis in androgen-independent prostate cancer cells[C]//BIOLOGY OF REPRODUCTION.1603 MONROE ST,MADISON,WI 53711-2021 USA:SOC STUDY REPRODUCTION,2005:128-128.
[7]OLA MS,NAWAZ M,AHSAN H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1-2):41-58.
[8]WU SH,HANG LW,YANG JS,et al.Curcumin induces apoptosis in human non-small cell lung cancer NCI-H460 cells through ER stress and caspase cascade-and mitochondria-dependent pathways[J].Anticancer Res,2010,30(6):2125-2133.
[9]戴昕,李占全,冀林华.凋亡相关蛋白Caspase研究进展[J].中国现代医药杂志,2010,12(4):130-132.
[10]GYRD-HANSEN M,MEIER P.IAPs:from caspase inhibitors to modulators of NF-κB,inflammation and cancer[J].Nature Rev Cancer,2010,10(8):561-574.
[11]CARGNELLO M,ROUX PP.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases[J].Microbiol Mol Biol Rev,2011,75(1):50-83.
[12]STEELMAN LS,FRANKLIN RA,ABRAMS SL,et al.Roles of the Ras/Raf/MEK/ERK pathway in leukemia therapy[J].Leukemia,2011,25(7):1080-1094.
[13]SUN C,HU Y,HUANG J,et al.Brain-derived neurotrophic factor induces proliferation,migration,and VEGF secretion in human multiple myeloma cells via activation of MEK-ERK and PI3K/AKT signaling[J].Tumor Biol,2010,31(2):121-128.
[14]TU Y,GARDNER A,LICHTENSTEIN A.The phosphatidylinositol 3-kinase/AKT kinase pathway in multiple myeloma plasma cells:roles in cytokine-dependent survival and proliferative responses[J].Cancer Res,2000,60(23):6763-6770.
[15]PODAR K,RAAB MS,TONON G,et al.Up-regulation of c-Jun inhibits proliferation and induces apoptosis via caspase-triggered c-Abl cleavage in human multiple myeloma[J].Cancer Res,2007,67(4):1680-1688.
[16]王誉霖,张励才.p38MAPK信号转导通路与细胞凋亡研究进展[J].慢性病学杂志,2010,12(12):1665-1667.
