Fas/FasL/Caspase-9凋亡基因多态性和环境危险因素的交互作用与腰椎间盘突出症的关系
2015-02-18袁启令李新友蔡永松叶茂林张银刚
袁启令,李新友,刘 亮,蔡永松,叶茂林,张银刚
(1.西安交通大学医学部第一附属医院骨科,陕西西安 710061;2.西安交通大学附属红会医院关节外科,陕西西安 710054;3.河南中医学院,河南郑州 450000)
腰椎间盘突出症(lumbar disc herniation,LDH)的发病率较高,是引起腰腿痛最主要的原因,其致残及社会负担已成为一项重大的公共卫生难题[1]。LDH的基本病理是腰椎间盘退变(LDD)。以往对LDH病因学的研究大多集中于环境危险因素,如重体力作业、抬举重物、弯腰扭腰、全身震动及静态作业姿势等职业因素均可加速椎间盘退变,导致椎间盘内压力增高,使得纤维环强度减弱,形成腰椎间盘突出的病理基础。我们在前期研究中发现,腰椎负荷、家族史、平均体重指数、业余活动、业余运动、社会心理等是重要的风险因素[2]。然而,环境风险因素难以完全解释LDH的发病机制。近期研究发现,LDH的遗传力达到52%~68%[3],提示遗传因素可能在LDH的发病机制中发挥重要作用。目前,多数学者认为LDH很可能是由遗传因素和环境因素相互协同导致的一种复杂性疾病。近年来,随着高通量测序技术的快速发展,复杂性疾病易感基因的定位与功能研究已成为当前研究热点之一,大量常见疾病的易感基因被相继定位出来。目前,在椎间盘退变方面的研究虽然也取得了一些进展[4-5],但LDH的易感基因与环境风险因素在LDH发病中的联合作用机制仍存在空白。阐明LDH环境-基因的联合作用途径,将有助于阐明LDH的发病机制,进而开发有效的早期预防及治疗措施。
既往对椎间盘退变的病理过程研究发现,细胞凋亡是其重要的环节之一[6-7]。对于腰椎间盘退变的凋亡通路,目前研究发现主要涉及两条途径:Fas/FasL介导的死亡受体途径,也叫外源性途径;线粒体途径,也称内源性途径。在死亡受体通路中,Fas(也称CD95)介导的凋亡通路最为典型,FasL通常以三聚体的形式出现,3个Fas受体与1个FasL结合,三聚体与配体结合后,Fas通过其胞内的死亡结构域与其衔 接 子 蛋 白 FADD(Fas-associated protein with death domain)梭基端的死亡结构域相互作用,募集细胞中的FADD,同时FADD的死亡效应结构域与Caspase-8酶原中的死亡效应结构域相互作用,从而募集细胞中Caspase-8酶原,形成死亡诱导信号复合体(death-inducing signing complex,DISC)[8]。在凋亡的线粒体依赖途径中,Caspase接受死亡信号,启动凋亡,激活下游分子,降解细胞骨架、蛋白质和核酸等,是凋亡的真正执行者。而Caspase-9是处在该途径顶端的关键蛋白酶。效应Caspase无法选择性地结合凋亡蛋白酶活化因子(Apaf-1),因此它们对Caspase-9具有依赖性[9]。基于此,我们推测FAS、FASL、Caspase-9在椎间盘退变中可能有重要作用。
在本研究中,我们采用病例-对照研究设计,探讨凋亡相关基因FAS、FASL和Caspase-9的多态性与腰椎间盘突出症的相关性,鉴定阳性关联的单核苷酸多态性(single nucleotide polymorphism,SNP)位点,并分析其与环境危险因素的交互致病模式。在预实验中(30个病例和对照),我们发现CASP-9rs2308941、rs2308950、FASL INV2nt-124A>G rs5030772多态性在中国汉族人群不存在。因此,在本研究中,我们仅探讨了Fas-1377G/A rs2234767、Fas-670G/A rs1800682、Fas rs2147420、Fas rs2296603、Fas rs7901656、Fas rs1571019、FasL-844C/T rs763110、CASP-9-1263A>G rs4645978、CASP-9-712C>T rs4645981 9个SNP位点。
1 材料与方法
1.1 研究对象 病例组由131例来源于在2005年1月至2007年1月间西安交通大学医学院第一附属医院、陕西省人民医院和西安唐都医院的门诊LDH患者组成。这些患者由于各种相关症状或体征来院就诊,例如腰腿疼、CT和(或)MRI诊断的腰椎间盘突出且伴有坐骨神经痛。排除了腰椎椎管狭窄、腰椎先天发育异常、腰椎内肿瘤和腰椎滑脱。从住院患者或接受医学检查的患者当中采用电脑软件随机选取137例对象作为对照组,这些对象在目前或一个多月内没有腰痛史和(或)坐骨神经痛,没有腰椎创伤导致的腰椎不稳,没有腰椎侧凸和腰椎滑脱。所有研究对象都为中国北方汉族,对照组和病例组按照性别、年龄和生活环境进行了1∶1匹配。
1.2 环境危险因素 根据前期研究结果,选择LDH潜在环境风险因素,并采用问卷调查进行定量评估。主要包括:①腰椎负荷的分级:以瑞典斯德哥尔摩肌肉骨骼疾病研究中心的体力负荷评估问卷为核心,并根据BATTIE等[10]对职业分级积分标准并结合国内实际情况将腰椎负荷大小用职业积分代替:(很轻)=(无固定职业,且很少有体力劳动);(轻)=(工作以坐位为主);(中)=(工作以弯腰扭腰和全身震动为主);(重)=(工作以提举重物和重体力劳动为主)。②吸烟的定义:每天至少吸1支烟并持续1年,或每年累计量大于18包为吸烟,并依次计算吸烟指数(包年)=吸烟年限×每天吸烟支数×20-1。③饮酒的定义:平均每周饮酒达到两次,每次至少2两且持续1年以上为饮酒。④业余活动:主要指工作之余的活动,如家务劳动。⑤业余运动:即健身锻炼,要求每次持续≥20min,直至心跳加快和出汗。
1.3 SNP基因型分型 采集外周静脉血,用蛋白酶K和苯酚/氯仿从白细胞中提取DNA。用分光光度计(NanoDrop ND-100,Foster,USA)对提取的DNA进行定性和定量。用Mass ARRAY Assay设计软件(Sequenom,Salt Lake City,USA)设计扩增及等位基因引物延伸。表1中为寡核苷酸引物。聚合酶链式反应(polymerase chain reaction,PCR)混合物包括5ng基因组DNA(5ng/μL),每种特异性引物各1μL,每种dNTP各2.5mmol/L,3.25mmol/L MgCl2,和0.5U的 Hot-Star Taq DNA聚合酶(5U/μL,Qiagen,Valencia,CA,USA)。PCR扩增程序:94℃15min;变性94℃20s,延伸56℃30s,退火72℃1min,共计45个循环;最后,72℃3min。用改良基质辅助激光解吸附电离飞行时间质谱分析法(Brucker,Billerica,MA,USA)对产物进行分析。

表1 质谱分析的凋亡基因多态性位点的引物Tab.1 The primers of single nucleotide polymorphic(SNP)sites of apoptosis genes analyzed by mass spectrometer
1.4 环境-基因交互作用分析 本研究采用多因素Logistic回归模型检测环境风险因素与候选基因的交互致病作用。回归模型中包括遗传因素、环境危险因素、两者交互组成的变量,以及年龄、性别、身高和体重协变量。假设:在没有环境危险因素的条件下,基因多态性和疾病危险性的增加无关,只有在暴露于环境危险因素条件下,基因突变才会影响疾病的患病风险;KHOURY等[11]将这称为2型交互作用,根据交互系数(=βeg/βe)来判断是否有交互作用、交互方式和强度。判定依据1:OReg=ORe+ORg为相乘模型;OReg>ORe+ORg为超相乘模型;OReg<ORe+ORg为次相乘模型;OReg=ORe+ORg-1为相加模型。判定依据2:在病例-对照研究中,g为两变量交互作用系数。若>1,表示遗传因素对环境暴露的效应有放大作用;若<1,则表示遗传因素对环境暴露的效应有减弱作用;若=1,则表示遗传因素与环境暴露没有交互作用。如果所研究的环境因素是危险因素,此时βe大于0,为负值,则表示基因有保护作用。
1.5 统计学方法 使用SPSS 17.0统计学软件进行χ2检验,比较病例组和对照组之间年龄、性别、吸烟和各基因型分布差异。采用Excel进行Hardy-Weinberg平衡检验。以年龄、性别、身高和体重作为协变量,采用非条件Logistic回归模型分析各SNP位点多态性和LDH患病风险的关系,并以比值比(odds rations,ORs)及其95%可信区间(confidence intervals,CIs)表示相对危险度。所有的统计检验均为双侧概率检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 研究对象的基本资料 本研究收集了病例131例,对照137例;DNA样品经PCR-RFLP的电泳和质谱分析后有8例(其中病例组3例,对照组5例)不符合要求,故将此8例样本排除,最终有128例LDH患者和132例正常对照进入研究,其基本资料见表2。分析发现,年龄、性别、体重、吸烟和饮酒在病例组与对照组分布差异无统计学意义,而病例组与对照组在业余劳动(P=0.011)、睡床类型(P=0.003)和脊柱负荷指数上差异具有统计学意义(P<0.001)。

表2 研究对象的基本资料Tab.2 The basic characteristics of the subjects
2.2 凋亡基因的多态性和腰椎间盘突出症患病风险的相关性 Hardy-Weinberg平衡检验发现,3个基因9个SNP位点在病例组和对照组,男性和女性及全体研究样本中3种基因型分布都符合Hardy-Weinberg平衡定律(P>0.05),提示研究样本有较好的代表性,即能代表一般人群。关联分析发现,3个基因9个多态性位点中,只有FasL-rs763110、CASP-9-rs4645978和腰椎间盘突出症风险显著关联(P<0.05)。FasL-844中CT基因型者患LDH的危险性是 CC者的1.227倍(χ2=0.615;95%CI:0.736~2.048),TT基因型者患 LDH 的危险性是CC者的3.128倍(χ2=4.601;95%CI:1.059~9.242),T等位基因携带者患LDH的危险性是C等位基因者的1.329倍(χ2=2.047;95%CI:0.900~1.963),TT基因型与CC基因型相比差别有统计学意义(P<0.05)。CASP-9-rs4645978中 AG基因型者患LDH 的危险性是AA者的1.570倍(χ2=2.701;95%CI:0.915~2.692),GG 基因型者患LDH的危险性是 AA者的2.760倍(χ2=10.08;95%CI:1.464~5.203),G等位基因携带者患LDH的危险性是A等位基因者的1.572倍(χ2=9.122;95%CI:1.171~2.110),GG基因型与 AA 基因型相比差别有统计学意义(P<0.05,图1、图2)。
2.3 凋亡基因的多态性和环境危险因素的交互作用FasL-844C/T基因多态和环境危险因素的交互作用分析见图3。在多种环境因素中,可以确定腰椎负荷与FasL-844C/T为超相乘模型。我们用轻表示腰椎负荷1~2级,用重表示腰椎负荷3~4级。调整了年龄、性别、身高、体重、家族史、吸烟、睡床类型、业余活动和业余运动后,单独暴露于腰椎负荷3~4级的ORe为3.49(95%CI:1.58~7.69);单独FasL-844TT基因型的 ORg为3.16(95%CI:0.73~13.75);FasL-844TT基因型和腰椎负荷3~4级同时存在的OReg为21.1(95%CI:2.43~182.67)。OReg21.0>3.49×3.16,提示FasL-844TT基因型和腰椎负荷3~4级交互作用机制在LDH发生中为超相乘模型(P=0.006)。
CASP-9-rs4645978基因多态和环境危险因素的交互作用分析结果如图4所示。在多种环境因素中,可以确定腰椎负荷与CASP-9-rs4645978为次相乘模型。调整了年龄、性别、身高、体重、吸烟、睡床类型、业余活动和业余运动后,单独暴露于腰椎负荷3~4级的ORe为5.67(95%CI:2.08~15.45);单独CASP-9-rs4645978GG基因型的 ORg为1.55(95%CI:0.51~4.69);CASP-9-rs4645978GG基因型和腰椎负荷3~4级同时存在的OReg为7.40(95%CI:1.77~30.94)。OReg7.40<1.55×5.67,提示CASP-9-rs4645978GG基因型和腰椎负荷3~4级交互作用机制在LDH发生中为次相乘模型,有统计学意义(P=0.006)。
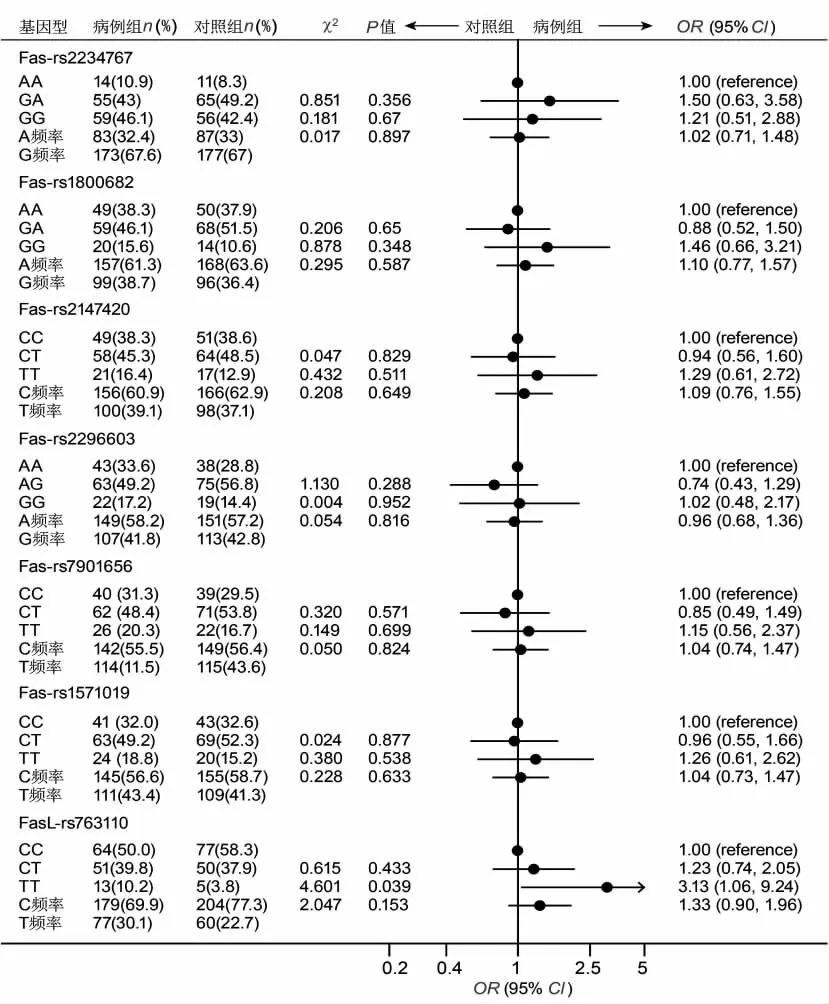
图1 凋亡基因的多态性和腰椎间盘突出症风险(第一部分)Fig.1 The risk of lumbar disc herniation associated with polymorphisms of apoptosis genes(Part 1)
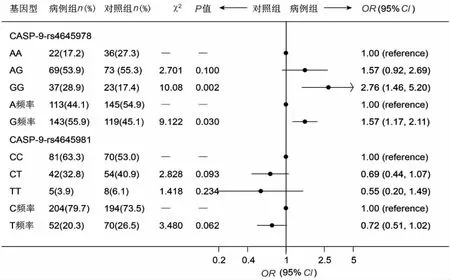
图2 凋亡基因的多态性和腰椎间盘突出症风险(第二部分)Fig.2 The risk of lumbar disc herniation associated with polymorphisms of apoptosis genes(Part 2)
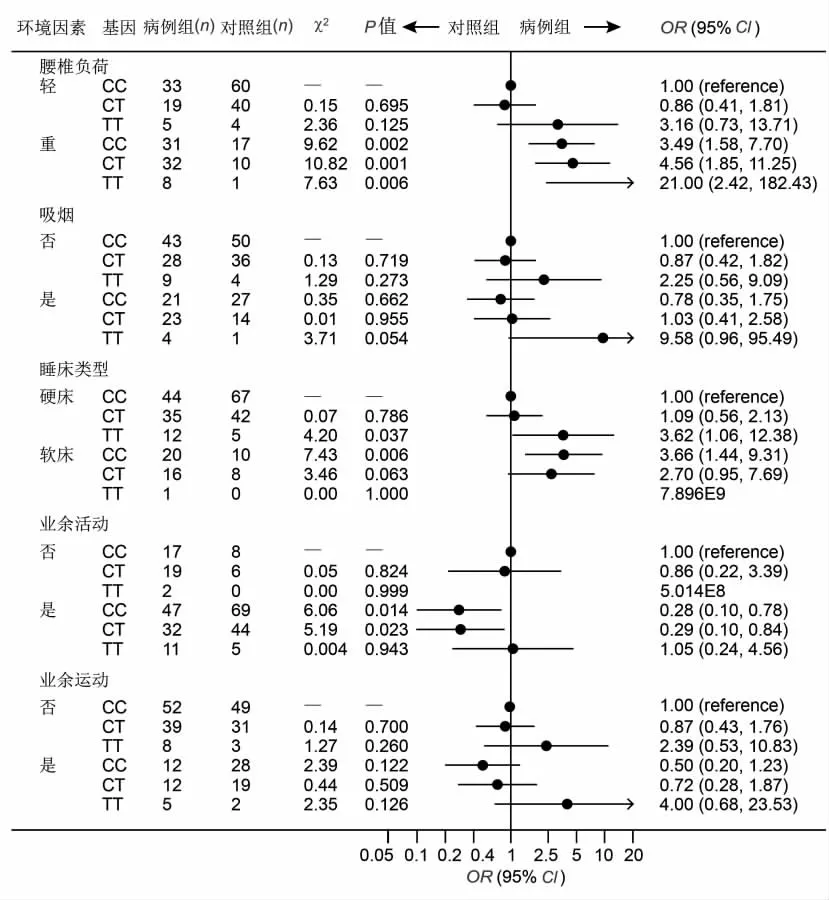
图3 FasL-844C/T基因多态性和环境危险因素的交互作用Fig.3 Interaction between polymorphisms of FasL-844C/T gene and environmental risk factors
3 讨 论
在本研究中,我们采用病例-对照关联研究方法探讨凋亡相关基因Fas、FasL、CASP-9 3个基因9个SNP位点与腰椎间盘突出症患病风险的关系。结果显示,只有FasL-844C/T(rs763110)、CASP-9-1263A>G(rs4645978)与腰椎间盘突出症风险显著关联,其中FasL-844C/T TT基因型、CASP-9-1263A>G GG基因型可能是腰椎间盘突出症的危险因素。进一步对 FasL-844C/T(rs763110)、CASP-9-1263A>G(rs4645978)和环境危险因素的交互作用分析发现,FasL-844TT基因型和腰椎负荷3~4级交互作用在LDH发生中为超相乘模型,CASP-9-rs4645978 GG基因型和腰椎负荷3~4级交互作用在LDH发生中为次相乘模型。
对于环境与基因交互作用的评价,最重要是对环境因素的量化评价。虽然脊柱负荷(应力)是腰椎间盘突出症的最重要的危险因素,但脊柱负荷的评价缺乏体内生物标记物。目前,国内外无较权威和通用的关于腰椎负荷等级的定义,我们所定义的腰椎负荷等级分类还需进一步检验,还需制定更合理的腰椎负荷等级分类。腰椎间盘突出症是个复杂性疾病,涉及基因-基因,基因-环境,基因-年龄等众多模式,由于样本量的原因,我们仅对基因-环境的交互作用进行了分析。为了获得机制的全貌,需要更大的样本量。
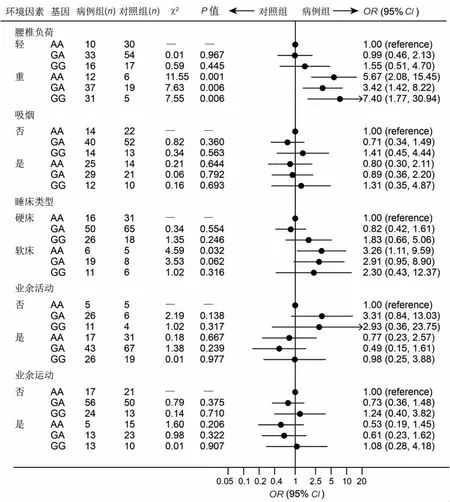
图4 CASP-9-rs4645978基因多态和环境危险因素的交互作用Fig.4 Interaction between polymorphisms of CASP-9-rs4645978gene and environmental risk factors
对于凋亡相关基因与腰椎间盘突出症风险的研究,显 示 只 有 FasL-844C/T(rs763110),CASP-9-1263A>G(rs4645978)和腰椎间盘突出症风险有关联。已发现的Fas启动子区存在2个SNP:-1377G/A多态和-670A/G多态,这两个多态在功能上有重要的意义。Fas-1377G/A多态位于转录子SP-1的结合部位,-1377A等位基因可破坏SP-1的结合部位,启动子活性下降。Fas-670A/G多态则位于IFN γ活 化 信 号 (gamma interferon activation signal,GAS)中,GAS在IFNγ-STAT-1通路中有重要作用,细胞转导与转录激活因子(STAT-1)与GAS结合,可激活启动子。Fas-670G等位基因可破坏GAS,影响STAT-1转录因子结合,因而降低启动子活性,Fas基因表达下降。但是这两个位点并没有发现与腰椎间盘突出症有关联,这可能是广泛表达于椎间盘细胞表面的Fas基因微小的变化尚不足以分析出其与LDH风险的关系。因此,需要更大的样本量和更有效的统计工具进一步深入研究。FasL-844T/C存在FasL启动子区,位于CAAT/enhancer-binding proteinβ转录因子的结合基序。FasL-844C等位基因可比T等位基因产生更高水平的FasL表达。有研究提示携带FasL-844CC基因型者Fas表达下降和/或FasL表达增加,发生肿瘤的风险增大[12]。而我们的结果显示FasL-844C/T TT基因型与腰椎间盘突出症的风险有关,携带FasL-844TT基因型者患LDH的风险是携带FasL-844CC基因型者的3.128倍。我们推测,对于携带FasL-844TT基因型的个体,其椎间盘髓核中FasL的表达较携带FasL-844CC基因型的个体低,过低表达的FasL与浸润到椎间盘内活化的淋巴细胞表面Fas结合的机会减少,致使活化的淋巴细胞凋亡降低,即椎间盘组织获得免疫赦免的机会降低,引起椎间盘组织发生破坏性的免疫反应,最终导致LDD加速。
PARK等[13]进行了一项关于朝鲜族CASP-9基因多态性和原发性肺癌发病风险的研究。结果表明,与-1263AA基因型或结合的-1263AA和AG基因型相比,CASP-9-1263GG基因型与肺癌风险显著降低存在相关性。但是,与含有CC基因型的个体相比,至少有1个CASP-9-712C/T的T等位基因者的肺癌风险显著增高。凋亡失活是癌症特征之一,它允许有基因损伤倾向的细胞继续存活[14]。相反,凋亡激活导致退变椎间盘中细胞的减少。我们猜测,在携带CASP-9-1263GG基因型的个体中,CASP-9的表达和(或)活性可能相对较高,椎间盘细胞的凋亡会明显增强。椎间盘细胞维持着大量细胞外基质。因此,当细胞数量大量减少,椎间盘易于退变就显得不足为奇。在退变加速过程中,可能最终会发生椎间盘放射状撕裂。
由于人类疾病多是由遗传因素与环境因素相互作用的结果,机体损伤反应不仅与暴露于环境有害因素的程度有关,同时还与遗传易感性或耐受性有着密切联系,即存在环境与基因交互作用。我们发现,FasL-844C/T(rs763110)、CASP-9-1263A>G(rs4645978)和腰椎负荷有交互作用。这提示,LDH可能是由多种环境危险因素和遗传易感基因协同作用所致,不同基因型和同一环境因素或不同环境因素的交互作用机制不同。所以,针对LDH高危人群制定预防措施时,应把环境因素和基因型结合起来考虑。对于我们的研究,仍需要许多工作来做,下一步将对本研究获得的易感基因多态性通过更直接的方式验证,如将含凋亡多态性基因的细胞在不同应力下进行培养以观察其凋亡率等。
[1]BENOIST M.The natural history of lumbar disc herniation and radiculopathy[J].Joint Bone Spine,2002,69(2):155-160.
[2]ZHANG YG,SUN ZM,ZHANG Z,et al.Risk factors for lumbar intervertebral disc herniation in Chinese population.A case-control study[J].Spine(Phila Pa 1976),2009,34(25):E918-922.
[3]MACGREGOR AJ,ANDREW T,SAMBROOK PN,et al.Structural,psychological,and genetic influences on low back and neck pain:a study of adult female twins[J].Arthritis Rheum,2004,51(2):160-167.
[4]GUO TM,LIU M,ZHANG YG,et al.Association between Caspase-9 promoter region polymorphisms and discogenic low back pain[J].Connect Tissue Res,2011,52(2):133-138.
[5]ZHANG YG,GUO X,SUN ZM,et al.Gene expression profiles of disc tissues and peripheral blood mononuclear cells from patients with degenerative disc[J].J Bone Miner Metab,2010,28(2):209-219.
[6]DING F,SHAO ZW,XIONG LM.Cell death in intervertebral disc degeneration[J].Apoptosis,2013,18(7):777-785.
[7]PARK JB,PARK IC,PARK SJ,et al.Anti-apoptotic effects of Caspase inhibitors on rat intervertebral disc cells[J].Bone Joint Surg Am,2006,88(4):771-779.
[8]GURUNG P,ANAND PK,MALIREDDI RK,et al.FADD and Caspase-8 mediate priming and activation of the canonical and noncanonical Nlrp3 inflammasomes[J].J Immunol,2014,192(4):1835-1846.
[9]BRATTON SB,SALVESEN GS.Regulation of the Apaf-1-Caspase-9 apoptosome[J].J Cell Sci,2010,123(Pt 19):3209-3214.
[10]BATTIÉMC,VIDEMAN T,GIBBONS LE,et al.1995 Volvo Award in clinical sciences.Determinants of lumbar disc degeneration.A study relating lifetime exposures and magnetic resonance imaging findings in identical twins[J].Spine (Phila Pa 1976),1995,20(24):2601-2612.
[11]KHOURY MJ,WAGENER DK.Epidemiological evaluation of the use of genetics to improve the predictive value of disease risk factors[J].Am J Hum Genet,1995,56(4):835-844.
[12]XU Y,HE B,LI R,et al.Association of the polymorphisms in the Fas/FasL promoter regions with cancer susceptibility:a systematic review and meta-analysis of 52 studies[J].PLoS One,2014,9(3):e90090.
[13]PARK JY,PARK JM,JANG JS,et al.Caspase 9 promoter polymorphisms and risk of primary lung cancer[J].Hum Mol Genet,2006,15(12):1963-1971.
[14]HANAHAN D,WEINBERG RA.Hallmarks of cancer:the next generation[J].C Cell,2011,144(5):646-674.
