缺氧相关蛋白HIF-1α和CAIX在妊娠滋养细胞疾病中的表达
2015-02-18周伟华安瑞芳
周伟华,安瑞芳
(1.西安交通大学医学部第一附属医院妇产科,陕西西安 710061;2.西安市第四医院妇产科,陕西西安 710004)
妊娠滋养细胞疾病(gestational trophoblastic disease,GTD)是一组来源于胎盘绒毛滋养细胞的疾病,一般包括葡萄胎、侵蚀性葡萄胎、绒毛膜癌、胎盘部位滋养细胞肿瘤和上皮样滋养细胞肿瘤。我国是GTD高发国度之一,严重威胁育龄期妇女的健康,且发病机制尚未完全明了。缺氧是进展性实体肿瘤最常见的现象,与肿瘤的多种生物学行为密切相关[1]。缺氧诱导因子-1α(hypoxia-inducible factor 1α,HIF-1α)是肿瘤细胞在缺氧调控中的核心因子,可诱导激活多种缺氧相关基因的转录表达[2]。碳酸酐酶IX(carbonic anhydrase IX,CAIX)是一种跨膜糖蛋白,是HIF-1α调控的重要靶基因,通过催化H2O+CO2和H++HCO3-的相互转化,调节细胞内外的pH值变化[3]。目前已证实,HIF-1α和CAIX在人类多种固体肿瘤中存在过度表达且与其生物学行为相关,但在妊娠滋养细胞疾病中的研究国内外鲜有报道。本研究通过免疫组化方法检测二者在正常早孕绒毛和GTD中的表达,以期为GTD的发病机制研究提供新的思路及理论依据。
1 材料与方法
1.1 研究对象 正常早孕绒毛组(NP组):2012年6月至2012年9月在西安交通大学医学部第一附属医院妇科人流室收集32例新鲜早期妊娠绒毛组织(6~9周),均为计划外妊娠,无内外科合并症及异常妊娠史。常规甲醛液固定,石蜡包埋。
妊娠滋养细胞疾病组:收集自1993年至2012年期间在西安交通大学医学部第一附属医院组织病理学确诊的妊娠滋养细胞疾病蜡块存档标本61例,其中葡萄胎33例(HM组),均为首次清宫标本,侵袭性葡萄胎26例(IM组),均为手术标本。
1.2 实验方法 兔抗人HIF-1α多克隆抗体(cat#2015-1)及兔抗人CAIX多克隆抗体(cat#3829-1)均购于Epitomics生化公司;SP试剂盒(GK500710)购于基因科技上海有限公司。
标本连续切片,厚度约4μm,严格按试剂盒说明进行S-P法染色。HIF-1α抗体、CAIX抗体的稀释浓度分别为1∶20、1∶200。阴性对照:一抗由0.01mol/L PBS溶液代替;阳性对照:前列腺癌组织切片染色。
1.3 结果判定标准 HIF-1α阳性染色标准为细胞核出现棕黄色颗粒;CAIX阳性染色标准为细胞膜出现棕黄色颗粒;染色强度均由淡黄色至棕黄色。结果判定参考半定量积分方法,每张切片随机选取观察5个高倍视野(×400)进行计数,根据每个高倍视野中阳性细胞染色强度及着色细胞占观察细胞的百分比进行分级评分,具体标准如表1。根据以下两项结果之和确定每张切片的阳性程度:≥3分为阳性表达(+),<3分为阴性表达(-)。
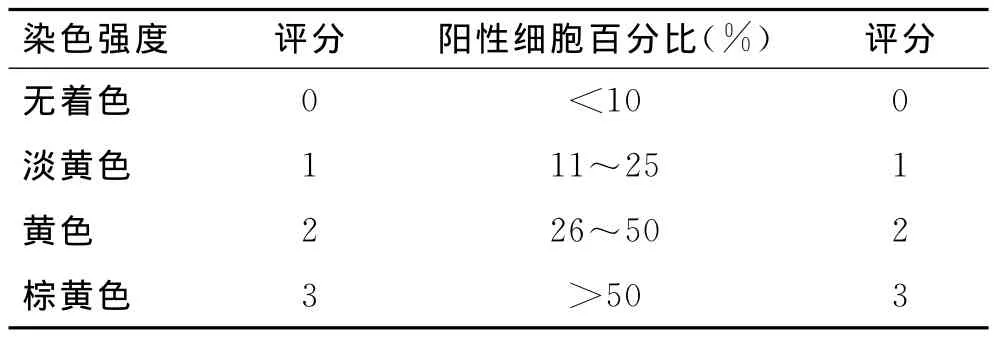
表1 阳性结果统计方法Tab.1 Statistical methods of positive results
1.4 统计学方法 采用SPSS 17.0统计软件进行统计学分析。组间比较采用卡方检验(当1≤T<5时,用连续性校正公式计算卡方值;当N≤40或T<1时,用Fisher's确切概率法),相关性分析采用Spearman等级相关法。P<0.05时,差异具有统计学意义。
2 结 果
2.1 HIF-1α在NP、HM、IM中的表达情况 HIF-1α主要表达于滋养细胞的细胞核。在NP中以淡黄色颗粒表达为主,阳性细胞呈弥散分布;在HM中以黄色颗粒表达为主,阳性细胞呈弥散分布;在IM中以棕黄色粗大深染颗粒表达为主,阳性细胞呈局灶性分布,且染色强度较正常早孕绒毛和葡萄胎组织明显增强(图1)。
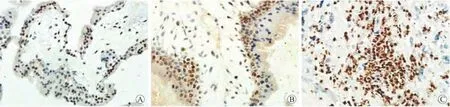
图1 HIF-1α在NP(A)、HM(B)和IM(C)中的表达Fig.1 The expression of HIF-1αin normal pregnancy villi(A),hydatidiform moles(B)and invasive hydatidiform moles(C)(×400)
HIF-1α在IM中的阳性表达率明显高于HM和NP组,差异具有统计学意义(P<0.05);HM和NP组间的表达差异无统计学意义(P>0.05,表2)。在26例IM中,术前未化疗12例,化疗14例,HIF-1α表达的组间差异无统计学意义(P>0.05,表3)。
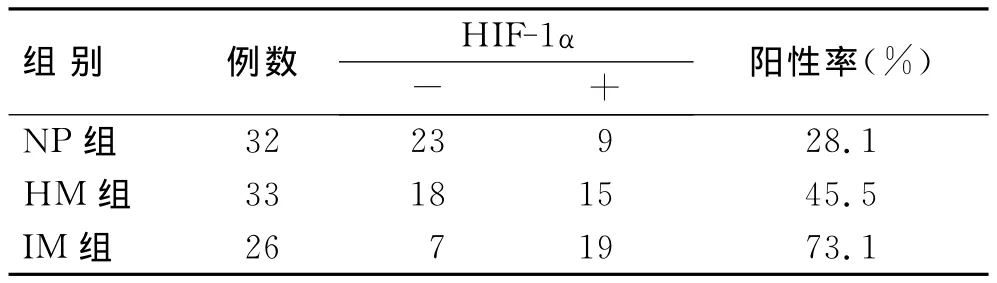
表2 HIF-1α在NP、HM和IM中的表达情况Tab.2 The expression of HIF-1αin NP,HM and IM
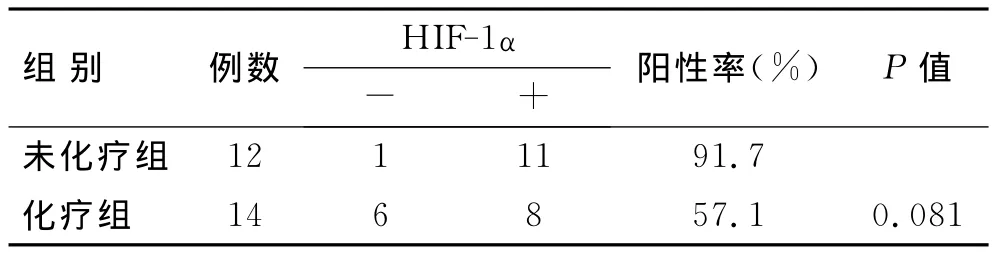
表3 HIF-1α的表达水平与化疗的关系Tab.3 Relationship between the expression of HIF-1αand chemotherapy
2.2 CAIX在NP、HM和IM中的表达情况 CAIX蛋白主要表达于滋养细胞的细胞膜。在NP中以淡黄色颗粒表达为主,阳性细胞呈弥散分布;在HM中几乎呈阴性表达;在IM中以粗大深染的棕黄色颗粒表达为主,阳性细胞呈弥散分布,且染色强度较NP和HM明显增强(图2)。
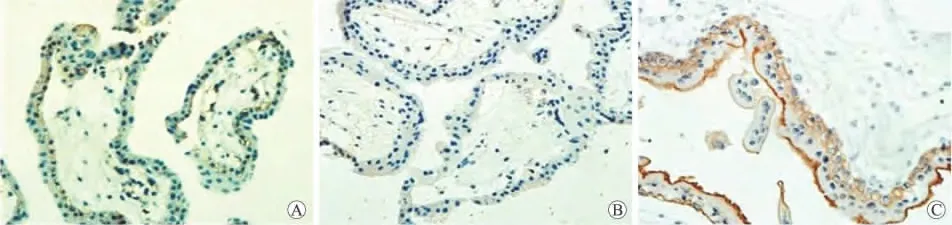
图2 CAIX在NP(A)、HM(B)和IM(C)中的表达Fig.2 The expression of CAIX in normal pregnancy villi(A),hydatidiform moles(B)and invasive hydatidiform moles(C)(×400)
CAIX在IM中的阳性表达率明显高于HM和NP组,差异具有统计学意义(P<0.05);在 HM中几乎呈阴性表达,与NP组间差异具有统计学意义(P<0.05,表4)。经统计学分析,在IM中术前化疗组与未化疗组间的表达差异无统计学意义(P>0.05,表5)。
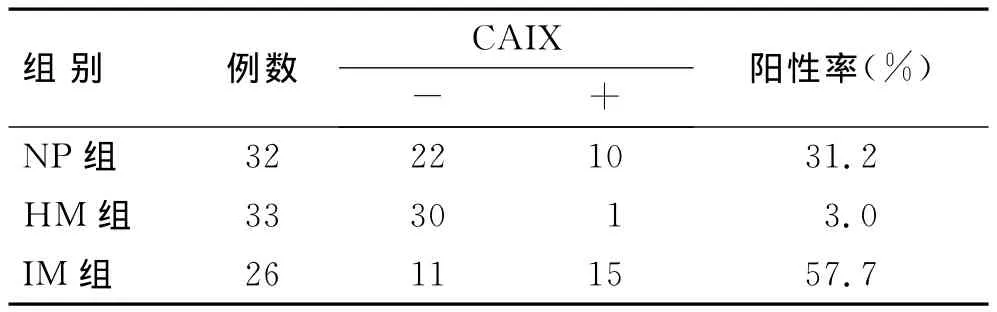
表4 CAIX在NP、HM和IM中的表达情况Tab.4 The expression of CAIX in NP,HM and IM
2.3 HIF-1α和CAIX在IM中表达的相关性分析在IM中,HIF-1α和CAIX的表达都明显高于NP组及HM组,但Spearman相关性分析表明,HIF-1α和CAIX的阳性表达无统计学差异(r=-0.374,P=0.082,表6)。
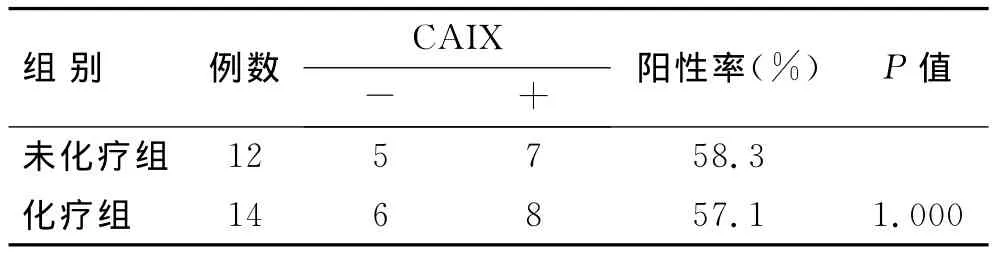
表5 CAIX的表达水平与化疗的关系Tab.5 Relationship between the expression of CAIX and chemotherapy
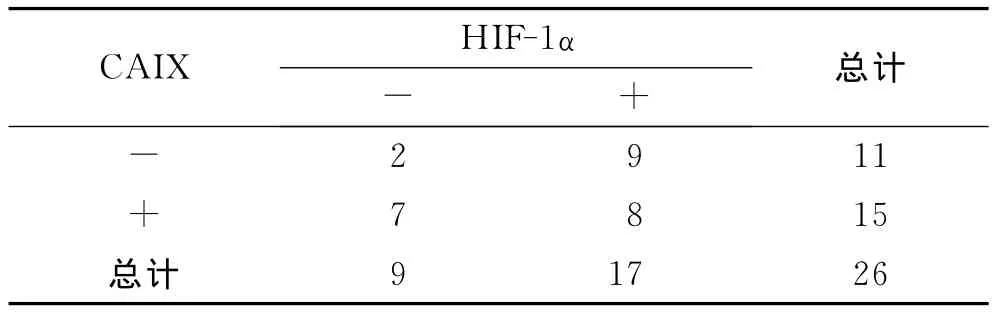
表6 HIF-1α和CAIX在GTN中表达的相关性Tab.6 Relationship between HIF-1αand CAIX expressions in GTN
3 讨 论
肿瘤微环境是肿瘤发生发展、侵袭及转移的前提和保障。缺氧是进展性实体肿瘤微环境中最常见的现象,与肿瘤的多种生物学行为密切相关。HIF-1α和CAIX作为可靠的缺氧标记物,在多种恶性肿瘤中存在过度表达,且与肿瘤的恶性进展、对放化疗的抵抗及不良预后相关[4-5]。目前,众多研究都表明以HIF-1α为靶点的治疗可能成为肿瘤治疗的重要手段[6]。
本研究结果显示,HIF-1α的表达随着GTD疾病的进展而呈上升趋势,在IM中的表达明显高于HM和NP组,特别是染色强度,这与既往的研究相一致[7]。区别于其他两组,HIF-1α在IM中的阳性细胞呈局灶性分布,这种高表达与灶性分布与其在其他恶性肿瘤中的研究一致。有学者认为[8],局灶性的缺氧及周围坏死区的出现才是诱导细胞恶性表型的关键。考虑到化疗对于滋养细胞恶性转化的影响,对IM组12例术前未接受化疗和14例化疗标本进行分析,HIF-1α的表达差异无统计学意义(P=0.081),说明化疗对HIF-1α在IM中的表达无干扰。因此,我们认为HIF-1α在妊娠滋养细胞疾病的恶性转化过程中发挥作用。
既往研究表明,CAIX的表达主要位于坏死区域周围的肿瘤组织中,呈局灶性,与缺氧分布一致[9-10]。在本研究中,CAIX在IM中表达水平明显高于HM和NP组,特别是染色强度,这种肿瘤组织中的过表达与其他恶性肿瘤的研究相一致,提示CAIX在妊娠滋养细胞疾病的恶性转化中发挥作用。但是,CAIX在3组中的阳性分布均呈弥散性,提示在GTD的发展中是否存在其他机制调控CAIX的表达。同样的,我们分析了化疗对于CAIX表达的影响,结果无统计学意义(P=1.000)。
CAIX是HIF-1α的重要靶基因,其表达优先受HIF-1α调控。研究表明,HIF-1α和CAIX的阳性表达空间分布非常相似,且诱导HIF-1α表达可使CAIX表达增加[11]。本研究对HIF-1α和CAIX在侵袭性葡萄胎中的表达做相关性分析,结果显示,二者在IM组均存在过度表达,但表达无相关性(P>0.05)。且两者在IM中的表达分布不一致,HIF-1α呈局灶性,而CAIX呈弥散性,由于妊娠滋养细胞肿瘤的发病机制不十分清楚,是否存在其他调控机制影响两者的表达尚需进一步验证。
综上所述,HIF-1α和CAIX在妊娠滋养细胞肿瘤中的表达高于正常早孕绒毛和葡萄胎组织,提示两者在GTD的发生发展及恶性转化过程中发挥作用。随着对妊娠滋养细胞肿瘤缺氧微环境研究的深入,有望为其治疗提供新的思路。
[1]HARRIS AL.Hypoxia-a key regulatory factor in tumor growth[J].Nat Rev Cancer,2002,2(1):38-47.
[2]ADAMS JM,DIFAZIO LT,ROLANDELLI RH,et al.HIF-1αkey mediator in hypoxia[J].Acta Physiol Hung,2009,96(1):19-28.
[3]HYNNINEN P,PARKKILA S,HUHTALA H,et al.Carbonic anhydrase isozymesⅡ,Ⅸ,andⅫin uterine tumors[J].Apmis,2012,120(2):117-129.
[4]PASTOREKOVA S,PARKKILA S,ZAVADA J.Tumor-associated carbonic anhydrases and their clinical significance[J].Adv Clin Chem,2006,42:167-216.
[5]MONTI E,GARIBOLDI MB.HIF-1 as a target for cancer chemotherapy,chemosensitization and chemoprevention[J].Curr Mol Pharmacol,2011,4(1):62-77.
[6]王健,郝继辉.HIF-1α在肿瘤乏氧微环境中的作用及其靶向治疗的研究进展[J].中国肿瘤临床,2013,40(17):1068-1071.
[7]BOLAT F,HABERAL N,TUNALI N,et al.Expression of vascular endothelial growth factor(VEGF),hypoxia inducible factor 1 alpha(HIF-1alpha),and transforming growth factors beta1(TGFbeta1)and beta3(TGFbeta3)in gestation trophoblastic disease[J].Pathol Res Pract,2010,206(1):19-23.
[8]SEEBER LM,HORREE N,VOOIJS M,et al.The role of hypoxia inducible factor-1alpha in gynecological cancer[J].Crit Rev Oncol Hematol,2011,78(3):173-184.
[9]NORDFORS K,HAAPASALO J,KORJA M,et al.The tumour-associated carbonic anhydrases CAII,CAIX and CAXII in a group of medulloblastomas and supratentorial primitive neuroectodermal tumours:an association of CAIX with poor prognosis[J].BMC Cancer,2010,10:148.
[10]ROBERT N,POTTER C,HARRIS AL.Role of carbonic anhydrase IX in human tumor cell growth,survival and invasion[J].Vanver Res,2004,64(17):6160-6165.
[11]RUSSELL J,CARLIN S,BURKE SA.Immunohistochemical detection of changes in tumor hypoxia[J].Int Radiat Oncol Bio Phys,2009,73(4):1177-1186.
