吸烟对肺癌患者表皮生长因子影响的Meta分析
2015-02-18徐兴祥
杭 欣 徐兴祥
吸烟对肺癌患者表皮生长因子影响的Meta分析
杭欣徐兴祥
【摘要】目的探讨吸烟对肺癌患者表皮生长因子受体(EGFR)突变、表达及其耐药性和临床疗效的影响,为临床肺癌患者的疗效评估或靶向治疗的优势人群筛选提供依据。方法计算机检索PubMed、ProQuest Research Library、Web of science、中国生物医学文献数据库、维普中文生物医学期刊及万方数据库,收集吸烟对肺癌患者EGFR影响的临床试验文章,检索时间1997年1月至2013年12月。用RevMan 5.0软件进行Meta分析。结果共纳入38个国内外研究。Meta分析结果显示未吸烟肺癌患者的EGFR突变率为41.1%,高于吸烟患者的10.6%;而EGFR表达阳性率,未吸烟患者为53.1%,高于吸烟患者的42.2%;吸烟肺癌患者原发耐药性为18.3%,高于未吸烟患者的6.4%;肺癌患者EGFR-TKIs治疗效果显示,未吸烟患者77.7%的疾病控制率优于吸烟患者56.9%的控制率。结论吸烟对肺癌EGFR影响显著, 吸烟与EGFR的突变呈负相关,不吸烟患者的表皮生长因子的突变率及EGFR表达阳性率均较高, EGFR-TKIs对没有吸烟史的肺癌患者治疗效果优于吸烟患者。 阅读文献题目和,排除明显不符合纳入标准的试验后,对可能符合纳入标准的试验阅读全文,以确定其是否符合纳入标准。对符合纳入标准的研究按统一的资料提取表提取以下信息:文献题目、作者、发表时间、文献来源、研究对象的一般情况、各组患者的基线及EGFR-TKIs临床获益情况。采用RevMan5.0进行Meta分析。对研究文献所得的OR值进行异质性检验。当结果存在异质性,用随机效应模型进行合并,反之用固定效应模型分析。同时进行敏感性分析,主要包括:比较全部入选文献与排除小样本研究资料后剩余文献的Meta分析结果;比较全部文献与排除质量相对较低的研究资料后剩余文件的Meta分析。 初检有关文献2 445篇(其中英文文献1 871篇,中文文献574篇),阅读文题排除综述、叙述性研究综述、重复检出研究1 091篇,余1 354篇查找原文,进一步阅读全文,排除1 316篇未达纳入标准的文献,最终纳入38篇研究文献。属于Ⅲ级临床研究证据。
【关键词】支气管肺癌;表皮生长因子;Meta分析;吸烟
肺癌的发病率和病死率均为恶性肿瘤的首位。非小细胞肺癌(non small cell lung cancer, NSCLC)约占原发性肺癌的80%~85%。约1/3患者一经确诊即为晚期,以顺铂为基础的化疗效果仍不满意[1]。近年来,分子靶向治疗已逐步成为研发热点之一,其代表就是表皮生长因子受体酪氨酸激酶抑制(epidermal growth factor receptor -tyrosine kinase inhibitors, EGFR-TKIs)。EGFR-TKIs靶向治疗针对性强,能有效改善药物在体内的代谢动力学,增加药物定向富集到肿瘤部位甚至肿瘤细胞内,提高疗效,降低毒副作用,优于传统疗法,且患者的生存时间可明显延长[2]。
目前,已经公认为引发肺癌的诸多因素中,吸烟一直是最为主要和确定的危险因子,90%肺癌的发生都与吸烟相关[3]。研究结果表明,吸烟与肺癌患者EGFR突变相关,并且与依赖EGFR突变信号传导通路的肺腺癌的发生关系密切。EGFR的异常可导致其下游信号途径的异常激活,最终促进细胞的转化、增殖,抵抗细胞凋亡,与肿瘤的发生、发展密切相关[4-5],因此EGFR成为肿瘤治疗的重要靶分子。EGFR-TKIs是目前针对EGFR治疗NSCLC的重要分子靶向药物。
本研究通过Meta分析,系统评估吸烟对肺癌患者EGFR突变、表达及其耐药性和临床疗效的影响,旨在为临床肺癌患者的疗效评估或靶向治疗的优势人群的筛选提供依据,同时也为临床药物的个体化治疗提供依据。
资料与方法
一、纳入排除标准
1. 研究类型:独立的病例对照研究。研究文献为全文文献、不受语种限制;在期刊发表过的文献。
2. 研究对象: 确诊为肺癌的患者;病理诊断明确,提供有病例及对照来源,未经过系统治疗的肺癌患者。
3. 吸烟标准:根据WHO1997年定义为一生中连续或累积吸烟6个月以上者。包括经常吸烟者:每天吸卷烟1支以上,连续或累计6个月;偶尔吸烟者:每周吸卷烟超过4次,但平均每天不足1支。
4. 结局指标: 具有肺癌患者的EGFR的原发突变率、蛋白表达情况、EGFR原发耐药情况及EGFR-TKIs治疗的疗效评价等数据。
5. 耐药性评价标准:检测未经治疗的EGFR突变阳性的肺癌患者中耐药基因,包括20外显子(T790M),位于EGFR信号通路通路的下游的K-ras基因突变的检测。
6. 疗效评价标准:根据美国国家肿瘤研究所实体瘤疗效评价标准(NCI-RECIST1.0 版)分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。疾病控制(disease control, DC)=CR+PR+SD。
7. 排除标准:①未达到“吸烟”定义的肺癌患者;②资料收集方法不科学;③综述性文献;④重复性文献。
二、检索策略
以smoking AND (lung carcinoma or lung tumor) AND(EGFR or epidermal growth factor receptor )为检索词检索ProQuest Research Library(1084) 、PubMed(621)和Web of science(811);以吸烟和(肺癌 or 肺肿瘤)和(EGFR or 表皮生长因子的受体)为检索词检索中国生物医学文献数据库(163)、维普中文生物医学期刊(5)、万方数据库(201),各数据库检索时间1997年1月至2013年12月。
三、资料提取和质量评价
通过绘制漏斗图发表偏倚的识别,由RevMan 5生成,以OR为横坐标,并采用自然对数刻度,OR自然对数的标准误为纵坐标,从上向下依次增大。漏斗图对称则说明发表性偏倚得到有效控制。
结果
一、文献检索
二、纳入研究的一般情况和质量学评价
38篇研究提及患者诊断及患者来源,患者一般情况[1-38],其中有9篇报道了关于EGFR-TKIs治疗效果及以DC作为抑制治疗效果的评价[30-38],见表1。
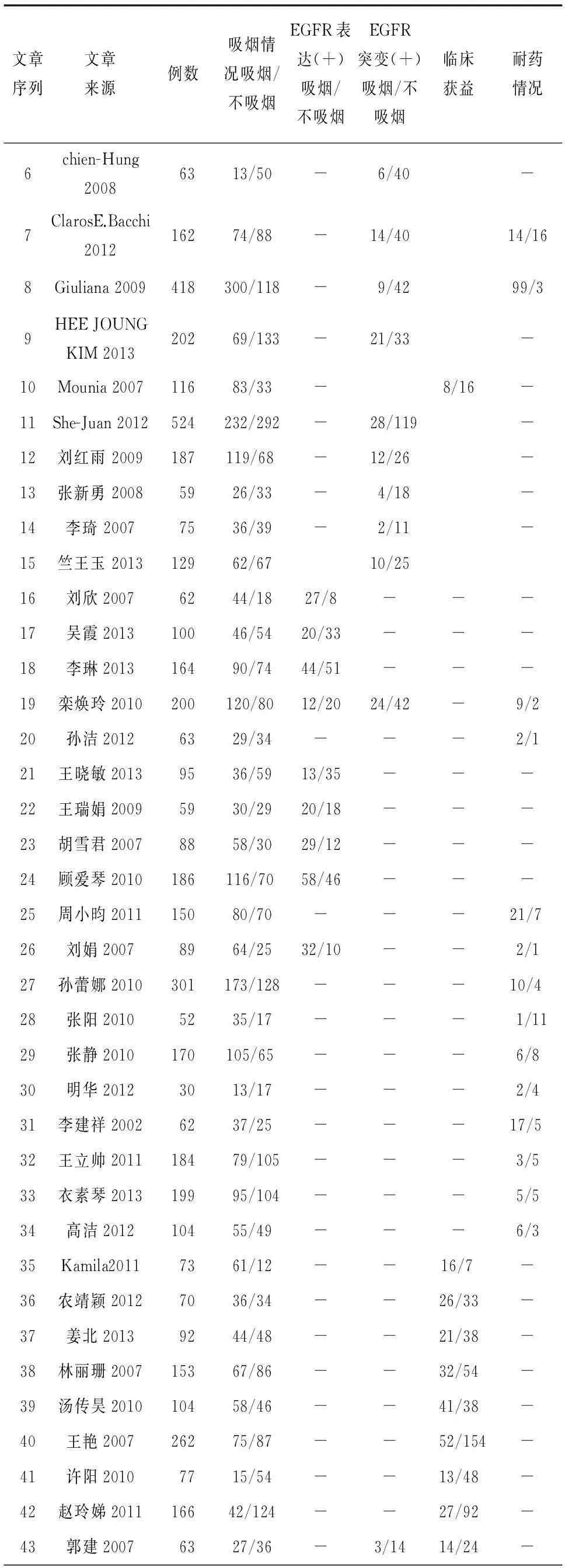
表1 纳入研究的一般情况
三、Meta分析
1. 吸烟对EGFR的突变影响:11篇研究报告了在不同的条件下EGFR突变情况[6-15]。异质性检验同质(P=0.25),采用固定效应模型进行分析;结果显示吸烟者EGFR突变发生率10.6%显著低于不吸烟者41.1%(OR=0.20,95%CI[0.15,0.25],P<0.001),见图1。由Forest plot图表分析可知,合并效应量偏向于未吸烟者。未吸烟肺癌患者EGFR的原发突变率明显高于吸烟患者。
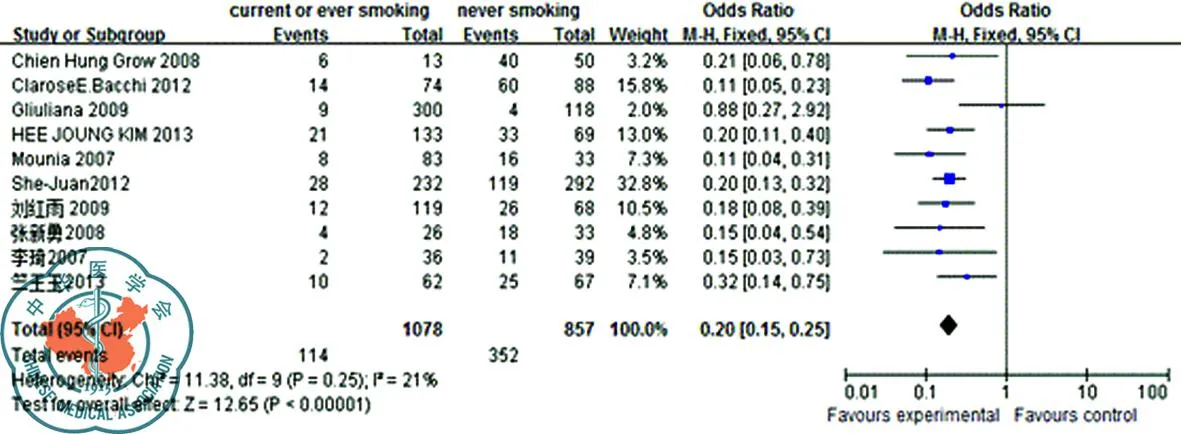
图1 吸烟与肺癌患者EGFR突变森林图
2. 吸烟对EGFR 表达的影响:9篇研究报告了吸烟对EGFR表达的影响[16-19,21-24,26]。异质性检验不同质(P=0.02)Meta分析结果,采用随机效应模进行分析;结果显示吸烟者EGFR阳性表达率42.2%低于不吸烟者53.1%,但无统计学意义(OR=0.69,95%CI[0.46,1.05],P=0.09),见图2。

图2 吸烟与肺癌患者EGFR表达森林图
3. 吸烟对EGFR耐药性的影响:11个研究报告了吸烟对EGFR耐药的影响[7-8,19-20,25,27-31,34]。异质性检验不同质(P=0.02)Meta分析结果,采用随机效应模进行分析;结果显示吸烟者EGFR耐药率18.3%高于不吸烟者6.4%(OR=2.27,95%CI[1.15,4.48],P=0.02)显示吸烟者肺癌患者与未吸烟患者在EGFR的耐药率差异明显,见图3。
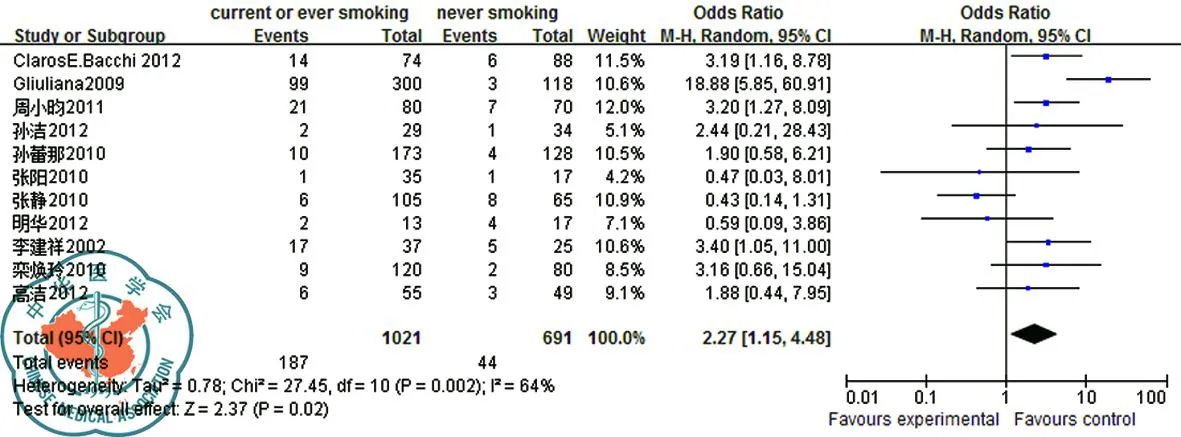
图3 吸烟与肺癌患者EGFR耐药性森林图
4. 吸烟对EGFR-TKIs疗效的影响: 9篇研究报告了吸烟对EGFR-TKIs影响[35-43],异质性检验不同质(P=0.02)Meta分析结果,采用随机效应模进行分析;结果显示吸烟者EGFR-TKIs疾病控制率56.9%显著低于不吸烟者77.7%(OR=0.45,95%CI[0.34,0.61],P<0.001),显示吸烟者肺癌患者与未吸烟患者在EGFR的治疗效果上差异明显,见图4。
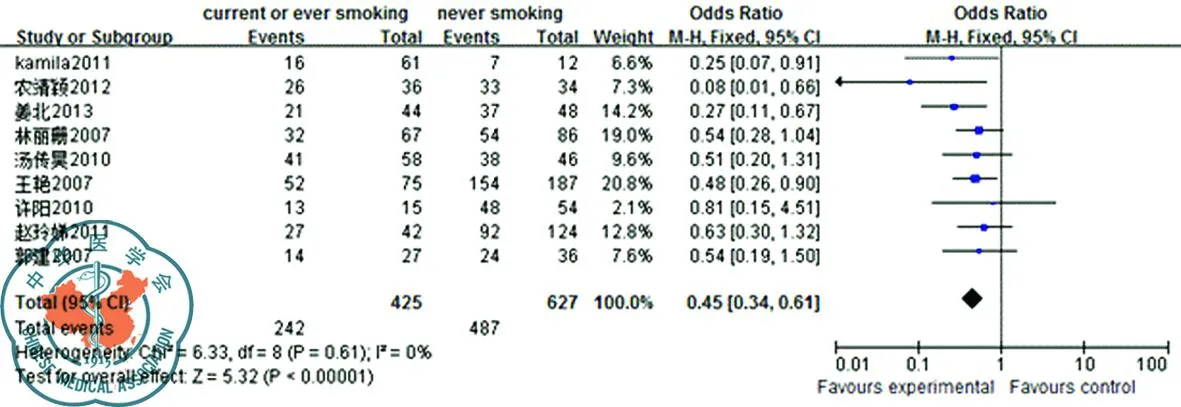
图4 吸烟EGFR-TKIs疗效森林图
5. 敏感性分析与发表偏倚分析: 本次Meta 分析对不同危险因素进行了敏感性分析,分析结果与原结果基本相似,支持总样本研究结果,并且都做了漏斗图判断发表偏倚,大致对称。
讨论
EGFR基因的突变89%集中在19外显子的缺失和21外显子的L858R、L861Q错义突变。19外显子缺失以Del E746-A750为主,21位外显子点突变率以L858R[44]。由吸烟对EGFR的突变影响结果可知,不吸烟者肺癌患者的突变率高于吸烟者,文献报道为:未吸烟患者存在以19外显子的缺失和21外显子的错义突变,导致了EGFR突变率增高,而吸烟干扰了EGFR的基因编码。未吸烟者第19号外显子多个核苷酸框架缺失突变,含有共同的碱基序列的缺失(第747-750个密码子),为LREA(亮氨酸、精氨酸、谷氨酸、丙氨酸),缺失突变靠近alpha-C-helix,而后者控制着与ATP结合囊的角度,突变使ATP结合囊变窄。21号外显子上主要是858位点氨基酸替代突变。突变导致EGFR活性增加,下游增殖通路被高度激活,因此称为EGFR的激活性突变,L858R单核苷酸的替换突变靠近保守的Asp-Phe-Gly序列,突变使A-100p的稳定性增加[45]。
由Meta分析2、3、2结果可知,未吸烟患者的EGFR的蛋白表达情况要高于吸烟患者,可能与EGFR的突变有关。在NSCLC的发生和发展中, EGFR及其配体在肺癌中高表达与TMN分期、淋巴结浸润显著相关,从而EGFR可以作为肺癌的预后判断指标。研究证实,EGFR蛋白的表达与19外显子的突变有明显的相关性,但与18、20、21外显子的突变没有明显的相关性。吸烟肺癌患者的19外显子突变率较高,使得EGFR蛋白呈现高表达。
吸烟肺癌患者的EGFR原发耐药性要高于未吸烟患者。目前研究表明:吸烟的肺腺癌患者中存在 K-ras基因突变,K-ras是EGFR介导的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的重要分子,肺癌中,激活突变的K-ras基因是早期发现的遗传改变基因之一,被认为是不良预后指标。突变后的K-ras基因不依赖于上游EGFR的活化而直接激活MAPK信号通路,导致肿瘤增殖、转移等[46]。临床研究证实K-ras基因突变与EGFR的突变不共存,K-ras基因突变独立于EGFR突变,其可以作为预测EGFR原发耐药的分子指标[47]。吸烟可导致肺癌患者免疫功能低下。新陈代谢的快速失活,以及吸收能力的低下将降低表皮生长因子酪氨酸激酶抑制的有效性。在多种因素的共同作用下,导致了吸烟患者原发耐药性的产生。
由吸烟对EGFR 表达的影响可知,EGFR-TKIs对非吸烟的患者治疗效果更佳[48]。查阅文献,探讨原因,可知EGFR基因存在后天性突变[49]。研究显示EGFR基因突变与EGFR-TKIs临床疗效有一定的相关性:EGFR基因突变导致EGFR-TKIs疗效增强,韩国首尔大学Han等[50]首次报导EGFR突变型的疾病进展时间(time to progression, TTP)和总体生存率(overall survival, OS)等指标均显著优于野生型,提示突变型患者经药物治疗的预后较好,日本Aichi癌症中心医院的Mitsudomi等[51]发现,外显子19碱基缺失的靶向治疗的有效率显著高于点突变(G719C,L858R和L861Q),Kaplan-Meier 检验解释了EGFR基因突变是影响预后的主要因素。EGFR细胞内的受体结合区主要是酪氨酸激酶(TK)系统,对EGFR-TKIs治疗敏感的患者体内EFGR的突变主要在TK结构域的第19个外显子的框架缺失和第21个外显子内的氨基酸被取代。未吸烟肺癌患者EGFR的19、21外显子突变率较高,对靶向治疗有良好反应性,而吸烟使EGFR的第20个外显子产生突变,使得药物治疗药物空间位阻无法与TK区结合,从而大大地降低了药物的敏感性。所以吸烟患者治疗效果不佳。
由于EGFR基因的突变, 致使19外显子中746-752位密码子的缺失突变,导致EGFR蛋白中氨基酸序列丢失。这一突变改变了受体ATP结合囊的角度,从而显著增强肿瘤细胞对EGFR-TKIs的敏感性能。吸烟肺癌患者的外显子20突变率较高。当外显子20点突变(T790M)单独或者与其他的EGFR突变类型—外显子18的点突变(G719X)、外显子19的缺失突变(ΔE746-A750,ΔE746-T751等)、外显子20的点突变(L858R)同时存在时,发生在EGFR基因的外显子第20区,编码的苏氨酸转变为甲硫氨酸。这种氨基酸的改变直接导致了ATP结合功能区的结构改变,影响靶向药物与其结合,从而影响EGFR-TKIs的疗效。所以未吸烟肺癌患者EGFR表达阳性率高,患者靶向治疗的效果好。同样,对EGFR-TKIs产生原发耐药的肺癌患者,其K-ras基因或EML4-ALK或HER-2基因发生突变,这些突变相互之间不共存,他们能使受体持续激活,从而导致肿瘤细胞的不断增值[48]。所以有原发耐药性的患者其EGFR-TKIs的治疗效果不佳[52]。
由Meta分析结果可知吸烟对肺癌EGFR突变在各研究之间存在统计学异质性,采用不同模型合并后, Meta分析结果显示吸烟影响EGFR突变,吸烟者及未吸烟者差异明显。吸烟与肺癌患者EGFR的突变呈负相关。EGFR突变是非吸烟患者最早的分子改变。烟草不是非吸烟患者EGFR突变的致癌剂。大规模的临床试验已经表明酪氨酸激酶抑制剂EGFR-TKIs在晚期非小细胞肺癌中的疗效和生存上的优势。综合本次Meta分析的结果:未吸烟患者的突变率较高,主要集中在18、21号外显子,同时蛋白阳性表达的情况也优于吸烟的肺癌患者,激活的EGFR对EGFR-TKIs有良好的反应,所以治疗效果也优于吸烟的肺癌患者。有文献报道,EGFR-TKIs治疗的患者中,无吸烟史的患者在生存上明显优于有吸烟史的患者[37]。
目前临床治疗指南已将靶向治疗作为治疗NSCLC的重要方法,与化疗和手术治疗相并列[41]。其靶向治疗的代表药物有:EGFR-TKIs[吉非替尼(gefitinib)和厄洛替尼(erlotinib)],此次分析结果可知,未吸烟肺癌患者的EGFR的突变率高于吸烟者,EGFR表达阳性率也优于吸烟者,其靶向治疗的效果也优于吸烟者,这为靶向治疗优势人群的筛选提供了依据,未吸烟患者可以优先考虑靶向治疗。
本次Meta 分析结果基本稳定,但在纳入文献方面尚存在以下局限性:①本研究采取了广泛的检索策略,却因诸多原因未能获取未发表的文献,因而不能排除潜在的发表偏倚,故在应用本研究结果时应加以考虑;②检索文献的语种仅局限于中文和英文,可能会造成漏检其他语种临床试验的语种偏倚。因而还有待于进一步研究和完善。本次研究由于文献搜集等方面的原因,未对其他影响因素,例如患者的性别、年龄、其他病理类型进行分析,尚需对此次未涉及的因素进行Meta 分析研究。
参考文献
1Schiller JH, Harrinqton D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung caneer[J]. N Ensl J Med, 2002, 346(2): 92-98.
2Shepherd FA, Rodrigues Pereira J,Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer[J]. N Engl J Med, 2005, 353(2): 123-132.
3Pirozynski M. 100 years of lung cancer[J]. Respir Med, 2006, 100(12): 2073-2084.
4Reinmuth N, Brand B, Kunze WP, et al. Ploidy, expression of erbB1, erbB2, p53 and amplification of erbBl,erbB2, erbB3 in non -small celllung cancer[J].Eur Respir J, 2000, 16(5): 991-996.
5Yarden Y. The EGFR family and its ligands in human cancer signalingmechanisms and therapeutic opportunities[J]. Eur J cancer, 2001, 37(suppl 4), S3-S8.
6Gow CH, Chien CR, Chang YL, et al. Radiotherapy in lung adenocarcinoma with brain metastases:effects of activating epidermal growth factor receptor mutations on clinical response[J]. Clin Cancer Res , 2008, 14(1): 162-168.
7Bacchi CE, Ciol H, Queiroga EM, et al. Epidermal growth factor receptor and KRAS mutations in Brazilian lung cancer patients[J]. Clinics, 2012, 67(5): 419-424.
8Sartori G, Cavazza A, Sgambato A, et al. EGFR and K-ras mutations along the spectrum of pulmonary epithelial tumors of the lung and elaboration of a combined clinicopathologic and molecular scoring system to predict clinical responsiveness to EGFR inhibitors[J]. Am J Clin Pathol, 2009, 131(4): 478-489.
9Kim HJ, Oh SY, Kim WS, et al. Clinical investigation of EGFR mutation detection by pyrosequencing in lung cancer patients[J]. Oncol Lett, 2013, 5(1): 271-276.
10Mounawar M, Mukeria A, Le Calvez F, et al. Patterns of EGFR, HER2, TP53, and KRAS mutations of p14arf expression in non-small cell lung cancers in relation to smoking history[J]. Cancer Research, 2007, 67(12): 5667-5672.
11An SJ, Chen ZH, Su J, et al. Identification of enriched driver gene alterations in subgroups of non-small cell lung cancer patients based on histology and smoking status[J]. PLoS One, 2012, 7(6): e40109.
12刘红雨, 李颖, 陈钢, 等. 187例非小细胞肺癌中EGFR基因突变和扩增的检测及其临床意义[J]. 中国肺癌杂志, 2009, 12(12): 1219-1228.
13张新勇, 徐丽艳, 汪惠, 等. EG FR基因突变与酪氨酸激酶抑制剂疗效及预后之间的关系[J]. 中国肺癌杂志, 2008,11(2): 206-213.
14李琦, 赵亚力, 郝好杰, 等. 中国肺癌患者EGFR基因突变的研究[J]. 中华肿瘤杂志, 2007, 29(4): 270-273.
15竺王玉, 何剑营, 陈冬冬, 等. 海岛地区非小细胞肺癌EGFR基因突变与临床病理特征的关系[J]. 中国卫生检验杂志, 2013, 23(6): 1369-1363.
16刘欣, 田慧芳, 王秀问, 等. SSTR2A、SSTR5与EGFR蛋白在非小细胞肺癌中的表达及其意义[J]. 中国肺癌杂志, 2007, 10(1): 14-19.
17吴霞, 李代强. ALK和EGFR蛋白在非小细胞肺癌中的表达及意义[J]. 国际病理科学与临床杂志, 2013, 33(2): 120-123.
18李琳, 王晖, 杜俊, 等. 雌激素受体α和β及表皮生长因子受体的表达与非小细胞肺癌临床病理特点关系[J]. 现代肿瘤医学, 2013, 21(3): 539-543.
19栾焕玲, 孙蕾娜, 董娜, 等. 非小细胞肺癌中EGFR和K-ras基因突变与蛋白表达相关性的研究[J]. 中国肺癌杂志, 2010, 20(7): 486-491.
20孙洁, 明华, 孙建国, 等. 焦磷酸测序技术检测63例晚期NSCLC患者血浆KRAS基因突变[J]. 重庆医学, 2012, 41(11): 1062-1064.
21王晓敏, 任力, 岳颖, 等. EGFR、VEGF和nm23在非小细胞肺癌中的表达及临床意义[J]. 诊断病理学杂志, 2013, 20(4): 239-242.
22王瑞娟, 张建中, 王萍. EGFR与ERβ在非小细胞肺癌组织中的表达及其临床意义[J]. 诊断病理学杂志, 2009, 16(5): 375-377.
23胡雪君, 宋娜, 刘云鹏, 等. 非小细胞肺癌中EGFR、VEGF和Cox-2表达的预后意义[J]. 现代肿瘤医学, 2007, 15(6): 772-775.
24宋懿懿, 顾爱琴, 韩宝惠, 等. VEGF及EGFR在非小细胞肺癌组织中的表达及临床意义[J]. 中国癌症杂志, 2010, 20(7): 492-496.
25周小昀, 李龙芸, 崔巍, 等. 检测肺癌患者血清有力DNA的EGFR基因点突变与EGFR-TKI疗效的相关性分析[J]. 癌症进展, 2011, 9(1): 13-18.
26刘娟, 吴翠环, 吕彦, 等. 非小细胞肺癌中HPV感染与EGFR、VEGF表达的相关性研究[J]. 肿瘤, 2007, 27(10): 821-824.
27孙蕾娜, 栾焕玲, 臧凤琳, 等. 中国人非小细胞肺癌EGFR和K-ras基因突变与临床病理特征及厄洛替尼治疗效果的关系[J]. 中华肿瘤杂志, 2010, 32(9): 667-670.
28张阳, 潘振奎, 张星, 等. 非小细胞肺癌患者K-RAS基因突变的研究[J]. 中国肺癌杂志, 2010, 13(6): 602-606.
29张静, 梁智勇, 高洁, 等. 非小细胞肺癌表皮生长因子受体基因及k-ras基因突变与临床病理特征的关系[J]. 协和医学杂志, 2010, 1(1): 53-59.
30明华, 孙洁, 孙建国, 等. 30例晚期非小细胞肺癌胸腔积液KRAS基因突变的检测[J]. 重庆医学, 2012, 41(11): 1058-1061.
31李建祥, 陈锐, 周立人, 等. 肺癌患者支气管肺泡灌洗液中K-ras基因第1外显子点突变与吸烟的关系[J]. 环境与职业医学, 2002, 19(5): 278-280.
32王立帅, 张瑜, 陆小军, 等. 双环探针特异引物荧光聚合酶链反应法检测非小细胞肺癌表皮生长因子受体基因突变[J]. 中华病理学杂志, 2011, 40(10): 667-670.
33衣素琴, 庄园, 朱卫东, 等. 非小细胞肺癌中KRAS 基因突变分析[J]. 中华临床医师杂志, 2013, 7(20): 9111-9115.
34高洁, 陈佳琦, 张力, 等. 中国非小细胞肺癌患者表皮生长因子受体和KRAS基因突变与预后的相关性[J]. 中华病理学杂志, 2012, 41(10): 652-656.
35Wojas-Krawczyk K, Krawczyk P, Mlak R, et al. The applicability of a predictive index for second- and third-line treatment of unselected non-small-cell lung cancer patients[J]. Respiration, 2011, 82(4): 341-350.
36农靖颖, 王敬慧, 杨新杰, 等. 表皮生长因子酪氨酸酶抑制剂老年晚期非小细胞肺癌临床分析[J]. 中华全科医师杂志, 2012, 11(3): 221-223.
37姜北, 李晶, 万鹏, 等. EGFR-TKIs在晚期非小细胞肺癌靶向治疗中的临床研究[J]. 现代生物医学进展, 2013, 13(8): 1489-1492.
38林丽珊, 张力, 赵洪云, 等. 吉非替尼治疗化疗失败的局部晚期或转移性非小细胞肺癌疗效及生存的预测因素[J]. 中国肺癌杂志, 2007, 10(5): 411-417.
39汤传昊,刘晓晴,高红军,等. 厄洛替尼治疗晚期非小细胞肺癌的临床观察[J]. 中华肿瘤杂志, 2010, 32(2): 143-147.
40王燕, 张湘茹, 朱红霞, 等. 吉非替尼治疗非小细胞肺癌的临床疗效预测模型的初步建立[J]. 中华医学杂志, 2007, 87(43): 3069-3073.
41许阳, 陈良安, 田庆, 等. 表皮生长因子受体酪氨酸酶抑制剂在晚期非小细胞肺癌一线治疗中的应用[J]. 中国肺癌杂志, 2010, 13(1): 48-53.
42赵玲娣, 李峻岭, 王燕, 等. 影响表皮生长因子受体酪氨酸激酶抑制剂治疗晚期小细胞肺癌放疗的临床因素分析[J]. 中国肿瘤杂志,2011, 33(3): 217-221.
43郭建, 周彩存, 张颉, 等. EGFR基因突变与EGFR酪氨酸激酶抑制剂近期疗效的关系[J]. 中国肺癌杂志, 2007, 10(6): 504-507.
44李媛, Song Lihua. 非小细胞肺癌分子靶向治疗中EGFR-TKI的耐药机制研究进展[J]. 中国肺癌杂志, 2012, 15(2): 106-111.
45Shigematsu H, Gazdar AF. Somatc mutations of epidermal growth factor receptor signaling pathway in lung cancers[J]. Int J Cancer, 2006, 118(2): 257-262.
46Schleger C, Heck R, Steinberg P. The role of wild-type and mutated N-ras in the malignant transformation of Iiver cells[J]. Mol Carcinog, 2000, 28(1): 31-41.
47Toyooka S, Date H, Uchida A, et al. The epidermal growth factor receptor D761Y mutation and effect of tyrosine kinase inhibitor [J]. Clinical Cancer Reseach, 2007, 13(11): 3431-3432.
48Petrelli F, Borgonovo K, Cabiddu M, et al. Erlotinib as maintenance therapy in patients with advanced non-small cell lung cancer: a pooled analysis ofthree randomized trials[J]. Anticancer drugs, 2011, 22(10): 1010-1019.
49Maemondo M, Inore A, Kobayashi K, et al. Gefitinib or Chemotherapy for Non-Small-Cell Lung Cancer with Mutated EGFR [J]. N Engl J Med, 2010, 362(25): 2380-2388.
50Han SW, Kim TY, Hwang PG, et al . Preditive and prognostic impact of epidermal growth factor receptor mutation in non-small cell lung cancer patients treated with gefitinib[J]. J Clin Oncol, 2005, 23(11): 2493-2501.
51Mitsudomi T, Kosaka T, Endoh H, et al. Mutations of the epidermal growth factor receptor gene predict prolonged survival after gefitinib treatment in patients with non-small-cell lung cancer with postoperative recurrence [J]. J Clin Oncol, 2005, 23(11): 2513-2520.
52Gazdar AF, Minna JD. Inhibition of EGFR signaling: all nmtations are not created equal[J]. PLoS Med, 2005, 2(11): e377.
(本文编辑:黄红稷)
杭欣,徐兴祥. 吸烟对肺癌患者表皮生长因子影响的Meta分析[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(5): 579-585.
·论著·
Effects of smoking on epidermal growth factor receptor of lung carcinoma patients: a Meta-analysis
HangXin,XuXingxiang.SubeiPeople′sHospitalofJiangSuProvince,Yangzhou225002,China
Correspondingauthor:XuXingxiang,Email:xuxx63@sina.com
【Abstract】ObjectiveTo study the effect of smoking on epidermal growth factor receptor (EGFR) of lung carcinoma patients, including EGFR mutation, expression, drug resistance and clinical therapeutic. To provide scientific evidence for assessment of curative effect and the selectivity of advantage patients on targeted therapy. MethodsThe database of Pudmed, ProQuest Research Library, Web of science, Chinese biomedical database, CQVIP and wanfang data were searched and literature domestically and internationally from January 1997 to December 2013 was collected. The RevMan 5.0 software was used for Meta-analysis. ResultsThe results from 38 case control studies on the effect of smoking on EGFR. EGFR mutation rate in non-smoking patients with lung cancer (41.1%) was higher than ever and current smoking patients (10.6%). EGFR was more over-expressed in non-smoking lung carcinoma patients (53.1%) than the smoking patients(42.2%). Never smoking patients (6.4%) have lower primary drug resistance than the smoking ones(18.3%). On the other hand, the therapeutic efficacy of epidermal growth factor receptor-tyrosine kinase inhibitors(EGFR-TKIs)in lung carcinoma patients, the non-smoking patients(77.7%) have better disease control rate than the smoking ones(56.9%). ConclusionsSmoking has significant influence in EGFR of lung cancer. Smoking has negative correlation with EGFR mutation. The mutation rate of epidermal growth factor is higher in non-smoking patients. Besides, non-smoking lung cancer patients have higher positive expression. To EGFR-TKIs treatment, the patients who never have smoking history are superior to the cigarette-taking patients in therapeutic effect.
【Key words】Lung carcinoma;Epidermal growth factor receptor;Meta-analysis;Smoking
收稿日期:(2015-03-03)
文献标识码:中图法分类号: R563,R743.2 A
通讯作者:徐兴祥,Emall: xuxx63@sina.com
基金项目:作者单位: 225002 扬州,江苏省苏北医院呼吸内科
DOI:10.3877/cma.j.issn.1674-6902.2015.05.010
