椰子中果皮微晶纤维素的制备工艺
2015-02-16方培蓉蒋达洪
方培蓉,蒋达洪,黄 敏
(广东石油化工学院化学工程学院,广东茂名 525000)
椰子中果皮微晶纤维素的制备工艺
方培蓉,蒋达洪,黄 敏*
(广东石油化工学院化学工程学院,广东茂名 525000)
本研究以椰子中果皮为原料,采用硝酸-乙醇法提取纤维素,并将提取的纤维素水解制备微晶纤维素;采用分光光度法测定纤维素含量,滴定法测定微晶纤维素得率。单因素实验结果表明椰子中果皮纤维素提取的适宜工艺条件为:80℃下水浴回流2h、料液比为1∶20(g/mL)、酸醇比为1∶3、该条件下,提取所得纤维素含量为75.24μg/mL。以提取的椰子中果皮纤维素为原料制备微晶纤维素的适宜工艺条件为:水解温度100℃、水解时间70min、盐酸质量分数7%、料液比1∶15(g/mL),在此条件下,微晶纤维素得率为97.50%;将制备出来的微晶纤维素进行了红外表征。本工艺能够较好地提高椰子中果皮的应用价值。
椰子中果皮,纤维素,微晶纤维素,分光光度法,滴定法
微晶纤维素(Microcrystalline cellulose,MCC)是一种以β-1,4葡萄糖苷键结合的直链式多糖,由天然纤维素经稀酸水解至极限聚合度(LODP)的可自由流动的白色或近白色粉末状固体产物,是纤维素的一种新形式。微晶纤维素广泛应用于医药、食品、轻化工等国民经济各部门。在食品工业上可作为一种功能性基料——膳食纤维,是一种理想的保健食品添加剂;在医药工业上作为药物赋形剂和崩解剂;在化学工业上用于人造革、电焊条等生产,是一种具有广阔前景的精细化工产品[1]。
椰子(Coconut),属棕榈科,是热带地区主要的木本油料作物之一,其综合利用经济效益高,故享有“宝树”之称。椰衣含有较高含量的木质素、纤维素和半纤维素,是一种很好的潜在资源。成熟椰子的椰衣中中果皮纤维的含量为30%左右,其余70%左右为椰衣粉(椰糠)和极短的纤维。椰衣纤维的颜色因椰子的品种、纤维成熟度、剥取和沤浸纤维的时间以及土壤中的矿物质含量和沤浸纤维所用水的不同而异,通常为淡褐色至深褐色或近于黑色[2-4]。每生产1t椰干会有0.85t椰衣纤维和 1.9t椰糠废弃物产生[4]。目前,对椰子中果皮的综合加工利用还比较落后,大部分中果皮被当作柴烧或废弃,生物利用率很低,造成资源的极大浪费,同时还严重污染环境。因此开发利用椰衣,不但可以获得较好的经济效益,而且具有很好的生态效益。
本研究以纤维含量较高的椰子中果皮为原料,采用硝酸-乙醇法提取纤维素,并对椰子中果皮微晶纤维素制备工艺进行了研究,对制备出来的微晶纤维素进行了红外表征。研究结果为椰衣的资源化利用提供技术支持,也为其他植物资源的开发利用提供了理论参考。
1 材料与方法
1.1 材料与仪器
实验原料 来自于茂名市官渡市场上收集的海南青椰子中果皮。
盐酸、硫酸、硝酸、无水乙醇、蒽酮、硫代硫酸钠、重铬酸钾等试剂,均为AR。
恒温水油浴锅 巩义市予华仪器有限责任公司;电热鼓风干燥箱 上海实验仪器厂有限公司;V-5100可见光分光光度计 上海元析仪器有限公司;毛细管黏度计(φ0.4mm) 上海隆拓仪器设备有限公司;Nicolet6700红外光谱仪 美国尼高力公司。
1.2 实验方法
1.2.1 椰子中果皮纤维素的提取 将原料椰子中果皮干燥,粉碎,并过100目分子筛。称取5.00g试样于圆底烧瓶中,按料液比1∶20(g/mL)加入硝酸-乙醇(1∶2)的混合溶液,在80℃下水浴回流2h。降至室温后,抽滤,用少量硝酸-乙醇(1∶2)溶液洗涤。再用玻璃棒将滤渣转移至烧瓶中,按1∶20(g/mL)的料液比加入硝酸-乙醇(1∶2)溶液,在沸水上加热回流1h,直至纤维变白为止;抽滤,用热水洗涤滤渣至无酸性,最后再用乙醇洗涤两次,将滤渣干燥,即得纤维素[5]。
1.2.2 纤维素含量的测定 本论文中纤维素含量的检测方法是分光光度法;分光光度法是在波长为620nm处利用蒽酮试剂与糠醛类化合物的蓝绿色反应进行比色测定。根据文献[6],准确配制0、20、40、60、80、100μg/mL的纤维素溶液。用分光光度计测定溶液在620nm处的吸光度,并做标准曲线。试样纤维素溶液的配制和测定也按照相同的方式。
1.2.3 椰子中果皮纤维素提取的实验条件 水浴温度的确定:在料液比为1∶20(g/mL),硝酸-乙醇溶液体积比为1∶2的条件下,研究提取时间为2h时,提取温度分别为70、75、80、85、90℃对纤维素含量的影响。
料液比的确定:在提取温度为80℃,提取时间为2h,硝酸-乙醇溶液体积比为1∶2的条件下,研究料液比分别为1∶12、1∶15、1∶20、1∶25、1∶30时对纤维素含量的影响。
硝酸-乙醇配比的确定:在料液比为1∶20,提取温度为80℃,提取时间为2h时,研究硝酸-乙醇配比分别为1∶1、1∶2、1∶3、1∶4、1∶5时对纤维素含量的影响。
1.2.4 微晶纤维素的制备 MCC的制备是以提取所得纤维素作为原料,按照一定的料液比加入盐酸溶液,在一定温度水浴中进行水解。然后在水解液中加入两倍体积的蒸馏水,待固液分层后,抽滤,并将固体物水洗至中性,烘干,研磨,即得微晶纤维素[7]。
1.2.5 铜氨溶液的配制 参照文献[8],配制铜氨溶液,并进行标定、校正。最后加入葡萄糖作为阻氧剂。本实验所配制的铜氨溶液在标定后的质量浓度:铜为13.12g/L,氨为151g/L,葡萄糖2g/L。
1.2.6 纤维素的聚合度测定 准确称取0.05g试样,放入锥形瓶中,再准确量取50mL铜氨溶液加入,盖紧,在磁力搅拌器上搅拌1h,过滤,滤液为纤维素铜氨溶液,量取该滤液,用毛细管黏度计测定流经两刻度间的时间,根据文献[8]公式计算出试样的聚合度。
ηsp=(t1-t0)/t0
式(1)
式(2)

1.2.7 水解时间的确定 将水解得到的样品用铜氨溶液将其溶解,配制成质量浓度 0.1g/100mL 的纤维素铜氨溶液。用毛细管黏度计测定其黏度值来判断水解达到极限聚合度的时间。聚合度越高黏度越高,当纤维素水解成为微晶纤维素时,其聚合度下降到极限聚合度,则样品的铜氨溶液将出现黏度值由逐渐下降到趋于平衡的现象。本实验中,在水解温度100℃、料液比1∶25(g/mL)、盐酸质量分数6%的条件下,水解30、40、50、60、70、80、90min,当水解达到平衡聚合度,即以水解产物样液的黏度达到稳定时为适宜水解时间。
1.2.8 微晶纤维素制备得率的测定 按照文献[9],将试品置锥形瓶中,加水25mL,精密加重铬酸钾溶液50mL,混匀,小心加入质量分数为50%的硫酸100mL,迅速加热至沸腾,冷却至室温;移至250mL容量瓶中,加水稀释至刻度,摇匀;精密量取25mL,加邻二氮菲指示液3滴,用硫酸亚铁铵滴定液(0.1mol/L)滴定,计算纤维素的得率。而每毫升的硫酸亚铁铵滴定液相当于0.675mg的微晶纤维素。
微晶纤维素得率(%)=微晶纤维素的质量/式样中纤维素的质量×100
式(3)
1.3 产物的表征
采用KBr压片法在Nicolet6700傅里叶红外光谱仪测定产物红外光谱谱图。
1.4 数据处理
椰子中果皮纤维素提取及微晶纤维素制备实验使用Microsoft Excel 2007以及Origin7.5软件进行数据处理及绘图。
2 结果与讨论
2.1 椰子中果皮纤维素的提取
2.1.1 纤维素标准曲线的绘制 配制纤维素标准溶液,在620nm波长下测定试样的吸光度,制得纤维素标准曲线和回归方程为:y=0.0053x+0.0012,R2=0.9988。
2.1.2 影响纤维素含量的单因素实验
2.1.2.1 水浴温度的确定 水浴温度对纤维素含量的影响结果如图1。

图1 水浴温度对产物纤维素含量的影响Fig.1 Effect of water bath temperature on the cellulose content
水浴温度的高低会直接影响椰子中果皮的溶胀程度,从而影响硝酸-乙醇溶液提取液打断半纤维素与纤维素的连接的程度,影响半纤维素的溶出率。从图1中可以看出,当水浴温度从70℃上升到80℃,纤维素的含量随蒸煮反应温度的提高而增加,这是因为在高温作用下,紧致的椰子中果皮纤维结构发生溶胀,使半纤维素和纤维素之间的非离子键合作用力降低,更易于半纤维素的溶出,但是随着温度的升高,半纤维素会有比较微弱的降解[10]。因此当水浴温度上升到80℃以上时会加速半纤维素的降解,半纤维素的结构和性质发生变化,纤维素含量开始下降,故选择水浴温度为80℃为适宜水浴温度。
2.1.2.2 料液比的确定 料液比(g/mL)对纤维素含量的影响结果如图2。

图2 料液比对产物纤维素含量的影响Fig.2 Effect of solid-liquid ratio on the cellulose content
在椰子中果皮纤维素的提取过程中,料液比对实验结果有比较大的影响,当料液比过大时,椰子中果皮不能完全浸入提取液中,而不利于水解反应的进行;当料液比过小时,过多的酸可能会和水解得到的半纤维素发生降解反应,导致纤维素含量降低[11]。从图2中可以看出,在一定的水浴温度、硝酸-乙醇配比的条件下,随着料液比的增加,纤维素的含量也随之增加。从实验结果可以认为1∶20倍的提取溶剂用量已经达到较佳条件。大于1∶20倍的料液比不仅使纤维素含量降低,而且造成浪费,故选择料液比1∶20为适宜料液比。
2.1.2.3 硝酸-乙醇配比的确定 硝酸-乙醇配比对产物纤维素含量的影响结果如图3。

图3 酸醇配比对产物纤维素含量的影响Fig. 3 Effect of acid-glycol ratio on the cellulose content
从图中可以看出,在一定的水浴温度、料液比的条件下,当酸醇比较小,硝酸浓度较低时,不利于椰子中果皮纤维素的提取,因而纤维素含量低。但随着混合溶剂中硝酸含量的增加,纤维素的含量也随之增加。当硝酸-乙醇(体积比)大于1∶3时,纤维素含量开始下降,因为酸性强,会促进纤维素的水解。故选择硝酸-乙醇的配比1∶3为适宜料液比。最优参数下所得纤维素含量最高为75.24μg/mL。
2.2 微晶纤维素的制备
2.2.2 水解时间的确定 通过黏度法测定试样的黏度和聚合度如图4所示。

图4 试样黏度与水解时间的关系Fig.4 Relationship between sample’s viscosity and hydrolysis time
由图4可知,水解70min 时,样液的黏度值由下降趋势转为趋于平缓。这说明在酸水解过程中,水解到70min 时,纤维素已经降解到了微晶纤维素阶段,此时其聚合度也即微晶纤维素的极限聚合度,这个时间即为纤维素水解成微晶纤维素的时间。超过这个时间聚合度下降不大,如果继续水解,将使纤维素降解到低于微晶纤维素的极限聚合度阶段。所以纤维素水解到微晶纤维素适宜时间为70min。
2.2.3 影响微晶纤维素得率的单因素实验
2.2.3.1 盐酸质量分数的确定 研究盐酸质量分数对微晶纤维素制备得率的影响结果如图5。
从图中可以看出,在一定的水解温度、水解时间、料液比的条件下,随着盐酸质量分数的增加,微晶纤维素的得率也逐渐增大,当盐酸的质量分数大于7%时,微晶纤维素制备的得率有所下降,其原因是当盐酸质量分数较小时,水解反应的酸性环境不强,纤维素降解力度不够,生成微晶纤维素的得率不高。但是当盐酸的质量分数大于7%时,纤维素严重降解,微晶纤维素的得率显著降低。所以盐酸质量分数7%为宜。
2.2.3.2 料液比的确定 在水解温度、水解时间、盐酸质量分数不变的条件下,研究料液比(g/mL)对微晶纤维素制备得率的影响。结果如图6。

图6 料液比对微晶纤维素得率的影响Fig.6 Effect of solid-liquid ratio on the yield of microcrystalline cellulose
从图中数据可以看出,在一定的水解温度、水解时间、盐酸质量分数的条件下,料液比在1∶10~1∶15(g/mL)时,微晶纤维素的得率缓慢提高。这是因为反应体系内溶液的量较小时,水解液流动性小,不能充分地与纤维素颗粒表面接触,进而纤维素的非结晶区结构不能得到充分降解,微晶纤维素的得率不高[12]。微晶纤维素的得率在料液比1∶15(g/mL)时出现最大值后,随着液体量的增大,水解强烈,有部分已经降解为葡萄糖,得率下降。所以料液比控制在 1∶15(g/mL)左右为宜。
椰子中果皮纤维素水解实验表明:在水解温度为100℃、水解时间为70min、盐酸质量分数为7%、料液比为1∶15(g/mL)时微晶纤维素得率可达97.50%。
2.3 产物的表征
产物的红外光谱图见图7。与文献[13-14]标准图谱一致。
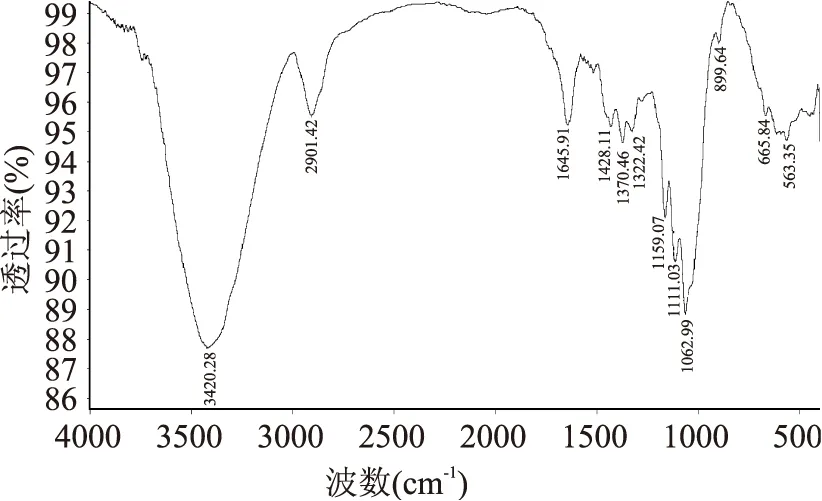
图7 产物的红外光谱图Fig.7 IR of the produt
红外检测在1062cm-1左右处的吸收峰反映了纤维素的C-O-C伸缩振动,是纤维素分子的特征峰,在3420cm-1左右处的吸收峰反映了分子内羟基O-H键的伸缩振动,2901 cm-1左右处的吸收峰是由纤维素的-CH2-伸缩振动引起的,而1428cm-1左右处的吸收峰则是由纤维素的-CH2-弯曲振动和剪切振动引起的,由此可以定性检测物为微晶纤维素。
3 结论
选取硝酸-乙醇法提取纤维素,当恒温回流2h、水浴温度为80℃、料液比为1∶20(g/mL)、硝酸-乙醇的体积比为1∶3时,所得纤维素含量最高为75.24μg/mL。
通过测定试样的聚合度,制备微晶纤维素的适宜水解时间为70min。
以所提取的纤维素为原料,制备微晶纤维素,在水解温度为100℃、水解时间为70min的条件下,当盐酸的质量分数为7%、料液比为1∶15(g/mL)时,微晶纤维素制备的得率最高为97.5%。
产物微晶纤维素的红外光谱图与标准谱图一致。
实验达到了充分利用椰子资源,变废为宝,制备出多功能的高分子材料——微晶纤维素的目的,符合目前开发资源、绿色环保的生态主题。
[1]陈珍珍,刘爱国,李晓敏,等.微晶纤维素的特性及其在食品工业中的应用[J].食品工业科技,2014,35(4):380-383.
[2]孙程旭,陈华,刘立云,等.椰子副产物的应用与发展[J].中国热带农业,2011,38(1):45-47.
[3]肖红,易美华.椰子的开发利用[J].海南大学学报自然科学版,2003,21(2):183-189.
[4]郑侃,梁栋,张喜瑞.椰子废弃物综合利用现状与分析[J].广东农业科学,2013(5):175-176.
[5]祝桢祥.凤眼莲纤维素黄原酸盐的制备工艺优化及其吸附特性研究[D].武汉:华中农业大学,2012.
[6]牛森.作物品质分析[M].北京:农业出版社,1992.
[7]袁毅,张黎明,高文远.穿龙薯蓣微晶纤维素的制备及其理化性质研究[J].生物质化学工程,2007,41(4):22-26.
[8]陈英.染整工艺实验教程[M].北京:中国纺织出版社,2004:5-7.
[9]温瑾,郑洲,缪锦来,等.利用海带渣制备药用辅料微晶纤维素的研究[J].中国海洋药物杂志,2012,31(1):15-19.
[10]宋珺玲.绿茶渣半纤维素的提取、特性表征及应用研究[D].无锡:江南大学,2013.
[11]李玲.椰壳半纤维素的提取与表征[D].海口:海南大学,2012.
[12]郭美丽,罗仓学. 响应面实验优化苹果渣微晶纤维素制备工艺[J].食品科学,2011,32(4):54-58.
[13]凌关庭.食品添加剂手册(第2版)[M].北京:化学工业出版社,1997:904.
[14]Maha M. Ibrahim;Waleed K. El-Zawawy;Yvonne Jüttke. Cellulose and microcrystalline cellulose from rice straw and banana plant waste:preparation and characterization[J]. Cellulose,2013,20(5):2409-2413.
Preparation of microcrystalline cellulose from coconut mesocarp
FANG Pei-rong,JIANG Da-hong,HUANG Min*
(College of Chemical Engineering,Guangdong University of Petrochemical Technology,Maoming 525000,China)
Microcrystalline cellulose was prepared through extraction of cellulose from coconut mesocarp by nitric acid-ethanol method and then hydrolysis of the cellulose. The content of the cellulose was determined by spectrophotometry and the yield of the microcrystalline cellulose was obtained by titration. The result of single-factor experiment showed that optimized conditions for the extraction of cellulose from coconut mesocarp were as following:refluxing in water bath at 80℃,solid-liquid ratio of 1∶20(g/mL)and acid-glycol ratio of 1∶3 afford 75.24μg/mL of cellulose by content. The optimized conditions for the preparation of microcrystalline cellulose from the resulted cellulose were described as follows:100℃ as hydrolysis temperature,70min as hydrolysis time,7% as HCl concentration and 1∶15(g/mL)as the solid-liquid ratio,microcrystalline cellulose was obtained in a yield of 97.50%. The microcrystalline cellulose prepared is characterized by IR. The process described in this paper gives great support for the utilization of coconut mesocarp.
coconut mesocarp;cellulose;microcrystalline cellulose;titration method;spectrophotometric method
2014-07-22
方培荣(1991-),女,本科,研究方向:应用化学。
*通讯作者:黄敏(1966-),女,硕士, 教授,研究方向:精细有机合成,生物质利用。
广东省科技计划项目(2012A020602061)。
TS255.1
B
:1002-0306(2015)09-0220-05
10.13386/j.issn1002-0306.2015.09.039
