茜草丙酮提取物抑菌活性及机制的研究
2015-02-16郑翠萍权美平康莉娜马婷婷田呈瑞
郑翠萍,权美平,2,康莉娜,马婷婷,赵 佩,田呈瑞,*
(1.陕西师范大学食品工程与营养科学学院,陕西西安 710062;2.渭南师范学院多河流湿地重点实验室,陕西渭南 714000)
茜草丙酮提取物抑菌活性及机制的研究
郑翠萍1,权美平1,2,康莉娜1,马婷婷1,赵 佩1,田呈瑞1,*
(1.陕西师范大学食品工程与营养科学学院,陕西西安 710062;2.渭南师范学院多河流湿地重点实验室,陕西渭南 714000)
目的:对茜草丙酮提取物的抑菌活性及机理进行研究,为茜草资源开发利用提供科学依据。方法:用滤纸片法和刃天青指示剂法测定抑菌圈和MIC、MBC研究抑菌活性,并进一步通过生长曲线的绘制,电导率值的变化和细胞内容物渗漏的测定研究提取物的抑菌机理。结果:通过抑菌圈、最小抑菌浓度和最小杀菌浓度的测定,发现茜草提取物对枯草芽孢杆菌抑菌作用最强,其次是表面葡萄球菌,最差是蜡样芽孢杆菌。枯草芽孢杆菌的生长曲线,菌液电导率及其细胞内容物的变化趋势检测结果表明:抑菌机理可能源于抑制细菌的对数生长期分裂速度,导致细胞膜渗透性的增加和细胞内容物的外漏。本研究结果表明:茜草丙酮提取物作为天然抗菌剂有很大的应用潜力。
茜草,丙酮提取物,抑菌活性,抑菌机理
茜草(RubiaCordifoliaL.)为茜草科茜草属植物,别名破血丹、粘粘草、拉拉藤、血见愁、小活血和活血草等。在我国主要分布于陕西、江苏、安徽、河南、山东[1],药用茜草以陕西、山西和河南为主产区,且药效最好[2]。茜草为中国传统常用中药之一,始载于《神农本草经》,名“茜根”[3]。药用其干燥根及根茎,有凉血、止血、祛瘀、通经等功效[4]。
茜草中主要含有水溶性的环已肽类系列物质,脂溶性成分蒽醌及其糖苷、萘醌及其糖苷,此外还含有萜类、β谷甾醇、脂肪酸化合物和微量元素等成分[5-6],具有广泛的生理活性,经常作为染色剂添加于食品当中。对于茜草抑菌活性的研究,许多学者的研究结果表明[7-9],茜草根水提液在体外对金黄色葡萄球菌、肺炎链球菌、流感杆菌和部分皮肤真菌等均有一定的抑制作用[7];于相丽等[8]研究了茜草根不同部位提取物的抑菌效果,结果表明基部根效果最好;刘艳娟等[9]对茜草不同极性有机层提取物的体外抑菌活性进行了研究,发现茜草具有抑菌活性,特别是甲醇层提取物和丙酮层提取物具有较强的抑菌活性。但有关茜草的抑菌机制方面尚无研究。本文系统地对茜草丙酮提取物的抑菌活性和抑菌机制进行初步研究,以为茜草的传统药用价值以及后续研究建立科学根据。
1 材料与方法
1.1 材料与仪器
鲜采茜草根 室温阴干,粉碎过40目筛备用;丙酮、NaOH、刃天青、PBS、葡萄糖、考马斯亮蓝、DNS、二甲基亚砜(DMSO)、琼脂、营养肉汤、牛肉膏、蛋白胨等 均为分析纯试剂;庆大霉素(8万单位) 郑州卓峰制药厂;牛肉膏蛋白胨培养基[10]牛肉膏,蛋白胨,琼脂,NaCl(NaOH调pH7.2~7.4);金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escheichiacoli)、痢疾杆菌(Shigelladysenteriae)、枯草芽孢杆菌(Bacillussubtilis)、表面葡萄球菌(Staphepidermidis)、蜡状芽孢杆菌(Bacilluscereus)、伤寒沙门氏菌(Salmonellatyphi) 由陕西师范大学生命科学学院微生物实验室提供,将各种细菌分别用斜面培养法进行活化,活化后挑取适量菌苔用无菌水配制成107cfu/mL和108cfu/mL的菌悬液备用。
旋转蒸发仪(RE-52) 上海安亭实验仪器有限公司;恒温振荡器(SHA-C) 金坛市富华仪器有限公司;净化工作台(S.SW-CJ-1F) 上海跃进医疗器械厂;立式压力蒸汽灭菌器(LDZX-30KB) 上海申安医疗器械厂;全波长酶标仪(Multiskan Go) 美国热电公司;紫外可见分光光度计(TU-1810) 上海光谱仪器有限公司;电导率仪(DDS-307) 上海精密科学仪器有限公司;分析天平(AL204) 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 丙酮提取物的制备 以丙酮为溶剂,精确称取处理后的茜草粉50.0000g,料液比1∶10添加,40℃恒温振荡器中24h震荡提取后,真空抽滤,旋转蒸发,烘箱内加热浓缩后成浸膏状,最终用二甲基亚砜配成10mg/mL样品备用。茜草丙酮的最终提取物得率为2.67%。
1.2.2 抑菌活性和抑菌机制的测定
1.2.2.1 菌株敏感性即抑菌圈(DIZ)的检测 在无菌条件下,用已灭菌的牛肉膏蛋白胨琼脂培养基制成平板,待冷却凝固后,分别加入0.1mL的107cfu/mL的菌悬液,用无菌涂布器涂布均匀,于培养箱内倒置培养10~15min至培养基表面干燥后,用无菌镊子夹取直径为6mm的圆形灭菌(121℃,30min)滤纸片贴于含菌平板上,每个平板贴3片,移取10μL提取物(8mg/mL)加在滤纸片上,以庆大霉素(4mg/mL)作为阳性对照,二甲基亚砜(DMSO)作为阴性对照。于37℃培养箱内培养24h后,取出平板,采用十字交叉法测量各纸片周围抑菌圈直径。
1.2.2.2 茜草提取物最小抑菌浓度(MIC)与最小杀菌浓度(MBC)的测定 取5mL的107cfu/mL浓度的菌液和7.5mL的刃天青指示剂贮备液(0.07g/100mL[11])混匀,将混匀的菌液取100μL加入到96孔板中,无菌对照组不加。取最大浓度10mg/mL的样品,采用对半稀释法稀释后浓度最终为10、5.0、2.5、1.25、0.5、0.25、0.125、0.0625mg/mL,各取10μL加入96孔板中,每孔均加入100μL的液体培养基,37℃恒温培养,每5~6h观测一次,有细菌生长的孔会逐渐由蓝色变粉色,其中无菌对照孔为蓝色,细菌正常(不添加样品)孔为亮红色,以发生颜色变化的前一孔为最低抑菌浓度(MIC)。MIC确定后,吸取所有未变色浓度的样品5μL,加入到100μL培养基与刃天青指示剂贮备液中,同样的条件培养24h,仍旧不见颜色变化的孔中,即为最小杀菌浓度(MBC)[11-12]。同时,以DMSO作为阴性对照,以庆大霉素作为阳性对照,所有处理都重复三次。
1.2.2.3 茜草提取物对细菌生长曲线的影响 以MIC为基础配制含药液体培养基,设置空白组和实验组。取10μL培养至对数期、浓度108cfu/mL的供试菌液接种于含200μL液体培养基的96孔板中,每个菌种接三孔,其中两管分别加入20μL的1×MIC、2×MIC浓度的提取液,另一管加等量无菌水作为对照。于37℃水浴震荡培养,分别在培养0、2、4、6、8、12、24h时测定于600nm吸光值,并绘制微生物的生长曲线,每组处理重复三次。
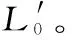
1.2.2.5 茜草提取物对细胞内容物渗漏的影响 菌体活化后用PBS清洗三次,混匀。将混匀的菌悬液分成3等份,再加入不同浓度的样液,使样液在菌悬液中的终浓度分别为1×MIC、2×MIC、0(0即为空白对照,加入无菌水即可)。混匀后,立即取8mL,5000r/min离心15min,取上清液待用。菌悬液置于37℃,120r/min的环境中,之后每隔2h取一次样,离心。取离心后的上清液0.3mL,紫外可见分光光度计260nm下测定吸光值(PBS调零)。再取离心后的上清液0.5mL,加入5mL的考马斯亮蓝试剂,5min后,调分光光度计波长至595nm处,以0.5mL蒸馏水+5mL的考马斯亮蓝试剂管为调零点,测样品管的吸光值,通过标准曲线查得待测样品的蛋白质含量。最后取处理好的上清液0.5mL,加入1.5mL的蒸馏水,再加入1.5mL DNS,摇匀,在沸水浴中准确加热10min,取出,用冷水迅速冷却至室温,调分光光度计波长至540nm,以2mL 蒸馏水+1.5mL DNS管为调零点,测定OD值[13],通过标准曲线查得待测样品的还原糖含量。以上处理均重复三次。
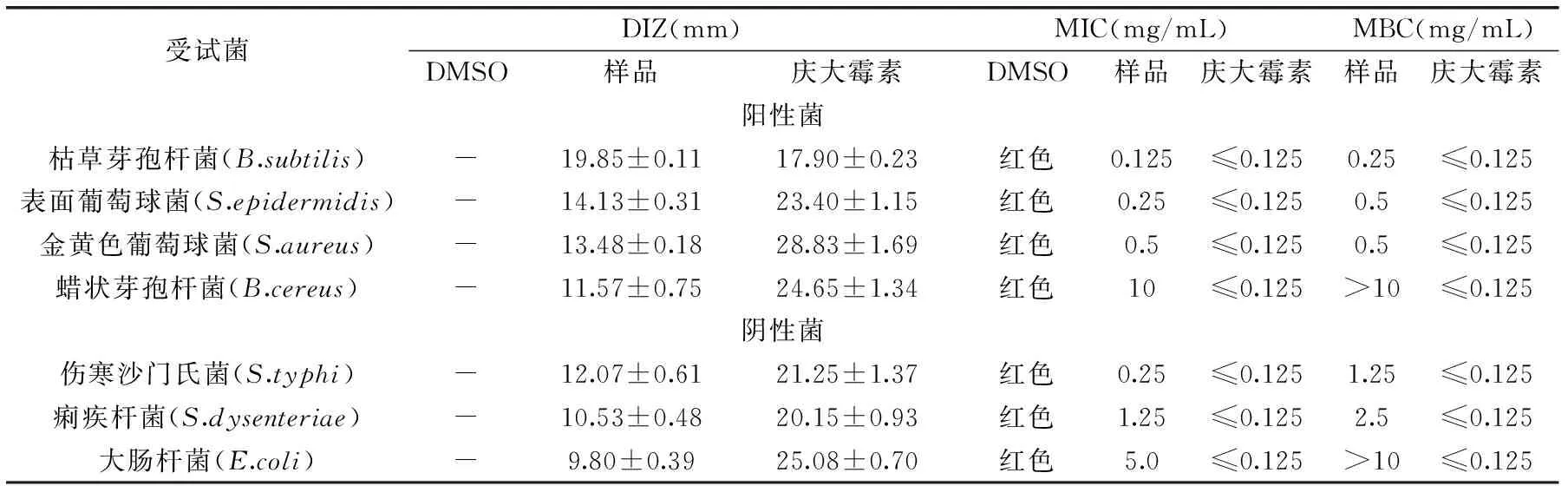
表1 茜草提取物对受试菌的DIZ、MIC和MBC测定结果Table1 DIZ,MIC and MBC of the extract from Rubia Cordifolia
注:-表示未检出。
1.3 统计分析
数据统计采用DPS进行数据处理和方差分析,数值以均值±标准差表示。
2 结果与分析
2.1 抑菌圈的测定结果
表1表明,茜草的丙酮提取物对金黄色葡萄球菌、表面葡萄球菌、蜡状芽孢杆菌、枯草芽孢杆菌、痢疾杆菌、伤寒杆菌和大肠杆菌具有不同程度的抑制作用。其中,革兰氏阳性菌中枯草芽孢杆菌的抑菌圈直径为(19.85±0.11)mm,表面葡萄球菌为(14.13±0.31)mm,金黄色葡萄球菌为(13.48±0.18)mm,蜡状芽孢杆菌为(11.57±0.75)mm;革兰氏阴性菌中痢疾杆菌为(12.07±0.61)mm,伤寒沙门氏菌为(10.53±0.48)mm,大肠杆菌仅为(9.80±0.39)mm,而作为阳性对照的庆大霉素对测试的7种微生物都表现出较强的抑制作用,作为阴性对照的二甲基亚砜(DMSO)没有表现出任何抑菌作用,表明其作为精油的溶剂不会影响抑菌实验的结果。从表1明显看出,茜草丙酮提取物对阳性菌的抑制作用强于阴性菌,这和Nikaido等人的研究结果相似[14]。Nikaido和Wendakoon等人研究表明,革兰氏阴性菌与阳性菌相比具有不同结构的细胞壁,独特的外膜结构,对于抑菌物质具有一定的抵抗作用[14-15]。但是,Chunyan Gao,Kim等人研究指出多个因素影响抑菌物质的活性,不同种类的抑菌物质对于不同的细菌具有不同的抑菌作用[16-17]。所以,需要我们对于抑菌机理进行深入的研究。
茜草提取物对枯草芽孢杆菌的最小抑菌浓度为0.125mg/mL、最小杀菌浓度是0.25mg/mL,抑菌效果最好,其次是表面葡萄球菌的最小抑菌浓度是0.25mg/mL、最小杀菌浓度是0.5mg/mL,抑菌效果最差的是蜡样芽孢杆菌,最小抑菌浓度为10mg/mL,因为丙酮提取物的最大浓度是10mg/mL,所以最大杀菌浓度无法测定。由表1综合可得,茜草丙酮提取物对枯草芽孢杆菌抑菌效果最好。
2.2 茜草的丙酮提取物对菌体生长曲线的影响
由图1可以看出,枯草芽孢杆菌的正常组经过短暂的延滞期后迅速进入快速生长的对数期,OD值显著增高,而加入茜草提取物的1×MIC和2×MIC组OD值稍有增长,但涨幅较小,表明茜草提取物抑菌效果很好。同时可以得出茜草提取物的抑菌作用主要表现在生长对数期,通过抑制细菌的分裂速度,延缓其对数期,降低细菌总数,从而有效控制菌体数量的增加[18]。

图1 枯草芽孢杆菌生长曲线Fig.1 The growth curve of B. subtilis
2.3 茜草提取物对菌液电导率的影响
由图2得出,随着抑菌物质作用时间的延长,菌液电导率呈上升趋势。其中生长控制组在前4h相对电导率基本没有变化,随后因为细菌的正常死亡导致细胞溶解,相对电导率小幅度上升。与控制组相比,加入茜草萃取物的两组随着培养时间的延长,相对电导率均有大幅度增长,而且2×MIC组的相对电导率值明显增长幅度大于1×MIC组。菌液电导率的改变,反映细胞膜渗透性的变化,加入茜草提取物,菌液的电导率增加,表明茜草提取物可使菌体细胞膜的通透性增加,使菌体细胞质渗漏到了细胞外[19]。原因可能是茜草提取物诱导产生了某些降解细胞壁和细胞膜的酶所致[20]。
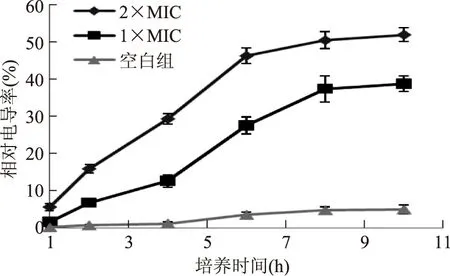
图2 茜草提取物对枯草芽孢杆菌菌液电导率的影响Fig.2 Effect of the extract from Rubia Cordifolia. on the impermeability of cell membrane of tested B. subtilis.
2.4 茜草提取物对细胞内容物渗漏的影响
细胞内容物渗漏的检测指标有菌悬液的上清液在260nm测定的吸光值、上清液中的蛋白质和还原糖的含量。表2所示枯草芽孢杆菌被不同浓度的茜草提取液处理4h后测定的结果。结果显示:细胞内容物的渗漏量与控制组相比,随着茜草提取物的添加量的增加而显著性增加(p<0.05)。1×MIC组的细胞内容物渗漏的OD值从0.035增加到0.869(p<0.05),2×MIC组的细胞内容物渗漏从0.035增加到1.043(p<0.05),原因是枯草芽孢杆菌的胞内物质外泄。由此得出,细胞膜的通透性增加[13],甚至细胞膜破裂,导致细胞内容物比如蛋白质、还原性糖等细胞的主要成分释放到胞外[21]。

表2 茜草提取物对细胞内容物渗漏的影响Table2 The effect of the of the extracton cell constituents’ release of tested B. subtilis
注:在同一列中不同的小写字母表示两两数据之间差异显著(p<0.05)。
3 结论
本研究测定了茜草提取物对枯草芽孢杆菌的抑菌圈、MIC和MBC,并以MIC为基础,研究了茜草提取物对枯草芽孢杆菌的生长曲线,菌液电导率变化和细胞内容物渗漏的影响。结果表明,茜草提取物对枯草芽孢杆菌抑菌效果最好,其次是表面葡萄球菌,最差的是蜡样芽孢杆菌,茜草抑菌物质主要影响细菌生长曲线的对数生长期,有效抑制细菌的增长。通过对电导率变化和细胞内容物渗漏的测定,推测其抑菌机理可能是茜草提取物诱导菌体产生降解细胞壁和细胞膜的酶,提高了膜的通透性,致使胞内物质外泄,菌体不能正常生长繁殖,从而达到抑菌作用。
[1]张琳.茜草的化学成分研究进展[J].现代中医药,2008,128(2):52-53.
[2]侯喜祥,李永茜草的生药学研究[J].中国新医药,2003(1):34-36.
[3]清顾观光重辑.神农本草经(中品,卷3)[M].北京:人民卫生出版社影印本,1958:162-162.
[4]药典编委会.中华人民共和国药典:第一部[M].北京:人民卫生出版社,2005:162-162.
[5]方晓艳,孙艳红,杨林莎.茜草的研究进展[J].河南中医药学刊,2002,17(5):78-80.
[6]张振英,黄显峰.茜草的药理作用研究进展[J].现代中西医结合杂志,2007,17(5):58-60.
[7]宋立人,洪恂,丁绪亮,等.现代中药学大辞典[M[.北京:人民卫生出版社,2001:1463-1466.
[8]于相丽,李勇慧,秦磊.茜草根不同部位提取物的抑菌效果[J].河南科技大学学报,2013(5):78-81.
[9]刘艳娟,杨世海,陈德仁,等.茜草不同极性提取物的体外抑菌活性研究[J].人参研究,2013(2):35-38.
[10]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999:214 - 215.
[11]张敏.山莓叶有效成分分离、解析及其生物活性研究[D].长沙:湖南农业大学,2012.
[12]Reham A Khalifa,Marwa S Nasser,Ashraf A Gomaa,et al. Resazurin Microtiter Assay Plate method for detection of susceptibility of multidrug resistant Mycobacterium tuberculosis to second-line anti-tuberculous drugs[J].Egyptian Journal of Chest Diseases and Tuberculosis,2013(62):241-247.
[13]Diao Wen-Rui,Hu Qing-Ping,Zhang Hong,et al. Chemical composition,antibacterial activity and mechanism of action of essential oil from seeds of fennel[J].Food Control,2014(35):109-116.
[14]Nikaido H. Multidrug efflux pumps of gram-negative bacteria[J]. Journal of Bacteriology,1996(178):5853-5859.
[15]Wendakoon C N,Sakaguchi M. Inhibition of amino acid decarboxylase activity of Enterobacter aerogenes by active components of spices[J]. Journal of Food Protection,1995(58):280-283.
[16]KimY S,Shin D H.Volatile constituents from the leaves of Callicarpa japonica Thunb and their antibacterial activities[J]. Journal of Agricultural and Food Chemistry,2004(52):781-787.
[17]Gao Chunyan,Tian Chengrui,Lu Yuehong,et al. Essential oil composition and antimicrobial activity of Sphallerocarpus gracilis seeds against selected food-related bacteria[J].Food Control,2011(22):517-522.
[18]Zeng Wei-cai,Zhu Rui-xue,Jia Li-rong,et al. Chemical composition,antimicrobial and antioxidant activities of essentialoil from Gnaphlium affine[J]. Food and Chemical Toxicology,2011,49(6):1322-1328.
[19]王海涛.大豆异黄酮的抑菌活性及其机制的研究[D].大连:辽宁师范大学,2009.
[20]汤雪明,戴书文.生物样品的环境扫描电镜观察[J].电子显微学报,2001,20(3):217-223.
[21]Xing Ke,Chen Xi-guang,Kong Ming,et al. Effect of oleoylchitosan nanoparticles as a novel antibacterial dispersion system on viability,membrane permeability and cell morphology ofEscherichiacoliandStaphylococcusaureus[J]. Carbohydrate Polymers,2009,76(1):17-22.
Study on the antibacterial activity and its mechanism of acetone extract fromRubiaCordifolia
ZHENG Cui-ping1,QUAN Mei-ping1,2,KANG Li-na1,MA Ting-ting1,ZHAO Pei1,TIAN Cheng-rui1,*
(1.College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’ an 710062,China;2.Key Lab of Wet Land Ecology and Environment of Duoheliu of Shaanxi Province,Weinan 714000,China)
Objective:The antibacterial activity and its mechanism were investigated on acetone extracts from theRubiaCordifoliato provide a scientific basis for development and utilization of therubiacordifoliaresources. Method:The antibacterial activities were evaluated by using the filter method and resazurin indicator method to measure the inhibition zone,MIC and MBC. The antibacterial mechanisms were studied by drawing growth curve,the change of conductivity and leakage of cellular contents. Result:The results showed that the sensitivities to the extract were different for different tested bacteria. The antibacterial activity of the extract was particularly strongest against B subtilis,and was weakest against B. Cereus. The following test results including growth curve of B subtilis and its variation trend of liquid conductivity and the cell contents showed that antibacterial mechanism may due to inhibit split speed of bacterial exponential phase and result in the increase in permeability of cell membranes and the leakage of intracellular constituents on the basis of the cell constituents’ release assay. The data of this study suggested that the extract fromRubiaCordifoliahad great potential for application as a natural antimicrobial agent.
RubiaCordifol;acetone extract;antibacterial activity;antibacterial mechanism
2014-06-24
郑翠萍(1989-),女,在读硕士,研究方向:植物新资源开发利用。
*通讯作者:田呈瑞(1955-),男,博士,教授,研究方向:植物新资源开发利用。
陕西省2013年军民融合研究基金项目(13JMR21)。
TS201.2
A
:1002-0306(2015)09-0116-04
10.13386/j.issn1002-0306.2015.09.016
