层层自组装技术在脂质体修饰中的应用
2015-02-16彭盛峰邹立强
彭盛峰,刘 伟,邹立强,周 磊
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
层层自组装技术在脂质体修饰中的应用
彭盛峰,刘 伟*,邹立强,周 磊
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
脂质体作为载体具有良好的生物相容性和生物降解性等优点,在药品和化妆品等领域中应用广泛,但由于脂质体的贮藏和消化稳定性较差,限制了其在食品中的应用。利用层层自组装技术将聚电解质沉积在脂质体表面形成一层保护膜是提高其贮藏和消化稳定性的有效手段。本文从层层自组装过程的影响因素、薄膜表征手段以及薄膜对脂质体的保护作用等方面综述了层层自组装在脂质体中的应用。
脂质体,层层自组装技术,聚电解质
层层自组装技术(Layer-by-layer assembly technology,LBL)是指以分子间的静电引力、氢键等为驱动力,将聚电解质逐层沉积到基质表面,构建多层纳米级薄膜的过程[1]。Decher等[2]在Langmuir-Blodgett技术[3]的基础上将聚电解质连续的分层堆积到硅片、玻璃等基质表面,形成一层超薄的纳米级薄膜,开创了LBL的先河。LBL具有许多优点,它对基质没有特定限制,修饰材料来源广泛,修饰条件温和,不需要特殊的设备,操作简单且能制备出不同性质的结构稳定薄膜。Sukhorukov[4]等将LBL应用到微米级的胶体中,发现能提高微粒的稳定性,缓释效果,使微粒功能多样化等,因此许多学者开始探索LBL在胶体微粒(空心微球[5]、脂质体[6]、微胶囊[7]和微乳[8]等)中的应用。脂质体是一种类似于细胞结构的双分子层薄膜,由于脂质体能保护包裹的活性物质而被应用于基因转染、癌症治疗和化妆品等领域[9]。而脂质体存在着保存期内粒径变大、絮凝、药物渗漏以及口服后在胃肠道中易被分解的,限制了其在食品中的应用[9]。以LBL在脂质体表面沉积聚电解质形成一层保护膜能提高其贮藏稳定性和消化稳定性[6,10]。而LBL在脂质体中的应用较少,本文归纳了LBL在脂质体修饰中的应用,并对影响LBL制备过程中的因素、表征手段和LBL修饰脂质体的作用进行综述,为脂质体的制备提供参考。
1 影响LBL的因素
在自组装过程中,一般分为两个步骤,即聚电解质固定在基质表面和聚电解质缓慢松弛在基质表面形成浓密的聚电解质层[11]。影响自组装的因素主要有聚电解质浓度、溶液的pH和离子强度以及修饰完成后游离聚电解质的分离。
1.1 聚电解质
聚电解质是指分子中有可离子化基团的聚合物,在极性溶剂如水中会电离,在水中形成带电的高分子离子和小分子离子[12]。聚电解质根据其来源将其分为天然聚电解质和合成聚电解质两类[13],前者包括核酸蛋白质和多糖(海藻酸和硫酸软骨素盐)、DNA、肝素、壳聚糖、纤维素硫酸纸、葡聚糖硫酸酯以及羧甲基纤维素等;后者包括聚丙乙烯磺酸盐(PSS)、聚二甲基二烯丙基氯化铵(PDDA)、聚乙烯亚胺(PEI)、聚N-异丙烯酰(PNIPAM)、聚丙烯酸(PAA)、聚甲基丙烯酸(PMA)、聚乙烯基硫酸酯(PVS)和聚丙烯酰胺盐酸盐(PAH)等。根据聚电解质所带离子的电荷种类,可将其分为聚阳离子(如壳聚糖)和聚阴离子(如海藻酸钠)。
聚电解质需要达到一定的浓度,才能改变脂质体表面的带电正负值,这个浓度称为最小临界浓度,临界浓度是由聚电解质的溶解度和表面电荷密度决定的[11]。在聚电解质的浓度高于临界浓度后,聚电解质浓度的大小不影响吸附作用,而平均粒径则随聚电解质浓度的增加呈指数递增[6]。
1.2 离子强度和pH
由于聚合物单体间的同种电荷相互排斥,聚电解质在溶液中的构象更为舒展,尺寸更大,而小分子尤其是强电解质的加入会屏蔽聚电解质之间的带电基团间的电荷作用力,使得由电荷排斥引起的舒展减弱,分子尺寸缩小,构象由舒展线性收缩成球状线团[14-15]。因此随着离子浓度的增加,吸附的薄膜厚度也随之增加,粒径会显著上升。而达到一定浓度后,聚电解质溶液变成浑浊的固体,不再具有吸附作用[16]。
当聚电解质表面的电荷浓度低于一定值时,自组装过程不能发生,即“临界电荷密度效应”[17]。pH的变化会改变弱聚电解质的电离度,从而改变其表面的电荷密度,影响自组装进行。Krasemann L[18]指出,pH是两个聚电解质的pKa值的平均值时,吸附效果最好,即pH最佳=(pKa聚阳离子+pKa聚阴离子)/2,常磊[19]等测量在不同的pH条件下PAA和PAcrNPP在不同基质上的吸附量,发现在pH5.5时,聚电解质吸附量大,正好是PAA和PAcrNPP两者的pKa的均值,与Krasemann,L的理论相吻合。
1.3 分离方法
为了避免由于聚合物不足导致其与脂质体之间交联或絮凝,通常将待修饰的脂质体溶液逐滴滴入到聚电解质溶液中,并持续搅拌[20]。同时,为了避免带相反电荷的聚电解质之间发生交联生成聚电解质复合物,因此在进行下一层的修饰之前,需要除去未结合的游离聚电解质。
目前常用的技术为超速离心法[21],该法具有操作简单、高效等优点,但却存在耗能、复水难、复水后脂质体凝聚使平均粒径变大等缺点。另一种常用的技术是超滤,Keiji[10]等将聚赖氨酸和聚天冬氨酸修饰在脂质体表面,通过多次超滤的方式将脂质体从修饰剂溶液中分离,Fukui[22]等用多次超滤将修饰完成后的脂质体从壳聚糖和葡聚糖溶液中分离,超滤具有处理温和、高选择性、低能耗等优点,然而随着过滤的进行,大分子逐渐聚积在膜表面,并堵塞膜孔,降低过滤通量,即使增加压力,也只能将聚积层压紧,而不能改善过滤状态[23]。与之相比,切向流过滤技术就克服了上述的缺点。该技术料液流动方向与过滤方向呈垂直方向的过滤形式,沿滤膜表面流动的料液会将膜表面由于浓差极化而形成的凝胶层“扫掠”清除,从而维持膜的过滤状态,保证小分子通过。切向流过技术具有较好的浓缩和分馏功能,能在除去未结合的聚电解质的同时改变其浓度或置换缓冲液,该方法具有快速、高效、节能等优点[24],但一些天然聚电解质如壳聚糖等粘度很高,容易粘附在膜表面造成膜堵塞,因此其应用有限。Monika[25]等利用凝胶过滤层析技术分离游离壳聚糖,凝胶过滤具有条件温和、操作简单和对高分子聚合物分离效果好的优点,但存在收率较低、耗时和分离后脂质体浓度降低等缺点。由于聚电解质与脂质体或聚电解质之间的作用力较弱,超滤过程中会伴随着聚电解质解吸附的作用,因此超滤过程应尽量减少超滤的次数和时间。
磁分离技术是利用组分磁敏感性的差异,借助外磁场将物质进行磁场处理,从而达到强化分离效果的一种快速、高效的分离技术[26]。磁分离技术常被用于分离细胞和生物大分子如核酸等[27]。da Silva Gomes[28]等以磁分离技术将磁性脂质体从溶液中分离,再用新的缓冲液分散,进行下一步修饰。由于作用时间短,对脂质体薄膜结构基本没有影响,且磁性脂质体本身就具有靶向性等功能,因此以磁性脂质体作为分离手段具有良好的发展前景。
2 LBL薄膜的结构表征
脂质体的平均粒径随修饰层数的增加而增加,且在前两次修饰时粒径变化较为明显,平均粒径的增加是其表面膜变厚和聚电解质与脂质体之间桥连的共同结果[29]。然而Haidar等在脂质体表面交替修饰壳聚糖和海藻酸钠时发现,第一层修饰后,其平均粒径由180nm变为345nm,而第二层修饰后发现其粒径不升反降,由345nm降为210nm左右,随着层数的增加,粒径则趋于平稳。这种现象可能是相对较短的海藻酸钠分子容易在长链壳聚糖分子之间扩散形成一层致密的网状结构造成的[30]。粒径是脂质体的重要性质,文献表明较大的微粒(<5μm)会被淋巴细胞摄取而较小的微粒(<500nm)则会被上皮细胞以内吞的方式摄取[31]。ζ-电位是脂质体体系稳定性的另一个重要参数。电位绝对值越大,膜表面的电荷量越高,微粒间的排斥力就越大,体系就越稳定[32]。LBL需要脂质体膜表面先带有电荷,再利用静电作用,将带相反电荷的聚电解质沉积在膜表面,随着聚电解质在脂质体表面的沉积,表面电位会随之改变正负值。脂质体的粒径和电位一般是以动态光散射法测定的,如Zou[33]等使用美国Nicomp 380 ZLS激光粒度仪测定脂质体的平均粒径和表面电位,Tamaru[34]等使用英国马尔文纳米粒度仪及Zeta电位分析仪测定了脂质体的平均粒径和表面电位。
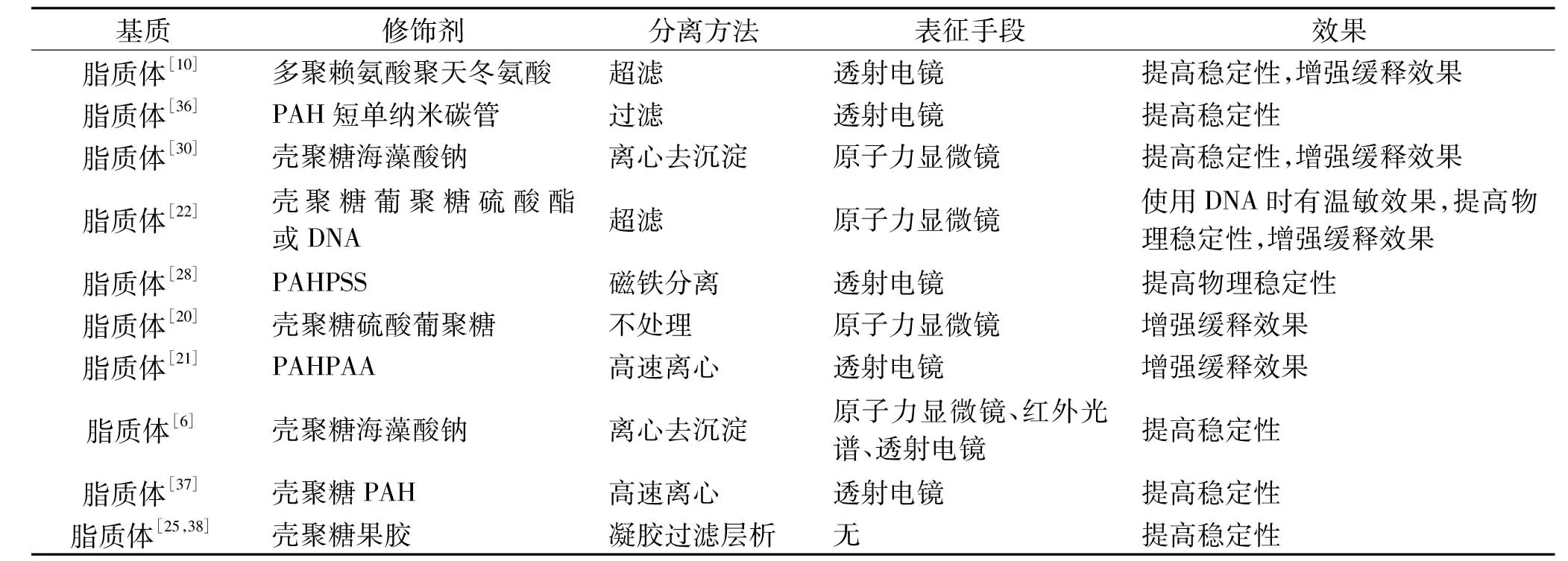
表1 LBL层层自组装技术在脂质体修饰中的应用Table1 Layer-by-Layer self-assembly technology for the modification of liposome
除粒径和电位外,可以通过光谱学和电镜等对脂质体修饰进行表征。如红外图谱显示修饰前后脂质体的特征峰偏移情况,并用来分析脂质体与聚电解质的作用力和作用方式[6]。原子力显微镜(AFM)一般用于验证动态光散射法(DLS)测量的粒径结果,但由于样品制备和测量过程中的影响,其结果与DLS有一定的差异,而原子力显微镜无法识别包覆在脂质体表面的聚合物[28],因此AFM能给出的信息有限。相比于AFM,透射电镜(TEM)可以更为直观的观察出脂质体的微观结构包括粒径,Fujimoto[10]等用AFM观察脂质体表面的轮廓判断多聚赖氨酸和聚天冬氨酸成功的沉积在脂质体表面形成保护膜。然而AFM仍然不能给出关于脂质体表面聚电解质的层数和分布等信息。激光共聚焦显微镜(CLSM)可以清楚的观察到荧光标记的聚电解质在脂质体表面的分布,但由于其分辨率有限,只能测量粒径较大的微粒,限制了它在脂质体中的应用[35]。
目前尚且没有技术能很好的表征脂质体表面的膜的结构,只能综合粒径、电位和电镜图的信息判断自组装的成功与否。
3 LBL对脂质体的影响
表面修饰技术是为了解决脂质体在保存期内粒径变大、絮凝、药物渗漏以及给药后在体内脂质体破裂、包封药物快速渗漏等问题。以表面活性剂(曲通X-100)处理修饰前后的脂质体,对比其透明度,修饰后的脂质体稳定性较好,这主要是因为聚电解质在脂质体表面形成的薄膜能保护脂质体,提高其物理稳定性[10,22,28,36],Haidar[30]等比较了脂质体壳聚糖-海藻酸盐修饰三层和五层的脂质体冻干前后平均粒径和表面电位的变化,发现表面修饰后的脂质体冻干前后平均粒径和表面电位基本没变化,而未修饰的脂质体,冻干再复水后粒径急剧增大,可能出现了絮凝沉淀。除了提高其稳定性外,体外消化实验表面LBL对脂质体的缓释效果也有提高[22],这是聚电解质薄膜能阻止胰酶对磷脂的降解,从而提高其缓释效果。
除了提高贮藏和消化稳定性外,通过LBL也能赋予脂质体一些特殊的性能。Ziyad S[30]发现随着脂质体表面的聚电解的增加,包裹的水溶性蛋白也随之增加,在聚电解质达到10层时,包封率高达80%,LBL或将成为控制水溶性药物包封率的技术手段。Fujimoto[10]发现沉积在脂质体第一层的聚赖氨酸量直接决定药物的释放特性;Fukui[22]用低分子壳聚糖作为阳离子修饰剂,葡聚糖硫酸酯或DNA作为阴离子修饰剂,壳聚糖单层修饰的脂质体具有非常好的缓释效果,再修饰一层葡聚糖硫酸酯或DNA没有显著提高,在60℃条件下,DNA解螺旋,使脂质体表面的聚电解质壳结构破坏,脂质体药物释放迅速,使脂质体具有温敏性。在脂质体表面修饰具有特定性能的聚电解质使脂质体功能多样化是LBL发展趋势。
4 展望
LBL利用静电引力、氢键、配位键等作用力将聚阳离子和聚阴离子交替沉积到脂质体表面,形成一层保护膜,能提高其贮藏及消化稳定性。该技术具有操作简单、条件温和、材料来源广泛且能通过控制修饰参数(聚电解质种类、修饰层数、溶液pH及离子强度等)来调节脂质体的表面性质(平均粒径、表面电位、表面粗糙度)、理化稳定性以及功能多样性等优点。随着更多的聚电解质被提取和合成,LBL构建的脂质体体系将得到更大的发展。
[1]Coustet M,Irigoyen J,Garcia T A,et al. Layer-by-layer assembly of polymersomes and polyelectrolytes on planar surfaces and microsized colloidal particles[J]. Journal of Colloid and Interface Science,2014,421:132-140.
[2]Decher G,Hong J,Schmitt J. Buildup of ultrathin multilayer films by a self-assembly process:III. Consecutively alternating adsorption of anionic and cationic polyelectrolytes on charged surfaces[J]. Thin Solid Films,1992,210(2):831-835.
[3]Blodgett K B,Langmuir I. Built-up films of barium stearate and their optical properties[J]. Physical Review,1937,51(11):18.
[4]Sukhorukov G B,Donath E,Lichtenfeld H,et al. Layer-by-layer self assembly of polyelectrolytes on colloidal particles[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,1998,137(1):253-266.
[5]Dam H H,Caruso F. Formation and degradation of layer-by-layer-assembled polyelectrolyte polyrotaxane capsules[J]. Langmuir,2013,29(24):7203-7208.
[6]Liu W,Liu J,Liu W,et al. Improved physical andinvitrodigestion stability of a polyelectrolyte delivery system based on layer-by-layer self-assembly alginate-chitosan-coated nanoliposomes[J]. Journal of Agricultural and Food Chemistry,2013,61(17):4133-4144.
[7]Parekh G,Pattekari P,Joshi C,et al. Layer-by-layer nanoencapsulation of camptothecin with improved activity[J]. International Journal of Pharmaceutics,2014,465(1-2):218-227.
[8]Carvalho A G S,Silva V M,Hubinger M D. Microencapsulation by spray drying of emulsified green coffee oil with two-layered membranes[J]. Food Research International,2014,61(1):236-245.
[9]Liu W L,Ye A Q,Liu C M,et al. Structure and integrity of liposomes prepared from milk-or soybean-derived phospholipids duringinvitrodigestion[J]. Food Research International,2012,48(2):499-506.
[10]Fujimoto K,Toyoda T,Fukui Y. Preparation of bionanocapsules by the layer-by-layer deposition of polypeptides onto a liposome[J]. Macromolecules,2007,40(14):5122-5128.
[11]de Villiers M M,Otto D P,Strydom S J,et al. Introduction to nanocoatings produced by layer-by-layer(LbL)self-assembly[J]. Advanced Drug Delivery Reviews,2011,63(9):701-715.
[12]Joseph N,Ahmadiannamini P,Hoogenboom R,et al. Layer-by-layer preparation of polyelectrolyte multilayer membranes for separation[J]. Polymer Chemistry,2014,5(6):1817-1831.
[13]于菲菲,邹豪,钟延强. 逐层组装技术在药物递送领域应用的研究进展[J]. 药学学报,2012,47(3):332-338.
[14]Llamas S,Guzman E,Ortega F,et al. Adsorption of polyelectrolytes and polyelectrolytes-surfactant mixtures at surfaces:a physico-chemical approach to a cosmetic challenge[J]. Advances in Colloid and Interface Science,2014.
[15]Zhang P,Qian J,Yang Y,et al. Polyelectrolyte layer-by-layer self-assembly enhanced by electric field and their multilayer membranes for separating isopropanol-water mixtures[J]. Journal of Membrane Science,2008,320(1):73-77.
[16]Buron C,Filiatre C,Membrey F,et al. Surface morphology and thickness of a multilayer film composed of strong and weak polyelectrolytes:effect of the number of adsorbed layers,concentration and type of salts[J]. Thin Solid Films,2009,517(8):2611-2617.
[17]Schoeler B,Kumaraswamy G,Caruso F. Investigation of the influence of polyelectrolyte charge density on the growth of multilayer thin films prepared by the layer-by-layer technique[J]. Macromolecules,2002,35(3):889-897.
[18]Krasemann L,Toutianoush A,Tieke B. Self-assembled polyelectrolyte multilayer membranes with highly improved pervaporation separation of ethanol/water mixtures[J]. Journal of Membrane Science,2001,181(2):221-228.
[19]Chang L,Kong X,Wang F,et al. Layer-by-layer assembly of poly(N-acryloyl-N′-propylpiperazine)and poly(acrylic acid):Effect of pH and temperature[J]. Thin Solid Films,2008,516(8):2125-2129.
[20]Madrigal-Carballo S,Lim S,Rodriguez G,et al. Biopolymer coating of soybean lecithin liposomes via layer-by-layer self-assembly as novel delivery system for ellagic acid[J]. Journal of Functional Foods,2010,2(2):99-106.
[21]Jain S,Kumar D,Swarnakar N K,et al. Polyelectrolyte stabilized multilayered liposomes for oral delivery of paclitaxel[J].Biomaterials,2012,33(28):6758-6768.
[22]Fukui Y,Fujimoto K. The preparation of sugar polymer-coated nanocapsules by the layer-by-layer deposition on the liposome[J]. Langmuir,2009,25(17):10020-10025.
[23]Mohammad A W,Ng C Y,Lim Y P,et al. Ultrafiltration in food processing industry:review on application,membrane fouling,and fouling control[J]. Food and bioprocess technology,2012,5(4):1143-1156.
[24]Hirsjarvi S,Qiao Y,Royere A,et al. Layer-by-layer surface modification of lipid nanocapsules[J]. European Journal of Pharmaceutics and Biopharmaceutics,2010,76(2):200-207.
[25]Gibis M,Zeeb B,Weiss J. Formation,characterization,and stability of encapsulated hibiscus extract in multilayered liposomes[J]. Food Hydrocolloids,2014,38(0):28-39.
[26]Ai L,Zhou Y,Jiang J. Removal of methylene blue from aqueous solution by montmorillonite/CoFe2O4composite with magnetic separation performance[J]. Desalination,2011,266(1-3):72-77.
[27]Xu L,Guo C,Wang F,et al. A simple and rapid harvesting method for microalgae by in situ magnetic separation[J]. Bioresource Technology,2011,102(21):10047-10051.
[28]Pereira da Silva Gomes J F,Rank A,Kronenberger A,et al. Polyelectrolyte-coated unilamellar nanometer-sized magnetic liposomes[J]. Langmuir,2009,25(12):6793-6799.
[29]Panya A,Laguerre M,Lecomte J,et al. Effects of chitosan and rosmarinate esters on the physical and oxidative stability of liposomes[J]. Journal of Agricultural and Food Chemistry,2010,58(9):5679-5684.
[30]Haidar Z S,Hamdy R C,Tabrizian M. Protein release kinetics for core-shell hybrid nanoparticles based on the layer-by-layer assembly of alginate and chitosan on liposomes[J]. Biomaterials,2008,29(9):1207-1215.
[31]Zhang Z,Feng S-S. The drug encapsulation efficiency,invitrodrug release,cellular uptake and cytotoxicity of paclitaxel-loaded poly(lactide)-tocopheryl polyethylene glycol succinate nanoparticles[J]. Biomaterials,2006,27(21):4025-4033.
[32]Mu L,Feng S. Vitamin E TPGS used as emulsifier in the solvent evaporation/extraction technique for fabrication of polymeric nanospheres for controlled release of paclitaxel(Taxol®)[J]. Journal of Controlled Release,2002,80(1):129-144.
[33]Zou L-q,Peng S-f,Liu W,et al. Improvedinvitrodigestion stability of(-)-epigallocatechin gallate through nanoliposome encapsulation[J]. Food Research International,2014,64:492-499.
[34]Tamaru M,Akita H,Kajimoto K,et al. An apolipoprotein E modified liposomal nanoparticle:Ligand dependent efficiency as asiRNA delivery carrier for mouse-derived brain endothelial cells[J]. International Journal of Pharmaceutics,2014,465(1):77-82.
[35]Johnston A P,Zelikin A N,Lee L,et al. Approaches to quantifying and visualizing polyelectrolyte multilayer film formation on particles[J]. Analytical Chemistry,2006,78(16):5913-5919.
[36]Angelini G,Boncompagni S,De Maria P,et al. Layer-by-layer deposition of shortened nanotubes or polyethylene glycol-derivatized nanotubes on liposomes:A tool for increasing liposome stability[J]. Carbon,2007,45(13):2479-2485.
[37]Chen M-X,Li B-K,Yin D-K,et al. Layer-by-layer assembly of chitosan stabilized multilayered liposomes for paclitaxel delivery[J]. Carbohydrate Polymers,2014,111:298-304.
[38]Gibis M,Vogt E,Weiss J. Encapsulation of polyphenolic grape seed extract in polymer-coated liposomes[J]. Food Function,2012,3(3):246-254.
Layer-by-Layer self-assembly technology for the modification of liposome
PENG Sheng-feng,LIU Wei*,ZOU Li-qiang,ZHOU Lei
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Liposomes were commonly investigated as vehicles and utilized in medicine and cosmetic industries because of their good biocompatibility and biodegradability. Nonetheless,their poor stability during storage and gastrointestinal environment greatly limited their application. One of the strategies was to modify the liposomes with polyelectrolytes using Layer-by-layer assembly technology. In this review,the factors that influenced the self-assembly process,the characterization of Layer-by-layer constructs and the contribution of LbL self-assembly to liposome were discussed.
liposomes;layer-by-layer self-assembly technology;polyelectrolyte
2014-08-07
彭盛峰(1992-),男,硕士研究生,研究方向:食物(含生物质)资源开发与利用。
*通讯作者:刘伟(1972-),男,博士,教授,研究方向:食品高新技术与资源综合利用。
国家自然科学基金(21266021);研究生创新计划(YC2014-S056)。
TS201.4
A
:1002-0306(2015)09-0391-05
10.13386/j.issn1002-0306.2015.09.076
