枣花蜜和荞麦蜜中葡萄糖氧化酶的活性及热稳定性研究
2015-02-16王萌,杜冰,曹炜,2,*
王 萌,杜 冰,曹 炜,2,*
(1.西北大学 化工学院,陕西西安 710069;2.陕西省蜂产品工程技术研究中心,陕西西安 710065)
枣花蜜和荞麦蜜中葡萄糖氧化酶的活性及热稳定性研究
王 萌1,杜 冰1,曹 炜1,2,*
(1.西北大学 化工学院,陕西西安 710069;2.陕西省蜂产品工程技术研究中心,陕西西安 710065)
分别测定了不同地理源的枣花蜜和荞麦蜜中葡萄糖氧化酶(glucose oxidase,GOD)的活性。在测定的枣花蜜样品中陕西佳县枣花蜜GOD活性最高,为(0.161±0.002)U/g,山西吕梁枣花蜜GOD活性最低,为(0.007±0.001)U/g;荞麦蜜中四川西昌荞麦蜜GOD活性最高,为(0.112±0.001)U/g,山西晋北荞麦蜜GOD活性最低,为(0.007±0.001)U/g。结果表明,蜂蜜植物源不同,GOD活性不同;植物源相同时,地理源不同,蜂蜜中GOD活性差异也较大。对GOD的热稳定性研究表明,枣花蜜中的GOD在70℃加热90min活性完全损失,荞麦蜜GOD活性仍有部分残存,表明四川西昌荞麦蜜中的GOD热稳定性较陕西佳县枣花蜜高。
蜂蜜,葡萄糖氧化酶,热稳定性
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合后经充分酿造而成的天然甜物质[1]。蜂蜜中除了含有丰富的碳水化合物外,还含有维生素、酚酸、黄酮类物质、游离氨基酸、有机酸及酶类等多种营养素和生物活性成分[2]。这些物质与蜂蜜多种生物活性相关,如抑菌、抗氧化及抗炎等[3]。其中,蜂蜜的抑菌活性,与其高渗透压、所含葡萄糖氧化酶(GOD)产生的过氧化氢(H2O2)等相关[4-5]。

目前测定GOD活性的方法有多种,如滴定分析法和傅立叶红外变换色谱法等[12-16]。辣根过氧化物酶-邻联茴香胺法一直广泛应用于食品中GOD活性测定,但由于邻联茴香胺具有一定致癌性,因而需要一种较为安全的方法替代该法。本文采用GOD催化葡萄糖生成的H2O2在辣根过氧化物酶的催化下与4-氨基安替比林、苯酚及溶液中的二氧化碳反应生成红色醌亚胺来测定蜂蜜中的GOD活性,该法具有简便、灵敏度高、重现性好等优点[17-18]。此外,本文对枣花蜜和荞麦蜜中GOD的热稳定性进行了初步研究。本文研究结果可以为揭示蜂蜜的抑菌活性机制和质量控制提供依据。
1 材料与方法
1.1 样品来源信息
蜂蜜样品 由蜂农或蜂场提供,主要花粉孢子比率大于50%确定为单花种蜂蜜。蜂蜜样品采集地点与采集时间详见表1。
1.2 试剂与仪器
辣根过氧化物酶 南京都莱生物技术有限公司,纯度:生化级;4-氨基安替比林,30% H2O2,Na2HPO4·12H2O,NaH2PO4·2H2O 均为国产分析纯试剂。
751-GD紫外可见分光光度计 上海分析仪器厂。
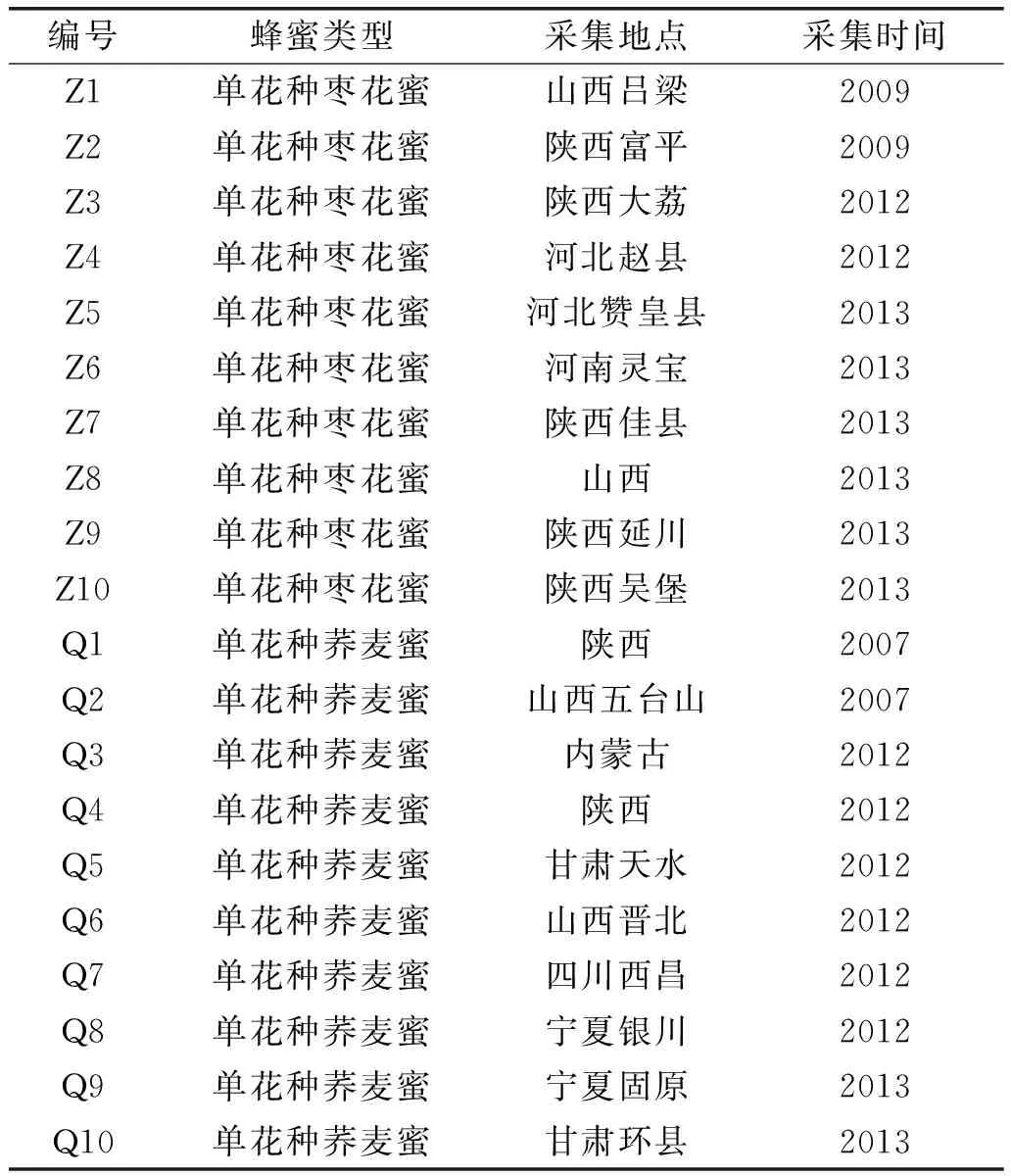
表1 蜂蜜样品信息Table1 Information of honey samples
1.3 测定方法
1.3.1 溶液配制 称取3.5mg辣根过氧化物酶和3.5mg 4-氨基安替比林溶于20mL磷酸缓冲液(0.02mol/L,pH4.7)中,再加入1mL浓度为3%的苯酚溶液即为溶液A,混匀置于冰箱中备用;将葡萄糖配制成6.5%的溶液B;用磷酸缓冲液(0.02mol/L,pH4.7)将蜂蜜样品稀释至0.2g/mL,置于冰箱中备用。
1.3.2 过氧化氢含量标准曲线的测定 向9支棕色试管中分别加入2.50、2.45、2.40、2.35、2.30、2.25、2.20、2.15、2.10mL缓冲液和1.5mL溶液A,混匀,依次加入0、50、100、150、200、250、300、350、400μL 2mmol/L的H2O2溶液。混合均匀,35℃下反应5min,反应终止后在500nm波长下测定吸光度。以吸光度为纵坐标,H2O2含量为横坐标作图,即为标准曲线。
1.3.3 蜂蜜样品中的GOD活性测定 分别取1.5mL溶液A,1.5mL溶液B,缓冲液200μL于试管中。向试管中加入800μL配制好的蜂蜜样品溶液,混匀后将样液置于35℃环境中,测定其在500nm波长下15min内吸光度的变化。以每分钟催化1μmol葡萄糖生成H2O2和葡萄糖酸所需的酶量为1个GOD酶活力单位,用U表示。将相同的蜂蜜样品溶液在沸水中加热10min,保证酶失活,作为空白对照。
1.3.4 热稳定性测定 将一定量的枣花蜜和荞麦蜜分别在50、60、70℃下加热30、60、90、120、150、180min。取出后,立即用冰水冷却,采用上述测定样品中GOD活性的方法进行热稳定性实验。
1.4 实验数据统计分析
每个实验均重复三次,实验数据采用origin 8.0软件处理,并用SPSS 17.0软件对数据进行差异显著性分析(p<0.05)。
2 结果与分析
2.1 过氧化氢含量标准曲线
对反应液吸光值和生成的H2O2的量进行线性回归,求得回归方程和相关系数分别为:y=0.8727x+0.0059,R2=0.9976。如图1所示,结果表明,H2O2浓度在测量范围内与吸光度具有良好的线性关系。

图1 H2O2含量标准曲线Fig.1 Standard curve of H2O2
2.2 蜂蜜样品中GOD活性
按照上述实验方法,本文测定了不同产地的枣花蜜和荞麦蜜中GOD活性,结果如表2所示。
由表2可知,枣花蜜和荞麦蜜的GOD活性存在显著差异,枣花蜜样品GOD的最高活性为(0.161±0.002)U/g,平均值为(0.089±0.051)U/g;荞麦蜜GOD最高活性仅为(0.112±0.002)U/g,平均值为(0.044±0.030)U/g。此实验结果与金银花蜜、野菊蜜及野坝子蜜中GOD活性(经单位换算分别约0.056、0.029、0.054U/g)相当[19-21]。该结果表明,蜂蜜植物源不同,其GOD活性不同。此外,植物源相同而产地不同时,蜂蜜的GOD活性亦有较大差异,如陕西佳县枣花蜜GOD活性为(0.161±0.002)U/g,而同一年采集的河南吴堡枣花蜜GOD活性为(0.129±0.002)U/g,两者之间存在显著性差异,这一现象在荞麦蜜中亦存在,这可能与蜂蜜采集时间、采集气候、采集蜂的种类等多种因素相关。

表2 枣花蜜和荞麦蜜样品中葡萄糖氧化酶的活性Table2 Results of glucose oxidase activities in honey samples
注:字母不同表示差异性显著,字母相同表示差异性不显著(p<0.05)。
除了枣花蜜和荞麦蜜两种蜂蜜外,本文对油菜蜜、洋槐蜜、龙眼蜜、荆条蜜、枸杞蜜等一些蜂蜜中的GOD活性也进行了测定,但这些样品中GOD活性很低(数据未列出),部分样品的GOD活性几乎为零,可能与蜂蜜的种类和酿制时间有关,其原因有待进一步研究。
2.3 枣花蜜和荞麦蜜中GOD的热稳定性
蜂蜜加工一般要经过二次加热,解晶和真空浓缩等处理,蜂蜜经过热加工后GOD活性可能部分失活,本研究考察了陕西佳县枣花蜜和四川西昌荞麦蜜的热稳定性,结果如图2和图3所示。

图2 温度对枣花蜜GOD活性的影响Fig.2 Effect of temperature on GOD activity in jujube honey

图3 温度对荞麦蜜GOD活性的影响Fig.3 Effect of temperature on GOD activity in buckwheat honey
由图2可知,枣花蜜GOD活性随加热温度的升高而降低,70℃加热10min,GOD活性降低67%,加热90min,GOD完全失活,60℃加热30min,GOD活性损失22%,50℃加热30min,GOD活性降低11%。可见,当温度达到70℃时,GOD活性显著降低。
由图3可知,50℃加热30min,荞麦蜜中GOD活性损失了12%,60℃加热30min,GOD 活性损失了54%,但随加热时间的延长GOD活性基本不变,70℃加热30min,GOD 活性损失了88%,此后随加热时间的延长,GOD活性趋于平稳。
本文研究表明,当温度达到70℃时,枣花蜜和荞麦蜜中GOD活性均显著下降。与荞麦蜜相比,枣花蜜中GOD活性较高但热稳定性较差,70℃加热30min酶活性损失91%,加热90min后GOD完全失活,荞麦蜜中GOD仍有活性,这可能与荞麦蜜的复杂组成有关,其原因有待进一步探究。本实验结果与曾哲灵等的研究结果相近,曾哲灵等研究发现,当加热温度低于55℃时,野菊蜜中GOD活性在加热过程中变化不明显;当加热温度高于60℃时,在加热过程GOD活性损失较大[18]。
3 结论
本实验通过H2O2与4-氨基安替比林、苯酚、CO2等反应生成红色醌亚胺,间接测定了蜂蜜GOD活性。结果发现,蜂蜜中GOD活性在植物源和地理源上存在显著差异(p<0.05),这可能与蜂蜜的采集时间、成熟过程、地理因素等多种因素相关。枣花蜜在70℃时加热90min后GOD完全失活,但是荞麦蜜仍有一定活性,表明四川西昌荞麦蜜的GOD热稳定性高于陕西佳县枣花蜜。
[1]冯继让. 国家《蜂蜜》标准解读[J]. 蜜蜂杂志,2011,1:8-11.
[2]Escuredo O,Silva L R,Valentão P,et al. Assessing Rubus honey value:Pollen and phenolic compounds content and antibacterial capacity[J]. Food Chemistry,2012,130(3):671-678.
[3]Liu J R,Ye Y L,Lin T Y,et al. Effect of floral sources on the antioxidant,antimicrobial,and anti-inflammatory activities of honeys in Taiwan[J]. Food Chemistry,2013,139(1-4):938-943.
[4]Snow M J,Harris M M. On the nature of non-peroxide antibacterial activity in New Zealand manuka honey[J]. Food Chemistry,2004,84(1):145-147.
[5]Brudzynski K. Effect of hydrogen peroxide on antibacterial activities of Canadian honeys[J]. Canadian Journal of Microbiology,2006,52(12):1228-1237.
[6]White J W J,Subers M H,Schepartz A I. The identification of inhibine,the antibacterial factor in honey,as hydrogen peroxide and its origin in a honey glucose-oxidase system. Biochimica et Biophysica Acta(BBA)-Specialized Section on Enzymological Subjects,1963,73:57-70.
[7]Sandip B B,Mahesh V B,Rekha S S,Laxmi A. Glucose oxidase-An overview[J]. Biotechnology Advances,2009,27:489-501.
[8]Bang L M,Buntting C,Molan P. The effect of dilution on the rate of hydrogen peroxide production in honey and its implications for wound healing[J]. Journal of Alternative and Complementary Medicine,2003,9:267-273.
[9]Tur E,Bolton L,Constantine B E. Topical hydrogen peroxide treatment of ischemic ulcers in the guinea pig:blood recruitment in multiple skin sites[J]. Journal of the American Academy of Dermatology,1995,33:217-221.
[10]Kwakman P H S,Zaat S A J. Antibacterial components of honey[J]. IUBMB Life,2012,64(1):48-55.
[11]Kwakman P H S. Two major medicinal honeys have different mechanisms of bactericidal activity[J]. PLOS One,2011,6:e17709.
[12]Tongbu L,Peng X,Yang H,et al. The production of glucose oxidase using the waste myceliums of Aspergillus niger and the effects of metal ions on the activity of glucose oxidase[J]. Enzyme and Microbial Technology,1996,19:339-342.
[13]Witt S,Singh M,Kalisz H. Structural and kinetic properties of nonglycosylated recombinant Penicillium amagasakiense glucose oxidase expressed inEscherichiacoli[J]. Applied and Environmental Microbiology,1998,64(4):1405-1411.
[14]Gutmann I,Wahlefeld A W,Bergmeyer H U. Methods of enzymatic analysis[J]. Academic Press,1974,3:457-458.
[15]Petruccioli M,Federici F,Bucke C,Keshavarz T. Enhancement of glucose oxidase production by Penicillium variabile P16[J]. Enzyme and Microbial Technology,1999,24:397-401.
[16]Karmali K,Karmali A,Teixeira A,Marcelo M. Assay for glucose oxidase from Aspergillus niger and Penicillium amagasakiense by Fourier transform infrared spectroscopy[J]. Analytical Biochemistry,2004,333:320-327.
[17]翟彤宇,单金缓. 葡萄糖氧化酶催化反应动力学特征及其抑制剂[J]. 河北省科学院学报,1998,18(2):203-205.
[18]刘文涵,鲁汝庆.催化动力学光度法测定葡萄糖氧化酶活性研究[J]. 分析化学,1993,21(1):66-69.
[19]曾哲灵,薛艳辉,高荫榆. 金银花蜜中生物酶的热稳定性[J]. 南昌大学学报,2006,30(1):29-31.
[20]曾哲灵,灵胡虹,熊涛,等. 野菊蜜中生物酶的耐热性能研究[J]. 食品与发酵工业,2005,31(11):43-45.
[21]范路军,和绍禹,张永云,等. 不同贮存条件和时间对野坝子蜜中葡萄糖氧化酶活性的影响[J]. 蜜蜂杂志,2013,33(5):12-14.
Research of activity and thermal stability of GOD in jujube and buckwheat honeys
WANG Meng1,DU Bing1,CAO Wei1,2,*
(1.Department of Food Science and Technology,College of Chemical Engineering,Northwest University,Xi’an 710069,China;2.Bee Product Research Center of Shaanxi Province,Xi’an 710065,China)
The activities of glucose oxidase in jujube and buckwheat honey of different geographical sources were determined. Jujube honey from Jiaxian,Shanxi Province and buckwheat honey from Xichang,Sichuan Province had the highest glucose oxidase activity with the value of(0.161±0.002)U/g and(0.112±0.001)U/g,respectively. The activity of GOD in Lvliang,Shanxi jujube honey samples was only(0.007±0.001)U/g,and the lowest activity appeared in buckwheat honey from Jinbei,Shanxi Province with the same value. The results showed that the GOD activity varied significantly between different botanical and geographical sources of Chinese unifloral honey. Furthermore,thermal stability of GOD in these two honey samples was detected. The result showed that with increasing of temperature,the activity of GOD in jujube was reduced and there was no activity when the temperature up to 70℃ with 90min. Under the same conditions,the activity of GOD still can be determined in buckwheat honey. This research indicated that the thermal stability of buckwheat honey was higher than jujubehoney.
honey;glucose oxidase activity;thermal stability
2014-07-22
王萌(1990-),女,硕士,研究方向:蜂蜜中的活性成分及其研究。
*通讯作者:曹炜(1969-),男,博士,教授,研究方向:食品中活性成分及其评价。
国家自然科学基金(31272510);西安市农业技术研发项目(NC1405(1))。
TS201.2
A
:1002-0306(2015)09-0083-04
10.13386/j.issn1002-0306.2015.09.009
