18β⁃甘草次酸对变应性鼻炎大鼠鼻黏膜中水通道蛋白1和5表达的影响
2015-02-13黎桥席克虎桂岩王有虎张福宏陈小婉江英侯赟张小兵
黎桥,席克虎,桂岩,王有虎,张福宏,陈小婉,江英,侯赟,张小兵
(兰州大学附属第一医院耳鼻咽喉头颈外科,兰州 730000)
·论著·
18β⁃甘草次酸对变应性鼻炎大鼠鼻黏膜中水通道蛋白1和5表达的影响
黎桥,席克虎,桂岩,王有虎,张福宏,陈小婉,江英,侯赟,张小兵
(兰州大学附属第一医院耳鼻咽喉头颈外科,兰州 730000)
目的 观察18β-甘草次酸对变应性鼻炎大鼠鼻黏膜水通道蛋白(AQP)表达的影响并探讨其意义。方法将60只Wistar大鼠随机均分为18β-甘草次酸组、氯雷他定组、模型组和正常对照组,18β-甘草次酸组、氯雷他定组及模型组大鼠经卵清蛋白(OVA)致敏建立变应性鼻炎疾病模型,造模成功后分别给药干预,于给药2、4、6、8、10周时,应用免疫组织化学方法(SP法)检测各组鼻黏膜中AQP1和AQP5的表达并进行比较。结果AQP1和AQP5在各组大鼠鼻黏膜中分布相同,AQP1主要表达于上毛细血管、血窦内皮细胞及成纤维细胞。AQP5强表达于腺上皮、导管上皮及黏膜上皮细胞的胞膜及胞质。免疫组化染色统计学分析显示,AQP1和AQP5在模型组的表达量显著高于正常对照组(P<0.05),在18β-甘草次酸组及氯雷他定组大鼠鼻黏膜中的表达量均随给药干预的时间延长逐渐下降,并接近于正常对照组。结论18β-甘草次酸可能通过下调AQP1和AQP5的表达缓解变应性鼻炎挠鼻、喷嚏及流涕等症状。
18β-甘草次酸;水通道蛋白1;水通道蛋白5;变应性鼻炎;免疫组织化学
甘草次酸(C30H46O4)是甘草在体内经β-葡萄糖醛酸酶代谢后产生的主要有效成分,属于五环三萜烯类化合物,可分为18β-甘草次酸(18β-glycyrrhetinic acid,18β-GA)及18α-甘草次酸2种光学异构体。自然界18α-甘草次酸含量极少,目前的研究主要以18β-GA为主。研究表明,18β-GA具有抗炎[1]、抗肿瘤[2]、抗病毒[3]、抗过敏[4]等多种药理作用。变应性鼻炎(allergic rhinitis,AR)是IgE介导的Ⅰ型超敏反应,以黏膜水肿、毛细血管扩张及腺体增生为基本病理改变,临床症状主要表现为鼻塞、鼻痒及大量清涕,影响着全球10%~20%人的生活质量和健康。水通道蛋白(aquaporin,AQP)是一类参与水跨膜转运的特异性通道蛋白,与细胞内外液体的转运及腺体的分泌密切相关。已有研究证明AQP广泛分布于鼻黏膜组织,且在组织的水转运和代谢异常过程中发挥重要作用[5]。18β-GA能通过调节免疫功能干预AR[6],但其对AR鼻黏膜组织中AQP的影响鲜有报道。因此,本研究拟观察18β-GA治疗AR过程中对AQP1、AQP5的影响,探讨18β-GA的干预作用与AQP的相关性。
1 材料与方法
1.1 试剂
卵清蛋白(ovalbumin,OVA)(美国Sigma公司,批号:1001445093),18β-GA(甘肃泛植生物科技有限公司,批号:12081603),氯雷他定(四川奥邦药业有限公司,批号:121109)。兔抗大鼠AQP5购自英国Abcam公司,兔抗大鼠AQP1购自美国Sigma公司,兔SP检测试剂盒、DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 动物模型的建立及维持:无特定病原体(specific pathogen free,SPF)级Wistar大鼠60只(甘肃中医学院SPF动物实验室提供),4~6周龄,体质量180~220 g。采用随机数字表法将60只大鼠随机分成18β-GA组(n=15)、氯雷他定组(L组,n=15)、模型组(MC组,n=15)和正常对照组(NC组,n=15)。18β-GA组、L组及MC组大鼠经OVA造模:首先基础致敏,给予大鼠腹腔注射1 mL抗原佐剂混悬液[含0.3 mg OVA、30 mg AL(OH)3]进行致敏,隔日1次,共7次,14 d。然后鼻腔激发,在末次腹腔注射基础致敏后隔1日开始,用2%OVA溶液对实验组大鼠双侧鼻孔滴鼻,50 μL/侧,1次/d,共7 d。每次鼻腔激发后即刻至30 min内,观察并记录大鼠搔鼻动作次数、喷嚏个数及流涕情况,进行症状学评分。NC组大鼠:以生理盐水代替OVA,其余方法和步骤与实验组相同。造模成功后,为了维持动物模型,18β-GA组、L组及MC组大鼠继续给予2%OVA滴鼻,50 μL/侧,2次/周,NC组大鼠以等量生理盐水替代。1.2.2 大鼠行为学评分标准:每次鼻腔激发后即刻至30 min内观察并记录大鼠鼻痒程度、喷嚏次数及流涕情况。叠加量化计分法记录各组大鼠症状评分值,鼻痒程度:轻度挠鼻1~2次,记1分;抓挠鼻、面不止,到处摩擦记2分。喷嚏:1~3个为1分,4~10个为2分,11个以上为3分。流涕:流至前鼻孔为1分,超过前鼻孔为2分,流涕满面为3分。各症状记分叠加,总分数≥5分者为造模成功。
1.2.3 给药方法:造模完成后,根据动物体表面积转换计算公式,参考临床氯雷他定胶囊及复方甘草酸苷片(日本米诺发源制药株式会社,每片含甘草酸苷25 mg)用药量进行换算:L组大鼠给予氯雷他定(0.96 mg/kg溶于2 mL生理盐水)灌胃,18β-GA组给予18β-GA(21.6 mg/kg溶于2 mL生理盐水)灌胃,NC组和MC组以等量生理盐水替代,1次/d。分别于给药干预2、4、6、8、10周的末次给药24 h后,随机挑选每组3只大鼠,共计60只大鼠,给予10%水合氯醛(3 mL/kg)腹腔注射麻醉,迅速取双侧鼻中隔黏膜,放入4℃的4%多聚甲醛溶液中固定,无水乙醇梯度脱水,石蜡包埋,4.5 μm厚连续切片。
1.2.4 免疫组化染色:采用链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)法,切片经常规脱蜡、水化后,3%过氧化氢孵育15 min,PBS清洗3次,每次5 min。高压抗原修复10 s。滴加山羊血清封闭液,室温15 min,倾去直接滴加一抗AQP1多克隆抗体(1∶500)或AQP5多克隆抗体(1∶500),4℃,20 h。PBS清洗3次,每次5 min。加入生物素标记二抗,室温下孵育15 min,PBS清洗3次,每次5 min。加辣根酶标记链霉素卵白素工作液,孵育15 min,3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色,苏木精复染、脱水、二甲苯透明、中性树胶封片,光学显微镜下观察。
1.3 统计学处理
选择背景清晰、染色清晰的切片做统计学分析,每只动物选取2个高倍视野。采用Image-Pro Plus 6.0软件测量大鼠鼻黏膜AQP1、AQP5表达的平均光密度值,所有数据均用表示。应用SPSS统计学软件进行处理,行单因素方差分析,比较两两差异,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠AR模型的建立
18β-GA组、L组及MC组大鼠(n=45)在末次鼻腔激发后均出现明显外鼻红肿、反复搔鼻、喷嚏不止及不同程度流涕,叠加评分均超过5分,说明AR模型造模成功。NC组大鼠仅有轻微的搔鼻、打喷嚏。MC组动物至实验完成时每日评分均>5分;随给药时间延长,18β-GA组和L组外鼻红胀程度逐渐减轻,喷嚏次数、搔鼻次数和鼻涕逐渐减少。
2.2 免疫组化染色定位、表达情况
光镜下鼻黏膜组织中AQP1或5阳性表达呈棕黄色或棕褐色,阴性对照不着色。MC组、NC组、L组、18β-GA组大鼠鼻黏膜中AQP1、AQP5分布一致,AQP1表达于鼻黏膜上皮下结缔组织、毛细血管及血窦内皮细胞,AQP5分布于鼻黏膜上皮细胞、腺上皮及导管上皮细胞的胞膜和胞质。见图1。

图1 各组鼻黏膜AQP1和AQP5的阳性表达 SP法×400Fig.1 Positive expression of AQP1,5 in the nasal mucosa of each group SP×400
AQP1的表达情况如表1所示。MC组:2、4、6、8、10周时,AQP1平均光密度值均明显高于NC组(P<0.05)。18β-GA组:2、4周时,AQP1平均光密度值略低于MC组,但仍高于NC组(P<0.05);6、8、10周时,该值持续下降,均显著低于MC组(P<0.05),接近于NC组。L组:2周时,AQP1的平均光密度值较MC组略低,但高于NC组(P<0.05);4、6、8、10周时,该值进行性下降,明显低于MC组(P<0.05),与NC组无显著差异。L组与18β-GA组各时间点AQP1平均光密度值比较,差异均无统计学意义。此外,18β-GA组及L组中AQP1的平均光密度值在第6、8、10周时与第2周时比较有统计学差异(P<0.05)。
表1 各组大鼠鼻黏膜AQP1表达的平均光密度值Tab.1 The mean optical density value of AQP1 expression in the nasal mucosa of each group
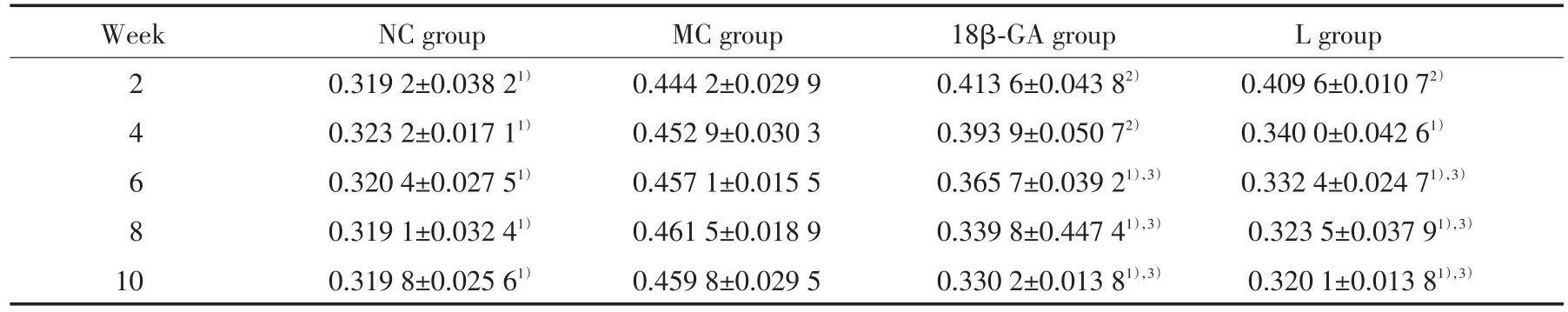
表1 各组大鼠鼻黏膜AQP1表达的平均光密度值Tab.1 The mean optical density value of AQP1 expression in the nasal mucosa of each group
1)P<0.05 vs MC group;2)P<0.05 vs NC group;3)P<0.05 vs 2 weeks in the same group.
Week NC group MC group 18β-GA group L group 2 0.319 2±0.038 21) 0.444 2±0.029 9 0.413 6±0.043 82) 0.409 6±0.010 72)4 0.323 2±0.017 11) 0.452 9±0.030 3 0.393 9±0.050 72) 0.340 0±0.042 61)6 0.320 4±0.027 51) 0.457 1±0.015 5 0.365 7±0.039 21),3) 0.332 4±0.024 71),3)8 0.319 1±0.032 41) 0.461 5±0.018 9 0.339 8±0.447 41),3) 0.323 5±0.037 91),3)10 0.319 8±0.025 61) 0.459 8±0.029 5 0.330 2±0.013 81),3) 0.320 1±0.013 81),3)
AQP5的表达情况如表2所示:MC组的AQP5平均光密度值在各时间点均较NC组升高(P<0.05)。18β-GA组:2、4周时,AQP5平均光密度值较MC组显著下降(P<0.05),但仍高于NC组(P<0.05);6、8、10周时,该值进一步下降,显著低于MC组(P<0.05),并接近于NC组。L组:2周时,AQP5的平均光密度值略低于MC组,但高于NC组(P<0.05);4、 6、8、10周时,该值不断下降,明显低于MC组(P<0.05),并接近于NC组。各时间点L组与18β-GA组AQP1平均光密度值比较,差异无统计学意义。此外,18β-GA组AQP5的值在第10周时较第2周时明显降低(P<0.05),L组中AQP5值在第8、10周时较第2周时显著下降,差异有统计学意义(P<0.05)。
表2 各组大鼠鼻黏膜AQP5表达的平均光密度值Tab.2 The mean optical density value of AQP5 expression in the nasal mucosa of each group
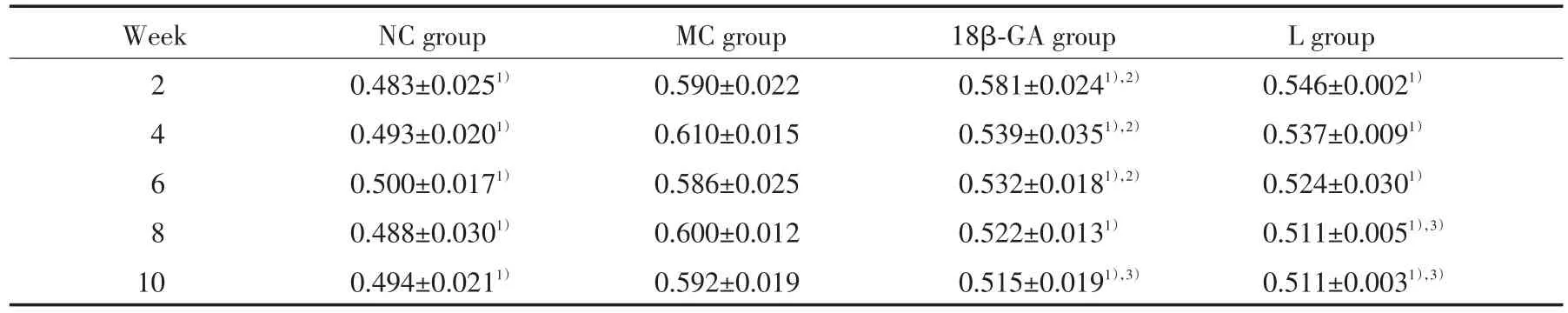
表2 各组大鼠鼻黏膜AQP5表达的平均光密度值Tab.2 The mean optical density value of AQP5 expression in the nasal mucosa of each group
1)P<0.05 vs MC group;2)P<0.05 vs NC group;3)P<0.05 vs 2 weeks in the same group.
Week NC group MC group 18β-GA group L group 2 0.483±0.0251) 0.590±0.022 0.581±0.0241),2) 0.546±0.0021)4 0.493±0.0201) 0.610±0.015 0.539±0.0351),2) 0.537±0.0091)6 0.500±0.0171) 0.586±0.025 0.532±0.0181),2) 0.524±0.0301)8 0.488±0.0301) 0.600±0.012 0.522±0.0131) 0.511±0.0051),3)10 0.494±0.0211) 0.592±0.019 0.515±0.0191),3) 0.511±0.0031),3)
3 讨论
迄今为止,哺乳动物组织中至少发现了13种AQP,即AQP0~AQP12。AQP分布于人类机体所有的内皮屏障组织及部分上皮屏障组织,与机体中液体的平衡及分泌紧密相关[7],还可通过跨膜转运一氧化氮调节血管舒张功能[8]。研究发现,喉癌及鼻息肉组织中AQP1表达升高且与血管内皮生长因子水平呈显著正相关[9,10],而在缺乏AQP1的小鼠胸腔中渗透力明显下降[11],提示AQP1参与毛细血管的增生并提高其通透性。本研究中,通过免疫组化检测观察到AQP1在MC组呈更高水平表达,在干预第2、4、6、8及10周,AR组大鼠鼻黏膜AQP1表达水平均明显高于NC组。而AQP1在变应性鼻炎大鼠毛细血管内皮和血窦内皮细胞的表达增强,提示其可能参与促进毛细血管扩张、提高毛细血管通透性、导致炎性细胞和液体渗出而引起局部炎性反应及黏膜水肿;同时,AQP1在纤毛上皮细胞及基底细胞无表达,黏膜下渗出液转运显著受抑,使液体聚集于组织间隙而进一步加重黏膜水肿。
在人体中,AQP5主要表达于肺泡上皮细胞、唾液腺、腮腺、汗腺上皮细胞上,对于这些组织和器官内的水平衡起重要作用。Ma等[12]发现AQP5基因敲除后,小鼠胸膜、唾液腺及腮腺分泌液明显减少。本研究采用免疫组织化学染色法观察到在各观测时间点,MC组AQP5表达水平均显著高于NC组,提示腺上皮、导管上皮内高度表达的AQP5可能参与促进黏膜下浆液性腺、黏液腺增生及分泌,从而导致MC组大鼠出现大量清涕等表现。
氯雷他定是临床治疗变应性鼻炎的一线药物,属于长效2代抗组胺药,竞争性地抑制组胺H1受体,抑制组胺所引起的过敏症状。在临床治疗中,效果良好,相比1代抗组胺药物,该药无明显的抗胆碱和中枢抑制作用。长期服用该药可能出现头痛、嗜睡、口干、视觉模糊、心悸、晕厥、运动机能亢进、黄疸、肝炎、肝坏死、脱发、癫痫发作、乳房肿大、多形性红斑及全身性过敏反应等不良反应。本研究中,氯雷他定具有改善大鼠变应性鼻炎的症状,下调变应性鼻炎大鼠鼻黏膜AQP1和AQP5表达的作用。而18β-GA对大鼠鼻黏膜症状改善及AQP1和AQP5的调节作用与氯雷他定无明显差别,故认为在变应性疾病中,18β-GA可达到和氯雷他定相同的干预效果,均能通过下调变应性鼻炎大鼠鼻黏膜中AQP1和AQP5的表达,改善AR症状。但18β-GA的不良反应还需进一步研究。
甘草次酸又称甘草亭酸,分子式为C30H46O4,其骨架11位上有C=O,类似18-H-齐墩果烷型结构。因GA的分子构像与类固醇激素相似,其物理特性、生物活性与类固醇激素也相类似,故其可作为配体与类固醇激素竞争性结合甾体激素的受体,还可与其代谢酶结合,从而产生多种多样的生物学功效。甘草次酸通过下调11β-HSD活性从而阻止类固醇激素的失活代谢,使内源性和外源性类固醇激素的血液浓度升高和半衰期延长[13]。甘草次酸在兔肝胞浆中与类固醇受体结合的抑制常数达1.7 nmol/L,即甘草次酸可以与类固醇激素受体相匹配,对激素引起下丘脑-垂体-肾上腺-受体系统抑制有拮抗作用,从而一定程度减少和减轻激素的某些副作用以及不良反应[14]。单用甘草次酸时可出现轻度的激素样作用,而与糖皮质激素合用时,可有效提高激素的抗过敏反应、抗炎和抗应激反应等效果,从而制造直接或间接的糖皮质激素样作用。暗示甘草次酸可能通过其糖皮质激素样作用干预AR疾病。
已有研究发现,18β-GA应用于哮喘治疗时,能显著下调血清IgE、白细胞介素4(interleukin-4,IL-4)、白细胞介素5(interleukin-5,IL-5)水平,抑制γ干扰素(interferon-γ,IFN-γ)和IgG的降低,从而纠正Th1/Th2失衡[15]。Kroes等[16]认为甘草次酸通过抑制补体经典途径而发挥抗炎作用,但对其旁路激活途径无影响。本研究中,AR大鼠经18β-GA干预后,外鼻红胀程度逐渐减轻,喷嚏次数、搔鼻次数和鼻涕逐渐减少,鼻黏膜中AQP1和AQP5表达水平低于MC组,且随干预时间的延长而逐渐下降并接近NC组。因此,推测18β-GA通过下调变应性鼻炎大鼠鼻黏膜中AQP1和AQP5的表达,减轻液体在组织间的潴留,抑制炎性细胞渗出及腺体分泌,改善AR症状。
[1]董方圆,王杰军.甘草次酸及其衍生物的抗炎机制[J].大连医科大学学报,2014,36(2):195-197.
[2]Lallem and B,Ouedraogo M,Wauthoz N,et al.Synthesis and plasma pharmacokinetics in CD-1 mice of a 18 ss-glycyrrhetinic acid derivative displaying anti-cancer activity[J].J Pharm Pharmacol,2013,65(3):402-410.
[3]Wang LJ,Geng CA,Ma YB,et al.Synthesis,biological evaluation and structure-activity relationships of glycyrrhetinic acid derivatives as novel anti-hepatitis B virus agents[J].Bioorg Med Chemistry Lett,2012,22(10):3473-3479.
[4]Park HY,Park SH,Yoon HK,et al.Anti-allergic activity of 18betaglycyrrhetinic acid-3-O-beta-D-glucuronide[J].Arch Pharm Res,2004,27(1):57-60.
[5]朱建国,崔航,赵丹,等.水通道蛋白亚型1-5在鼠鼻粘膜中表达及意义[J].中国实验诊断学,2007,11(4):528-530.
[6]Li XL,Zhou AG.Evaluation of the immunity activity of glycyrrhizin in AR mice[J].Molecules,2012,17(1):716-727.
[7]Mobasheri A,Marples D.Expression of the AQP-1 water channel in normal human tissues:a semiquantitative study using tissue microarray technology[J].Am J Physiol Cell Physiol,2004,286(3):C529-C537.
[8]HerreraM,Hong NJ,Garvin JL.Aquaporin-1 transports NO across cell membranes[J].Hypertension,2006,48(1):157-164.
[9]高晓葳,黄永旺,刘静.水通道蛋白1和血管内皮生长因子在喉鳞状细胞癌组织中的表达及相关性研究[J].临床耳鼻咽喉头颈外科杂志,2009,23(9):407-410.
[10]黄正华,陈峰,俞晨杰,等.水通道蛋白5与低氧反应通路因子在鼻息肉组织中的表达及其相关性研究[J].临床耳鼻咽喉头颈外科杂志,2010,23(10):458-461.
[11]Verkman AS.Aquaporins in endothelia[J].Kidney Int,2006,69(7):1120-1123.
[12]Ma T,Song Y,Gillespie A,et al.Defective secretion of saliva in transgenic mice lacking aquaporin-5 water channels[J].J BiolC hem,1999,274(29):20071-20074.
[13]张明发,沈雅琴.甘草酸及其苷元甘草次酸的糖皮质激素样作用[J].现代药物与临床,2011,26(1):33-35.
[14]Tamaya T,Sato S,Okada HH.Possible mechanism ofsteroid action of the plant herb extracts glycyrrhizin,glycyrrhetinic acid and paeoniflorin:inhibition by plantherb extracts of steroid protein binding in the rabbit[J].Am J Obstet Gynecol,1986,155(5):1134-1139.
[15]Ram A,Mabalirajan U,Das M,et al.Glycyrrhizin alleviates experimental allergic asthma in mice[J].Int J Immunopharmacol,2006,6(9):1468-1477.
[16]Kroes BH,Beu Kelman CJ,Van Den Berg AJJ.Inhibition of human complement by β-glycyrrhetinic acid[J].Immunology,1997,90(1):115-120.
(编辑 王又冬)
Effect of18β-glycyrrhetinic Acid on Aquaporin 1,5 Expression in the Nasal Mucosa of Rats with Allergic Rhinitis
LIQiao,XIKe-hu,GUIYan,WANGYou-hu,ZHANG Fu-hong,CHENXiao-wan,JIANGYing,HOUYun,ZHANGXiao-bing
(Department of Ear-Nose-Throat,The First Hospital Associated to the Lanzhou University,Lanzhou 730000,China)
Objective To investigate the influence and its significance of 18β-glycyrrhetinic acid on the expression of aquaqporin 1,5(AQP1,5)in rat nasal mucosa with allergic rhinitis(AR).MethodsSixty Wistar rats were randomly divided into four groups:model control group,loratadine group,18β-glycyrrhetinic acid group and normal control group.Rats in model control group,loratadine group and 18β-glycyrrhetinic acid group were first induced for allergic rhinitis by dripping ovalbumin,and then were treated respectively.After 2 weeks,4 weeks,6 weeks,8 weeks and 10 weeks,the expression of AQP1,5 in the nasal mucosa of each group was investigated and compared by immunohisto chemical technique.ResultsThe distribution of AQP1,5 was consistentin allgroups.AQP lexpressed mainly in capillary and blood sinus endothelial cells,and fibrocytes.AQP5 expressed intensively in the membrane and cytoplasm of the epithelium in the glands,cilia,and ductal epithelial area.The statistical analysis of immunohistochemical staining showed that the quantity of AQP1,5 in model group was significantly higher than that in normal group(P<0.05),and with the extension of drug intervention time,the expression of AQP1,5 in loratadine group and 18β-glycyrrhetinic acid group were gradually decreased and almost equivalent to normal group.Conclusion18β-glycyrrhetinic may relieve symptoms of AR by down-regulating the expression of AQP1,5.
18-βglycyrrhetinic acid;aquaporin 1;aquaporin 5;allergic rhinitis;immunohistochemistry
R765.21
A
0258-4646(2015)11-0961-05
国家自然科学基金(81160449);甘肃省卫生厅行业科技计划(GSWST2011-06);甘肃省中医药科学技术研究课题(GZK-2011-22))
黎桥(1989-),女,硕士研究生.
张小兵,E-mail:790736924@qq.com
2014-12-29
网络出版时间:
