非离子型表面活性剂HS 15在药剂中的研究进展
2015-02-10张蕾訾鹏高洁张灿
张蕾,訾鹏,高洁, 张灿*
(1.中国药科大学新药研究中心,江苏 南京 210009;2.巴斯夫(中国)有限公司,上海 200137)
非离子型表面活性剂HS 15在药剂中的研究进展
张蕾1,訾鹏1,高洁2, 张灿1*
(1.中国药科大学新药研究中心,江苏 南京 210009;2.巴斯夫(中国)有限公司,上海 200137)
Kolliphor®HS 15(HS 15)是一种新型注射用增溶剂,具有强大的增溶能力和优良的安全性,可用于提高药物的溶解度、促进吸收以及增加生物利用度。综述HS 15在制剂中的应用、临床研究和基础研究进展,为其在药剂中的应用研究提供参考。
Kolliphor®HS 15;注射剂安全性;临床研究
Kolliphor®HS 15,又名Solutol®HS 15,是由德国巴斯夫公司开发并上市的新型非离子型增溶剂和乳化剂,由15 mol环氧乙烷和1 mol 12-羟基硬脂酸反应制得的15-羟基硬脂酸聚乙二醇酯,已被德国药典、英国药典、美国药典和欧洲药典收录,其中,在美国药典和欧洲药典中的化学名分别为polyoxyl 15 hydroxystearate和macrogol 15 hydroxystearate。
HS 15在室温时呈浅黄色至白色黏稠状,约30 ℃时变为液体,由于其临界胶束浓度仅为0.005% ~ 0.02%(质量分数),因此对多种难溶性药物都具有强大的增溶能力。近年来,HS 15得到了广泛的应用。国外已有多个含HS 15的制剂上市或正在进行临床试验。其在注射液的应用中表现出良好的安全性,在口服胶囊、注射用乳剂、眼用制剂和滴鼻液等各种剂型中也有广泛的研究。除良好的增溶能力和安全性外,HS 15在促进药物吸收和提高生物利用度方面也表现出了极大的优势。该产品的主要特点包括:①化学稳定性佳,经长时间加热再冷却后会发生物理分离成固液两相,经均质搅拌即可复原;②保质期长,在室温下(≤25 ℃)未开封的原始容器中,至少可保存24个月;③可耐受高温灭菌,HS 15水溶液可加热至121 ℃灭菌,加热过程中可能出现相分离,但只要对热溶液进行搅拌即可使其复原。
本文对HS 15在药剂中的应用及研究进展作一介绍,为其在药剂中的进一步应用提供参考。
1 上市产品及其临床研究进展
国外已上市含有HS 15的产品如表1所示,包括注射液、口服给药和皮下给药等剂型,其中注射液Panitol中HS 15的含量高达50%。另外,目前已知美国有5个正在进行临床研究的制剂中含有HS 15,其中3个为静脉注射给药,1个为鼻腔给药,1个为口服给药(见表2)。
临床数据表明,HS 15人体单次静脉注射给药的最大耐受剂量为8 g·d-1,比泊洛沙姆188耐受性更好(最大耐受剂量为2 960 mg·kg-1·d-1)[1]。
1.1 静脉给药
普那布林注射液中HS 15的含量占40%,在38名小细胞肺癌患者参加的Ⅰ期临床研究中,该注射液以5%的葡萄糖溶液稀释20~200倍,给药方案为4周1个循环,每个循环给药3次,分别在每个循环的第1、8和15 d给药1次,在15~30 min内静脉注射完毕。给药剂量从2 ~ 30 mg·m-2逐级递增,最终推荐Ⅱ期临床研究
的剂量为30 mg·m-2,在该剂量下可有效减少肿瘤血流(减少16% ~ 82%)、肿瘤疼痛以及其他机械性相关不良反应,临床未见与辅料相关的不良反应[2]。目前其Ⅱ期临床试验已完成[3-4],无安全性问题出现,将进行Ⅲ期临床试验。

表1 含HS 15的已上市产品Table1 The registered drug products containing HS 15
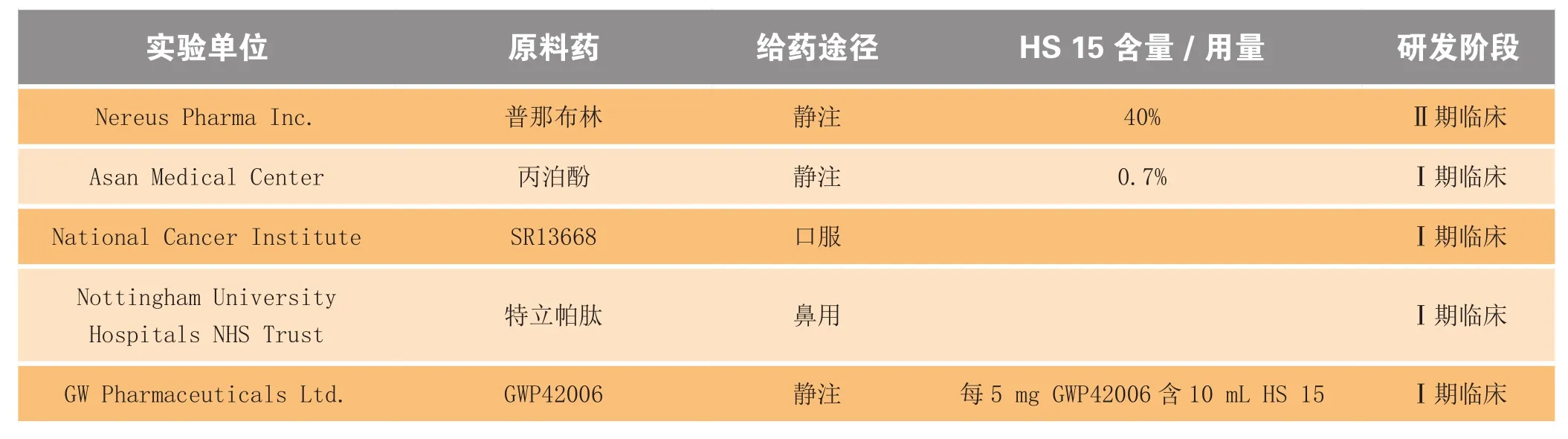
表2 在美国进行临床研究的含HS 15的制剂Table2 Preparations containing HS 15 in US clinical studies
AquafolTM为韩国大元制药公司研制的丙泊酚微乳,可避免含辅料长链三甘酯的丙泊酚乳剂(商品名:得普利麻)中脂质溶剂所引起的不良反应,包括感染、脂肪栓塞、高三酰甘油酯血症和胰腺炎。AquafolTM最初的处方含有8% HS 15和5%的Glycofurol。Sim等[5]的研究结果显示,AquafolTM注射时疼痛剧烈程度和频次均大于得普利麻,同时比较了2个制剂中游离丙泊酚的浓度,发现前者中游离丙泊酚浓度是后者的7倍,而通过评价AquafolTM中的辅料,发现HS 15等并不会引起疼痛,证实AquafolTM疼痛刺激较剧烈主要由游离药物引起。在美国进行的Ⅰ期临床研究在评价聚合物载体的安全性和耐受性时,发现该处方在健康志愿者身上会出现剂量限制性毒性,如注射部位疼痛及红肿、荨麻疹、感冒、头晕、呕吐以及体内总胆红素和乳酸脱氢酶升高等症状。后改用10%泊洛沙姆188和0.7% HS 15重新设计微乳处方进行临床研究,并考察药动学与药效学。结果发现新制备微乳AquafolTM与得普利麻生物等效,且在一定剂量范围内2种制剂的安全性及有效性基本无差异[1,6]。
1.2 口服给药
含100 g·L-1HS 15的口腔喷雾剂盐酸氨溴索(Ambrospray)由Cyathus Exquirere公司在奥地利上市。另有一种口服活性Akt抑制剂SR 13668的0期临床试验和Ⅰ期研究也已经完成。已公开的0期临床试验结果中,为了考察口服过程中食物对SR13668生物利用度的影响,分别比较了PEG 400 / Labrasol(体积比为1∶ 1)口服溶液、HS 15口服胶囊、HS 15 /维生素E聚乙二醇琥珀酸酯(Vitamin E TGPS)(质量比为1∶ 1)口服胶囊、VitaminE TGPS口服胶囊和Myrj 53口服胶囊5种制剂在饮食和禁食状态下SR13668的口服生物利用度[7]。18位
受试者参与随机试验,通过分析药动学数据发现,HS 15口服胶囊组在饮食和禁食状态下生物利用度均最高,且在饮食状态下AUC0-∞为122 ~ 439 µg·L-1·h-1,与其他处方有统计学显著差异(P= 0.007)。
1.3 鼻腔给药
用于治疗骨质疏松的人生长激素特立帕肽的Ⅰ临床期研究目前已经完成,其商品名为 CriticalSorbTM(主要辅料为HS 15)。生物标记物胰岛素生长因子诱导的初步数据显示CriticalSorbTM鼻腔给药的疗效与皮下注射时相当。Illum等[8]用有意识的大鼠模型对该制剂的吸收效率进行了研究。给予大鼠含不同浓度HS 15的人生长激素制剂,发现HS 15含量为10%的制剂在给药后2 h生物利用度可达49%,当HS 15与人生长激素质量比为4∶ 1时,对其促吸收的效果最佳。对大鼠反复鼻腔给药6个月后,组织病理学研究发现HS 15对鼻黏膜无毒性作用,表明HS 15是CriticalSorbTM有效且无毒的鼻腔吸收促进剂。此外,HS 15还可促进上皮细胞吸收,其作用包括细胞旁路和跨细胞转运双重机制,且未见细胞毒性,其对相对分子质量高达22 000的药物也能有效促渗[9]。
2 HS 15的基础研究进展
2.1 HS 15在不同给药途径中的应用
2.1.1 注射给药研究发现HS 15的溶血活性低于聚山梨酯 80,血清组胺释放水平和引起生物过敏的可能性远低于后者[10]。易红等[11]也进行了类似的研究,发现给小鼠静脉注射HS 15后测得其LD50为3.16 g·kg-1。豚鼠过敏性实验结果显示,与聚山梨酯80组相比,HS 15组血浆的组胺释放更低(60 min静脉注射后 HS 15组血清组胺水平为8 nmol·L-1,聚山梨酯80组为247 nmol·L-1),溶血性也较低(以增溶剂质量浓度为1%静脉注射后,HS 15组有1%红细胞溶解,聚山梨酯80组为4%);且由于HS 15本身黏度低,溶解的药物对溶液黏度几乎无影响,大大降低了注射给药刺激性,使注射含量达30%的HS 15而不引起疼痛成为可能。
市售的α-细辛脑注射剂(CA-ARE)增溶剂为聚山梨酯80和丙二醇,常出现严重的过敏性反应。Lu等[10]开发了一种新的使用HS 15作为增溶剂的α-细辛脑注射液(HS 15-ARE)。体内外研究发现,HS 15-ARE注射液性质稳定且呈现与CA-ARE同样的药动学特征;另一方面其还能减少聚山梨酯80引起的副作用,HS 15-ARE对哮喘的疗效强于CA-ARE,且在治疗过程中未发现过敏反应。
由于HS 15静脉注射安全性好,许多药剂工作者将HS 15作为静脉注射液增溶的首选。祁星星等[12]比较了HS 15、注射用聚山梨酯80和普通级聚山梨酯80对大鼠嗜碱性白血病细胞RBL-2H3的脱颗粒率及与人血清孵育后系统中人末端补体复合物SC5b-9的含量,评价了参麦注射液中增溶剂的致敏性。结果显示0.2%HS 15参麦注射液的稳定性与模拟市售制剂无显著性差异,且其溶血率较低,血管刺激性较小,HS 15的致敏性低于注射用和普通级聚山梨酯80。因此,HS 15具有更高的安全性,可取代市售参麦注射液中的聚山梨酯80。
聂飞等[13]对助溶剂可能影响注射液质量的关键因素(pH、可见异物、含量、溶液颜色、不溶性微粒)进行了研究,考察HS 15、高纯聚山梨酯80、普通聚山梨酯80溶液的稳定性及其对参麦注射液稳定性的影响。发现当HS 15在参麦注射液中用量为0.2%时可达到良好的助溶效果,且产品的质量和稳定性均符合要求。这些研究为使用HS 15替代中药注射液中常用的增溶剂聚山梨酯80提供了一定参考依据,两者的增溶原理相同,但前者的安全性更佳。
2.1.2 眼部给药Leonardi等[14]研究了眼用脂质纳米粒中表面活性剂的安全性,发现Tween 80和HS 15的最大耐受质量浓度为0.05 %,可认为完全没有刺激性,HS 15可在眼部给药的固体脂质纳米粒领域占有一席之地。刘睿等[15]考察了辛酸癸酸聚乙二醇甘油酯(labrasol)、HS 15、二乙二醇单乙基醚(transcutol P)对芒果苷离体角膜透过率的影响。采用离体扩散实验考察了不同体积分数的3种渗透促进剂对芒果苷角膜透过率的影响。结果显示:labrasol体积分数为1.0%、1.5%、2.0%、3.0%时,芒果苷的角膜表观渗透系数分别增加了1.80、3.27、3.41、4.76倍;HS 15体积分数为0.2%、0.4%时,芒果苷的角膜表观渗透系数分别增加了1.98、3.07倍,与对照组相比均具有显著性差异(P< 0.01);transcutol P体积分数为0.01%~0.03%时,芒果苷的角膜表观渗透系数并未增加。可见,HS 15促进眼角膜吸收的能力显著强于另外2种材料。
2.1.3 经鼻给药程艳珂等[16]利用平衡法测定了葛根素在不同溶剂及增溶剂中的平衡溶解度,通过蟾蜍体内纤毛毒性实验考察了溶剂和增溶剂的纤毛毒性,大鼠长期鼻黏膜刺激性实验考察了溶剂和增溶剂对鼻黏膜的刺激性。溶解度测定结果显示,30%聚乙二醇200和10% HS 15联用能使葛根素的溶解度达56.44 g · L-1,表现出良好的增溶效果。以生理盐水为阴性对照,有纤毛毒性的去氧胆酸钠为阳性对照,分别观察30%聚乙二醇200、30% 聚乙二醇400、10%HS 15及30%聚乙二醇 200与10% HS 15联用对蟾蜍上颚纤毛的影响,记录纤毛持续运动时间。结果显示,30%聚乙二醇200和10% HS 15与生理盐水相比纤毛持续运动时间无显著性差异。以生理盐水为对照,研究纤毛毒性较小的30%聚乙二醇200及10%HS 15的大鼠长期鼻黏膜刺激性。结果显示,该溶剂和增溶剂对鼻黏膜刺激性较小,与生理盐水相比,鼻黏膜上皮厚度及刺激指数无显著性差异,可见30%聚乙二醇200和10% HS 15能满足葛根素滴鼻液溶解度要求,纤毛毒性和刺激性小,可作为葛根素滴鼻液良好的溶剂和增溶剂。
2.2 HS 15在不同剂型中的应用
2.2.1 微乳微乳(microemulsion,ME)是水、油、表面活性剂和助表面活性剂按适当比例自发形成的各向同性、透明或半透明、略带乳光的、热力学和动力学稳定的胶体分散体系,粒径小于100 nm[17]。
由于ME中表面活性剂的用量较大(5%~30%),所以选择毒性低、乳化能力强的表面活性剂是制备ME的关键。非离子型表面活性剂具有毒性相对较低、受溶液pH和离子强度影响较小的优势,是制备ME时通常选用的表面活性剂,如增溶效果优良的聚氧乙烯蓖麻油(cremophor EL),但其缺点是易引起组胺释放、过敏性休克等不良反应。其他聚氧乙烯脂肪醇醚类非离子表面活性剂如卞泽、聚山梨酯类等,在高浓度静脉给药时易引起溶血,应尽量减小用量。与上述表面活性剂相比,HS 15(HLB=14 ~ 16)相容性更好,可用于乳剂的静脉给药,其30%溶液可实现无痛给药,且溶血作用低于聚山梨酯80[10]。如Date等[18]研究了基于HS 15乳化剂的3种丙泊酚ME,结果显示,以HS 15制得的丙泊酚ME疼痛刺激小于市售制剂 Propovan®。基于上述优点,目前有关采用HS 15制备ME的研究非常活跃。
Alexandre等[19]选择难溶性药物槲皮素(quercetin,QU)为模型药物,比较槲皮素微乳(QU- ME)和槲皮素混悬液(QU-SP)对气道过敏性炎症动物模型的抗炎效果。小鼠从首次使用卵清蛋白(OVA)免疫后的18天到第22天,每日口服QU-ME(3或10 mg·kg-1;在O / W微乳液中卵磷脂∶蓖麻油∶ HS15含量比为0.02∶ 0.2∶ 1),QU-SP(10 mg·kg-1,含0.5%羧甲基纤维素),以地塞米松作为阳性对照药物。HPLC-MS测定经口给予QU- SP或QU- ME后的大鼠血液中槲皮素代谢产物,结果显示,与QU- SP相比,QU- ME具有更好的口服吸收生物利用度。此外,QU-SP经口给药未能干扰白细胞募集,而QU-ME以剂量依赖方式抑制嗜酸性粒细胞募集至支气管肺泡灌洗液(BALF)。Q-ME也可显著降低IL-5和IL-4水平,但未能干扰CCL11、IFN和LTB4的水平。此外,QU- ME经口给药治疗过程中还可以抑制核转录因子κB(NF-κB)活化、P-选择素表达以及肺中产生黏液。该结果表明这种以HS 15作为乳化剂的QU微乳给药系统,在呼吸道过敏性炎症小鼠模型中表现出显著的抗炎性质。
Lazzari等[20]为水微溶性药物△9-四氢大麻(9-tetrahydrocannabinol,△9-THC)开发了不同给药途径的制剂,并评估了△9-THC制剂对疼痛的治疗效果。选用非离子表面活性剂HS 15制备了热力学性质稳定的△9-THC水包油微乳液体系。该体系中含0.2%的△9- THC,微乳样品在52 ℃下仍然稳定。通过腹腔及灌胃给药,在疼痛动物模型中表现出显著镇痛活性。相比其他对照制剂,微乳液起效更快,作用时间长,效果更加显著。
Scheller等[21]以水溶性差的能识别非肽GAL3受体的选择性拮抗剂SNAP 37889为模型药物,前期使用5%二甲基亚砜,用1%的羟丙基甲基纤维素盐溶解SNAP 37889,发现产生微悬浮现象,其增溶效果不太理想。随后他们对SNAP 37889注射液进行了改进,以30%的HS 15和磷酸钠缓冲液(0.01 mol·L-1,pH 7.4)作溶剂,在室温下用研钵将HS 15和SNAP 37889研磨成糊状,得到的混合物涡旋直至充分溶解,静置20 min后形成均一微乳。研究发现,该微乳经皮下注射后未出现疼痛和副反应,可进一步进行动物体内试验的研究;同时,使用30%HS 15增溶的SNAP 37889微乳剂的生
物利用度也可能因溶解度的提高而得到有效提高。
2.2.2 胶束邰文等[22]以磷脂和HS 15为药物载体,将紫杉醇制成新型聚合物胶束制剂(paclitaxel polymeric micelles,PPM)。PPM的抑瘤率为72.56%,抑瘤效果优于市售Taxol制剂(抑瘤率为58.28%)。生存周期实验中,PPM制剂组小鼠平均生存期为31.7 d,比Taxol制剂组(27.4 d)有所延长。在急性全身毒性实验中,PPM制剂组小鼠过敏反应严重程度低于Taxol制剂组,且恢复较快。实验中测得PPM制剂的LD50为43.970 mg·kg-1,高于市售制剂的33 mg·kg-1,表明PPM制剂的安全性有所提高。
2.2.3 囊泡类脂囊泡(niosomes)是由非离子型表面活性剂构成的、具有封闭双分子层的球形或椭球形的单室或多室结构[23]。由于类脂囊泡的结构与细胞膜的结构相似,故其在生物膜模拟、药物的封装和靶向释放、纳米粒子的合成以及微反应器等方面有着重要的应用价值。吕竹芬等[24]以司盘(Span)系列、HS 15等表面活性剂为膜材,以乙醇注入法制备多西他赛囊泡混悬液。采用正交设计筛选出的最优处方是:Span40∶ Span60∶HS 15∶ 胆固醇∶ 多西他赛的质量比为30∶ 10∶ 20∶ 3∶ 6。Span类是亲油性表面活性剂,单用此类类脂质为膜材时得到的冻干囊泡疏水性较大,难以复溶。在其中加入亲水性表面活性剂则可改善囊泡的复溶能力,实验结果表明当加入亲水性表面活性剂HS 15时,囊泡的复溶能力得以提高,且多西他赛囊泡的包封率也有所提高,制备的冻干制剂外观和再分散性也好。
2.2.4 球晶球晶是通过剪切脂质和表面活性剂的层状相得到的多层囊泡。它们由同心双层的两亲物和能够有效隔绝亲水药物的含水介质层交替组成。为实现其靶向性,球晶应具有较小的粒径并具有长循环作用。Simard等[25]用HS 15对球晶的结构进行了优化:其一,对球晶大小进行处方优化,获得小于300 nm的平均直径;其二,调节囊泡组合物使内容物体外泄漏量最小化;其三,球晶表面涂覆1,2-二硬脂酰-sn-甘油-3-磷脂酰乙醇胺-N- [甲氧基聚(乙烯乙二醇)](DSPE- PEG)以赋予其较长半衰期。随后,他们将聚乙二醇化的球晶(Phospholipon 90G / HS 15 /胆固醇/DSPE-PEG 2000或5000)中填装1- HD-阿糖呋喃胞嘧啶(Ara-C)并给大鼠静脉注射。根据血液浓度-时间曲线,比较聚乙二醇化的球晶、对照制剂未涂覆球晶和Ara-C溶液,发现聚乙二醇化的球晶呈现的长循环时间是未涂覆球晶的3.1~6.9倍;同时,聚乙二醇化的球晶在血液中Ara-C的包封率比对照制剂的高,注射后2 h,对照制剂中大多数药物从全身循环中清除,表明在未涂覆球晶中Ara-C从囊泡中迅速泄漏。此外,表面活性剂很大程度上影响着药物从球晶中的释放,研究发现,与含有聚山梨酯80的球晶相比,含有HS 15的球晶中药物释放的速度大大降低。
2.2.5 固体分散体Seo等[26]将姜黄素与HS 15制备成固体分散体(solid dispersion,SD),在生理pH条件下,姜黄素的溶解度显著提高。姜黄素在水中不稳定,研究表明,与Cremophor RH40和Kollidon 30相比,HS 15提高了药物在水性系统中的稳定性。通过差示扫描量热法和X-射线衍射表征聚合物基质中姜黄素的物理状态,发现SD制剂中姜黄素以无定形状态存在,促进了胶束整合,从而阻止其在水性介质中水解。大鼠药动学研究表明,与纯姜黄素相比,含HS 15的SD制剂其AUC0-12h提高了5倍,生物利用度显著增加,且在3个月内保持稳定。
3 结语
HS 15是一种增溶能力强、毒性低的新型辅料,主要用作增溶剂、乳化剂和促吸收剂等,已被广泛应用于各种剂型中。由于其良好的安全性,HS 15常被用于多种活性化合物的高通量筛选。此外,目前已有多个上市产品以及临床研究产品,为制剂研究提供了一种新的解决方案,其优势可总结为:①低组胺释放,使得不必在术前使用抗组胺药或皮质激素药物治疗成为可能;②低溶血活性;③卓越的生理耐受性;④可进行蒸汽灭菌,无需采用昂贵的无菌生产工艺;⑤强增溶能力使得用较小的体积注射高剂量药物成为可能;⑥即使在高浓度下黏度也较低,使注射含量达30%的HS 15不引起疼痛也成为可能;⑦除增溶外,口服给药时还可通过抑制P-gp、CYP3A酶和多药耐药酶,多重机制提高药物的生物利用度[27-28]。因此,积极开发和利用HS 15这一多功能新辅料,有利于提高产品的安全性和生物利用度,从而提升制剂的质量。
[1]Lee E H, Lee S H, Park D Y,et al.Physicochemical properties, pharmacokinetics, and pharmacodynamics of a reformulated microemulsion propofol in rats[J].Anesthesiology, 2008, 109(3): 436-447.
[2]Mita M M, Spear M A, Yee L K,et al.Phase 1 frst-in-human trial of the vascular disrupting agent Plinabulin (NPI-2358) in patients with solid tumors or lymp homas[J].Clin Cancer Res, 2010, 16(23): 5892-5899.
[3]Millward M, Mainwaring P, Mita A,et al.Phase 1 study of the novel vascular disrupting agent plinabulin (NPI-2358) and docetaxel[J].Invest New Drugs, 2012, 30(3): 1065-1073.
[4]Mita A C, Heist R S, Aren O,et al.Phase II study of docetaxel with or without plinabulin (NPI-2358) in patients with non-small cell lung cancer (NSCLC)[J].J Clin Oncol, 2010, 28(15): 7592-7592.
[5]Sim J Y, Lee S H, Park D Y,et al.Pain on injection with microemulsion propofol [J].Br J Clin Pharmacol, 2009, 67(3): 316-325.
[6]Kim K M, Choi B M, Park S W,et al.Pharmacokinetics and pharmacodynamics of propofol microemulsion and lipid emulsion after an intravenous bolus and variable rate infusion[J].Anesthesiology, 2007, 106(5): 924-934.
[7]Reid J M, Walden C A, Qin R,et al.Phase 0 clinical chemoprevention trial of the Akt inhibitor SR13668[J].Cancer Prev Res, 2011, 4(3): 347-353.
[8]Illum L, Jordan F, Lewis A L.CriticalSorb: a novel efficient nasal delivery system for human growth hormone based on Solutol HS15 [J].J Controlled Release, 2012, 162(1): 194-200.
[9]Brayden D J, Bzik V A, Lewis A L,et al.Critical Sorb™promotes permeation of flux markers across isolated rat intestinal mucosae and Caco-2 monolayers[J].Pharm Res, 2012, 29(9): 2543-2554.
[10]Lu H, Li J, Li M,et al.Systemic delivery of alpha-asarone with Kolliphor HS 15 improves its safety and therapeutic effect on asthma[J].Drug Deliv, 2015, 22(3): 266-275.
[11]易红, 高进, 杨华, 等.几种注射用表面活性剂的质量标准及安全性概述[J].中国实验方剂学杂志, 2010, 16(1): 115-119.
[12]祁星星, 李畅, 孙春萌, 等.一种以Kolliphor HS 15为增溶剂的参麦注射液的稳定性和安全性研究[J].中国新药杂志, 2014, 23(21):2536-2541.
[13]聂飞, 唐芳, 赵彬.15-羟基硬脂酸聚乙二醇酯在参麦注射液中的应用研究[J].中药与临床, 2014, 5(2): 42-44.
[14]Leonardi A, Bucolo C, Romano G L,et al.Influence ofdifferent surfactants on the technological properties andin vivoocular tolerability of lipid nanoparticles[J].Int J Pharm, 2014, 470(1): 133-140.
[15]刘睿, 刘志东, 舒乐新, 等.3种渗透促进剂对芒果苷离体角膜透过率的影响[J].中国中药杂志, 2010, 35(23): 3132-3135.
[16]程艳珂, 郭懿望, 尚可心, 等.以溶解度与刺激性为指标筛选葛根素滴鼻液溶剂及增溶剂[J].中国中药杂志, 2014, 39(22): 4335- 4339.
[17]刘洁, 何军, 张兵, 等.注射用微乳的研究进展[J].中国医药工业杂志, 2011, 42(4): 300-307.
[18]Date A A, Nagarsenker M S.Design and evaluation of microemulsions for improved parenteral delivery of propofol[J].AAPS PharmSciTech, 2008, 9(1): 138-145
[19]Alexandre P, Rogerio A, Cristiana L,et al.Anti-infammatory effect of quercetin-loaded microemulsion in the airways allergic inflammatory model in mice[J].Pharmacol Res, 2010, 61(4): 288-297.
[20]Lazzari P, Fadda P, Marchese G L,et al.Antinociceptive activity of 9-tetrahydrocannabinol non-ionic microemulsions [J].Int J Pharm, 2010, 393(1): 238-243.
[21]Scheller K J, Williams S J, Lawrence A J,et al.An improved method to prepare an injectable microemulsion of the galanin-receptor 3 selective antagonist, SNAP 37889,using Kolliphor®HS 15[J].MethodsX, 2014, 1:212-216.
[22]邰文, 孙敏敏, 刘楠, 等.应用动物活体生物发光技术观察紫杉醇混合胶束的抑瘤效果[J].药学学报, 2010, 45(4): 530-534.
[23]Vyas S P, Singh R P, Jain S,et al.Non-ionic surfactant based vesicles(niosomes) for non-invasive to pical genetic immunization against hepatitisB[J].Int J Pharm, 2005, 296(1): 80-86.
[24]吕竹芬, 刘立中, 黄红兵, 等.多西紫杉醇冻干泡囊的制备及其性质考察[J].中国新药杂志, 2009, 18(11): 90-93.
[25]Simard P, Hoarau D, Khalid M N.Preparation andin vivoevaluation of PEGylated spherulite formulations[J].Biochim Biophys Acta, 2005, 1715(1): 37-48.
[26]Seo S W, Han H K, Chun M K,et al.Preparation and pharmacokinetic evaluation of curcumin solid dispersion using Solutol®HS15 as a carrier[J].Int J Pharm, 2012, 424(1): 18-25.
[27]Kirtane A R, Kalscheuer S M, Panyam J.Exploiting nanotechnology to overcome tumor drug resistance:Challenges and opportunities[J].Adv Drug Deliv Rev, 2013, 65(13/14): 1731-1747.
[28]Balayssac D, Authier N, Cayre A,et al.Does inhibition of P-glycoprotein lead to drug-drug interactions? [J].Toxicol Lett, 2005, 156(3): 319-329.
Research Progress of Nonionic Surfactant HS 15 in Pharmaceutical Preparations
ZHANG Lei1, ZI Peng1, GAO Jie2, ZHANG Can1
(1.Center for Drug Discovery, China Pharmaceutical University, Nanjing 210009, China; 2.BASF (China) Co., Ltd., Shanghai 200137, China)
Kolliphor®HS 15 (HS 15) is a novel solubilizer for injections.With high solubilizing capacity and excellent safety, HS 15 has been used to increase drugs' solubility, enhance absorption and improve bioavailability.This paper reviewed the applications of HS 15 in marketed formulations as well as the progress in related clinical investigations and basic researches so as to provide reference for its application in pharmaceutical formulations.
Kolliphor®HS 15; safety of injection; clinical research
TQ423.2
A
1001-5094(2015)05-0370-06
接受日期:2015-03-08
*通讯作者:张灿,教授;
研究方向:药物新制剂与新技术及药用高分子材料;Tel:025-83271171; E-mail:zhangcan@cpu.edu.cn
