多糖高级结构解析方法的研究进展
2015-02-10徐航朱锐刘玮高向东
徐航,朱锐,刘玮,高向东
(中国药科大学生命科学与技术学院,江苏 南京 210009)
多糖高级结构解析方法的研究进展
徐航,朱锐,刘玮,高向东*
(中国药科大学生命科学与技术学院,江苏 南京 210009)
研究发现,多糖的生物活性不仅与其一级结构(如分支度、单糖组成及糖苷键连接方式等)有关,而且与其空间结构也密不可分。因此,对多糖高级结构的研究将有助于阐释其构效关系,为寻找具有生物活性的多糖和开发多糖药物提供理论依据。传统的多糖结构分析方法具有一定的局限性,已不能满足多糖研究的需求,而现代物理技术的发展则为多糖高级结构解析提供了新的手段。综述近年来多糖高级结构解析方法的研究进展。
多糖;高级结构;解析方法
多糖是一类由10个以上单糖通过糖苷键而形成的生物大分子,是构成生物有机体的4大基本物质之一。作为重要的生物活性物质,多糖具有免疫调节、抗肿瘤、抗凝血、降血糖等多种功能,在食品、药品、化妆品等领域均得到广泛应用[1-2]。而结构是多糖生物活性的基础,多糖的结构主要分为一级结构和高级结构。随着对多糖的研究不断深入,人们发现,相对于一级结构,多糖的高级结构与其活性之间的关系更为密切[3-4]。这一认识最早源于对β-葡聚糖的研究。Tao等[5]研究发现,呈现三螺旋结构的裂褶菌多糖具有较高的抗肿瘤活性,而具有相似一级结构的单螺旋β-葡聚糖却无此活性。对多糖结构的研究并没有止步于构象特征较为明显的螺旋结构上,近年来人们发现,硫酸化蛋白聚糖的抗肿瘤活性明显升高,其原因不仅在于化学修饰改善了分子的物理性质,如溶解性,更在于硫酸基团之间的排斥作用促使分子球体结构松散,暴露出某些功能基团,增强了分子与受体的相互作用[6]。除此之外,具有相对有序球体结构的枸杞多糖与絮状结构的枸杞多糖相比,具有更好的诱导肝癌细胞凋亡的活性[7]。尽管如此,目前对多糖高级结构与其活性关系的研究仍处于起步阶段,这不仅仅因为多糖自身结构的复杂性及其空间结构的多态性[8],更主要的是由于缺乏表征其高级结构动态变化的技术手段。
研究多糖高级结构的传统方法在应用中存在一定的局限性。如X-射线衍射法,它可以同时获得键角、键长、构型角等多方面的分子结构信息[9],但该技术要求样品结构必须高度有序且存在足量的微晶;而刚果红实验,操作简单,不需要特殊的仪器,较易普及,但是该方法只能作为判定样品是否为三螺旋结构的依据,无法对精密结构进行测定。现代物理技术的发展则推动了
多糖高级结构的研究,为多糖构效关系的研究提供了有力的技术手段,更为寻找具有生物活性的多糖和开发多糖药物提供了理论依据。本文对近年来多糖高级结构解析方法的研究进展作一综述。
1 基于高分子稀溶液理论的解析方法
目前,最常用的多糖高级结构解析方法是高效液相色谱(HPLC)与基于高分子稀溶液理论的动、静态光散射或黏度测定联用技术。Xu等[10]利用静态光散射法研究木耳葡聚糖的高级结构,结果根据多种定律及参数发现,木耳葡聚糖在水溶液中呈现刚性棒状构象。Li等[11]建立了一种HPLC与多种检测器(如多角度静态光散射仪、动态光散射仪、毛细管黏度仪及示差检测器等)联用的分析方法,从而实现了对β-葡聚糖聚集体与非聚集体的在线分离及实时检测,并将实验周期缩短至1周以内。
1.1 静态光散射法
HPLC-静态光散射(SLS)技术是一种简单有效的多糖高级结构解析方法[12],它依据高分子溶液光散射性质与分子质量、尺寸及浓度等相关特性,通过公式(1)可获取绝对分子质量(Mw)、分子质量分布(MWD)、回转半径(Rg)及构象等多种结构信息[13]。其中,光学常数K=[4π2n2(dn/dc)]NAλ4,n为溶液折光率,λ为激光光源波长,NA为阿伏伽德罗常数;c为高分子溶液浓度;θ为观测角度;A2为第二维利系数,其正值代表高分子处于理想溶剂中,负值则相反;Rθ=(Iθr2/I0),为瑞丽比值,I0与Iθ分别为入射光和散射光的强度,r为光源到测量点的距离。目前,大多数相关研究仍采用Zimm作图法进行数据处理[14],Zimm作图法属于一级拟合方式,需要大量的测量数据支持,且处理过程繁琐。而Renard等[15]采用二级拟合方式——Debye法进行数据分析,在保证准确性的同时又减少了实验周期。
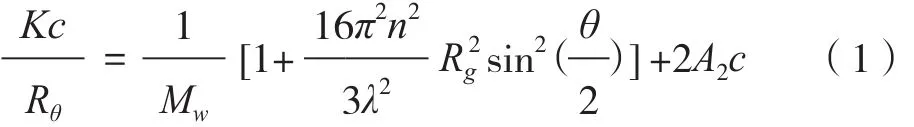
基于以上描述,利用Rg对Mw进行数据拟合,所得的斜率即为方程(2)的指数v,其为表征高分子构象的参数之一。通常,v值是0.2~0.4时,代表高分子为具有高分支的紧密卷曲构象;0.5~0.6时,为柔顺分子;0.6~1时,为刚性或半刚性棒状[16]。Yan等[17]利用HPLC-多角度激光光散射(MALLS)技术,以Rg和v为参考指标,解析羧基化凝胶多糖的构象。结果发现,超声作用在短时间内可使分子内或分子间的氢键断裂以及分子解聚、构象松散和半径增大,而随着超声时间的延长,分子内少量糖苷键发生断裂,半径减小,总体上多糖分子由刚性棒状转变为无规则线团状。
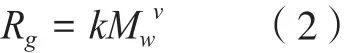
与v相似,分形维数df也是表征高分子内部结构紧密状态的参数,其计算方法采用公式(3)。当df为1时,代表多糖分子处于刚性棒状结构;5/3~2时,代表具有高斯线圈形态的线性高分子;2.5时,代表分支状结构;3时,代表紧密均匀的球形结构,且数值越大,内部结构越紧密[18-19]。

1.2 动态光散射法
动态光散射法(DLS)的基本原理是,高分子溶液存在分子热运动或布朗运动,散射体积中散射质点的位相关系随时间不断变化,使得散射光频率发生变化,且散射光强度也随时间不断起伏。因而,高分子溶液散射光强度Is(ω)随频率不断变化,符合劳化兹分布函数,其计算公式(4)中,I0(ω0)指频率为ω0时的入射光强度,C是溶液浓度,Г为峰的半高半宽。由于散射光强度随时间起伏,因而输出的光子数n是时间的函数:在时间间隔τ较小时,n(t)与n(t+τ)具有一定相关性,而τ较大时,n(t)与n(t+τ) 则相差甚远,不具备相关性。这种相关性可用G(2)(q,τ) 函数(5)表示,其中A为测量的基线值,β为常数,g(1)(q,τ)为自相关函数。对于多糖溶液,g(1)(q,τ)与峰的半高半宽Г相关,见等式(6),G(Г)为线宽分布函数,而Г又与高分子在溶液中的热扩散系数D相关,见等式(7),其中q为散射矢量。因此,水力学半径Rh就可以通过Stokes−Einstein方程式(8)计算得出,其中kB为玻尔兹曼常数,η0为溶剂黏度,T为热力学温度[20]。
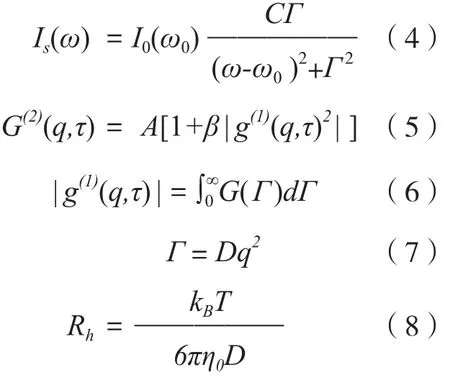
Rh是描述高分子在溶液中尺寸的重要参数,Rg则为高分子质心与转动轴距离的均方根值,高分子在稀溶液中的形态及刚性程度也可用ρ(Rg/Rh)来描述[21]。ρ值在0.77左右时,表明高分子聚合物为坚硬球体构象;1.0~1.1时,为高分支构象;1.5~1.8时,为柔顺型分子;大于2时,为蠕虫状或刚性结构。硫酸化的β-葡聚糖在0.9%氯化钠溶液中的ρ值为1.79,表明其呈柔顺的卷曲结构,与静态光散射法得出的结论基本一致[22]。
1.3 黏度法
指数α是高分子高级结构的特征参数,可以根据公式(9)计算得到,其中特性黏度[η]可以利用黏度仪,根据Huggins方程(10)与Kraemer方程(11),通过外推法获得。方程(9)、(10)和(11)中,K'为Huggins常数,K''为Kraemer常数,对于无规则卷曲构象,K'-K''=0.5;ηsp/C为比浓黏度;(Inηr)/C为特性黏度;K与α为高分子在给定温度、溶剂下的常数。对于球形结构,α一般为0.5左右;对于弹性无规则卷曲的构象,α通常在0.6~0.8范围内;对于刚性链构象,α一般大于0.8,甚至是1.0[23]。从冬虫夏草中分离得到的杂多糖在0.9%氯化钠溶液中的α值为0.42,说明其为球形结构,这与MALLS检测结果基本一致[24]。
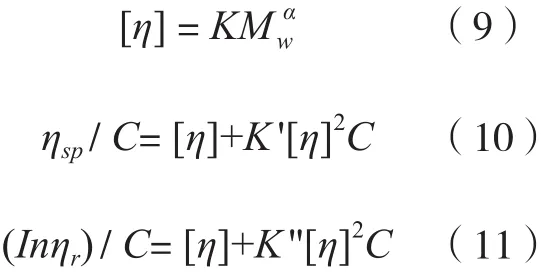
综上所述,从SLS法中得到的指数v和分形维数df,从DLS法中得到的参数ρ,以及从黏度法中得到的指数α,都可以从不同角度阐述多糖在溶液中的高级结构,因此,大量的研究将这3种方法联用,用于多糖高级结构的解析,其中最经典的实例当属对香菇多糖高级结构的研究。香菇多糖是由β-D-葡聚糖通过1→3糖苷键连接而成,在O-6位上连有吡喃型葡萄糖残基,其重复单元由5个β-(1→3)和2个β-(1→6)葡萄糖残基组成(见图1)。随着溶剂或温度的变化,香菇多糖可从三螺旋结构变成无规则卷曲的单链,Mw、Rg、Rh及[η]的改变即预示着其正从螺旋构象转变为无规则卷曲形态[25]。在低于0.05 mol·L-1的氢氧化钠溶液中,香菇多糖会以线性、圆形以及具有分支的三螺旋形态存在,而当氢氧化钠浓度高于0.08 mol·L-1时,该多糖就会变成单链结构,但这种转变的诱因可以通过透析的方法去除[26]。Xu等[27]发现,香菇多糖在二甲基亚砜(DMSO)溶液中会转变为单链卷曲构象,而且活性消失,说明三螺旋构象对香菇多糖的活性发挥至关重要。进一步的研究发现,香菇多糖的抗肿瘤机制主要包括:促进细胞凋亡与坏死;与DNA非特异性结合,抑制其解链、复制;抑制血管生成[28]。然而,作为多糖生物学的重要领域,多糖结构与活性的关系研究尚不完善,仍是我们今后努力的一大目标,但可以肯定的是,多糖结构的解析是实现这一目标的重要前提。
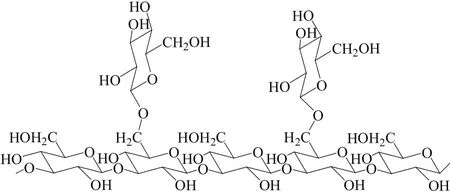
图1 香菇多糖重复单元结构Figure 1 The repeat unit structure of lentinan
2 差示扫描量热法
差示扫描量热法(DSC)是近几年在差热分析技术(differential thermal analysis,DTA)基础上发展起来的一种可用于多糖高级结构解析的方法[29],其不仅可以描述样品与参比物之间的温度变化,还可以实时记录热量差与温度之间的变化规律,常用于评价高聚物的热稳定性和相容性以及研究高分子物质之间的相互作用[30-31]。在给定温度下,每个体系总是趋向于达到自由能最小的状态,所以,在升温或降温的过程中,样品可转变成具有不同自由能的结构状态,而分析该过程的焓变化,就可以得到样品结构变化的某些信息。
不过,在多糖高级结构研究领域,DSC技术的应用还处于起步阶段。Liu等[32]运用该方法对灵芝多糖GLP20(ganoderma lucidum polysaccharide 20)的构象转变过程进行研究,结果,在DSC加热曲线中,吸热峰表明分子间氢键断裂,GLP20从三螺旋结构转变为单链无规则卷曲构象,而在冷却后再加热过程中,吸热峰随着扫描次数的增加而逐渐变小,表明超过135 ℃加热所导致的构象转变是不可逆的。DSC技术同样可
以对复合物的高级结构进行研究,如应用该技术进行的研究表明,随着环境的变化,卡拉胶会从螺旋构象转变为无规则线团形态,而与高分子物质结合后,由于空间位阻的存在,其不能发生正常的折叠[33]。因此,可以将DSC曲线中是否出现较大吸热峰作为评价一种药物传递系统——卡拉胶与聚甲氨基磷腈复合物是否稳定的重要指标[34]。
3 原子力显微镜法
目前,原子力显微镜(atomic force microscope, AFM)已成为可在纳米级别上直观表征生物大分子表面形貌及空间分布的一种重要计量工具,它的应用可避免样品的损坏,提高观测的准确度[35]。AFM成像原理是,在保持弹性悬臂形变而量不变的情况下,末端针尖会随着样品表面的起伏而上下移动,记录针尖上下运动的轨迹,即得到样品表面形貌。Zhang等[36]利用AFM成像技术,对香菇多糖LT1进行结构分析,结果发现,直链及支链螺旋形态为其主要结构特征。得益于原子质量级探针,AFM可以实现单个生物大分子的观察。Li等[11]利用AFM技术,对不同浓度的t-β-D葡聚糖在纯水中的结构进行研究。结果显示,在低浓度下,t-β-D葡聚糖以刚性直链形式存在,平均宽度为1.19 nm,根据理论模型计算的链长度(L,MW/ML)为770 nm,这与透射电子显微镜(transmission electron microscopy,TEM)观察结果一致;t-β-D葡聚糖在水中,随着浓度的增大,会发生聚集,并通过链之间的交联、重叠,形成具有3D网状的微凝胶。AFM技术对于从分子水平上解析多糖结构的改变及研究超分子结构来说,也是一种有力的手段。黄原胶是广泛用作药物缓释和医用材料、食品添加剂等的一种高分子材料,采用AFM技术可观察到,其在固态或水溶液中都呈现半柔顺的双螺旋结构,而在较高浓度下,其多个分子相互缠绕、折叠,最终形成紧密稳定的网状超分子结构[37]。
4 其他
除了上述方法以外,还有以下一些方法可用于多糖高级结构的分析,但它们并不具备通用性,目前只能用作多糖高级结构解析的补充方法。
圆二色谱(circular dichroism, CD)是一种可用于测定分子不对称结构的光谱法,目前已成功应用于蛋白质高级结构的解析[38]。多糖高级结构的转变会影响其中羧基、乙酰基、氨基等生色团的极化性、取向性以及静态力的改变,从而使CD在200~400 nm范围内发生显著变化[39]。基于此,CD为研究多糖等生物大分子高级结构转换提供了一种简便有效的方法。Zhao等[40]根据CD中的正负科顿效应,解析了在溶剂种类、温度、pH以及离子强度的影响下五味子多糖高级结构的转变。Wang等[41]则将硫酸化前后的沙蒿多糖进行CD对比,发现硫酸化后的多糖吸收光谱发生明显的红移现象,这多数是由S=O造成的;而且,结合MALLS等其他方法,进一步证实在负电荷引入过程中多糖高级结构发生了转换。
荧光相关光谱(fluorescence correlation spectroscopy, FCS)是一种灵敏度较高的单分子检测技术,主要用于测定高分子物质在溶液中的扩散系数,而扩散系数与观测区域的高分子物质浓度及尺寸相关,因此可用于研究浓度低至10-9mol·L-1的多糖分子的构象及尺寸。用罗丹明标记的裂褶菌多糖在水中的扩散系数为(7.6±0.4)×10-8mol·L-1,明显低于右旋糖酐,提示两者在水中的构象不同,这与实际情况相符,即裂褶菌多糖为三螺旋杆状,而右旋糖酐展现为无规则的卷曲形态。利用FCS测得裂褶菌多糖在0.1 mol·L-1硼酸溶液(pH 9.3)中的链长为175 nm左右,明显小于其在水中的尺寸,这主要是因为离子的存在使得多糖分子内或分子间的氢键发生断裂[42]。
核磁共振波谱(nuclear magnetic resonance spectrum, NMR)除了可以作为生物大分子一级结构解析的关键技术之外,有时还可以成为多糖高级结构研究的辅助性工具。Panagos等[43]通过对岩藻糖化硫酸软骨素三糖重复单元进行二维NMR图谱解析及耦合常数测定,发现其在水溶液中倾向于形成刚性棒状构象。
5 结语与展望
SLS、DLS与黏度法是目前研究多糖高级结构的主要手段,可以从多个角度综合评价多糖分子在不同条件下的主要结构特征。而单分子AFM技术的优势主要体现在视觉上的直观性,CD及DSC技术则更多的用于描述不同环境下多糖分子高级结构的变化过程,至于FCS
与NMR,主要用作辅助性分析手段。其实,上述这些多糖高级结构的分析方法在蛋白质、核酸等其他生物大分子领域的应用都已较为成熟,而由于多糖发展的滞后性及本身结构的复杂性,导致目前仍无一种方法能单独用于多糖高级结构的全面解析,因此,将多种分析方法相结合,不失为多糖高级结构解析的良策,可以提高多糖结构表征的准确性。从研究对象的角度来看,迄今为止,对高级结构的研究主要集中于一级结构相对简单的多糖分子上,如葡聚糖等,而对于那些单糖组成、连接方式等较为复杂的杂多糖涉猎较少。这可能因为杂多糖内部均一性相对较差,给数据的处理及图谱的解析带来了较大困难。Lundborg等[44]建立了计算机辅助液态核磁图谱解析技术,可通过图谱比对及耦合常数计算,对糖蛋白上的糖链及常规菌类多糖的一级结构进行分析。对于多糖的高级结构,特别是与已知结构蛋白相互作用的多糖分子,Rynkiewicz等[45]则采用计算机分子对接及分子动力学模拟技术,对其高级结构进行预测。当然,计算机辅助结构研究目前尚处在起步阶段,只能用来对少量糖类物质进行分析,但随着分析技术的发展,计算机预测与多种分析方法的结合将为多糖高级结构解析提供更准确更简便的新策略。
[1]Senthilkumar K, Kim S K.Anticancer effects of fucoidan[J].Adv Food Nutr Res, 2014, 72: 195-213.
[2]Zhu L, Tang Q, Zhou S,et al.Isolation and purification of a polysaccharide from the caterpillar medicinal mushroom Cordyceps militaris (Ascomycetes) fruit bodies and its immunomodulation of RAW 264.7 macrophages[J].Int J Med Mushrooms, 2014, 16(3): 247-257.
[3]Zhang B, Leung WK, Zou Y,et al.Immunomodulating polysaccharidesfrom Lessertia frutescens leaves: isolation, characterization and structure activity relationship[J].J Ethnopharmacol, 2014, 152(2):340-348.
[4]Patel B K, Campanella O H, Janaswamy S,et al.Impact of urea on the three-dimensional structure, viscoelastic and thermal behavior of iotacarrageenan[J].Carbohydr Polym, 2013, 92(2): 1873-1879.
[5]Tao Y, Zhang R, Yang W,et al.Carboxymethylated hyperbranched polysaccharide: synthesis, solution properties, and fabrication of hydrogel[J].Carbohydr Polym, 2015, 128: 179-187.
[6]Tao Y Z, Zhang Y Y, Zhang L N.Chemical modifcation and antitumor activities of two polysaccharide-protein complexes fromPleurotus tuber-regium[J].Int J Biol Macromol, 2009, 45(2): 109-115.
[7]Zhang M, Tang X, Wang F,et al.Characterization ofLycium barbarumpolysaccharide and its effect on human hepatoma cells[J].Int J Biol Macromol, 2013, 61(10): 270-275.
[8]Zhang L, Zhang M, Dong J,et al.Chemical structure and chain conformation of the water-insoluble glucan isolated fromPleurotus tuber-regium[J].Biopolymers, 2001, 59(6): 457-464.
[9]Chuang L, Panyoyai N, Shanks R,et al.Effect of sodium chloride on the glass transition of condensed starch systems[J].Food Chem, 2015, 184(10): 65-71.
[10]Xu S, Xu X, Zhang L.Branching structure and chain conformation of water-soluble glucan extracted fromAuricularia auricula-judae[J].J Agric Food Chem, 2012, 60(13): 3498-3506.
[11]Li S, Huang Y, Wang S,et al.Determination of the triple helical chain conformation of β-glucan by facile and reliable triple-detector size exclusion chromatography[J].J Phys Chem B, 2014, 118(3): 668-675.
[12]Jayme M O, Ames F Q, Bersani-Amado C A,et al.Primary characterization and evaluation of anti-ulcerogenic activity of an aqueous extract from callus culture of Cereus peruvianus Mill[J].Curr Pharm Biotechnol, 2015, 16(5): 462-467.
[13]Xu S, Xu X, Zhang L.Effect of heating on chain conformation of branched β-glucan in water[J].J Phys Chem B, 2013, 117(28): 8370-8377.
[14]Tao Y, Yan Y, Xu W.Shrinking factors of hyperbranched polysaccharide from fungus[J].Carbohydr Res, 2009, 344(11): 1311-1318.
[15]Renard D, Lepvrier E, Garnier C,et al.Structure of glycoproteins from Acacia gum: an assembly of ring-like glycoproteins modules[J].Carbohydr Polym, 2014, 99: 736-747.
[16]Shakun M, Maier H, Heinze T,et al.Molar mass characterization of sodium carboxymethyl cellulose by SEC-MALLS[J].Carbohydr Polym, 2013, 95(1): 550-559.
[17]Yan J K, Pei J J, Ma H L,et al.Effects of ultrasound on molecular properties, structure, chainconformation and degradation kinetics of carboxylic curdlan[J].Carbohydr Polym, 2015, 121: 64-70.
[18]Huang L, Zhang L, Huang X,et al.Study of the α-conformation of the conjugated polymer poly(9,9-dioctylfluorene) in dilute solution[J].J
Phys Chem B, 2014, 118(3): 791-799.
[19]Sillrén P, Swenson J, Mattsson J,et al.The temperature dependent structure of liquid 1-propanol as studied by neutron diffraction and EPSR simulations[J].J Chem Phys, 2013, 138 (21): 214501.
[20]Rolland-Sabaté A, Guilois S, Grimaud F,et al.Characterization of hyperbranched glycopolymers producedin vitrousing enzymes[J].Anal Bioanal Chem, 2014, 406(6): 1607-1618.
[21]Shao L, Wu Z, Tian F,et al.Molecular characteristics of an exopolysaccharide fromLactobacillus rhamnosus KF5in solution[J].Int J Biol Macromol, 2015, 72: 1429-1434.
[22]Chen C, Wu W, Xu X,et al.Chain conformation and anti-tumor activity of derivatives of polysaccharide fromRhizoma Panacis Japonici[J].Carbohyd Polym, 2014, 105: 308-316.
[23]Arinaitwe E, Pawlik M.Dilute solution properties of carboxymethyl celluloses of various molecular weights and degrees of substitution[J].Carbohyd Polym, 2014, 99: 423-431.
[24]Wu D T, Meng L Z, Wang L Y ,et al.Chain conformation and immunomodulatory activity of ahyperbranched polysaccharide fromCordyceps sinensis[J].Carbohydr Polym, 2014, 110: 405- 414.
[25]Zhang Y Y, Li S, Wang X H,et al.Advances in lentinan: isolation, structure, chain conformation and bioactivities[J].Food Hydrocolloid, 2011, 25(2): 196-206.
[26]Li S, Zhang Y, Xu X, et al.Triple helical polysaccharide-induced good dispersion of silver nanoparticles in water[J].Biomacromolecules, 2011, 12(8): 2864-2871.
[27]Xu X, Wang X, Cai F,et al.Renaturation of triple helical polysaccharide lentinan in water-diluted dimethylsulfoxide solution[J].Carbohydr Res, 2010, 345(3): 419- 424.
[28]Ren L, Perera C, Hemar Y.Antitumor activity of mushroom polysaccharides: a review[J].Food Funct, 2012, 3(11): 1118-1130.
[29]Taouti M B, Suffren Y, Leynaud O,et al.Structures, thermal behaviors, and luminescent properties of anhydrous lanthanum iodate polymorphs[J].Inorg Chem, 2015, 54(7): 3608-3618.
[30]Suvakanta D, Narsimha M P, Pulak D,et al.Optimization and characterization of purified polysaccharide fromMusa sapientumL.as a pharmaceutical excipient[J].Food Chem, 2014, 149(8): 76-83.
[31]Kelidari H R, Saeedi M, Akbari J,et al.Formulation optimization andin vitroskin penetration of spironolactone loaded solid lipid nanoparticles[J].Colloids Surf B Biointerfaces, 2015, 128: 473-479.
[32]Liu Y, Zhan J, Tang Q,et al.Physicochemical characterization of a high molecular weight bioactive β-D-glucan from the fruiting bodies ofGanoderma lucidum[J].Carbohyd Polym, 2014, 101: 968-974.
[33]Yang M, Wu Y, Li J,et al.Binding of curcumin with bovine serum albumin in the presence of ι-carrageenan and implications on the stability and antioxidant activity of curcumin[J].J Agric Food Chem, 2013, 61(29): 7150-7155.
[34]Grinberg V Y, Burova T V, Grinberg N V,et al.Conformational energetics of interpolyelectrolyte complexation between ι-carrageenan and poly(methylaminophosphazene) measured by high-sensitivity differential scanning calorimetry[J].Langmuir, 2011, 27(12): 7714-7721.
[35]Kong L, Yu L, Feng T,et al.Physicochemical characterization of the polysaccharide fromBletilla striata: effect of drying method[J].Carbohyd Polym, 2015, 125: 1-8.
[36]Zhang Y, Gu M, Wang K,et al.Structure, chain conformation and antitumor activity of a novel polysaccharide fromLentinus edodes[J].Fitoterapia, 2010, 81(8): 1163-1170.
[37]Liang H, Zeng G, Li Y,et al.Exploring the complex mechanical properties of xanthan scaffolds by AFM-based force spectroscopy[J].Beilstein J Nanotechnol, 2014, 5: 365-373.
[38]Tedesco D, Bertucci C.Induced circular dichroism as a tool to investigate the binding ofdrugs to carrier proteins: classic approaches and new trends[J].J Pharm Biomed Anal, 2015 Feb 19.pii: S0731-7085(15)00120-X.doi: 10.1016/j.jpba.2015.02.024.[Epub ahead of print].
[39]Sanandiya N D, Siddhanta A K.Chemical studies on the polysaccharides ofSalicornia brachiata[J].Carbohydr Polym, 2014, 112: 300-307.
[40]Zhao T, Mao G, Zhang M,et al.Structure analysis of a bioactive heteropolysaccharide fromSchisandra chinensis(Turcz.) Baill[J].Carbohydr Polym, 2014, 103: 488-495.
[41]Wang J L, Niu S F, Zhao B T,et al.Catalytic synthesis of sulfated polysaccharides II: comparativestudies of solution conformation and antioxidant activities[J].Carbohydr Polym, 2014, 107: 221-231.
[42]Meunier F, Wilkinson K J.Nonperturbing fluorescent labeling of polysaccharides[J].Biomacromolecules, 2002, 3(4): 857-864.
[43]Panagos C G, Thomson D S, Moss C,et al.Fucosylated chondroitin sulfates from the body wall of the sea cucumberHolothuria forskali[J].J Biol Chem, 2014, 289(41): 28284-28298.
[44]Lundborg M, Widmalm G.Structural analysis of glycans by NMR chemical shift prediction[J].Anal Chem, 2011, 83(5): 15514-1517.
[45]Rynkiewicz M J, Lu Z, Hui J H,et al.Structural analysis of a protective epitope of the francisella tularensisO-polysaccharide[J].Biochemistry, 2012, 51(28): 5684-5694.
Research Progress in Analytical Methods for Advanced Structures of Polysaccharides
XU Hang, ZHU Rui, LIU Wei, GAO Xiangdong
(School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China)
It has been found that the bioactivities of polysaccharides are not only dependent on their primary structures, such as branched degrees, monosaccharide compositions and glycosidic linkage modes, but also closely related to their spatial structures.Therefore investigation on advanced structures of polysaccharides could contribute to the elucidation of their structure-activity relationships, and provide theoretical evidence for the screening of bioactive polysaccharides and the development of polysaccharide drugs.Traditional structure analysis methods for polysaccharides can no longer meet the needs of polysaccharides research because of certain limitations, while the development of modern physical techniques has provided new strategies of advanced structure analysis for polysaccharides.The current research progress in analytical methods for advaneed struetures of polysaccharides was reviewed.
polysaccharide; advanced structure; analytical method
Q539;R284.1
A
1001-5094(2015)05-0364-06
接受日期:2015-04-01
项目资助:国家“重大新药创制”科技重大专项资助项目(No.2012ZX09502001-004);江苏高校优秀科技创新团队(多糖类药物研发关键技术)资助项目
*通讯作者:高向东,教授;
研究方向:生物大分子结构与功能;
Tel:025-83271298; E-mail:xdgao@cpu.edu.cn
