黑果枸杞化学成分研究进展
2015-02-10夏园园莫仁楠曲玮柳文媛
夏园园,莫仁楠,曲玮,柳文媛*
(1.中国药科大学药物分析教研室,江苏 南京210009;2.中国药科大学天然药物化学教研室,江苏 南京 210009)
黑果枸杞化学成分研究进展
夏园园1,莫仁楠1,曲玮2,柳文媛1*
(1.中国药科大学药物分析教研室,江苏 南京210009;2.中国药科大学天然药物化学教研室,江苏 南京 210009)
黑果枸杞是一种独特的药食两用植物,具有抗氧化、抗动脉粥样硬化、增强免疫力、抗衰老、降血脂等药理作用。综述近年来黑果枸杞的化学成分、生物活性、提取方法和质量分析等方面的研究进展,为黑果枸杞药效成分的进一步开发和利用提供参考。
黑果枸杞;化学成分;生物活性;检测方法
黑果枸杞(Lycium ruthenicumMurr.)为茄科枸杞属多年生灌木,广泛分布于中国西北部的盐化沙漠地区,集中产地为中国的青海省和新疆维吾尔自治区,是一种独特的药食两用植物[1-2]。黑果枸杞在藏药中称为“旁玛”,其味甘、性平、清心热,西藏医药名著《晶珠本草》将其列为传统珍贵中药。黑果枸杞不仅可直接食用或作饮品原料,还可入药用于治疗心脏病、高血压、月经不调、更年期紊乱、癣疖、尿道结石、牙龈出血等[3]。现代药理学研究也表明,其具有抗氧化、抗动脉粥样硬化、增强免疫力、降血脂、抗衰老等作用[4-7]。
黑果枸杞的化学成分复杂,富含枸杞多糖、色素、脂肪酸、挥发油、维生素、酚酸、甜菜碱、微量元素等多种成分。本文对黑果枸杞的化学成分、生物活性、提取方法和质量分析等诸多方面进行综述,为更好地开发利用此资源提供参考。
1 黑果枸杞多糖
黑果枸杞味甜、多汁,富含糖类。现代药理学研究表明,多糖是中草药发挥独特疗效的重要物质基础。黑果枸杞多糖(Lycium ruthenicumglycoconjugate polysaccharide,LRGP)不仅可作为能源物质,其在生物体内也具有多种生物活性,是黑果枸杞的主要功能组分。
1.1 黑果枸杞多糖的生物活性
1.1.1 抗疲劳作用负重游泳试验是评价抗运动性疲劳的重要指标。汪建红等[8]和Ni等[9]采用小鼠负重游泳试验研究均发现,黑果枸杞多糖具有明显的抗疲劳生物活性。
1.1.2 降血糖作用汪建红等[10]采用预防性灌胃黑果枸杞多糖溶液后再造模与先造模再治疗性灌胃黑果枸杞多糖溶液两种方法,研究黑果枸杞多糖对糖尿病的预防和治疗作用,结果显示,黑果枸杞多糖能显著降低糖尿病小鼠的血糖含量。
1.1.3 消炎作用对黑果枸杞分离、纯化后,Peng等[11]对其纯化多糖的生物活性进行了研究,发现黑果枸杞复合多糖LRGP3通过阻断TLR4/NF-κB信号通路来缓解或消除脂多糖 (LPS) 诱导的炎症。
1.1.4 抗氧化活性Liu等[4]通过测定对二苯代苦味酰基(DPPH)、过氧化氢、超氧负离子自由基的清除率来研究LRGP的抗氧活性,结果表明,LRGP可作为功能食品和药物的新型天然抗氧剂。
1.2 黑果枸杞多糖的提取与纯化
1.2.1 黑果枸杞多糖的提取工艺白红进等[12]采用不同方法(包括常规水浴法、微波法、超声法和超声-微波协同萃取法等)提取黑果枸杞多糖,再用蒽酮-硫酸比色法测定其含量,其中只有超声法未加热,其他三种方法均在加热条件下提取多糖。结果显示,4种方法的提取效果依次为超声-微波协同萃取法>常规水浴法>微波法>超声法。提示,黑果枸杞多糖的提取可能受温度的影响,提取时宜采用加热方法。但温度过高,又会使多糖降解、生物活性降低,故为提高黑果枸杞多糖的提取率,需对提取条件进一步优化。
鲁小静等[13]采用单因素试验,考察热水浸提法中提取温度、料液比和提取时间对多糖提取率的影响;再结合响应面分析法(response surface methodology,RSM)优化黑果枸杞多糖的提取工艺;确定了多最佳提取条件为热水温度90 ℃、料液比1∶25(g∶mL)、时间66 min,黑果枸杞多糖得率为29.36 %。陈亮等[14]则在单因素试验的基础上,利用Box-Behnken设计和响应面分析法,对超声浸提法提取黑果枸杞多糖的工艺进行了合理优化。RSM的优点为可对连续的而非一个个独立的试验点进行分析,以确立最佳试验条件,且所得数据准确、可靠,具有实用价值;缺点为需确保最佳的试验条件包含在设计的试验点中,若试验点选取不当,则得到的优化结果不理想,此外还需选择合适的评价指标,如某类成分的含量或损失量等。故RSM适用于黒果枸杞单类成分的提取优化,对于黒果枸杞水提、醇提等粗提液总体成分的提取优化,很难选择合适的评价指标,RSM不太适用。
Liu等[4]采 用 动 态 微 波 辅 助 萃 取(dynamic microwave-assisted extraction,DMAE)技术提取黑果枸杞多糖;用Box-Behnken设计和基于单因素试验的响应面法优化提取条件;优化后的提取条件为料液比31.5 mL·g-1、提取时间25.8 min、微波功率544.0 W。动态微波辅助萃取法的提取量大、选择性好、速度快,是一种能量和溶剂低消耗的环境友好型提取法;与热水浸提法相比,其多糖得率相近或更高。但热水浸提法操作简单、安全,虽提取时间较长、效率较低,因其提取成本低和干扰物质少或易除去的优点,目前仍是植物多糖提取的常用法。
1.2.2 黑果枸杞多糖的纯化工艺马玉婷等[15]采用基于单因素试验的响应面法,对黑果枸杞酒渣多糖的大孔树脂精制工艺进行了优化,获得其最佳吸附条件和解吸附条件。彭强等[16]研究黑果枸杞水溶性多糖的纯化工艺,结果显示,其最佳脱蛋白方法为三氯乙酸法,最佳脱色方法为过氧化氢法。
1.3 黑果枸杞多糖的结构表征
目前从黑果枸杞中分离、纯化了水溶性多糖LRGP1[17]、阿拉伯半乳聚糖蛋白(LRGP3)[18]、LRGP4-A[19]和免疫活性果胶(LRGP5)[20],并对其进行结构表征(基本实验流程见表1),其中LRGP1-4为中性多糖,LRGP 5为酸性多糖。
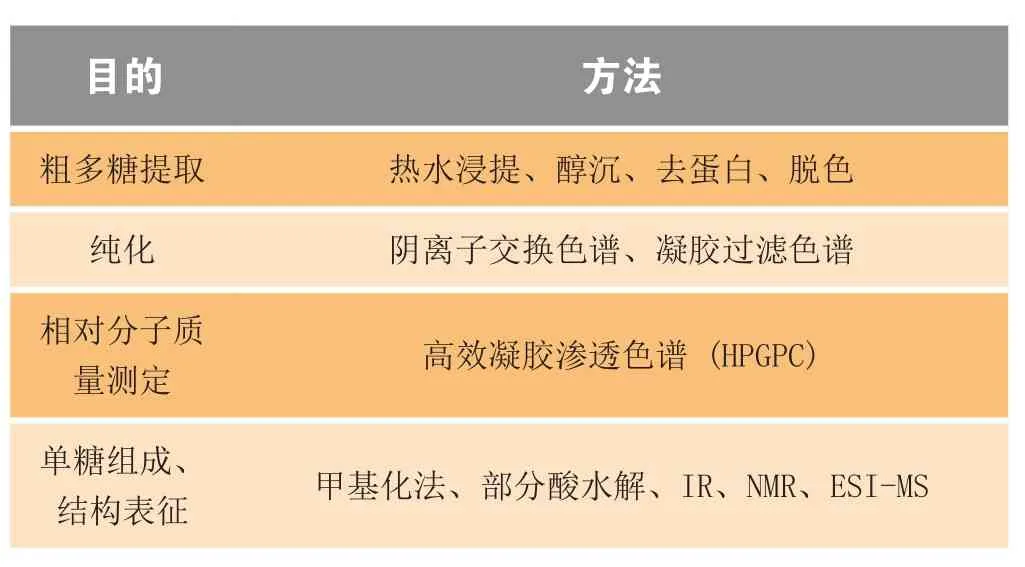
表1 黑果枸杞多糖结构表征的实验流程Table1 Experimental procedures for structural characterization of LRGP from Lycium ruthenicum Murr.
黒果枸杞多糖相对分子质量大、结构复杂、多含支链,故对其分析较困难。结构表征时,需先运用部分酸水解法等将多糖分解成相对分子质量较小的多糖或寡糖,才可进行色谱光谱联用分析以确定其单糖组成、糖苷键的类型和位置。纯度测定也是多糖分析的基本项目之一,经纯度确定的黒果枸杞纯化多糖,可进行药理或体内实验,进一步研究其构效关系。
1.4 黑果枸杞多糖的含量测定
测定黑果枸杞多糖含量多采用经典的苯酚-硫酸法[21],但该法只能测定总糖的含量,且易受其他还原性物质的干扰。超高效液相-蒸发光散射(UPLC-ELSD)法可进行梯度洗脱,适用于黒果枸杞多糖的分析[22],但灵敏度不高。
2 黑果枸杞色素
2.1 黑果枸杞色素的生物活性
黑果枸杞色素(L.ruthenicumpigment)具有延缓衰
老、抗氧化、调节血脂、预防动脉粥样硬化等多种生物活性[5,7,23],且安全、无毒[24],可作为药食两用的天然色素使用。
花色苷类色素是黒果枸杞色素的主要组成部分,花青素是花色苷的苷元,自然条件下游离状态的花青素极少见,主要以糖苷形式存在,原花青素在植物体内可转化成花青素,二者均为多酚类的类黄酮化合物。花色苷类色素耐热、耐光、耐酸,稳定性较好,不受蔗糖和防腐剂苯甲酸钠的影响,且有较强的浸染能力[25],可应用于医药、食品、化妆品等。类胡萝卜素也是黑果枸杞浆果中含有的一类重要天然色素,其不溶于水,是一种脂溶性色素,在保护组织抗光氧化方面起重要作用。
2.2 黑果枸杞色素的提取与纯化
2.2.1 黑果枸杞色素的提取工艺通过比较常规水浴法、超声波提取、微波提取和超声-微波协同萃取这4种方法对黑果枸杞色素提取率的影响发现,超声-微波协同萃取法的提取效果最好,常规水浴法次之,微波法最差[26]。柳福智等[27]通过单因素和多因素正交试验对影响提取物中黑果枸杞色素含量的各因素进行了研究,获得其最佳提取工艺条件为5%盐酸和 85%乙醇混合溶剂作浸提剂、溶剂比 1∶1、提取温度 70 ℃、提取时间4 h、固液比1∶20。酶解法[28]也是黑果枸杞花色苷的有效提取方法之一。
2.2.2 黑果枸杞色素的纯化工艺为获得黑果枸杞色素的精制品,还需优化精制工艺对其粗提物进一步纯化,以除去多糖等杂质。王丽玲等[29]利用均匀实验设计法,考察了pH值、料液浓度和树脂径高比对大孔树脂吸附色素的影响,以及pH值、乙醇浓度和洗脱剂速度对大孔树脂解析色素的影响,优化出AB-8大孔树脂对黑果枸杞色素动态吸附和动态解析的最佳纯化条件。
2.3 黑果枸杞色素的结构表征
Zhao等[30]经酸提和大孔吸附树脂得到黑果枸杞色素后,进一步研究了其组成;分离出11个已知化合物和一种新的亚精胺(命名为枸杞亚精胺A);利用波谱解析法[包括1D,2D (HSQC、HMBC),NMR,HRESI-MS]和已报道的文献数据比较以推测其结构。谭亮等[31]采用紫外-可见光谱法与高效液相色谱-电喷雾串联质谱技术对黑果枸杞中花色苷的组成结构进行了分析,推测其主要成分为酰化的锦葵色素- 3,5-二葡萄糖苷,且结合文献报道鉴定出黑果枸杞中含有8种花色苷。Zheng等[2]采用HPLC-DAD、HPLC-ESI-MS对青藏高原三个不同区域黑果枸杞的花青素组分进行研究,结果表明,在新鲜浆果中矮牵牛素衍生物占总花青素的95%,飞燕草素和锦葵色素占总花青素的5%。Zeng等[32]研究发现,飞燕草素衍生的花青素只在黑果枸杞的果实中累积,宁夏枸杞中未发现;基因表达模式和转录率可能决定了黑果枸杞和宁夏枸杞果实中花青素生物合成的表型差异。
除糖基化外,酰化是黒果枸杞花青素的主要存在形式之一,酰化可通过保护花青素免受亲核分子攻击来提高其稳定性,还可降低花青素的极性,延长保留时间。Hu等[33]研究了花青素的pH稳定性、光稳定性、热稳定性和抗氧化能力,结果表明,酰化型花青素比非酰化型花青素更稳定、抗氧化能力更强。顺反异构体是酰化花青素的一种常见存在形式,结构上的高度相似,增加了其分离纯化的难度,故少有文献报道有关天然产物中花青素异构体的有效分离方法。Jin等[34]通过比较4种色谱柱对一对花青素异构体的分离效果,从而选用了对异构体有更高选择性和柱效的基于反相色谱柱/强阴离子交换柱结合模式的色谱柱(XCharge C8SAX),并在此柱上优化了色谱条件,从而成功地从野生黒果枸杞中分离得到花青素的顺反异构体。
现有文献多运用LC-MS/MS等方法研究黒果枸杞花色苷类色素的组成和结构,研究发现其苷元主要为飞燕草素、矮牵牛素和锦葵色素三大类。花色苷的结构表征需确定苷元的类别、糖基的种类、糖苷键的位置以及糖苷的构象,单一的光谱技术很难完全确证花色苷的结构;另一方面,糖苷的对照品很难合成,目前市场上黒果枸杞花色苷类色素的对照品很少,相关文献的结构确证多是通过文献数据比较来推测。
2.4 黑果枸杞色素的含量测定
色价法、消光系数法、pH示差法[35]以及紫外-可见分光光度法[36]均只能测定总花色苷的含量。林丽等[37]采用高效液相色谱法测定黑果枸杞果实中花色苷的主要成分为矮牵牛素-5-O-葡萄糖苷,其含量为47.95%。目前对黑果枸杞中原花青素的含量测定,多以儿茶素为对照品,浓盐酸-香草醛法比色,该法操
作简单且灵敏度较高[38]。
黒果枸杞的花色苷、花青素、原花青素均为多酚类的类黄酮化合物。黑果枸杞叶总黄酮的生物活性[39-40]、提取[41]、分离纯化[42]均与黑果枸杞色素类似。有学者在研究其叶总黄酮时,还检测出芦丁、槲皮素、木犀草素、异鼠李素和山奈素等[43]。缩合单宁和鞣质(单宁)也是多酚类物质,黑果枸杞中多酚化合物的转化关系见图1。黑果枸杞叶的缩合单宁测定法与原花青素类似,以儿茶素为对照品,浓盐酸-香草醛法比色,紫外-可见分光光度法测定[44]。孟庆艳等[45]通过理化分析检测出黑果枸杞中含鞣质,并通过紫外分光光度法对黑果枸杞果实中鞣质进行了含量测定。闫亚美等[46]采用分光光度法和HPLC-MS对不同产地的黒果枸杞进行总花色苷、总黄酮、总酚的含量测定和酚类组成结构的鉴定;结果显示,不同产地间各成分含量差异较大,且共鉴定出19个多酚类化合物。
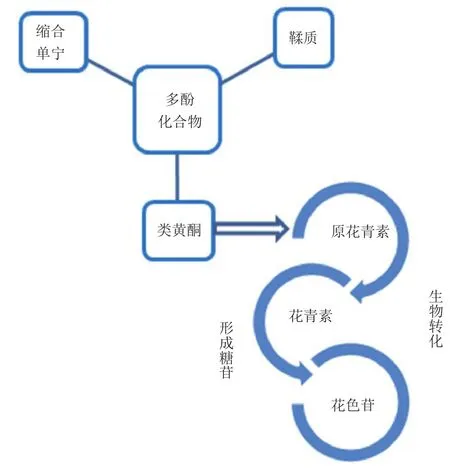
图1 黑果枸杞中多酚化合物的转化Figure1 Transformation of polyphenols in Lycium ruthenicum
Peng等[47]采用紫外分光光度法测得黑果枸杞中总类胡萝卜素的含量为0.084%,且首次利用HPLC-DAD法定量分析了不同品种枸杞中玉米黄素二棕榈酸酯(枸杞中主要类胡萝卜素)的含量,为黑果枸杞总类胡萝卜素的36.9%。与其他色谱法相比,HPLC-DAD法只需用石油醚和丙酮进行简单的一步提取,适当稀释后,即可快速分离提取物,并对总类胡萝卜素和玉米黄素二棕榈酸酯进行定性、定量分析。Liu等[48]研究发现,在宁夏枸杞的果实中可检测到大量以玉米黄素为主的类胡萝卜素,但在黒果枸杞的果实中未检测到。细胞学和基因转录分析研究表明,黒果枸杞果实成熟时色素母细胞未分化,导致类胡萝卜素的生物合成水平降低;类胡萝卜素裂解酶4 (CCD4) 在黒果枸杞中的表达量远高于宁夏枸杞,提示黒果枸杞中的类胡萝卜素存在连续降解现象。这两点可能是导致未能在黒果枸杞中检测到类胡萝卜素的主要原因。此外,提取方式与测定条件的不同,以及选择的黒果枸杞生长期不同,均会导致黑果枸杞中类胡萝卜素测定结果的差异。
3 黑果枸杞其他成分
3.1 脂肪酸
胡娜等[49]采用荧光衍生试剂柱前衍生,高效液相色谱-大气压化学电离源/质谱联用技术(HPLC-APCI/ MS)对黑果枸杞果实中的脂肪酸成分进行了分析。结果显示,黑果枸杞果实中主要含有不饱和脂肪酸,其含量约占脂肪酸总量的64%, 主要包括C18∶1(油酸)、C18∶2(亚油酸)以及少量的C18∶3(亚麻酸)。
3.2 挥发油
Altintas等[50]采用GC-MS法对黑果枸杞果实中水溶性挥发油进行了分析,共鉴定出18个挥发油组分,占挥发油总量的80.4%,其中二十七烷(14.3%)、亚油酸乙酯(10.0%)、廿六烷(7.0%)、二十九烷(6.2%)和棕榈酸乙酯(5.8%)为其主要组分。
3.3 维生素
沈建伟等[51]采用高压液相色谱法测定青海不同品种枸杞鲜果中5种B族维生素(VB1、VB2、VB6、VB12、烟酸)的含量,结果从黑果枸杞中只检出VB12,其他成分均未检出。
3.4 酚酸
陈晨等[52]采用固相萃取-HPLC快速测定黑果枸杞果汁中丁香酸、绿原酸、没食子酸、咖啡酸、儿茶素、原儿茶素等6种酚酸类成分的含量,为黑果枸杞果汁的资源开发和质量控制提供了依据。
3.5 甜菜碱
甜菜碱是黑果枸杞的主要药效成分之一,具有降压、抗脂肪肝、抗肿瘤等生物活性[53]。刘增根等[54]采
用RP-HPLC测定了黑果枸杞中甜菜碱的含量,该法操作简便、重现性好。
3.6 微量元素
黑果枸杞含有多种微量元素,是典型的高钾低钠食品,具有作为单纯意义的补钴剂、补镍剂药物的潜力。随着元素分析技术的发展,黑果枸杞中微量元素的测定方法也在不断更新。原子吸收法(AAS)[55]、电感耦合等离子体-原子发射光谱(ICP-AES)[56]和电感耦合等离子体-质谱(ICP-MS)[57]均已应用于黑果枸杞中微量元素的含量测定。
4 结语
黑果枸杞含有多种生物活性组分,作为藏药的一种已用于多种疾病的治疗。目前,国内外对黑果枸杞的研究多集中于其主要药效成分即多糖、色素等的获取(提取、纯化、结构表征)及含量测定方法。也有部分文献研究了黑果枸杞的其他成分,如脂肪酸、挥发油类、维生素、酚酸、甜菜碱、微量元素等,但多是对其含量测定的报道,没有比较详尽和确证的研究。黑果枸杞作为植物中药,其组成复杂,可能还有很多化合物未被发现。
目前尚未见对黑果枸杞的化学成分进行系统深入的研究,多是对单类组分的报道,其中某些组分的药理活性也尚未研究,大多数主要化学成分的物质基础研究尚属空白,其中多数成分的生物活性和结构表征研究较少,这大大限制了黑果枸杞的开发和利用。故需对黑果枸杞的化学组分进行系统研究,为进一步开发黑果枸杞提供依据,以指导黑果枸杞的合理利用。
[1]张绘芳, 李霞, 王建刚, 等.塔里木河下游植物群落结构特征分析[J].生态环境, 2007, 16(4): 1219-1224.
[2]Zheng J, Ding C X, Wang L S,et al.Anthocyanins composition and antioxidant activity of wildLycium ruthenicumMurr.from Qinghai-Tibet plateau[J].Food Chem, 2011, 126(3): 859-865.
[3]刘勇民.维吾尔药志(下)[M].乌鲁木齐: 新疆科技卫生出版社, 1999: 478- 485.
[4]Liu Z G, Dang J, Wang Q L,et al.Optimization of polysaccharides fromLycium ruthenicumfruit using RSM and its anti-oxidant activity[J].Int J Biol Macromol, 2013, 61: 127-134.
[5]林丽, 李进, 吕海英, 等.黑果枸杞花色苷对小鼠动脉粥样硬化的影响[J].中国中药杂志, 2012, 37(10): 1460-1466.
[6]贾琦珍, 陶大勇, 陈瑛, 等.黑果枸杞色素对巨噬细胞的激活作用研究[J].中兽医医药杂志, 2008(1): 29-30.
[7]陶大勇, 陈佳娟, 陈瑛, 等.黑果枸杞色素对小鼠抗衰老作用的研究[J].中兽医医药杂质, 2008(1): 11-13.
[8]汪建红, 陈晓琴, 张蔚佼.黑果枸杞果实多糖抗疲劳生物功效及其机制研究[J].食品科技, 2009, 34(2): 203-207.
[9]Ni W H, Gao T T, Wang H L,et al.Anti-fatigue activity of polysaccharides from the fruits of four Tibetan plateau indigenous medicinal plants[J].J Ethnopharmacol, 2013, 150(2): 529-535.
[10]汪建红, 陈晓琴, 张蔚佼.黑果枸杞果实多糖降血糖生物功效及其机制研究[J].食品科学, 2009, 30(5): 244-248.
[11]Peng Q, Liu H J, Shi S H,et al.Lycium ruthenicumpolysaccharide attenuates infammation through inhibiting TLR4/NF-κB signaling pathway[J].Int J Biol Macromol, 2014, 67: 330-335.
[12]白红进, 汪河滨, 褚志强, 等.不同方法提取黑果枸杞多糖的研究[J].食品工业科技,2007,28(3): 145-146.
[13]鲁小静, 冯艳波, 陈晓瑞, 等.响应面法优化黑果枸杞多糖的提取工艺研究[J].中国酿造,2013,32(6): 79-83.
[14]陈亮, 张炜, 陈元涛, 等.响应曲面法优化黑果枸杞多糖的超声提取工艺[J].食品科技, 2015, 40(1): 220-227.
[15]马玉婷, 李进, 张志怡, 等.响应面法优化黑果枸杞酒渣多糖精制工艺[J].食品科学, 2012, 33(6): 37-43.
[16]彭强, 吕晓鹏, 黄琳娟, 等.黑果枸杞多糖的纯化工艺研究[J].西北农业学报, 2012,21(2): 121-126.
[17]Peng Q, Lv X P, Xu Q S,et al.Isolation and structural characterization of the polysaccharide LRGP1 fromLycium ruthenicum[J].Carbohydr Polym, 2012, 90(1): 95-101.
[18]Peng Q, Song J J, Lv X P,et al.Structural characterization of an arabinogalactan-protein from the fruits ofLycium ruthenicum[J].J Agric Food Chem, 2012, 60(37): 9424-9429.
[19]Lv X P, Wang C J, Cheng Y,et al.Isolation and structural characterization of a polysaccharide LRP4-A fromLycium ruthenicumMurr.[J].Carbohydr Res, 2013, 365: 20-25.
[20]Peng Q, Xu Q S, Yin H,et al.Characterization of an immunologically active pectin from the fruits ofLycium ruthenicum.[J].Int J Biol Macromol, 2014, 64: 69-75.
[21]罗毅, 潘细贵, 刘刚, 等.苯酚-硫酸法测定多糖含量显色方式的优选[J].中国中医药信息杂志, 2005, 12(1): 45-46.
[22]曹静亚, 迟晓峰, 谭亮, 等.UPLC-ELSD 法测定柴达木栽培和野生枸杞子中水溶性糖含量[J].天然产物研究与开发, 2014, 26(2): 233-237.
[23]李进, 翟伟菁, 张素军, 等.黑果枸杞色素的抗氧化活性研究[J].中国中药杂志, 2006, 31(14): 1179-1183.
[24]李进, 原惠, 曾献春, 等.黑果枸杞色素的毒理学研究[J].食品科学, 2007, 28(7): 470-475.
[25]李进, 赵红艳, 原惠, 等.黑果枸杞色素性质研究[J].食品科学, 2006, 27(10): 146-151.
[26]白红进, 王河滨, 罗锋.黑果枸杞色素的提取及其清除DPPH自由基作用的研究[J].西北农业学报, 2007, 16(2): 190-192.
[27]柳福智, 师希雄.黑果枸杞色素最佳提取工艺研究[J].中国中医药信息杂志, 2012, 19(9): 68-70.
[28]马玉婷, 李进, 陈敏, 等.酶解法提取黑果枸杞酒渣花色苷的工艺研究[J].食品科技, 2011, 36(7): 182-186.
[29]王丽玲, 孙育, 白红进, 等.均匀设计优化黑果枸杞色素纯化工艺研究[J].食品工业, 2012, 33(8): 43-45.
[30]Zhao J, Xu F, Ji T F,et al.A new spermidine from the fruits ofLycium ruthenicum[J].Chem Nat Compd, 2014, 50(5): 880-883.
[31]谭亮, 董琦, 曹静亚, 等.黑果枸杞中花色苷的提取与结构鉴定[J].天然产物研究与开发, 2014, 26(11): 1797-1802, 1760.
[32]Zeng S H, Wu M, Zou C Y,et al.Comparative analysis of anthocyanin biosynthesis during fruit development in twoLyciumspecies[J].Physiol Plant, 2014, 150(4): 505-516.
[33]Hu N, Zheng J, Li W C,et al.Isolation, stability, and antioxidant activity of anthocyanins fromLycium ruthenicumMurray andNitraria TangutorumBobr of Qinghai-Tibetan Plateau[J].Separ Sci Technol, 2014, 49(18): 2897-2906.
[34]Jin H L, Liu Y F, Guo Z M,et al.High-performance liquid chromatography separation of cis−trans anthocyanin isomers from wildLycium ruthenicumMurr.employing a mixed-mode reversed-phase/ strong anion-exchange stationary phase[J].J Agric Food Chem, 2015, 63(2): 500-508.
[35]闫亚美, 冉林武, 曹有龙, 等.黑果枸杞花色苷含量测定方法研究[J].食品工业, 2012, 33(6): 145-147.
[36]陈晨, 文怀秀, 罗智敏, 等.白刺色素和黑果枸杞色素中花色苷与总多酚的测定[J].光谱实验室, 2010, 27(5): 1796-1798.
[37]林丽, 李进, 丁成丽.高效液相色谱法测定黑果枸杞果实中花色苷的含量[J].食品科学, 2013, 34(6): 164-166.
[38]陈晨, 文怀秀, 赵晓辉, 等.黑果枸杞色素中原花青素含量测定[J].光谱实验室, 2011, 28(4): 1767-1769.
[39]李淑珍, 李进.黑果枸杞叶黄酮降血脂及抗氧化活性的研究[J].北方药学, 2011, 8(11): 23-24.
[40]李进, 李淑珍, 冯文娟, 等.黑果枸杞叶总黄酮的体外抗氧化活性研究[J].食品科学, 2010, 31(13): 259-262.
[41]韩爱芝, 白红进, 耿会玲, 等.响应面法优化超声辅助提取黑果枸杞叶片总黄酮的工艺研究[J].西北林学院学报, 2013, 28(1): 114-118.
[42]李淑珍, 李进, 杨志江, 等.大孔树脂分离纯化黑果枸杞总黄酮的研究[J].食品科学, 2009, 30(1): 19-24.
[43]吕海英, 林丽, 潘云, 等.黑果枸杞叶总黄酮抗氧化和降血脂成分测定[J].新疆师范大学学报: 自然科学版, 2012, 31(2): 43-48.
[44]房江育, 马雪泷.影响黑果枸杞缩合单宁测定的因素分析[J].中国农通学报, 2006, 22(8): 105-107.
[45]孟庆艳, 马国财, 白红进.黑果枸杞中鞣质含量测定方法的优化[J].塔里木大学学报, 2011, 23(1): 9-14.
[46]闫亚美, 戴国礼, 冉林武, 等.不同产地野生黑果枸杞资源果实多酚组成分析[J].中国农业科学, 2014, 47(22): 4540-4550.
[47]Peng Y, Ma C, Li Y W,et al.Quantifcation of zeaxanthin dipalmitate and total carotenoids inLyciumfruits (fructus lycii) [J].Plant Food Hum Nutr, 2005, 60(4): 161-164.
[48]Liu Y L, Zeng S H, Sun W,et al.Comparative analysis of carotenoid accumulation in two goji (Lycium barbarumL.andL.ruthenicumMurr.) fruits [J].BMC Plant Biol, 2014, 14(1): 269.
[49]胡娜, 索有瑞, 韩丽娟, 等.柱前衍生HPLC-MS法测定黑果枸杞果实中脂肪酸[J].分析试验室, 2014, 33(6): 698-701.
[50]Altintas A, Kosar M, Kirimer N,et al.Composition of the essential oils ofLycium barbarumandL.ruthenicumfruits [J].Chem Nat Compd, 2006, 42(1): 24-25.
[51]沈建伟, 王环, 胡凤祖.高压液相色谱法测定青海不同品种枸杞中V_B含量[C]//西北地区第七届色谱学术报告会甘肃省第十二届色谱年会论文集.兰州: 甘肃省化学会色谱学会, 2012: 186.
[52]陈晨, 文怀秀, 赵晓辉, 等.固相萃取快速测定黑果枸杞果汁中酚酸类化合物[J].中国中药杂志, 2011, 36(7): 896-898.
[53]张宇金, 高世勇, 何立巍.甜菜碱的生物活性研究[J].哈尔滨商业大学学报: 自然科学版, 2006, 22(1): 13-16.
[54]刘增根, 陶燕铎, 邵赟, 等.柴达木枸杞和黑果枸杞中甜菜碱的测定[J].光谱实验室, 2012, 29(2): 694-697.
[55]陈红军, 马玲, 孔星云.黑果枸杞中十三种元素含量的测定[J].中国野生植物资源, 2002, 21(4): 59-60.
[56]矫晓丽, 冀恬, 迟晓峰, 等.微波消解- ICP-AES测定柴达木不同品种枸杞中17种元素[J].光谱实验室, 2011, 28(6): 3129-3132.
[57]李莉.ICP-MS测定野生黑果枸杞中的15种微量元素含量[J].光谱实验室, 2013, 30(5): 2260-2263.
Research Progress in Chemical Constituents of Lycium Ruthenicum Murr.
XIA Yuanyuan1, MO Rennan1, QU Wei2, LIU Wenyuan1(1.Department of Pharmaceutical Analysis, China Pharmaceutical University, Nanjing 210009, China; 2.Department of Natural Medicinal Chemistry, China Pharmaceutical University, Nanjing 210009, China)
Lycium ruthenicumMurr.is a medicinal and edible plant with various pharmacological activities including anti-oxidation, antiatherosclerosis, immunity enhancement, anti-aging and hypolipidemic activity.This review summarized progress in the researches on chemical constituents, biological activities, extraction methods and quality analysis ofLycium ruthenicumMurr.so as to provide reference for further exploitation and utilization of active ingredients inLycium ruthenicumMurr.
Lycium ruthenicumMurr.; chemical constituents; biological activities; determination methods
·新技术·新方法·
NEW TECHNOLOGY AND NEW METHOD

R284.2
A
1001-5094(2015)05-0351-06
接受日期:2015-04-20
*通讯作者:柳文媛,教授;
研究方向:药物现代仪器分析;
Tel:025-83271038; E-mail:liuwenyuan@cpu.edu.cn
