2014年全球新药研发报告
——第二部分:趋势和挑战(Ⅳ)
2015-02-10GraulSerebrovCrucesTracyDulsat
Graul A I, Serebrov M, Cruces E, Tracy M, Dulsat C
·全球药讯·
GLOBAL PHARMACEUTICAL INFORMATION
2014年全球新药研发报告
——第二部分:趋势和挑战(Ⅳ)
Graul A I, Serebrov M, Cruces E, Tracy M, Dulsat C

编者按:本刊自2013年起连续2年分期译载了汤森路透公司独家授权的“全球新药研发报告”,该报告一经刊出,就因内容全面、资料权威、视角独到、数据翔实、时效性强广受好评。读者纷纷来函索要单行本,众多药企高层对该报告也高度关注。
本期“全球药讯”栏目继续刊登“2014年全球新药研发报告”第二部分。
2014年制药和生物技术行业继续保持着高活力。截至2014年12月23日,全球共有55个新的化学药物和生物制品首次进入市场,另有29个重要的延伸性新药获批,还有19个药物首次获批,但尚未来得及上市。此外,在传统的年底冲刺期间,一些国家的监管机构在年底最后一刻还批准了其他一些药物,因此,这些获批药物未能被收录在内,所以2014年实际获批的新药数量应该大于前面提到的数字。除了新药的成功开发、注册和上市外,还有其他一些可反映整个行业现状和发展趋势的风向标,例如,监管机构采取新措施以刺激难治性疾病药物的开发、制药公司定期并务实地对其研发项目进行甄选以及通过并购整合研发管线、投资项目和销售队伍。
埃博拉病毒;孤儿药;生物仿制药;并购;中止开发药物
1 埃博拉病毒疫情及其治疗产品研发
西非埃博拉病毒疫情暴发,成为2014年重大新闻,并激发了人们对这个之前一直被忽视的热带疾病研究的空前热情。该疫情被首次报道,是在2014年3月,而首发病例却由世界卫生组织(World Health Organization,WHO)追溯到2013年12月。虽然在疫情暴发的最初数月里,病例数只是逐渐增加,但到2014年8月中旬,疫情出现转折,在疫情最严重的3个国家,病例数和死亡数急速上升(见图1)。截至2015年1月 30日,全球报告的埃博拉病例总数超过22 150例,其中死亡病例达8 844例[1]。
幸运的是,尽管数量极为有限,首批抗埃博拉病毒的实验性药物,包括被大众媒体称为“秘密血清”的ZMappTM,已在2014年夏末投入使用。同时,抗埃博拉病毒疫苗也成为高度优先开发的项目,其中2014年秋季进入Ⅰ期临床试验的首批抗埃博拉病毒疫苗有葛兰素史克(GlaxoSmithKline)公司和美国国家过敏症和传染病研究所(NIAID)合作开发的ChAd3以
及NewLinkGenetics公司和加拿大公共卫生署(Public Health Agency of Canada)合作开发的VZV-EBOV。到2015年1月初,已有6个抗埃博拉病毒疫苗在美国和欧洲进入人体试验阶段,而最重要的是,这些疫苗中的若干疫苗已在最为急需的西非国家开始试用。
在过去的12个月里,大约有12个抗埃博拉病毒药物和疫苗进入临床试验(见表1),而在疫情暴发之前,处临床前开发阶段的相关产品也不过寥寥。在2015年1月中旬召开的有关抗埃博拉病毒疫苗的一次会议上,WHO助理总干事Marie-Paule Kieny宣称,得益于多方的加速开发、监管机构的关照、疫苗的迅速高规格生产和独特的实验设计,预计到2月份,至少有2个疫苗(cAd3-EBO和VZV-EBOV)进入Ⅲ期临床试验[2]。
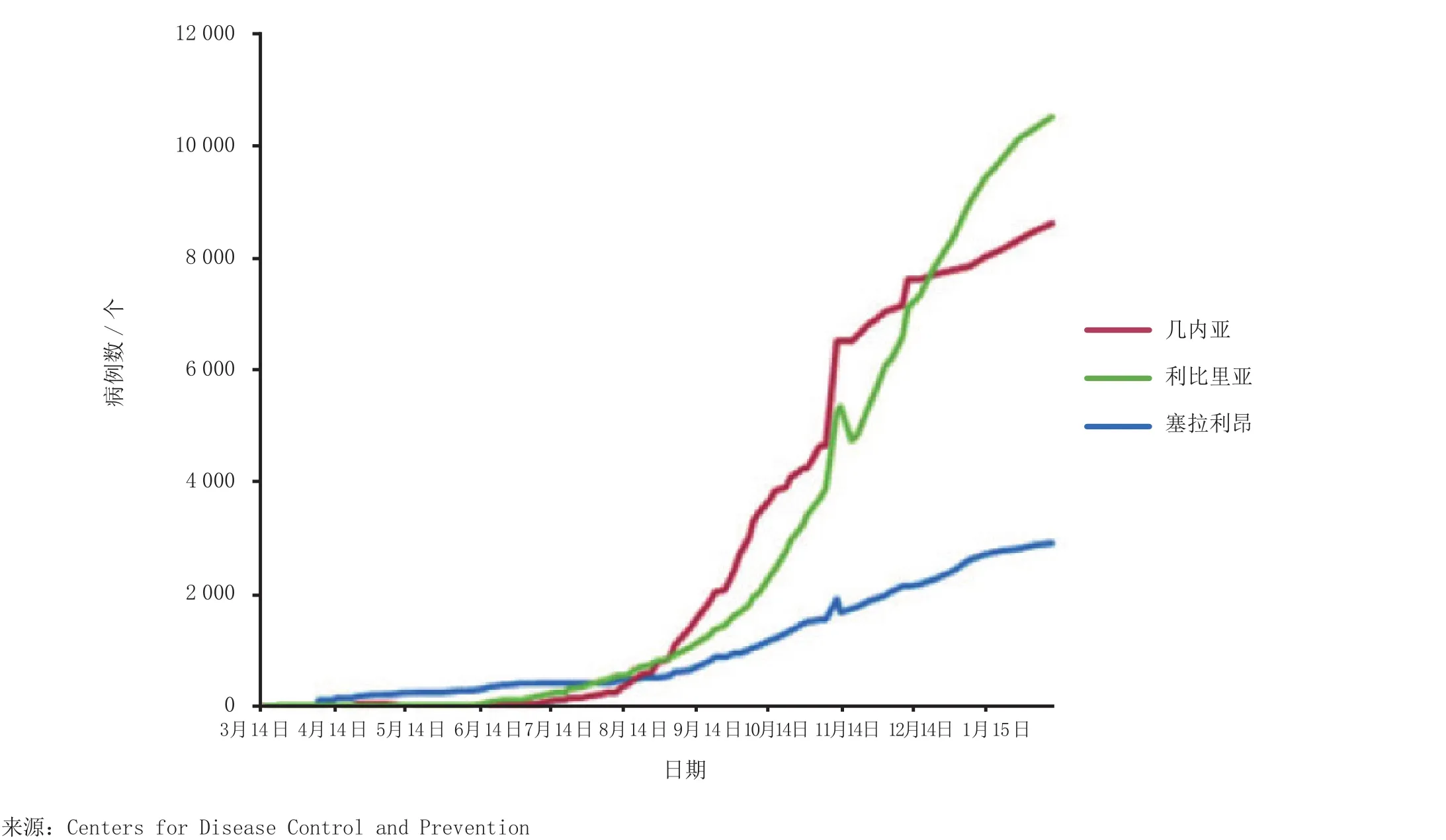
图1 WHO报道的2014年3月25日至2015年1月28日期间关于几内亚、利比里亚和塞拉利昂地区埃博拉病毒感染累计病例数Figure 1 Cumulative reported cases of Ebola in Guinea, Liberia and Sierra Leona provided in WHO situation reports between March 25, 2014 and January 28, 2015
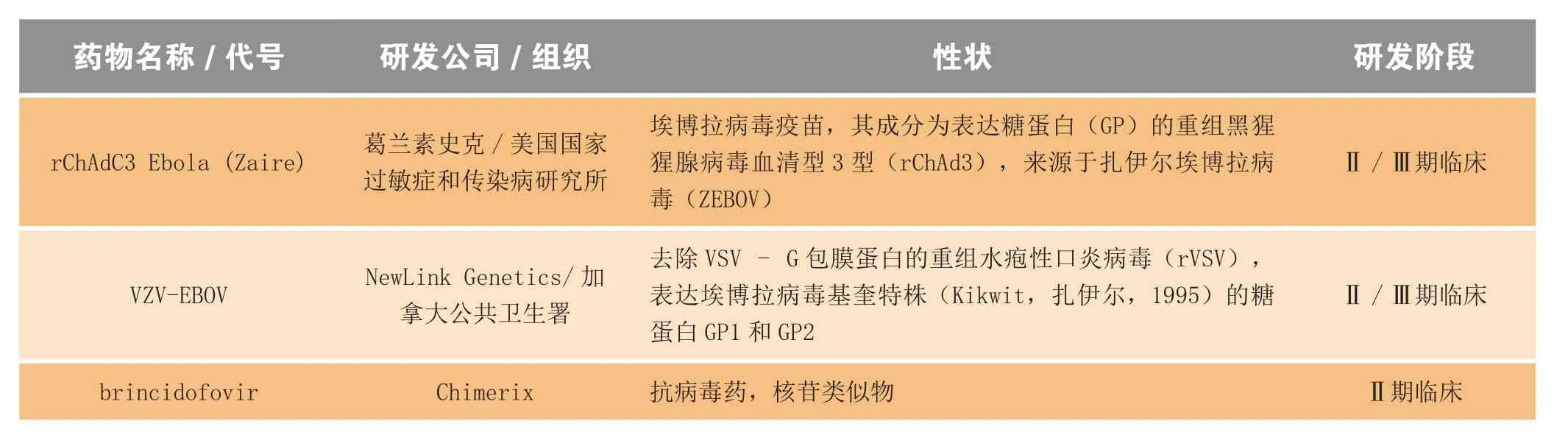
表1 进入临床试验阶段的埃博拉出血热预防、治疗用药物和生物制品Table1 Drugs and biologics progressing to clinical studies for the prevention and treatment of Ebola virus disease
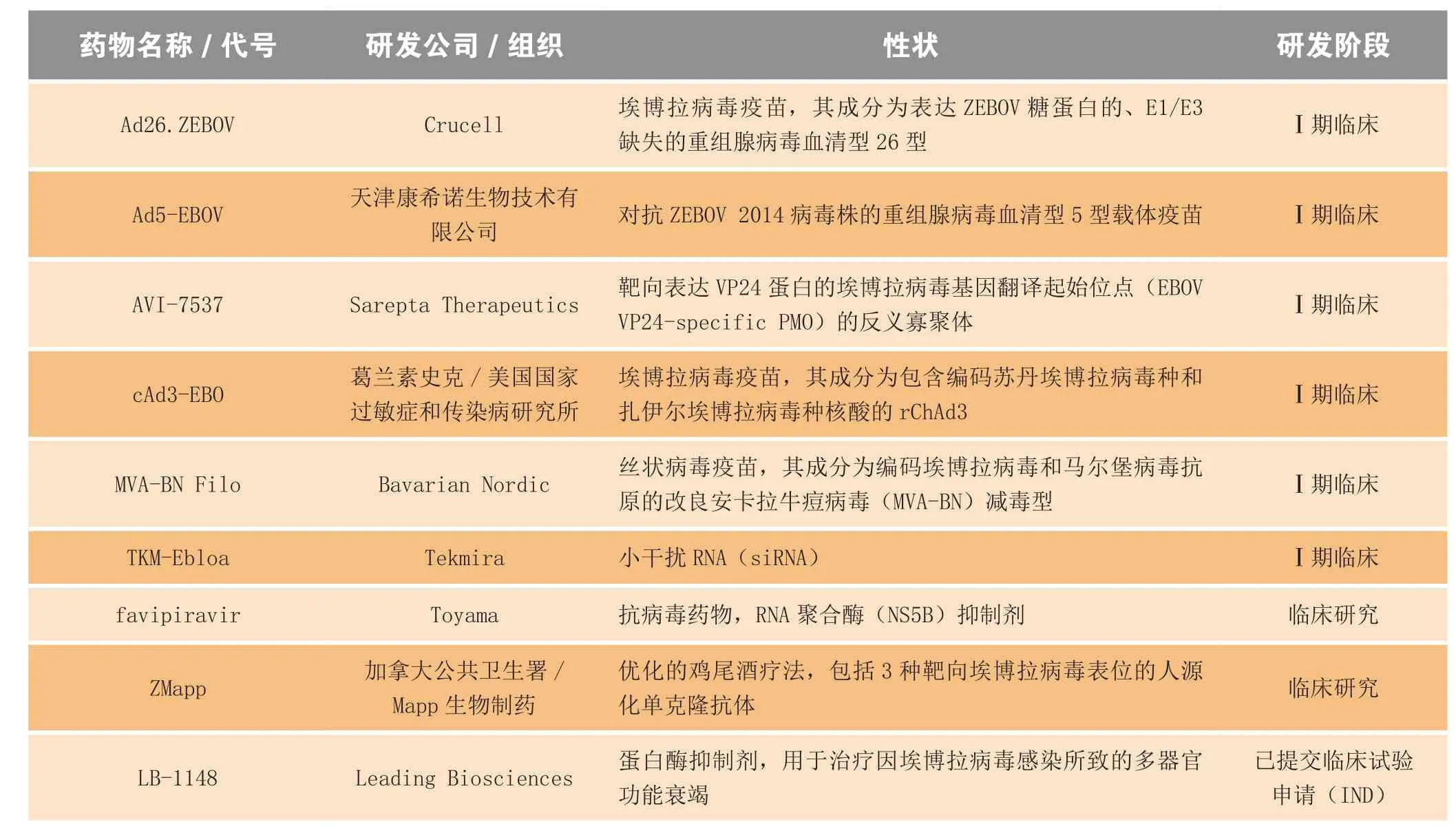
续表1
尽管抗埃博拉病毒疫苗和药物正在加速开发,但目前几乎还不可能有相关产品脱颖而出,并获准用于当前严重疫情中患者的治疗。况且,在受疫情影响的国家,新发病例数正在减少。然而,即使经济回报可能极为低微,但在如此短的时间内,抗埃博拉病毒疫苗和药物的研发取得进展,也足以展示了卫生组织和制药行业相互合作并应对如此大规模人类健康危机的能力。如果需要的话,这有望成为未来联合协作行动的范例。
2 孤儿药
虽然孤儿药的适用患者群很小,但其投资回报率很高,所以近年来制药行业在罕见病药物开发上投入的资源份额不断增加。这种关注度转变所带来的结果是显而易见的:2014年首次上市的84个药物(新化学实体+适应证扩展)中,有15个(将近18%)所获批的适应证在首次上市的国家获得孤儿药资格(见表2)。与此形成鲜明对比的是,在美国孤儿药法案(U.S.Orphan Drug Act)颁布之前的17年里,只有34个用于罕见病的药物上市。美国孤儿药法案于1983年颁布,是这类立法的先驱[3-4]。目前已知的有待治疗的罕见病有7 000多种,所以孤儿药的研发仍有充裕的继续增长空间。在欧洲,欧洲医药管理局(European Medicines Agency,EMA)人用药品委员会(Committee for Medicinal Products for Human Use,CHMP) 于2014年推荐批准的孤儿药达创纪录数量:总共82个获推荐批准的药物(包括57个创新化学药和生物药、21个化学仿制药和3个生物仿制药)中,有17个为罕见病治疗药物。

表2 2014年上市的孤儿药(化学药和生物制品)Table2 Drugs and biologics launched in 2014 for orphan indications
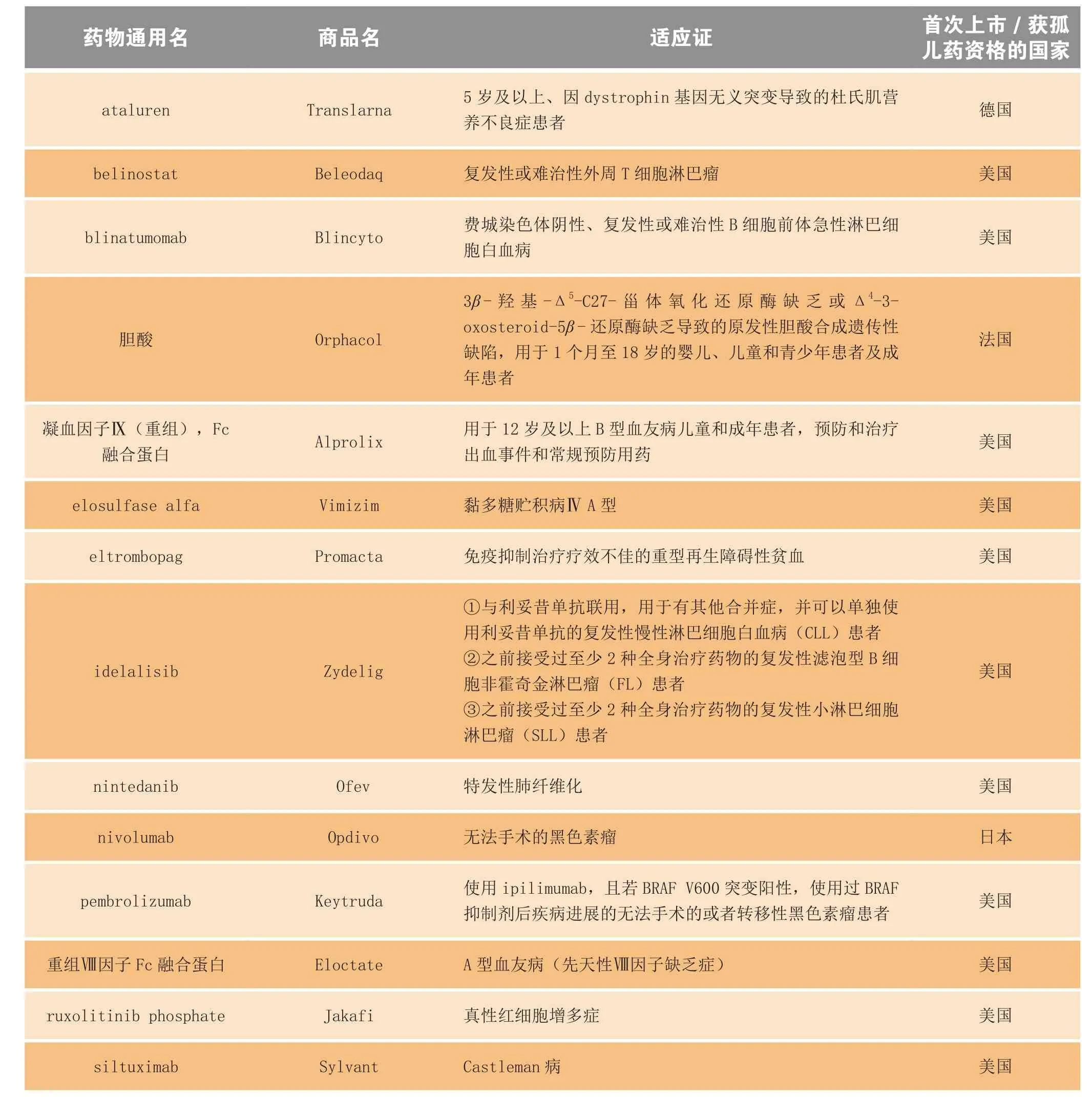
续表2
每个国家都有自己对“罕见病”的定义。在美国,罕见病是指在任何给定时间境内患者总数少于20万人的疾病。在欧洲,患病率小于或等于1/2 000的疾病被认定为罕见病。在日本,罕见病被定义为境内总患病人数少于5万且发病率不高于4/10 000的疾病。在澳大利亚,罕见病的患病率被限定为应不高于1.2/10 000。
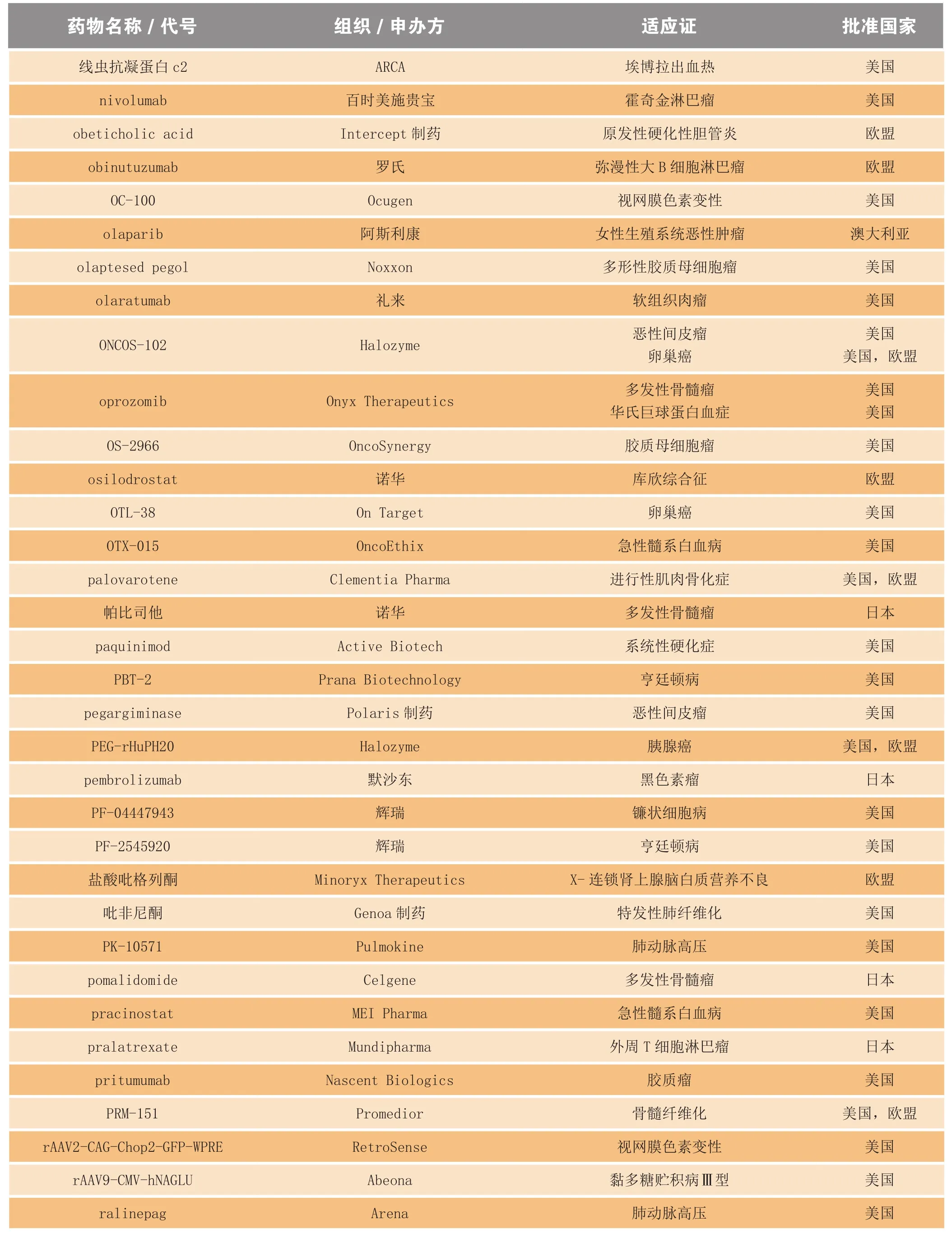
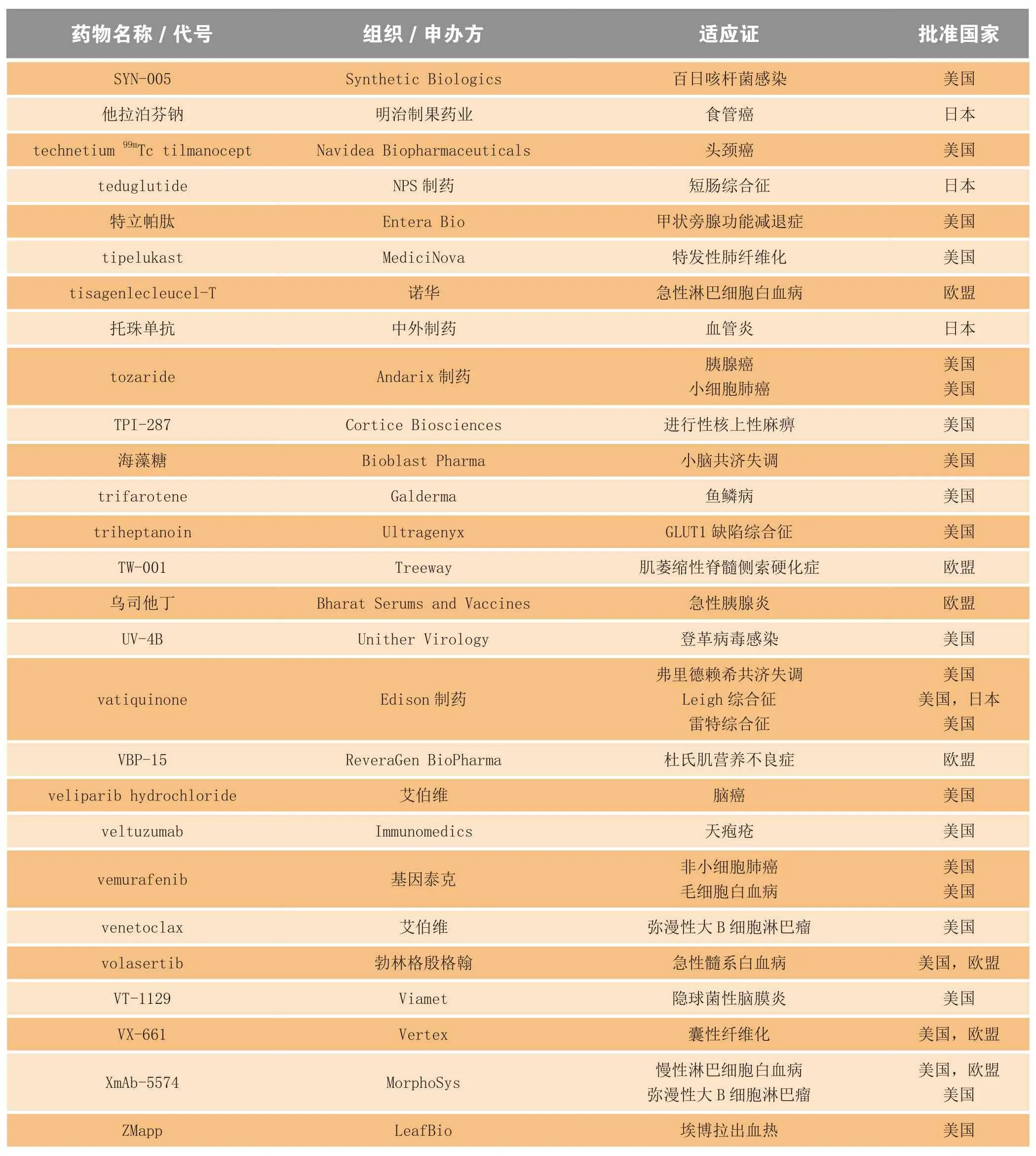
2014年,美国、欧盟、日本和澳大利亚的监管机构共授予400多个化学药和生物药孤儿药资格。其中,很大一部分是用于癌症和先天性代谢异常,也包括用于埃博拉病毒性疾患、狂犬病和色素性视网膜炎等适应证的药品。表3罗列了部分在2014年获得孤儿药资格的药物。
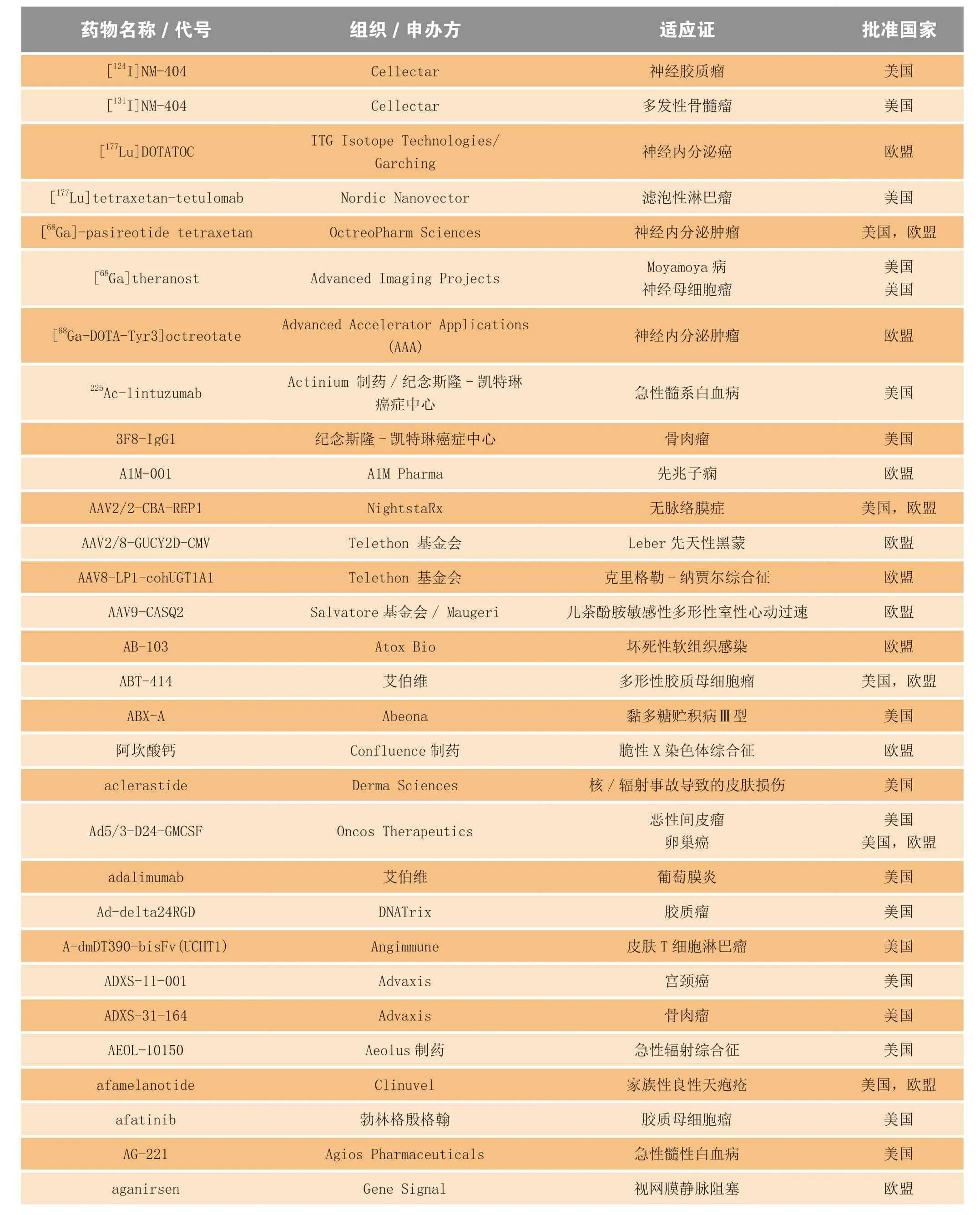
表3 2014年获得孤儿药资格的部分化学药和生物制品Table3 Selected drugs and biologics receiving orphan drug designation in 2014
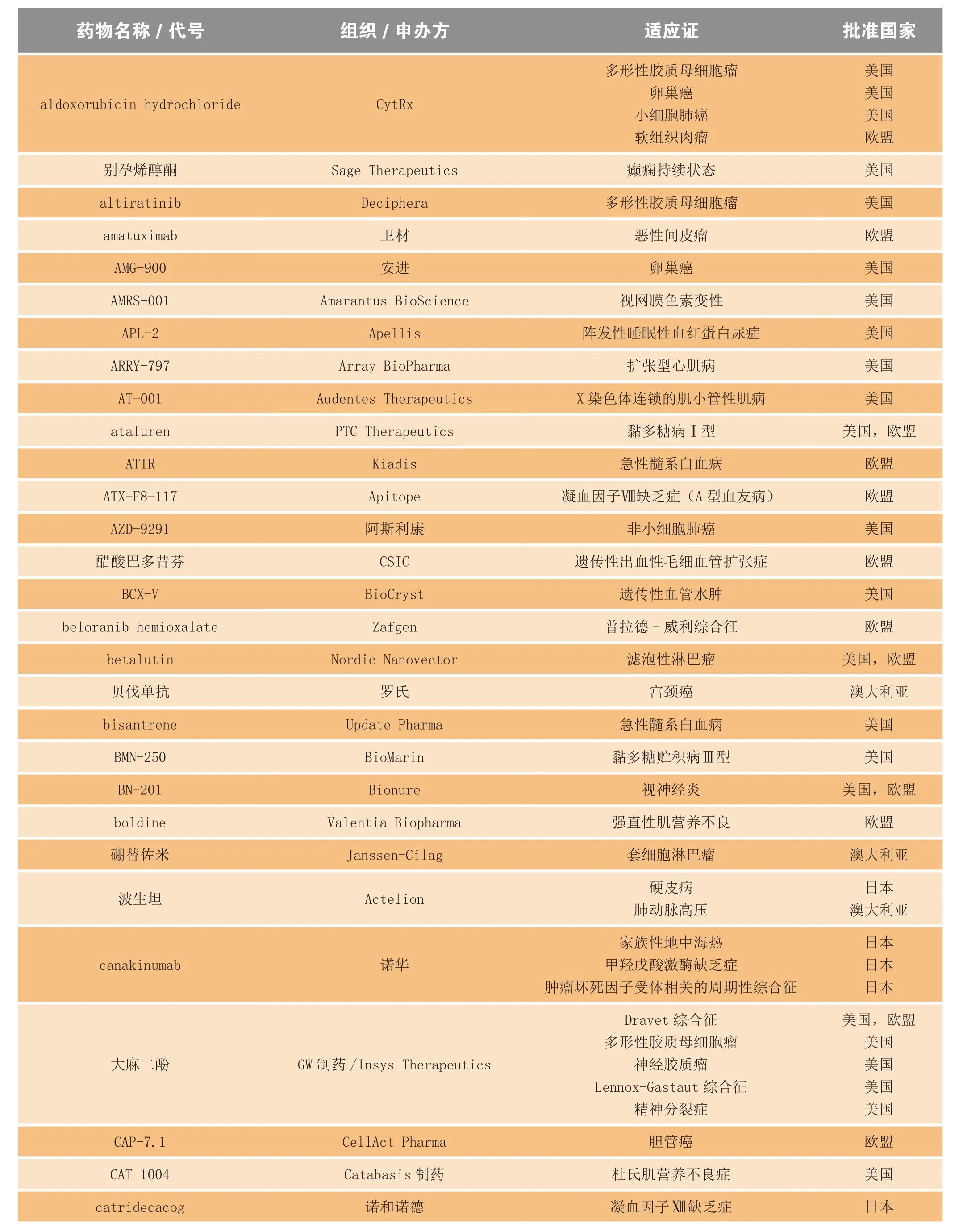
续表3
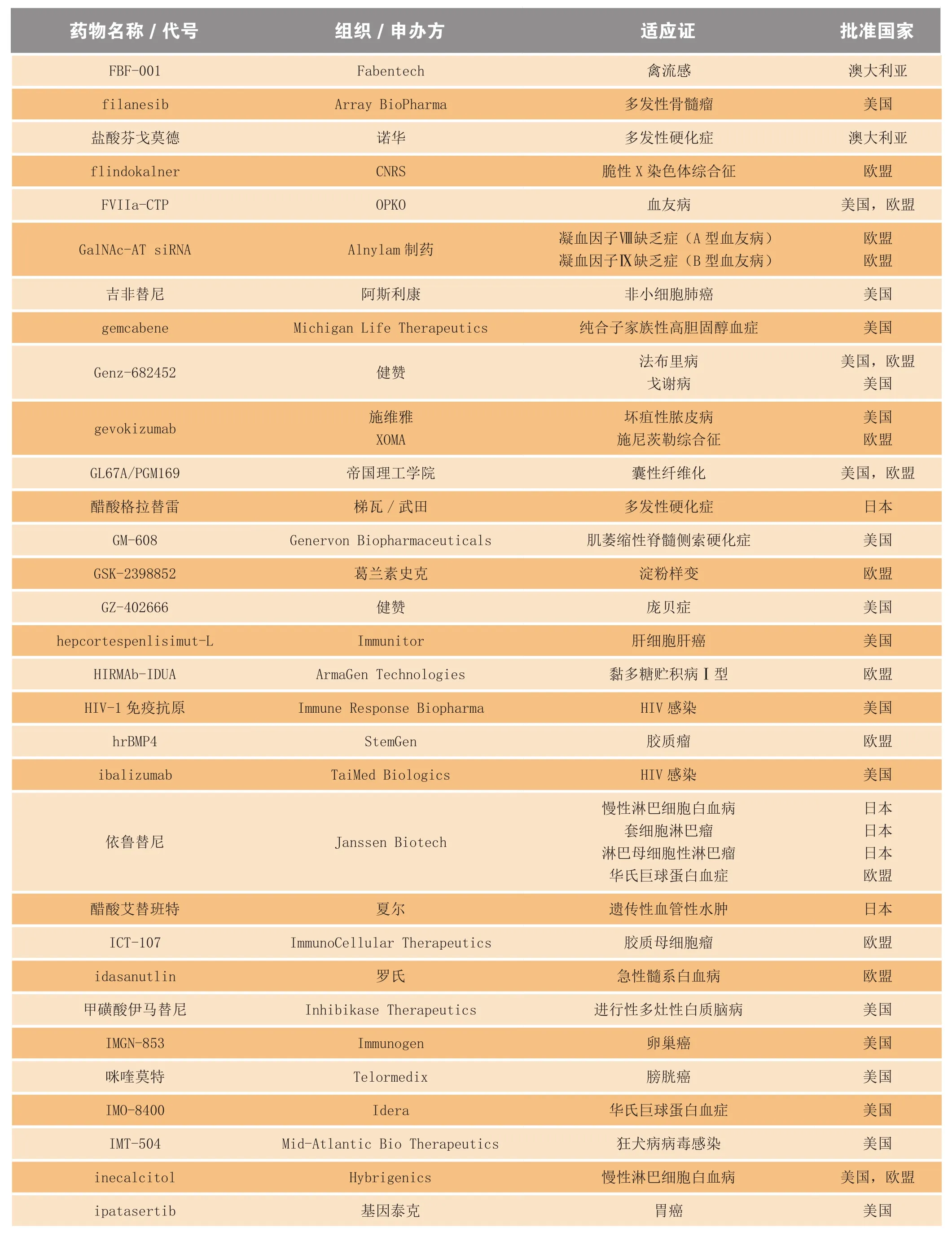
续表3
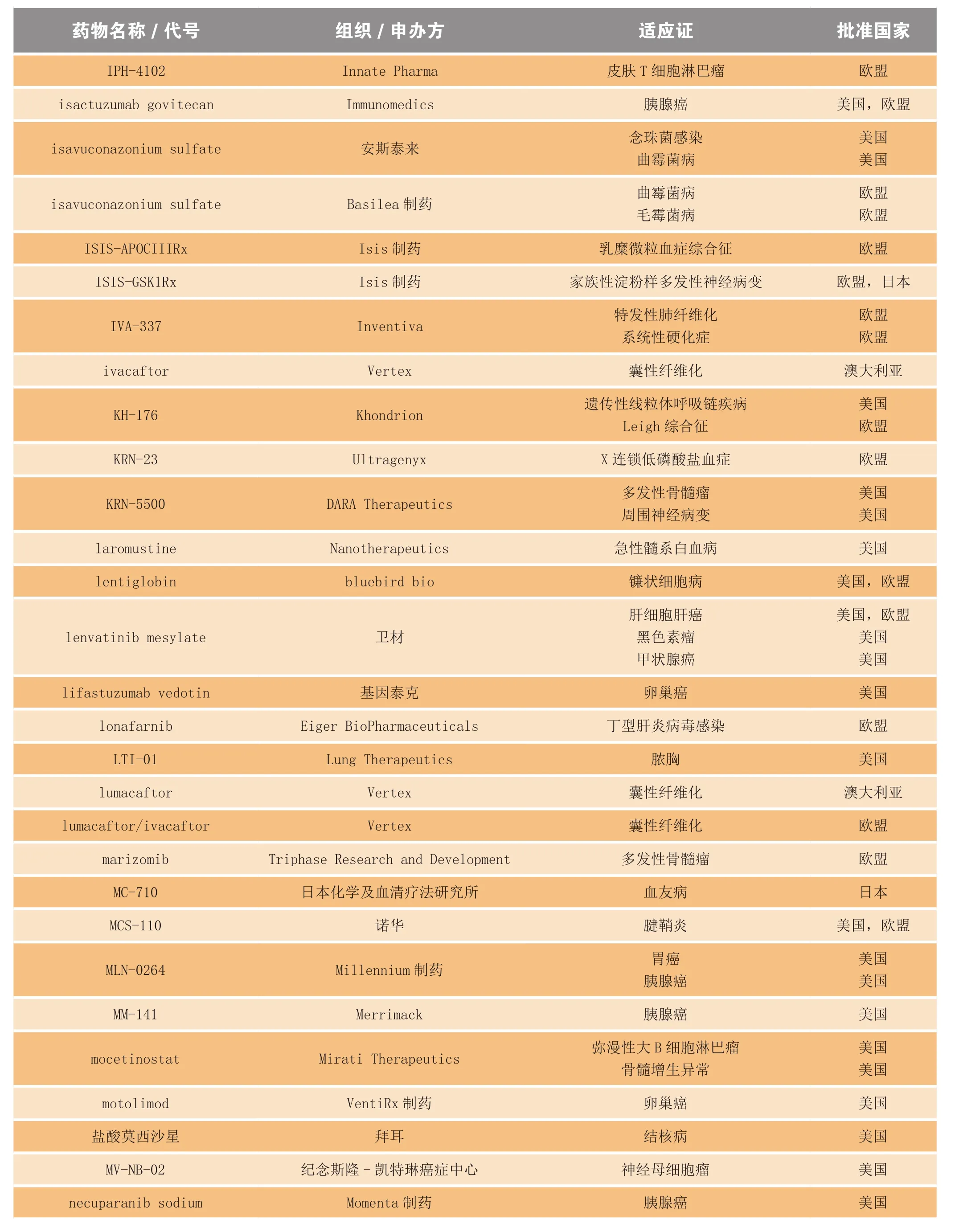
续表3
续表3
续表3
(待续)
原文来源:Drugs of Today,2015,51(2):125-152
翻译:储旻华
A Report of New Drugs Research and Development in 2014——Part II: Trends & Challenges (Ⅳ)
Graul A I, Serebrov M, Cruces E, Tracy M, Dulsat C
2014 was a year of continued high activity in the pharma and biotech industry.As of December 23, 2014, a total of 55 new chemical and biological entities had reached their frst markets worldwide, together with another 29 important new line extensions.Another 19 products were approved for the frst time during the year but not yet launched by December 23.Furthermore, during the now-traditional year-end sprint, several regulatory agencies issued last-minute approvals for other compounds that missed the deadline for inclusion in that article, bringing the total of new approvals for the year to a somewhat higher number.In addition to the successful development, registration and launch of new drugs and biologics, there are various other trends and tendencies that serve as indicators of the overall health and status of the industry.These include the pursuit of novel programs designed by regulators to stimulate the development of drugs for diseases that are currently under-treated; the regular and pragmatic culling by companies of their R&D pipelines; and the decision to unify pipelines, portfolios and sales forces through mergers and acquisitions.
Ebola virus; orphan drug; biosimilar; merger & acquisition; discontinued drug
R97
A
1001-5094(2015)05-0389-12
