免疫肿瘤学组合疗法
2015-02-01汤森路透
汤森路透
免疫肿瘤学组合疗法
汤森路透
综述了使用相似或者不同技术的化合物对免疫肿瘤学药物进行的组合疗法研究。免疫肿瘤学组合疗法掀起了大型制药公司和规模较小的生物技术公司的研究热潮,它们已经开始对组合疗法用于癌症治疗进行了专门性测试。综述来源于汤森路透Cortellis™数据库的战略数据。
免疫肿瘤学组合疗法;临床研究;分子靶点
1 免疫肿瘤学组合疗法
与目前大多数癌症治疗所使用的相对非特异性细胞毒药物相比,靶向疗法和免疫疗法药物有望主宰癌症治疗的新时代。
传统的化疗药物作用于所有快速分裂的细胞,包括正常细胞和癌细胞。与传统化疗相比,靶向和免疫疗法的优势是能定位到特异的信号通路或受体。由于传统化疗药物对正常细胞的影响,该类药物副作用较靶向疗法大得多。靶向治疗药物对正常细胞损伤很小甚至没有损伤,从而提高了癌症患者的生活质量。靶向疗法明显改变了对某些癌症的治疗效果。
与标准化疗药物相比,免疫疗法和靶向疗法药物在治疗结束或中止后还能持续产生抗肿瘤反应,这表明此免疫反应是经过一段时间逐渐形成的且可以长时间存续。
有效的组合治疗方案能破坏肿瘤的免疫耐受,可以使癌症免疫疗法的疗效最大化,比如将能主动激发抗肿瘤免疫的药物(如抗癌疫苗)与阻断肿瘤免疫抑制各种机制的药物[如免疫检查点抑制剂和(或)靶向癌症干细胞的药物]联用。因靶向疗法和免疫疗法在癌症治疗中的作用可能互补,因此二者联用可产生协同效应,这种方法被称为免疫肿瘤学组合疗法。
有了这种协同效应,据推测,免疫肿瘤学组合疗法的市场可达数十亿美元,比如易普利单抗(Tervoy)和nivolumab(Opdivo)在该领域就一路领先。免疫肿瘤学组合疗法正在吸引着诸如百时美施贵宝(BMS)、罗氏、默克、辉瑞和阿斯利康等大型制药公司的关注。他们不但将自己现有的重要靶向药物与来自其管线产品中的免疫治疗药物结合,而且还与竞争对手合作。例如,辉瑞公司和默克公司最近启动了一项合作,将抗PD-1药物pembrolizumab(Keytruda)与克唑替尼(Xalkori)一起用于治疗ALK 阳性晚期非小细胞肺癌(NSCLC),并且默克公司一直对Keytruda进行大力合作开发,力求将该产品最优化,使其领先于竞争品种。阿斯利康紧随默克之后,正加速对该公司免疫肿瘤学管线产品进行组合配对。
辉瑞肿瘤事业部临床开发与医学事务高级副总裁兼首席医疗官Mace Rothenberg博士称,“我们相信免疫肿瘤学组合疗法很有希望提高对癌症的治疗效果,使辉瑞新兴组合疗法的潜力最大化,这为我们提供了一个令人激动的机会。”
阿斯利康全球药物开发执行副总裁兼首席医疗官Briggs Morrison称,“我们相信免疫肿瘤学组合疗法有望成为治疗癌症最有效的方法之一。我们与协和发酵麒麟集团(Kyowa Hakko Kirin)的合作为探索这2种全新的组合疗法提供了机会。”
2 临床试验中的免疫肿瘤学组合疗法
目前有大量的免疫肿瘤学组合疗法处于临床试验阶段。医药公司正互相合作或组合其管线产品,在临床试验早期测试组合疗法对多种癌症的效果。表1~表3列出了来自大型制药公司和生物技术公司的目前处于Ⅰ、Ⅱ、Ⅲ期临床试验的免疫肿瘤学组合疗法药物。
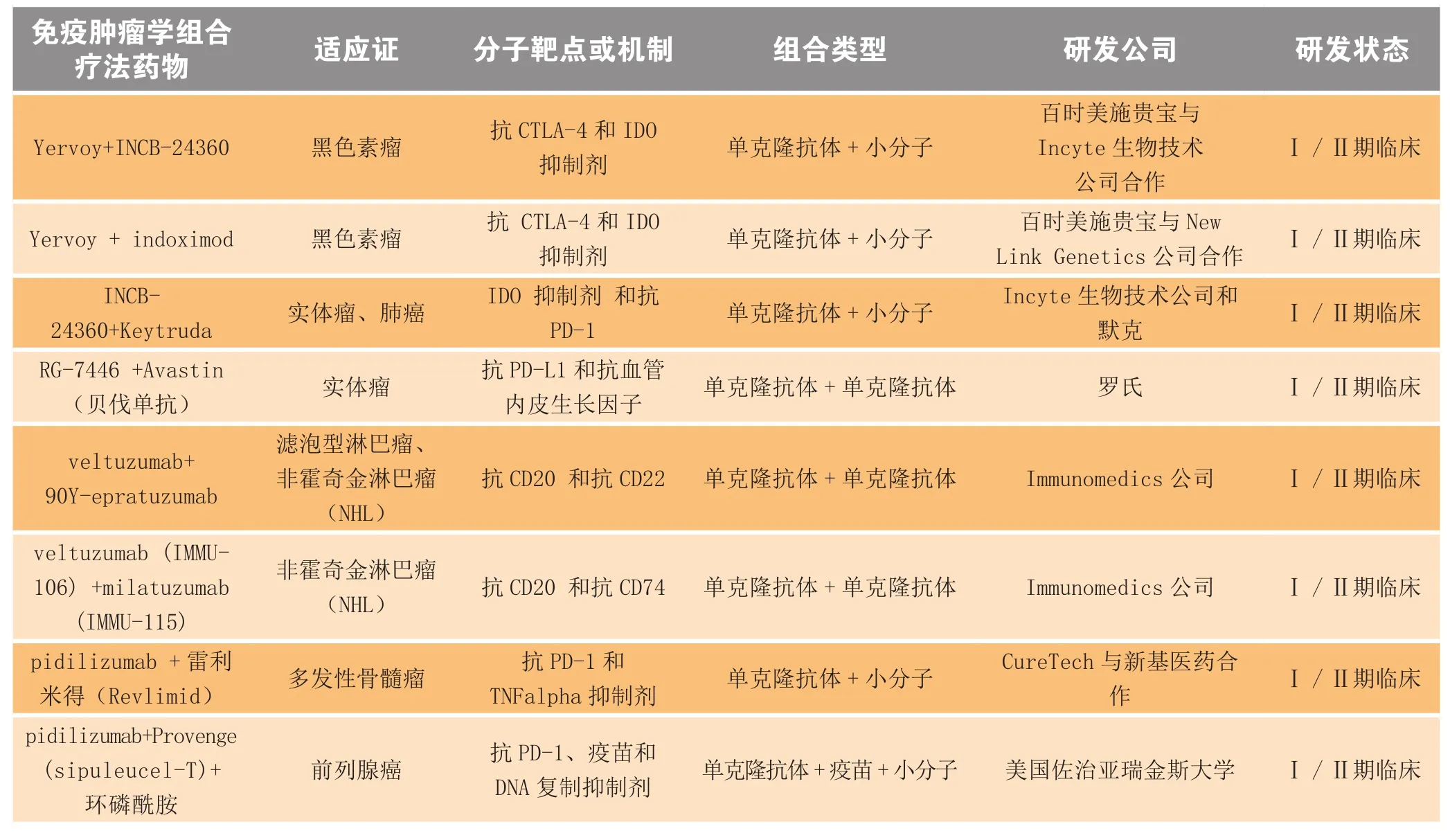
表2 处于Ⅰ/Ⅱ期临床研究阶段的免疫肿瘤学组合疗法Table2 Immuno-oncology combinations in phase I/II clinical trials
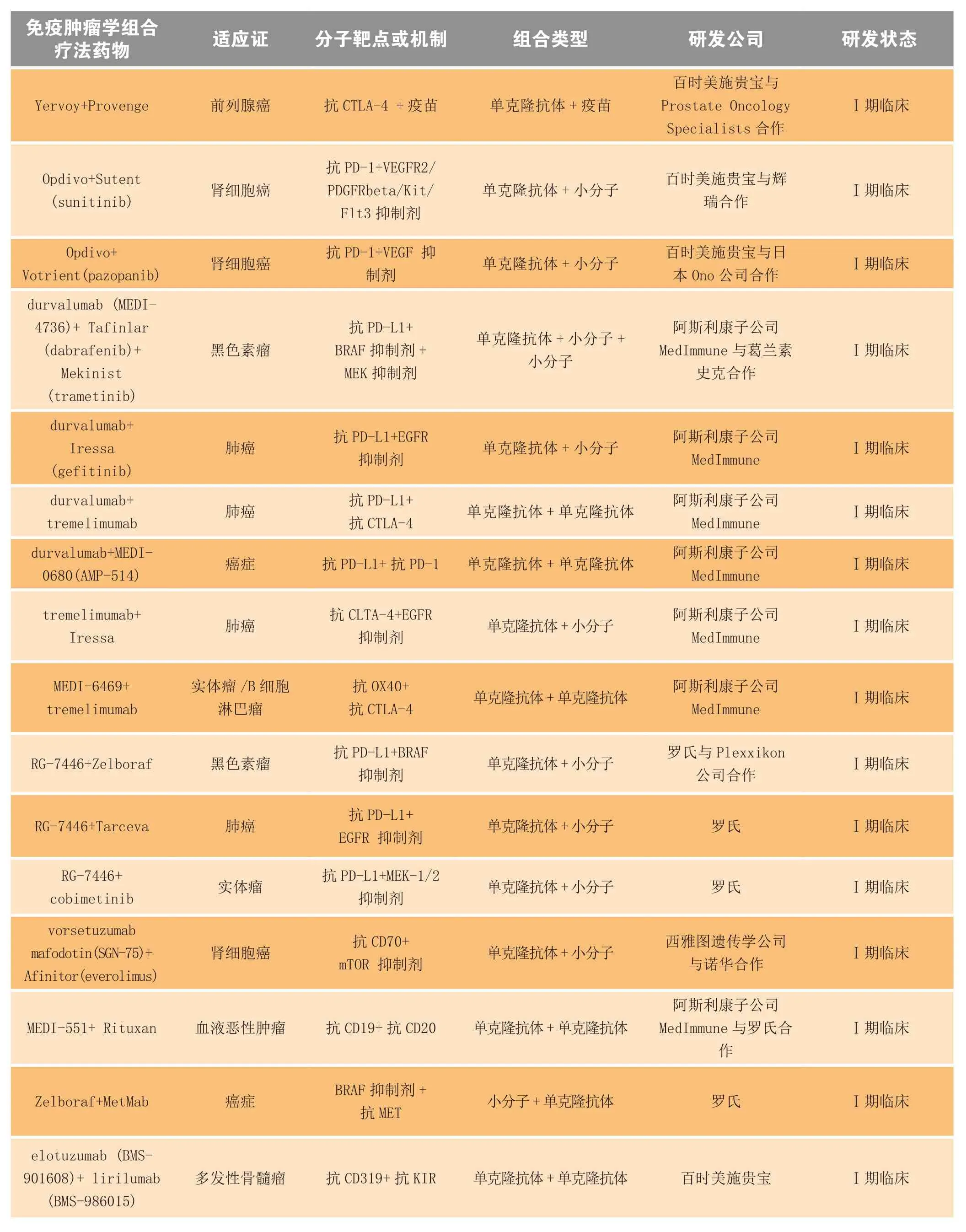
表3 处于Ⅰ期临床研究阶段的免疫肿瘤学组合疗法Table3 Immuno-oncology combinations in phase I clinical trials
免疫肿瘤学组合疗法中研究最多的是单克隆抗体和小分子组合,其次是单克隆抗体和疫苗组合(见图1)。本文列出的45个临床研究的免疫肿瘤学组合疗法药物中,单克隆抗体和小分子组合占49%,2种单克隆抗体的组合占34%,单克隆抗体和疫苗的组合占13%,单克隆抗体、小分子和疫苗的组合,以及癌症疫苗的组合各占2%。此分析既包括临床研究阶段的组合疗法药物,也包括研发或合作阶段项目中的药物。
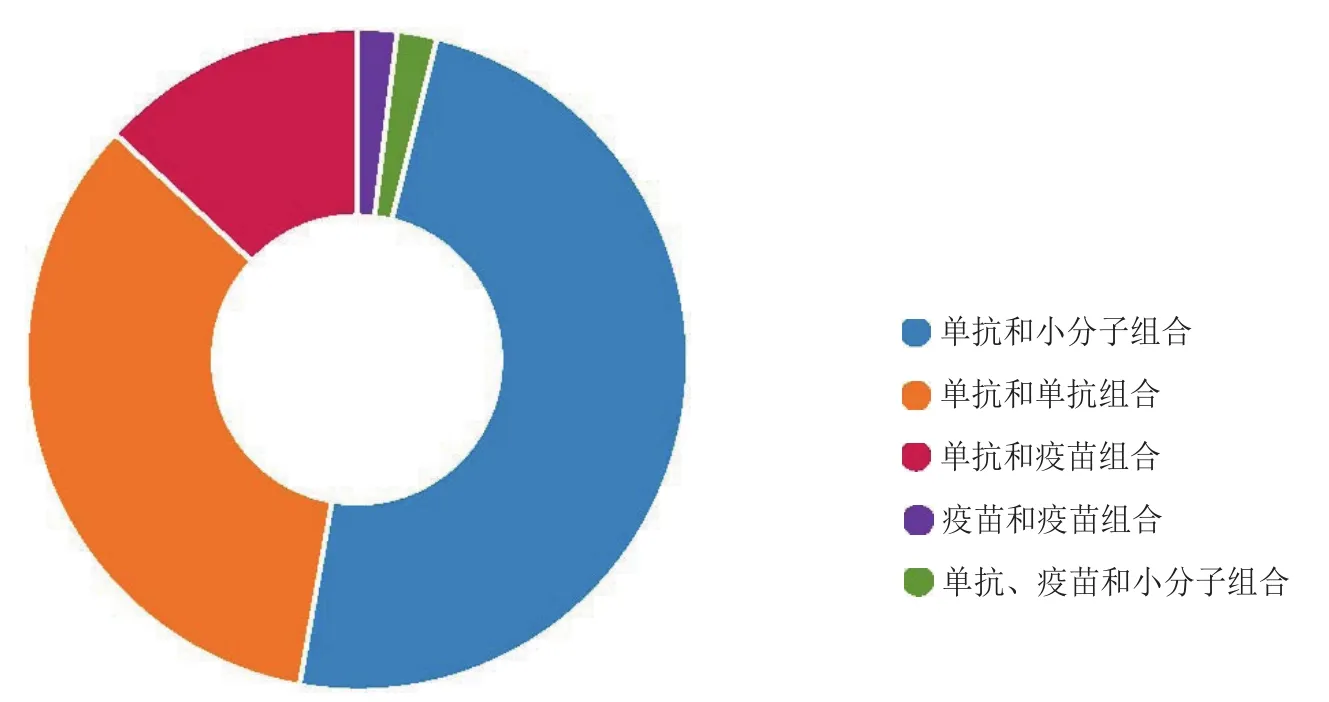
图1 临床前和临床研究中的免疫肿瘤学组合疗法药物Figure 1 Immuno-oncology combinations in preclinical and clinical development
很多免疫组合疗法的代表药物的评价工作正在进行中。由于肿瘤类型各异,而且它们能通过不同机制巧妙地避开免疫系统,因此抑制不同潜在通道的组合药物可能比瞄准单一通道的单个药物更为有效。这方面的一个重大突破是检查点信号通路抑制剂的开发——它们是一类能够阻断大多数癌细胞释放的免疫抑制配体活性的典型单克隆抗体。PD-1及其配体以及CTLA-4有望成为诸多癌症的分子靶点(见表4)。
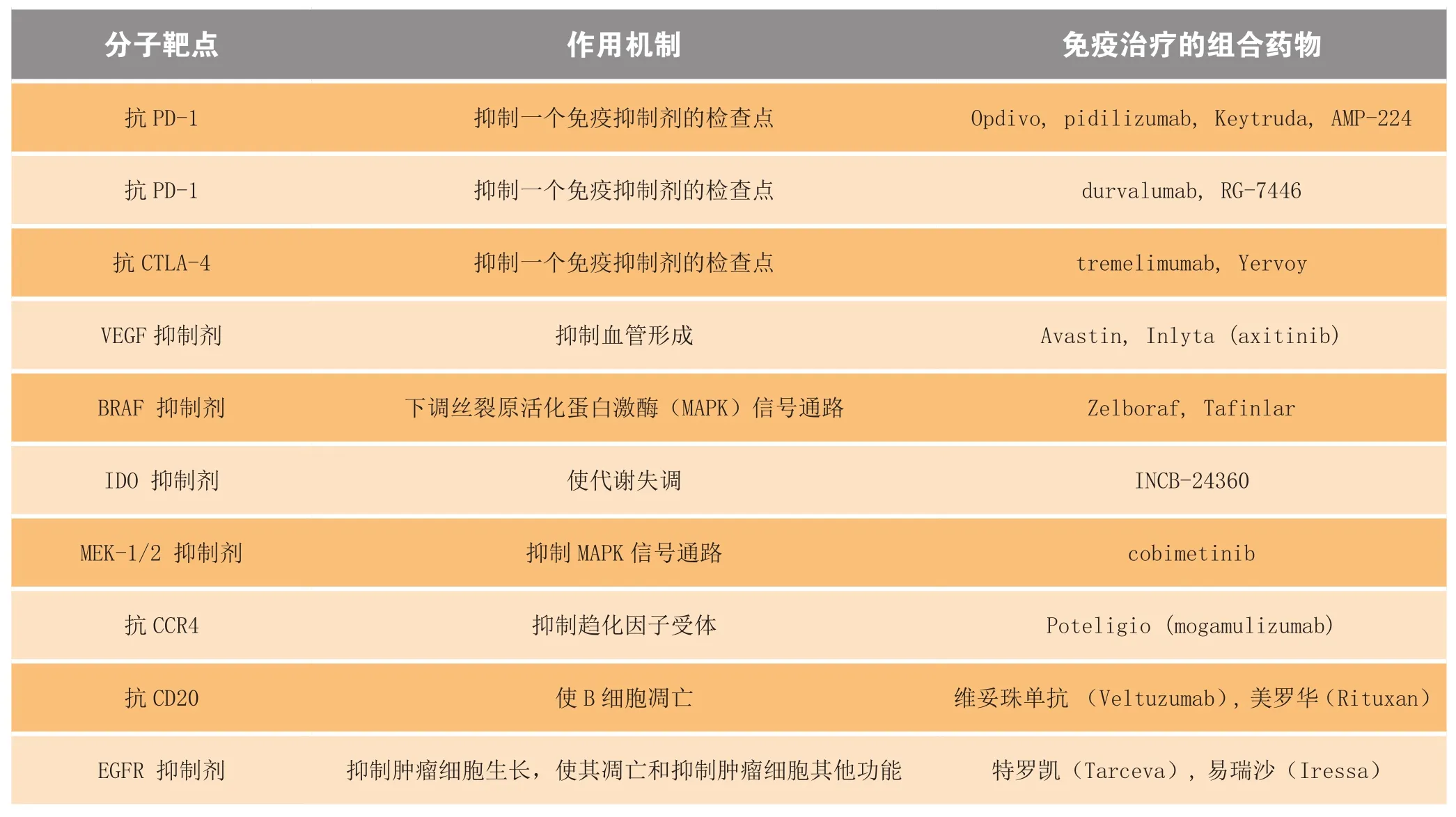
表4 免疫肿瘤学组合疗法药物的作用机制Figure 4 Action mechanisms of immune-oncology combinations
3 免疫肿瘤学组合疗法所面临的挑战
尽管目前已有很多研究证实,免疫疗法与多种药物联合使用后协同作用显著且疗效明显改善,但无论是在研发人员设计试验的过程中还是在患者耐受性研究中,采用组合疗法进行试验都可能出现预想不到的复杂性和风险。
3.1 毒性增加
采用化合物进行免疫肿瘤学组合疗法所面临的挑战是如何增强肿瘤应答而不增加毒性。在采用Yervoy+Zelboraf治疗黑色素瘤的Ⅰ期、Ⅱ期临床试验(NCT02095652和NCT01400451)中,人们观察到组合疗法存在毒性增加的风险。Yervoy是一种完全人源单抗,可通过阻断细胞毒T细胞抗原-4(CTLA-4)的作用而增强抗肿瘤免疫反应;Zelboraf是BRAF V600突变激酶的有效抑制剂,二者均被证实可以治疗晚期黑色素瘤。
在NCT01400451研究中,人们评估了采用Yervoy+Zelboraf组合疗法治疗BRAF V600突变阳性的转移性黑色素瘤的疗效。试验由于6名病人中有2名出现剂量限制性毒性而终止。试验过程中同时服用标准剂量的Zelboraf+Yervoy或较低剂量的Zelboraf所产生的肝脏毒性高于单药治疗所产生的预期毒性。NCT02095652试验采用Yervoy、Zelboraf及DNE3(PI3K-Akt抑制剂)进行组合治疗,数据安全监控委员会发现安全性问题比预期的严重,且出现了毒性反应,试验随之终止。目前,在一项治疗黑色素瘤的Ⅱ期临床试验(NCT01673825)中,受试者先服用6周Zelboraf,再采用Yervoy单药治疗,表现出更好的耐受性。
3.2 研发策略问题
在组合免疫疗法的研发过程中需要管控项目的许多层面,包括法规层面的问题。项目参与者均有兴趣致力于组合疗法的研发,因此组合免疫疗法研发初期遇到的障碍无法吸引参与者的强烈关注。
在组合疗法的临床试验中,药物若非制药公司提供则费用高昂。由于要提供大量分子认证和模型验证的证据以及相应的药效学标记物,试验设计方法会变得复杂。试验设计必须灵活,时间表及剂量的设定应根据适应性。
目前,监管部门已起草了评估组合疗法的草案,且尽量协调临床研究用新药(IND)管理部门进行试验而不泄露商业机密。
4 免疫肿瘤学案例研究
以下介绍目前最前沿的免疫肿瘤学组合疗法。
4.1 Yervoy与Opdivo联用
目前处于研发最前沿的免疫组合疗法是BMS公司的2个单抗Yervoy及Opdivo。2010年,BMS公司在美国上市Yervoy,用于治疗不可切除或转移性的黑色素瘤。Yervoy是一种可以直接阻断CTLA-4而抑制CD28/ CTLA-4检查点的抗体,于2011年7月在欧盟上市。Opdivo是免疫调节剂,可以阻断活化的T细胞表面上的PD-1受体配体活化,在日本已获批用于治疗黑色素瘤,且在美国及欧盟提交申请,期望于2015年获准用于治疗黑色素瘤及小细胞肺癌。PD-1及CTLA-4是T细胞活化的负调节因子,与单药治疗相比,组合疗法因能阻断二者,故可以增强抗肿瘤免疫反应。
在一项Ⅰb期临床试验中,127名晚期黑色素瘤患者接受了Yervoy+Zelboraf组合疗法,结果显示,94%患者的总生存期为1年,88%患者为2年。显著的疗效激励百时美施贵宝公司开始Ⅱ期临床试验(checkmate-069)及Ⅲ期临床试验(checkmate-067)。Ⅱ期临床试验预计于2015年结束,Ⅲ期临床试验于2017年结束。基于Ⅰ期临床试验令人振奋的数据,预计在Ⅱ期、Ⅲ期临床试验中,患者生存期将延长。在study-004研究中也观察到肿瘤迅速缩小。
4.2 CRS-207与GVAX联用
另一种方法采用异种免疫加强疫苗以利用不同载体免疫刺激特征,即以Aduro生物技术公司的CRS-207(表达人间皮素的李氏杆菌的减毒活疫苗)及GVAX(GMCSF生产细胞疫苗)进行组合治疗。
采用GVAX Pancreas及CRS-207组合疗法治疗胰腺癌的Ⅱ期临床试验展现出了显著的生存率,因而该组合疗法获得了FDA突破性治疗药物认证。采用组合疗法的患者总生存期为6.1个月,而采用GVAX Pancreas单药疗法的患者仅存活了3.9个月。组合疗法治疗胰腺癌的Ⅱb期临床试验的受试者目前正在招募中。Aduro公司希望依据该疗法获得的特殊地位而加快研发进程。显然,组合疗法使GVAX得以新生,原因是2008年出版的期刊中有研究报道,GVAX由于不能证实其效用而被认为是无效的疫苗。
4.3 Pidilizumab与Rituxan联用
采用Cure技术公司的抗PD-1抗体pidilizumab及罗氏公司的抗CD20单抗Rituxan的组合疗法治疗复发性滤泡淋巴瘤的Ⅱ期临床研究正在进行中。该组合疗法的耐受性良好,未见3级或4级自身免疫反应,也未见与治疗相关的不良反应。共29名患者参与了疗效评估,其中,19名(66%)客观缓解,15名(52%)完全缓解,4名(14%)部分缓解。上述阳性结果表明了免疫检查点阻断剂用于滤泡淋巴癌值得进一步研究。
4.4 Yervoy与INCB-24360联用
Incyte生物制药公司已与许多公司合作研发包括IDO抑制剂INCB-24360在内的组合疗法。临床前研究数据表明,INCB-24360与检查点受体的抗体拮抗剂进行组合给药具有抗肿瘤协同作用。
美国临床肿瘤学会(ASCO)于2014年公布了采用Yervoy及INCB-24360组合疗法治疗转移性黑色素瘤的试验的初步结果。结果显示,组合疗法普遍耐受良好。在适当的管理下,患者之前服用Yervoy产生的不良反应开始好转。经证实的疾病控制率为75%(6/8)。12名未接受过免疫疗法的患者中,41.7%表现出客观缓解,33.3%病情稳定。5名之前接受过免疫疗法治疗的患者中有2名病情稳定;缓解持续时间分别为179 d、148 d和大于127 d(持续)。肿瘤反应与缓解持续时间表明,相比于Yervoy单药疗法,组合疗法治疗恶性黑色素瘤效果更为显著,这为将来其他使用INCB-24360的组合疗法打下了基础。
4.5 Opdivo与Sutent或Votrient的组合疗法
抗血管生成素Sutent及Vitrient是治疗转移性肾细胞癌的标准药物,但由于患者生存率低,仍需新的疗法。ASCO于2014年公布了采用Opdivo与Sutent或Votrient的组合疗法治疗转移性肾细胞癌的Ⅰ期临床试验的初步结果:Opdivo与Sutent或Votrient联用,可以使抗肿瘤活性增加且安全性可控。Sutent与Opdivo联用的客观缓解率为52%(17/33);Votrient与Opdivo联用的客观缓解率为45%(9/20)。Sutent或Votrient与Opdivo联用6周,分别有41%及56%的患者客观缓解,且缓解状态持续了较长时间(分别为12.1~54周、12.1~69.1周)。
5 组合疗法的公司内及公司间合作
迄今,制药公司即使曾经有过也很少将2种处于研发阶段的药物在临床研究中联合使用以期望其药效超过单独用药。除一些政府主导的项目之外,由同一家制药公司提供2种新药进行组合疗法也很少。由于缺乏科学性的推动,以及操控和法律上的障碍,使得潜在的参与者未参与到其中来。当然,科学是不断进步的,许多肿瘤学研究人员也意识到,由于科技革新的导向以及临床研究成本高昂且耗时,早期相互合作是无法避免的。
目前大型制药公司或在本公司产品管线内组合用药,或与其他公司合作。同一公司的组合疗法用药的优点是可快速设计试验及组织临床试验(如施贵宝公司的Yervoy及Opdivo),且无经济及管理方面的问题;但缺点是制药公司产品管线规模大小不一,一些制药公司没有足够的药物供选择,所选药物也可能处于不同的研发阶段。再者,可选用的药物未必是所有可选药物中最佳的。组合疗法采用2家不同公司的药物则可能会有诚信及专利问题,因而会减缓或限制研发速度。然而,这些问题并非难以逾越的障碍。许多公司采取了有效措施共享产品管线,以使本公司在免疫肿瘤学组合疗法中拥有立足之地。
6 免疫肿瘤学组合疗法领域内的近期合作
处于早期研究阶段的免疫肿瘤学组合疗法候选药物如表5所示。
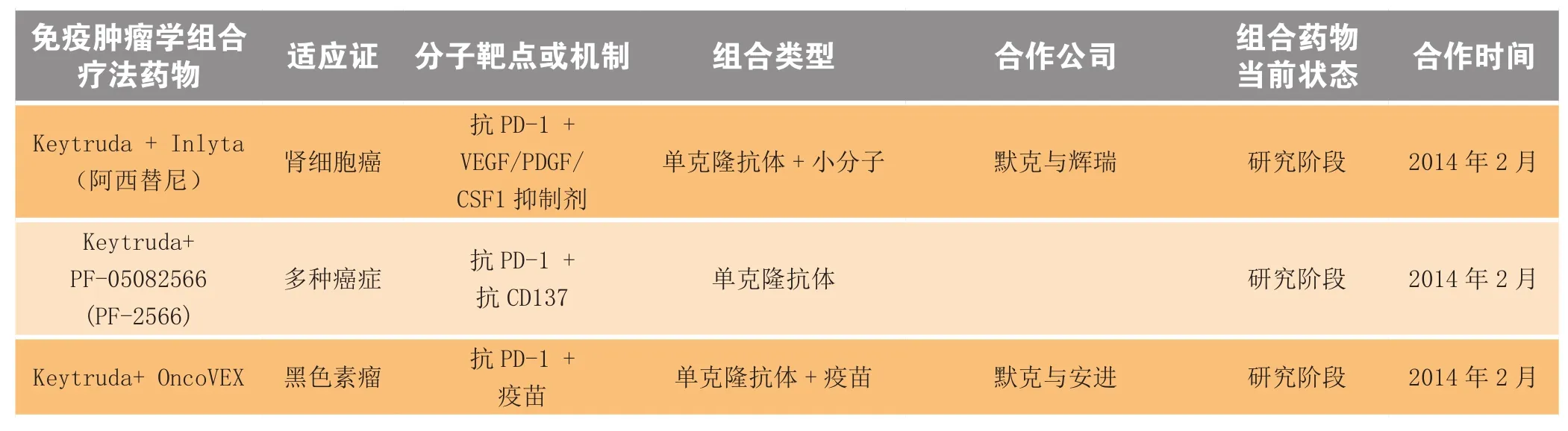
表5 处于早期研究阶段的免疫肿瘤学组合疗法候选药物Table5 The candidates of immune-oncology combinations in early-stage
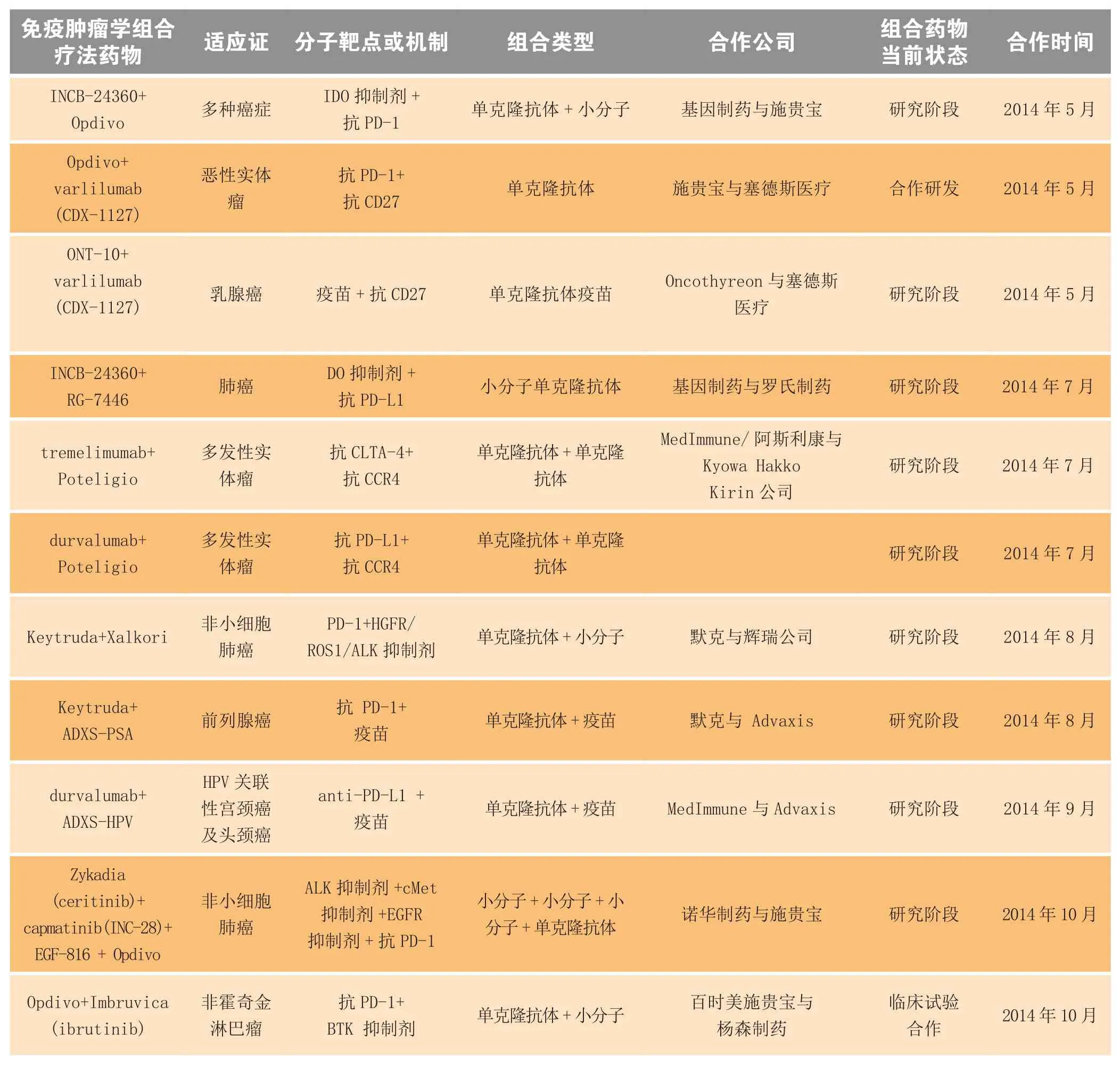
续表5
就合作结构而言,多个公司已经与其合作公司采取了一系列不同类型的合作形式。例如,默克公司开展与Keytruda联合使用的众多小分子药物研发,其中大部分仅是合作研发,并没有涉及到财务方面的交易。
当前,还有BMS公司和Celldex公司正在合作共同研发Opdivo与varlilumab组合疗法。根据他们的协议,BMS公司将一次性支付500万美元给Celldex公司,双方将共同承担研发成本。Ⅰ/Ⅱ期临床研究将由Celldex公司进行,如果Celldex公司希望对外授权varlilumab,BMS公司将享有受时间限制的第一谈判权。
与此相反,Incyte公司进行了大范围合作,旨在研发其IDO抑制剂INCB-24360与其他免疫抑制剂的联合用药。合作伙伴的产品包括默克公司的Keytruda、BMS公司的Opdivo、罗氏的RG7446和阿斯利康的durvalumab。这些合作形式包括合作公司共同承担临床研究成本(默克/Incyte,BMS /Incyte, 阿斯利康/Incyte)或由一家公司承担试验成本(Incyte公司负责罗氏/ Incyte公司合作的试验)。如果双方决定对组合疗法进行进一步研发,额外的合作条款即发挥作用。临床合作的财务细节并未披露。
7 监管视角
FDA建议,制药公司应该在组合疗法的临床研究启动之前咨询共同开发的适宜性。FDA表示更愿关注近年来的“新-新”药物组合疗法,并且在2010年12月发布了初次指导性意见草案,后来又在2013年6月发布了最终指导性意见,明确其对批准2种新药作为组合治疗方案的监管思路。
由于现有研发及监管途径主要是针对单独使用的在研药物或是其与已经获批的药物联用的有效性及安全性进行评价,FDA认为有必要帮助指导制药公司合作研发由2种或2种以上的药物组成的治疗方案。
该指导意见规定对于共同研发新药组合疗法,通常应达到以下所有条件:
1) 组合疗法应用于治疗严重的疾病;
2) 组合疗法的使用应有坚实的生物学依据;
3) 无论是组合疗法还是单个在研药物活性的完整非临床研究数据,或是确定生物标记物的短期临床研究,能够表明组合疗法明显优于当前所采用的治疗,并且优于单个药物的治疗;
4) 非临床研究证明,与单个药物相比,组合疗法效用更广、活性更强、效果更长久(例如,延迟耐药性)、毒性更低;
5) 新的试验中药物不能进行独立研发有一定的强制性原因。
8 结论
免疫肿瘤学疗法包括了那些可诱发或是增强抗肿瘤的免疫反应的不同策略,其中包括增强肿瘤免疫原性、抗癌疫苗及免疫调节剂的应用。组合疗法很可能使癌症患者获得意义重大以及前所未有的生存利益。为了实现癌症免疫疗法的效用最大化,需要对各种免疫疗法组合应用以及每种免疫疗法的影响因素进行确认。
推进组合免疫疗法的发展,需要在研发初期阶段就对试验药物进行评估,同时药物研发者之间需要加强协作。对于投资者而言,更多药物将会被一起使用,而不是互相竞争,这意味着将有更多的回报。相对于单个药物定价更高也意味着在未来10年内,逾300亿美元的免疫肿瘤药物市场份额也完全可以实现。
Immuno-Oncology Combinations
Thomson Reuters
The immuno-oncology drugs undergoing combination development with similar or variable techniques have been reviewed in this paper.Immuno-oncology combinations have led to a spate of research deals with big pharmaceutical companies and smaller biotechs, and these companies have moved into almost exclusively testing combinations to treat cancer.This review is based on the strategic data from Thomson Reuters Cortellis™.
immuno-oncology combinations; clinical trial; molecular target

R979.1
A
1001-5094(2015)01-0073-08
