多标记物法在心力衰竭风险评估中的应用
2015-02-01严颐丹江慧勇王艺璇何华柳晓泉
严颐丹,江慧勇,王艺璇,何华,柳晓泉
(中国药科大学药物代谢与动力学研究中心,江苏 南京 210009)
多标记物法在心力衰竭风险评估中的应用
严颐丹,江慧勇,王艺璇,何华,柳晓泉*
(中国药科大学药物代谢与动力学研究中心,江苏 南京 210009)
心力衰竭的发生发展涉及多条生理病理通路,选择不同通路中的多个生物标记物能够提高对心力衰竭风险评估的准确性。总结了心力衰竭发生发展过程中与心肌损伤、内皮功能障碍、神经激素紊乱、炎症反应、氧化应激过程相关的生物标记物,基于多标记物评价方法的数学模型及多标记物法在心力衰竭和药物心脏毒性风险评估中的应用。
多标记物法;心力衰竭;风险评估;生物标记物
心力衰竭(heart failure,HF)是冠心病、高血压、心肌梗死等多种心血管疾病的终末阶段,是最常见的心血管疾病之一。据美国心脏学会统计,每年约有55万新增的HF患者[1],因此,HF已经成为严重威胁人类健康的重大疾病之一。随着对HF的深入研究,人们逐渐将关注点放到该疾病的预测和预后方面,而不仅仅局限于疾病的治疗,但是目前仍然没有较好的评估HF风险的方法。
HF是一种涉及代谢、神经激素以及免疫系统相互作用导致心脏收缩功能障碍的复杂综合征,其发生发展涉及机体的多条生理病理通路。这些生理病理通路在HF疾病进程中并非孤立,而是相互联系、相互促进[2],形成恶性循环,共同促进疾病的恶化。心肌受损激活神经系统,引发炎症反应与氧化应激,造成内皮功能障碍等不良后果。因此,传统研究中将单一生物标记物或单一通路中的生物标记物作为考察HF这一复杂疾病的指标有其局限性,不能全面评估疾病的发生发展。目前越来越多研究表明,不同通路中的多个生物标记物合用对疾病风险分级的准确性优于单个生物标记物。本文根据文献报道,对HF发生发展过程中所涉及的生物标记物、评价多个生物标记物的分析方法以及多标记物法在HF评价中的应用进行综述。
1 与心力衰竭相关的生物标记物
1.1 反映心肌损伤的生物标记物
当心脏受到损伤时,心肌室壁压力和左室舒张末压增加,心脏负荷加重,心肌细胞膜损伤,释放肌钙蛋白(cTn),导致血液循环中cTn水平升高[3]。心肌细胞的坏死和凋亡同样会导致胞内的多种酶释放入血液。心肌酶谱中,肌酸激酶同工酶(CK-MB)在心肌损伤时具有较好的特异性和敏感性。
在诊断心肌损伤和心肌梗死中,CK-MB曾一度被认为是“金标准”。随着对cTn的深入研究,人们发现cTn的敏感性优于CK-MB,且血中的变化早于CKMB。因此,cTn正逐步取代CK-MB成为临床上检测心肌损伤的新标准。
1.2 反映神经系统激活的生物标记物
神经激素紊乱是HF发生发展的病理基础,神经激素系统主要包括交感神经系统(SNS)、肾素-血管紧张素-醛固酮系统(RAAS),此外,钠肽家族(NPs)以及其他一些神经激素也促进了HF的进程。
当心脏受损,室壁张力增加,压力感受器反射性激活SNS,抑制迷走神经系统[4]。在HF发生的早期,SNS的激活有益于心功能的代偿和维持。随着HF的发展,体内神经系统开始紊乱,如SNS过度激活,缩血管因子增多,造成水钠潴留、心肌重构和心功能损伤等不良后果[5]。
RAAS是HF发生发展中主要的病理基础之一。临床研究表明,血液循环中的肾素、血管紧张素Ⅱ(AngⅡ)和醛固酮(ALD)水平与HF的严重程度密切相关[6-7]。在HF患者体内,过度激活的RAAS导致患者血流动力学障碍。同时,外周循环中升高的肾素、AngⅡ和ALD能促进内皮细胞分泌炎症因子,损害内皮功能[8],改变细胞外基质的组成,从而促进左心室的纤维化和心室重构过程[9-10],加速HF的进程。
NPs也是维持体内平衡的神经激素,主要包括心房利钠肽(ANP)、脑钠肽(BNP)和C-型利钠肽(CNP),其共有的生理作用是利尿、利钠、舒张血管、抗纤维化、抗内皮细胞过度增殖、抗炎和调节神经内分泌等[11]。在HF发生发展过程中,心脏房、室壁压力增加,ANP和BNP分别由心房和心室大量分泌。NT-proBNP是BNP前体的裂解产物,具有敏感性强、半衰期长(60~120 min)、稳定性好等特点,是早期心功能不全的标记物[12]。
另外,诸如孤儿G蛋白偶联受体的内源性配体Apelin和内皮细胞分泌的肾上腺髓质素(ADM)等血管活性物质,具有扩血管、降血压、抑制血管平滑肌迁移和增殖、排钠利尿及对抗RAAS等多种生理作用[13-14],其浓度在HF中升高,以保持内环境的稳定。
临床上已经将BNP及NT-proBNP作为HF患者诊断、治疗和预后的“金指标”。目前,越来越多的研究也开始将ANP、Apelin和ADM等神经系统中的生物标记物作为HF的指标纳入疾病评估和风险分级中。
1.3 反映炎症反应的生物标记物
全身性炎症反应的发生发展是HF进程中重要的病理学机制之一。现公认的与HF相关的促炎因子有肿瘤坏死因子α(TNF-α)、白介素(IL)-1、IL-6和IL-18[15]。当心肌受损时,促炎因子将释放到血液循环中[16]。促炎因子通过与相应的受体结合发挥生物学效应。一些细胞膜表面的细胞因子受体被信使RNA剪切后可释放到细胞外间隙和血液循环中。由于这些受体相对分子质量大、稳定性好,它们已成为一类新的反映炎症反应过程的生物标记物[17]。例如,IL-1受体家族中的ST-2游离后成为可溶性的ST-2(sST-2)。
此外,还有一些与免疫反应相关的细胞介质,包括单核细胞趋化蛋白(MCP)-1、半乳糖凝集素(Gal)-3、C反应蛋白(CRP)和生长分化因子(GDF)-15等。MCP-1是趋化因子CC家族中的一员,可由单核细胞、血管内皮细胞和心肌细胞等多种细胞分泌[18],是炎症反应的始动因子。Gal-3是由巨噬细胞激活分泌的,能介导细胞黏附和调节其生长,抗凋亡,参与炎症反应过程及微血管形成[19]。CRP是急性炎症反应的指标,由IL-6刺激肝脏细胞及活化巨噬细胞合成,又通过激活单核细胞释放细胞因子[20]。GDF-15在心肌中的表达随心肌所受压力增大而大量增加[21],促进炎症反应的发展。
一直以来,TNF-α、IL和CRP都是临床上公认的表征炎症的因子。目前,越来越多的临床研究将sST-2、MCP-1、Gal-3、GDF-15等因子作为新的生物标记物以评价HF中的炎症反应。
1.4 反映氧化应激的生物标记物
氧化应激是由于机体受到有害刺激时产生的活性氧簇(ROS)过多,体内氧化系统和抗氧化系统失衡,导致组织损伤,引发或加重疾病。
多余的氧自由基可作用于心肌细胞膜造成脂质过氧化损伤,影响心肌的收缩和舒张功能,并损害心肌组织。血浆中的丙二醛和异前列腺素属于脂质过氧化的代谢产物,可间接反映细胞受氧自由基损害的程度。血浆中的超氧化物歧化酶是一种内源性的氧自由基清除剂,其变化可在一定程度上体现机体清除自由基的能力。
心肌受损导致心肌细胞缺血缺氧,心肌能量供应不足,ATP降解产物黄嘌呤、次黄嘌呤增多,而黄嘌呤最终代谢为尿酸的过程中产生大量ROS。大量积聚的ROS通过促进纤维细胞增殖和胶原蛋白合成上调基质金属蛋白酶家族的活性和表达,促进细胞外基质重构[22]。
目前,临床研究很少将氧化应激中相关生物标记物作为指标考察HF。在HF发生发展中,氧化应激与心肌代偿性肥大、心肌纤维化及心室重构等病理过程密切相关。因此,将与氧化应激相关的生物标记物纳入HF的评价是十分重要的。
1.5 反映内皮功能障碍的生物标记物
生理状态下的内皮是血管内的单层细胞,具有阻止血小板和白细胞黏附、控制血管壁通透性及调节血流的作用,是维持血管内平衡、保护血管的天然屏障。
一氧化氮(NO)是由内皮细胞分泌的调节内皮功能的主要因子之一[23]。在HF状态下,受损的心肌会产生大量ROS,造成内皮型一氧化氮合酶的下调和脱偶联,NO合成减少,其扩血管效应降低[24]。不对称二甲基精氨酸(ADMA)是一种内源性的一氧化氮合酶竞争性抑制剂[25]。ADMA水平的升高减少了NO的生成,进而影响到血管内皮的舒张功能,并将影响到整个心血管系统。
内皮素主要是由内皮细胞通过内皮素转化酶催化产生的缩血管因子。其表达的上调受到缺氧、血管壁收缩、炎性介质等心血管风险因子的影响,而其过度表达将影响内皮功能的平衡,进一步促进炎性反应和氧化应激的发生[26]。
目前,临床上还未将内皮功能相关的生物标记物作为HF的考察指标。动物实验已证实,NO、ADMA、内皮素等生物标记物与心血管疾病密切相关。其与HF的关系有待进一步临床研究。
HF的发生发展过程极其复杂,可因发病机制的不同分为急性失代偿性心力衰竭(ADHF)和慢性心力衰竭(CHF)。ADHF过程中,cTn、心肌酶和ADMA随心肌细胞坏死释放入血,因此三者水平的变化可用于ADHF的诊断。而其他神经激素的激活、炎症反应、氧化应激和内皮功能障碍过程中的生物标记物均贯穿于ADHF和CHF的发生发展,可用于ADHF和CHF的评价。由此可见,同时考察不同生理病理通路中多个标记物的变化为准确评估疾病的状态,进而对疾病风险进行分级提供了新的思路[27]。
2 基于多标记物评价方法的数学模型
2.1 Cox比例风险模型
目前,临床研究中常用多变量Cox比例风险模型逐步筛选生物标记物,优化其对疾病的预后效果[28]。Cox比例风险模型的一般公式为:
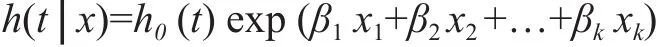
其中,h0(t)、h(t│x)分别为基础风险函数和具有协变量x的个体在时刻t的风险函数,x1、x2、…、xk表示与生存时间可能相关的协变量,β1、β2、…、βk为相应的回归系数。实验组(T)相对于对照组(C)的风险率的相对危险度(hazard ratio,HR)为:HR(T/C)=hT(t)/hC(t)。HR值越大,表明风险越高。若将某个生物标记物作为变量x加入到模型中能提高HR值,说明该生物标记物能提高模型对疾病的风险评估能力。
作为传统的处理多变量的数学模型,Cox比例风险模型已是一个成熟的疾病风险评估模型。但是由于其要求任2个个体风险函数之比不随时间而改变,同时要求任一个体的对数风险与协变量呈线性,这在实际情况下难以满足。因此,开发Cox比例风险模型的拓展模型已成为一种趋势。
2.2 多标记物指数
Biosite公司建立的一种新的多标记物法[29]是根据不同疾病选择合适的生物标记物,将各个标记物结合起来,计算出一个指数,即多标记物指数(MultimarkerIndexTM,MMX),用于评价疾病的状态,公式为:
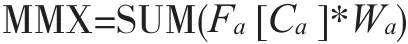
其中,Ca为标记物a的浓度,Wa为标记物a的权重,Fa为标记物a的传递函数。通常在利用标记物对疾病进行诊断时存在一个切分浓度,标记物的浓度在健康人和病人中都呈现正态分布。因而在切分值附近健康人和病人标记物的浓度通常会出现重叠(见图1)[29]。在此方法中,当标记物的浓度高于或低于重叠范围的浓度时,Fa的值为1或0;当标记物的浓度处于重叠范围内时,Fa的值与标记物的浓度成正比。测定2 172例急性心肌梗死病人血浆中CK-MB、cTnI、肌红蛋白以及BNP后比较MMX指数与单个标记物对急性心肌缺血诊断的95%置信区间,结果表明:采用MMX指数的多标记物法对于急性心肌缺血的诊断优于单标记物诊断法。
该模型的应用过程中,需要针对每一个生物标记物进行预判,从而进行评分。在预判过程中,需要对正常人群和患者进行大样本量统计分析,获得生物标记物分布图。因此其不适用于小样本分析。
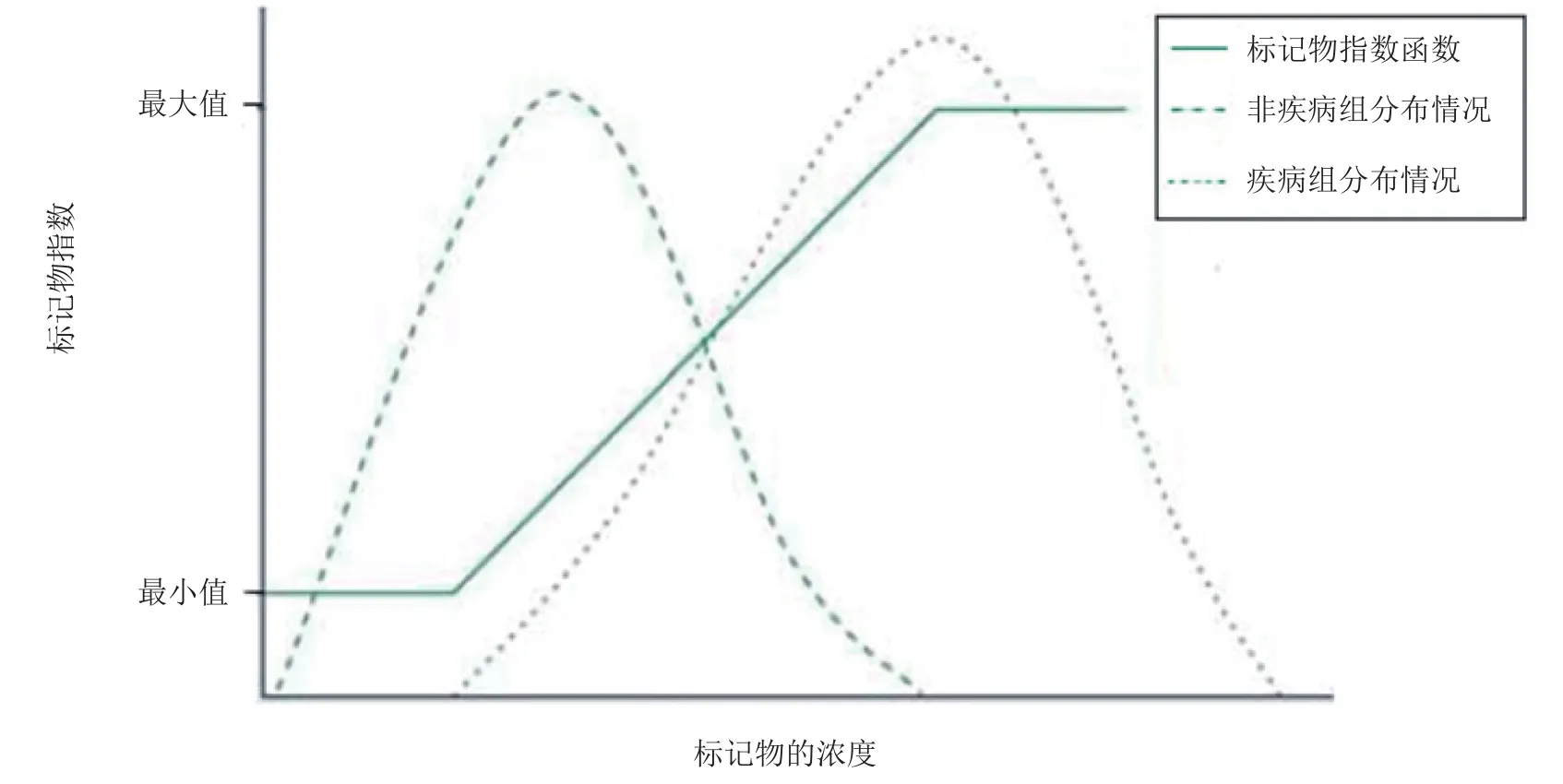
图1 标记物指数在正常人和患者中的分布情况Figure1 The distribution of biomarker index between healthy subjects and patients with the disease in question
2.3 分类回归树法
分类回归树算法是一种基于经验统计的方法。在此模型中,根据经验统计结果建立分类树。由某一标记物测试结果的阴性或阳性定位到分类树2个子树中的一个,根据其他不同的标记物继续定位下一级子树,直到最后一个标记物即可完成疾病风险的预测或分级。例如,Möckel等[30]以死亡和重症监护作为结果指标,以年龄、NT-proBNP、CRP作为标记物,并利用回归分析法对分类的顺序进行优化,得到了如图2所示的分类树。
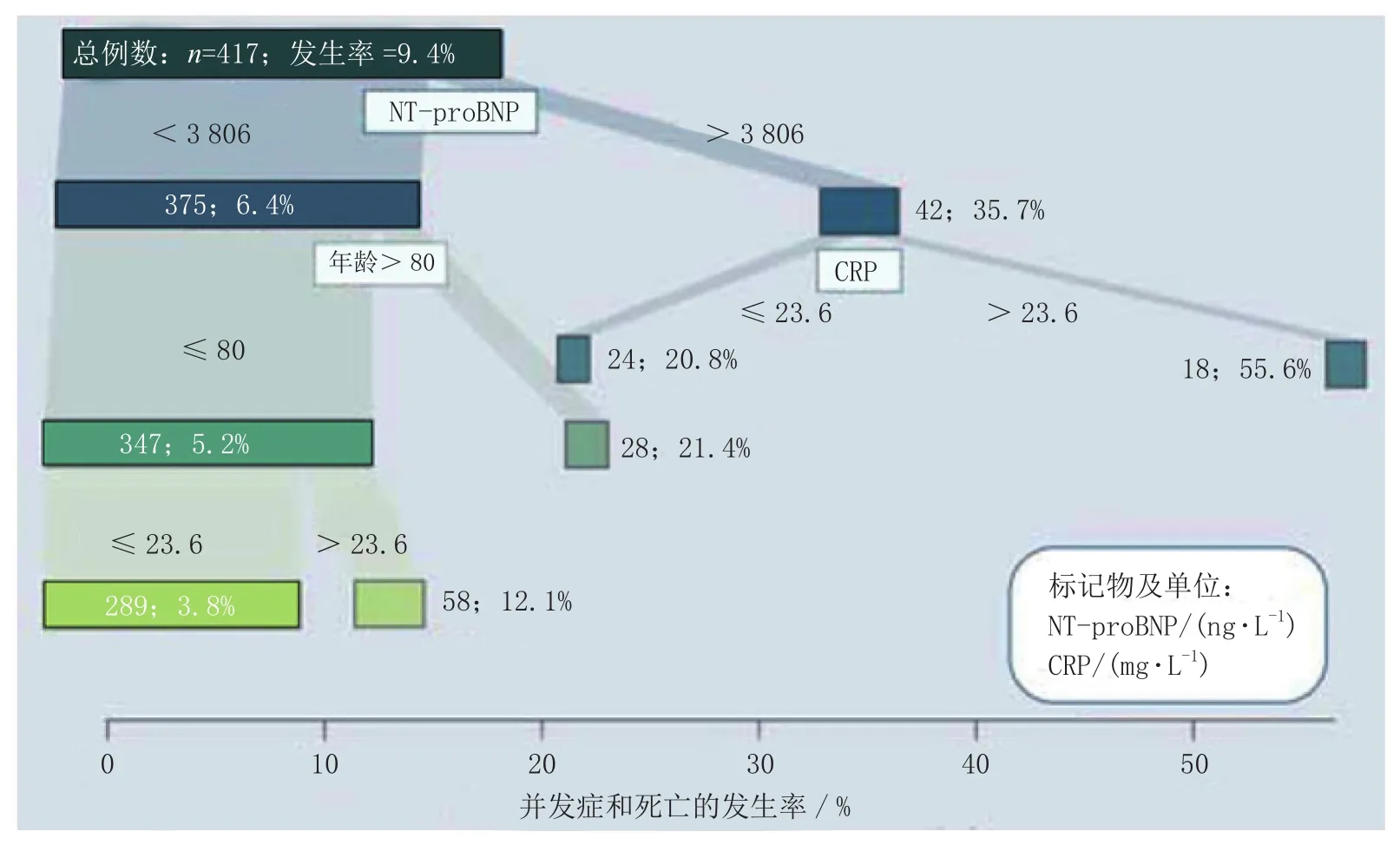
图2 分类回归树法对急诊患者进行风险分层的示意图Figure 2 Schematic diagram of risk classification of emergency patients by regression trees analysis method
根据病人的年龄以及NT-proBNP、CRP的浓度,依据分类树即可对病人进行风险分级。当NT-proBNP和CRP处于正常水平且年龄低于80岁时发生不良事件的概率较小;而NT-proBNP和CRP水平升高预示着不良反应事件概率的升高。年龄在NT-proBNP水平正常的病人分级中具有重要作用。当病人年龄高于80岁时,即使NT-proBNP水平正常,发生不良事件的概率也显著提高。
分类回归树法是将疾病以标记物切分点进行划分,而切分点选择的不同将导致分支的不同,最终产生不同的分类树。因此,当样本量较小时该模型缺乏稳健性,其适用于大样本量分析。
2.4 神经网络模型
神经网络是一种非线性人工智能模式。利用多个生物标记物的浓度和临床结果对该网络进行训练,建立二者之间的联系。当训练完成后即可将多个标记物的浓度代入神经网络模型,最后该模型经过计算得出是否有风险的结论。如图3所示,它通过生物标记物对疾病状态进行评估以判断疾病的风险[29]。Baxt等[31]利用包括生化指标、心电图指标、血压等在内的40个变量建立了神经网络模型,用于对胸痛病人心肌梗死的诊断。虽然结果显示该模型在对心肌梗死的诊断上具有良好的敏感性和特异性,然而与单用肌钙蛋白相比,该模型并没有表现出明显的优势。
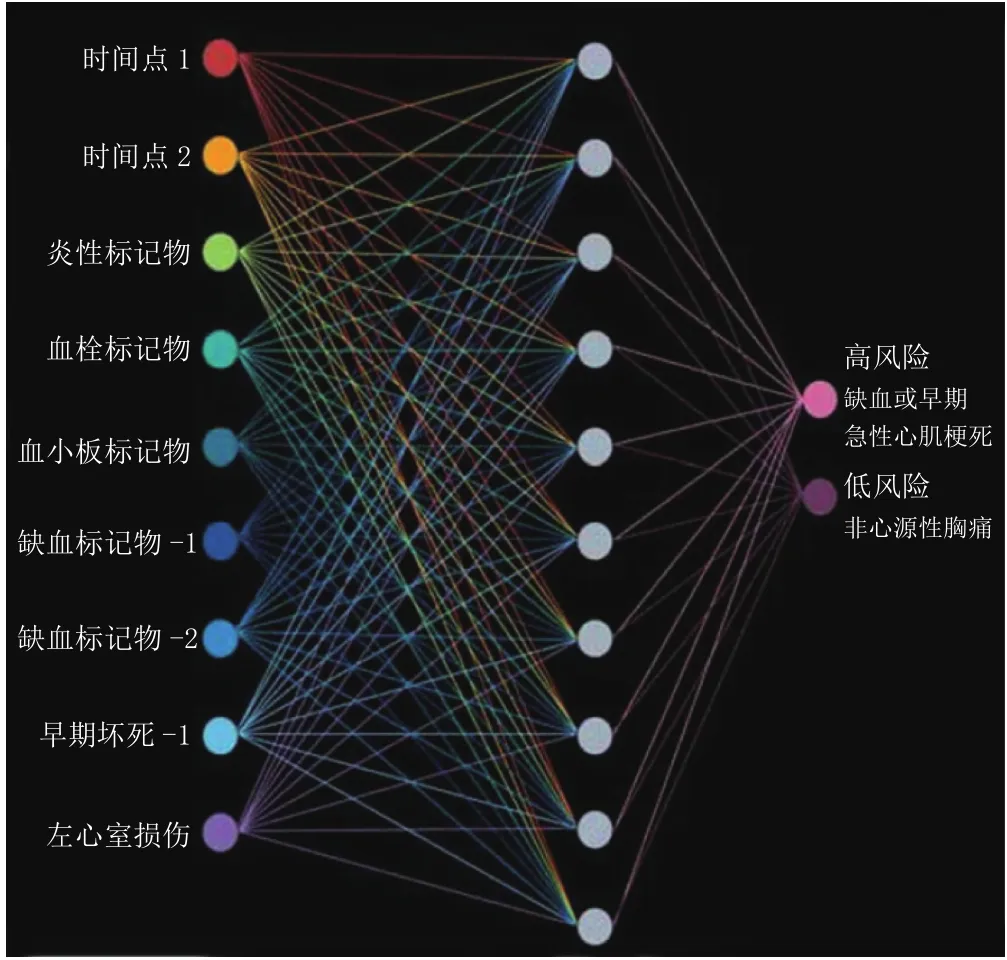
图3 利用神经网络模型分析多个标记物的示意图Figure 3 Schematic diagram of multimarker analysis by using neural network model
神经网络与MMX、回归分类树法不同,它并不需要针对每一个生物标记物进行预判。而Baxt等开展的实验提示我们,该模型的预后效果与所选择的变量密切相关,需要对变量进行筛选。
2.5 受试者工作特征曲线
受试者工作特征曲线(ROC曲线)是反映敏感性和特异性连续变量的综合指标。ROC曲线是以试验结果的每一个值作为可能的诊断界值,由此计算得到相应的灵敏度和特异度,以假阳性率(1-特异度)为横坐标,以真阳性率(灵敏度)为纵坐标绘制而成的曲线,其曲线下面积(AUC)的大小可作为预测试验准确度的衡量指标,其取值范围为0.5~1,AUC越接近于1,则表明诊断方法的准确性越高。因此,ROC曲线常用于评价基于多标记物法的数学模型的预后效果,以选择预测准确性较高的数学模型。
相比于传统的单标记物法,多标记物法通过考察多种生物标记物,反映了机体疾病发生后多种生理病理过程的变化,从整体上对疾病的状态和风险进行评估,因此多标记物法在疾病诊断和风险分级方面具有更高的准确性。目前,对于多标记物法的研究仍处于探索阶段,其在实际应用中还存在局限性。因此,如何利用多个标记物整体地对疾病进行诊断以及风险分级仍需建立更加完善的算法以及数学模型。
3 多标记物法在心力衰竭预测及预后中的应用
3.1 多标记物法在评价ADHF中的应用
在一个应用pro-BNP诊断疑似ADHF患者研究的分支研究中,研究者对209例ADHF患者的NT-proBNP、Gal-3及apelin水平进行检测,将60天的死亡率作为结果进行统计分析。结果显示,单独的NT-proBNP或Gal-3预测ADHF患者死亡的准确性较高,而apelin则不能预测死亡。其中,Gal-3水平高的患者的死亡风险是NT-proBNP水平高的患者的5倍[优势比(OR):10.3 vs 2.11]。当同时考察NT-proBNP和Gal-3预测患者死亡风险时,其预后准确性高于单个标记物[32]。
在另一项研究中,560例患者被随访,其中180例为ADHF患者,其余为疑似ADHF患者[33]。研究者收集患者血浆中NT-proBNP、MR-proADM、MR-proANP和Gal-3的数据,并将1年和4年内的死亡例数作为主要结果进行分析。1年死亡率的统计分析发现,将NT-proBNP单独、MR-proADM和NT-proBNP二者同时、NT-proBNP、MR-proADM和MR-proANP三者同时加入临床统计模型进行分析时,该模型的预后准确性逐步提高。4年死亡率统计分析中,NT-proBNP、MR-proADM、MR-proANP三者同时运用于模型与单独使用NT-proBNP的模型相比,预后准确性有了显著性提高。研究者将MR-proADM和MR-proANP加入多变量Cox模型,发现二者水平同时升高的HR是单个标记物水平升高的2倍以上。
Pascual-Figal等[34]对107例ADHF住院患者血样中的sST2、高敏肌钙蛋白T(hs-TnT)及NT-proBNP浓度进行为期739 d的跟踪监测。经Bootstrap法统计分析,3个生物标记物对于死亡风险的预测都是独立的。根据ROC分析中的cut-off值可知,所有死亡的ADHF患者中至少有1个生物标记物浓度高于其相应的cut-off值,并且死亡率随着超限的生物标记物个数的增加而增加。存活曲线显示,生物标记物水平能够用于疾病发生后一年的预后评价,可将ADHF患者分为低风险(0~1个生物标记物水平升高)和高风险(2个及以上生物标记物水平升高)这2类,为临床个体化治疗提供了依据。
3.2 多标记物法在评价CHF中的应用
Ky等[35]通过研究HF发生发展过程中所涉及的多个通路中的生物标记物群评价其预后效果。该研究对1 513例CHF门诊患者血样中hs-CRP、MPO、尿酸、BNP、可溶性fms样酪氨酸激酶受体-1(sFlt-1)、cTnI、sST2和肌酐进行测定,通过综合考察多个代谢通路,预期在经典的临床风险评估模型的基础上提高对CHF患者不良后果(如心脏移植、心室辅助器、死亡等)的风险评估。研究发现:标记物评分较高患者的风险远大于评分较低患者。研究者通过ROC分析发现,多标记物评分法能提高患者的风险评估,且当多标记物评分纳入经典算法中时,24.1%的患者将被重新分级,进入较高风险的分级中。该研究认为,多标记物法是一种能全面评价HF患者风险的方法,然而找到“最优”的多标记物组合还需要进一步的研究优化。
另外,在一个由CHF患者参加的临床研究中,Lupón等[36]考察了876例患者的NT-proBNP、sST2和hs-TnT水平,并对三者的联系进行了分析。该研究将3个生物标记物加入到已建立的分析模型中,模型已包含的11个风险因子是年龄、性别、缺血病因、射血分数、纽约心脏协会心功能分级、糖尿病、肾小球滤过率、血钠水平、血红蛋白浓度、β阻滞剂治疗药物及肾素-血管紧张素转换酶抑制剂或血管紧张素受体阻滞剂的使用。ROC分析显示,虽然NT-proBNP加入模型并没有提高预后的准确性,但sST2和hs-TnT的加入将AUC由0.76提高到0.789。该研究结果提示,生物标记物的选择与HF的预后准确性密切相关。
将NPs分别和sST2或hs-TnT联用已在早期的研究中报道过[37-38],而Lupón等的研究通过不同的分析方法对三者相关性进行了研究,结果显示:1)当sST2或hs-TnT水平低于其cut-off值时,NT-proBNP能够增加预后的准确性;2)NT-proBNP并不能提高sST2和hs-TnT联用模型的预后准确性和再分级指数[36]。综上所述,sST2和hs-TnT是CHF内环境中与后续不良后果密切相关的生物标记物。
Gaggin等[39]对151例心功能分级在Ⅱ-Ⅳ级的CHF患者进行跟踪,检测血样中GDF-15、sST2和hs-TnT水平,并将HF病征的恶化、因ADHF导致住院、严重的心律失常、急性冠脉综合征、脑缺血和死亡等作为结果考察3个生物标记物的预后效果。结果显示,这3个生物标记物间没有较强的相关性,当它们加入到包括NT-proBNP在内的经典临床生化指标中时,它们的预后信息同时具有独立性和加和性。
3.3 多标记物法在药物心脏毒性评价中的应用
在一项关于乳腺癌治疗药物心脏毒性的评价研究中,研究者将78例同时接受多柔比星和曲妥珠单抗治疗的乳腺癌患者作为研究对象,选择cTnI、hs-CRP、NT-proBNP、GDF-15、MPO、胎盘生长因子(PIGF)、sFlt-1和Gal-3这8个生物标记物作为评价药物心脏毒性的指标[40]。结果显示,患者体内cTnI、hs-CRP、GDF-15、MPO、PlG和sFlt-1浓度均在联合用药后升高。其中,cTnI和MPO水平与药物心脏毒性风险的相关性最大,当患者体内两者浓度均大幅升高时,心脏毒性风险为46.5%。因此,研究者认为早期cTnI和MPO水平的升高可预测药物的心脏毒性风险。目前,很多有效药物在临床上的应用受到其心脏毒性的限制,应用多标记物法对接受药物治疗患者的心功能进行监测,预测心脏毒性风险,可促进临床安全用药。
从现有的研究可知,多标记物法能够通过提供多条生理病理通路的信息,全面评价疾病状态,提高疾病的风险评估,其对于临床诊断与治疗具有重要意义。然而,与HF发生发展密切相关的生物标记物还有很多,如何选择生物标记物以优化该方法仍然有待研究。
4 展望
将多标记物法用于HF的预测和预后的研究才刚刚起步。一些与HF发生发展过程紧密相关的生物标记物(如cTn、NPs等)已广泛应用于临床,然而,这些单独的生物标记物并不能完整反映复杂疾病的状态,也不能全面预测不良后果。因此,多标记物法在HF风险评估中的应用与发展将成为一种趋势。
多标记物法通过对患者体内生物标记物的量化将疾病进行量化、分级,从而指导临床个体化治疗,其相比于传统的风险分级更加细化。目前研究显示,还有很多新的有效的生物标记物有待纳入多标记物法中进行研究,以进一步改善HF这一复杂疾病的诊断、治疗和预后效果。因此,将多条生理病理通路中的多个生物标记物纳入评价体系,以及选择有效的生物标记物群以优化该体系已成为研究的热点。同时,提高多标记物法评价体系的准确性和有效性也至关重要。在这一过程中,选择合适的数学统计方法同时分析多个生物标记物以共同评价疾病状态,提高疾病预测和预后的准确性将成为新的研究方向。
[1]Baker D W.Prevention of heart failure[J].J Card Fail, 2002, 8(5): 333-346.
[2]Smith J G, Newton-Cheh C, Almgren P, et al.Assessment of conventional cardiovascular risk factors and multiple biomarkers for the prediction of incident heart failure and atrial fbrillation[J].J Am Coll Cardiol, 2010, 56(21): 1712-1719.
[3]Sato Y, Fujiwara H, Takatsu Y.Cardiac troponin and heart failure in the era of high-sensitivity assays[J].J Cardiol, 2012, 60(3): 160-167.
[4]Schwartz P J, De Ferrari G M.Sympathetic-parasympathetic interaction in health and disease: abnormalities and relevance in heart failure[J].Heart Fail Rev, 2011, 16(2): 101-107.
[5]Triposkiadis F, Karayannis G, Giamouzis G, et al.The sympathetic nervous system in heart failurephysiology, pathophysiology, and clinical implications[J].J Am Coll Cardiol, 2009, 54(19): 1747-1762.
[6]Ferreira J P, Santos M, Almeida S, et al.High-dose spironolactone changes renin and aldosterone levels in acutely decompensated heart failure[J].CoretVasa, 2014, 56: e463-e470.
[7]Dzau V J, Colucci W S, Hollenberg N K, et al.Relation of the reninangiotensin-aldosterone system to clinical state in congestive heart failure[J].Circulation, 1981, 63(3): 645-651.
[8]Emdin M, Fatini C, Mirizzi G, et al.Biomarkers of activation of reninangiotensin-aldosterone system in heart failure: how useful, how feasible?[J].Clin Chim Acta, 2015, 443: 85-93.
[9]Mehta P K, Griendling K K.Angiotensin II cell signaling: physiological and pathological effects in the cardiovascular system[J].Am J Physiol Cell Physiol, 2007, 292(1): C82-C97.
[10]Xiao T, Zhang Y, Wang Y, et al.Activation of an apoptotic signal transduction pathway involved in the upregulation of calpain and apoptosis-inducing factor in aldosterone-induced primary cultured cardiomyocytes[J].Food Chem Toxicol, 2013, 53: 364-370.
[11]Guo S, Barringer F, Zois N E, et al.Natriuretic peptides and cerebral hemodynamics[J].Regul Pept, 2014, 192: 15-23.
[12]Luers C, Sutcliffe A, Binder L, et al.NT-proANP and NT-proBNP as prognostic markers in patients with acute decompensated heart failure of different etiologies[J].Clin Biochem, 2013, 46(12): 1013-1019.
[13]Holmager P, Schou M, Egstrup M, et al.The influence of diabetes mellitus on midregional proadrenomedullin concentrations and prognostic value in heart failure outpatients [J].J Card Fail, 2015, 21 (3): 250-257.
[14]Tycinska A M, Lisowska A, Musial W J, et al.Apelin in acute myocardial infarction and heart failure induced by ischemia[J].Clin Chim Acta, 2012, 413(3): 406-410.
[15]Bozkurt B, Mann D L, Deswal A.Biomarkers of infammation in heart failure[J].Heart Failure Rev, 2010, 15(4): 331-341.
[16]Doroudgar S, Glembotski C C.The cardiokine story unfolds: ischemic stress-induced protein secretion in the heart[J].Trends Mol Med, 2011, 17(4): 207-214.
[17]Hartupee J, Mann D L.Positioning of infammatory biomarkers in theheart failure landscape[J].J Cardiovasc Transl, 2013, 6(4): 485-492.
[18]Nakamura Y, Yamada Y, Shimomura H, et al.Effect of edaravone on plasma monocyte chemoattractant protein-1 levels in patients with acute myocardial infarction[J].J Cardiol, 2009, 54(3): 416-424.
[19]Filipe M D, Meijers W C, van der Velde A R, et al.Galectin-3 and heart failure: prognosis, prediction & clinical utility [J].Clin Chim Acta, 2015, 443: 48-56.
[20]Kalogeropoulos A P, Tang W H, Hsu A, et al.High-sensitivity C-reactive protein in acute heart failure: insights from the ASCEND-HF trial[J].J Card Fail, 2014, 20(5): 319-326.
[21]Kempf T, von Haehling S, Peter T, et al.Prognostic utility of growth differentiation factor-15 in patients with chronic heart failure[J].J Am Coll Cardiol, 2007, 50(11): 1054-1060.
[22]Spinale F G.Matrix metalloproteinases regulation and dysregulation in the failing heart[J].Circ Res, 2002, 90(5): 520-530.
[23]Sena C M, Pereira A M, Seiça R.Endothelial dysfunction——a major mediator of diabetic vascular disease[J].Biochim Biophys Acta, 2013, 1832(12): 2216-2231.
[24]Marti C N, Gheorghiade M, Kalogeropoulos A P, et al.Endothelial dysfunction, arterial stiffness, and heart failure[J].J Am Coll Cardiol, 2012, 60(16): 1455-1469.
[25]Blackwell S.The biochemistry, measurement and current clinical significance of asymmetric dimethylarginine[J].Ann Clin Biochem, 2010, 47(1): 17-28.
[26]Galindo-Fraga A, Arrieta O, Castillo-Martı́nez L, et al.Elevation of plasmatic endothelin in patients with heart failure[J].Arch Med Res, 2003, 34(5): 367-372.
[27]Fertin M, Dubois E, Belliard A, et al.Usefulness of circulating biomarkers for the prediction of left ventricular remodeling after myocardial infarction[J].Am J Cardiol, 2012, 110(2): 277-283.
[28]Nozaki T, Sugiyama S, Koga H, et al.Significance of a multiple biomarkers strategy including endothelial dysfunction to improve risk stratifcation for cardiovascular events in patients at high risk for coronary heart disease[J].J Am Coll Cardiol, 2009, 54(7): 601-608.
[29]Wu A H.Early detection of acute coronary syndromes and risk stratifcation by multimarkeranalysis[J].Biomark Med,2007, 1(1): 45-57.
[30]Möckel M, Müller R, Vollert J O, et al.Role of N-terminal pro-B-type natriuretic peptide in risk stratification in patients presenting in the emergency room[J].Clin Chem, 2005, 51(9): 1624-1631.
[31]Baxt W G, Shofer F S, Sites F D, et al.A neural computational aid to the diagnosis of acute myocardial infarction[J].Ann Emerg Med, 2002, 39(4): 366-373.
[32]vanKimmenade R R, Januzzi J L, Ellinor P T, et al.Utility of aminoterminal pro-brain natriuretic peptide, galectin-3, and apelin for the evaluation of patients with acute heart failure[J].J Am Coll Cardiol, 2006, 48(6): 1217-1224.
[33]Shah R V, Truong Q A, Gaggin H K, et al.Mid-regional pro-atrial natriuretic peptide and pro-adrenomedullin testing for the diagnostic and prognostic evaluation of patients with acute dyspnoea[J].Eur Heart J, 2012, 33: 2197-2205.
[34]Pascual-Figal D A, Manzano-Fernández S, Boronat M, et al.Soluble ST2, high-sensitivity troponin Tand N-terminal pro-B-type natriuretic peptide: complementary role for risk stratification in acutely decompensated heart failure[J].Eur J Heart Fail, 2011, 13(7): 718-725.
[35]Ky B, French B, Levy W C, et al.Multiple biomarkers for risk prediction in chronic heart failure[J].Circ Heart Fail, 2012, 5(2): 183-190.
[36]Lupón J, de Antonio M, Galán A, et al.Combined use of the novel biomarkers high-sensitivity troponin T and ST2 for heart failure risk stratifcation vs conventional assessment [J] Mayo Clin Proc, 2013, 88 (3): 234-243.
[37]Bayes-Genis A, de Antonio M, Galán A, et al.Combined use of highsensitivity ST2 and NTproBNP to improve the prediction of death in heart failure[J].Eur J Heart Fail, 2012, 14(1): 32-38.
[38]de Antonio M, Lupon J, Galan A, et al.Combined use of high-sensitivity cardiac troponin T and N-terminal pro-B type natriuretic peptide improves measurements of performance over established mortality risk factors in chronic heart failure[J].Am Heart J, 2012, 163(5): 821-828.
[39]Gaggin H K, Szymonifka J, Bhardwaj A, et al.Head-to-head comparison of serial soluble ST2, growth differentiation factor-15, and highly-sensitive troponin T measurements in patients with chronic heart failure[J].JACC Heart Fail, 2014, 2(1): 65-72.
[40]Ky B, Putt M, Sawaya H, et al.Early increases in multiple biomarkers predict subsequent cardiotoxicity in patients with breast cancer treated with doxorubicin, taxanes, and trastuzumab[J].J Am Coll Cardiol, 2014, 63(8): 809-816.
Application of Multimarker Approach in Risk
Assessment for Heart Failure
YAN Yidan, JIANG Huiyong, WANG Yixuan, HE Hua, LIU Xiaoquan
(Center of Drug Metabolism and Pharmacokinetics, China Pharmaceutical University, Nanjing 210009, China)
As a complex disease, heart failure is related to diverse pathophysiological pathways which can be assessed by several biomarkers.Combined use of these biomarkers could better assess the risk in heart failure.The biomarkers in pathophysiological pathways such as myocardial injury, endothelial dysfunction, neurohormone disorder, infammation and oxidative stress in the progress of heart failure,mathematical models for multimarker analysis, as well as multimarker approach for risk assessment in heart failure and cardiotoxicity of drugs have been summarized in this paper.
multimarker approach; heart failure; risk assessment; biomarker
R969.1
A
1001-5094(2015)01-0040-08
接受日期:2014-11-25
*通讯作者:柳晓泉,教授;
研究方向:药物代谢动力学;
Tel:025-83271260;E-mail:lxq@cpu.edu.cn
