聚乙二醇在化疗药物成药性研究中的应用
——以阿霉素为例
2015-02-01王林丁娅张灿
王林,丁娅,张灿
(1.中国药科大学药物质量与安全预警教育部重点实验室,江苏 南京 210009;2.中国药科大学药物科学研究院,江苏 南京210009)
聚乙二醇在化疗药物成药性研究中的应用
——以阿霉素为例
王林1,2,丁娅1*,张灿2**
(1.中国药科大学药物质量与安全预警教育部重点实验室,江苏 南京 210009;2.中国药科大学药物科学研究院,江苏 南京210009)
多数抗肿瘤药物的水溶性差、系统毒性和多药耐药性已成为其临床应用所面临的主要问题,而利用聚乙二醇材料构建前药或合适的递药系统来克服这些问题,备受广大药学研究者的关注。以具有良好抗肿瘤活性和分子荧光特性的阿霉素为例,综述聚乙二醇在化疗药物前药和递药系统的构建及制备等成药性研究中的应用,为高效低毒抗肿瘤药品的进一步研究与开发提供参考。
聚乙二醇;阿霉素;化疗药物;成药性;前药;递药系统
癌症已成为继心血管疾病之后,威胁人类健康的头号杀手。化疗是目前癌症治疗的重要手段,但多数抗肿瘤药物都存在水溶性差、毒副作用大、易产生耐药性等缺点。因此,设计开发出低毒、高效、专属靶向的药物传递系统,对于抗肿瘤药物的临床应用具有重要意义。
为了提高抗肿瘤药物的效用,降低其毒副作用,前药策略和各种递药系统已被开发用于药物的转运,如纳米粒[1-2]、聚合共轭物[3-4]、胶束[5-6]、脂质体[7-9]等,所用材料也种类繁多,包括天然产物如碳水化合物[10]、脂类[11]、人血清蛋白[12]、壳聚糖[13]等以及一些合成材料如金纳米粒子[14]、聚乳酸(PLA)[15]、聚乙烯吡咯烷酮[16]、聚乙二醇(polyethylene glycol, PEG)/聚乙二醇单甲醚(mPEG)(1)[1-8]等,其中PEG具有良好的水溶性和生物相容性,且它的使用可减少药物被血浆蛋白和内皮网状系统摄取,故PEG已被广泛用于抗肿瘤前药和递药系统的构建。而阿霉素(doxorubicin, DOX, 2)由于其良好的抗肿瘤活性和红色荧光特性,已被作为一种模型药物广泛用于各种抗癌药物传递系统的性能研究。因此,本文以DOX为例,对PEG在化疗药物成药性研究(包括前药和递药系统的构建及制备)中的应用进行分析和探讨,并对相关研究作一综述,为高效低毒抗肿瘤药品的进一步研究与开发提供参考。
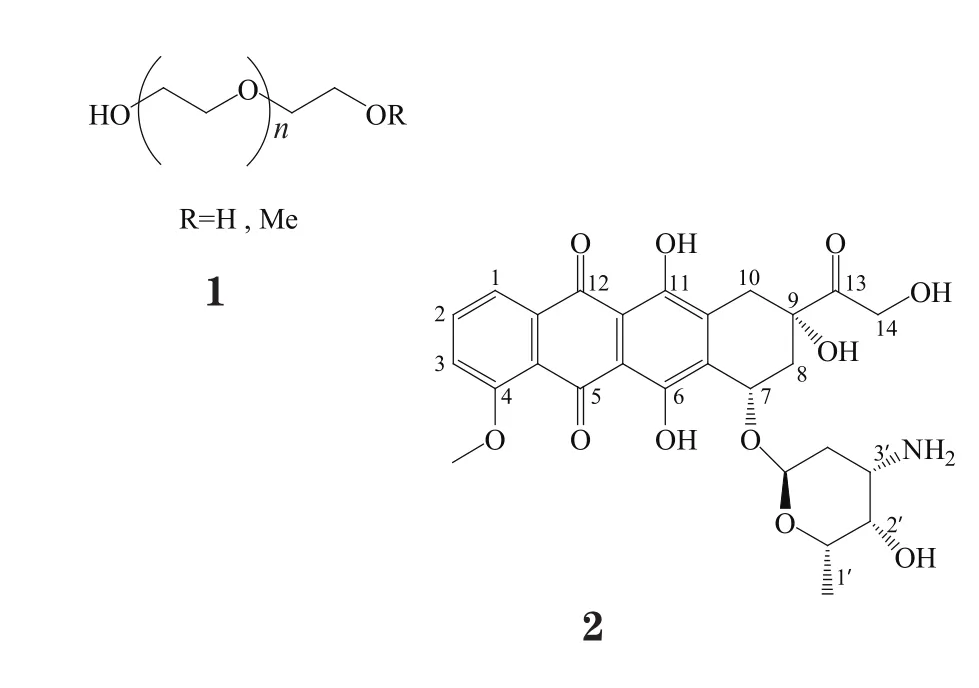
1 阿霉素
DOX是一种蒽环类抗肿瘤抗生素,可嵌入DNA分子中,与DNA形成稳定的复合物,抑制肿瘤细胞RNA和DNA的合成,从而发挥抑制肿瘤细胞生长的作用(Momparler等, Cancer Res, 1976年; Fornari等, Mol Pharmacol, 1994年)。DOX抗瘤谱广,对不同生长周期的肿瘤细胞都有杀灭作用,属细胞周期非特异性抗肿瘤药物,临床上通常用于治疗白血病、霍奇金淋巴瘤、膀胱癌、乳腺癌、胃癌、肺癌、卵巢癌、甲状腺癌、软组织肉瘤、多发性骨髓瘤等[17]。
与大多数抗肿瘤药物一样,DOX缺乏对肿瘤细胞的选择性,其主要的毒副作用为抑制骨髓造血功能和心脏毒性,当其累积剂量达到55 mg·m-2时,可致充血性心衰、扩张型心肌病甚至死亡的风险显著提高[18-20]。
此外,随着DOX的多次使用,会使肿瘤产生耐药性,这种现象主要与肿瘤细胞的多种主动转运蛋白相关。由于耐药性的出现,需要增大DOX的使用剂量,这又导致其毒副作用相应增大,致使DOX的临床应用受限。
2 聚乙二醇
PEG是一种pH中性、无毒、水溶性良好的亲水聚合物,重复单元为氧乙烯基,端基为2个羟基,呈线性或支化链状结构(Bailon等, Pharm Sci Technol Today, 1998年),而其单甲醚衍生物则是一端为羟基、另一端为甲氧基的聚合物。PEG是蛋白和细胞吸附水平最低的已知聚合物(Hooftman等, J Bioact Compat Polym, 1996年),广泛用于药物制剂及相关药物转运系统的合成和构建,由于其低毒性和良好的生物相容性,已被美国FDA批准为体内注射药用聚合物。在体内,PEG化的药物或递药系统可减少药物的肾脏滤过、网状内皮系统摄取以及酶降解,延长药物的半衰期,改善其生物利用度,增加药物在肿瘤部位的蓄积,从而降低给药频率和给药剂量,减小药物的毒副作用。
3 前药
DOX结构中有3个功能化基团:14-OH、3'-NH2和13-C O,它们可与相应配体形成酯键、酰胺键和pH敏感的腙键,这为设计结构相对简单的DOX-PEG前药提供了可能。通过共价键的方式在DOX功能基团上直接或通过连接臂修饰上PEG分子,能提高DOX在体内的稳定性,延长其体内循环时间,增加其在肿瘤部位的蓄积,降低DOX的系统毒性;且与DOX包埋在修饰有PEG的载体中构成的递药系统相比,DOX-PEG具有稳定性高、可控性好等优点;此外,在一定浓度下,DOX-PEG可在溶液中自组装形成胶束,兼具纳米药物载体的传递特征。在DOX-PEG前药的设计中,有两方面的问题值得关注,即所用PEG的分子质量范围和前药主动靶向功能的设计。
在聚合物-抗癌药物前药的设计研究中,常用的聚合物有甲基丙稀酸羟基丙基酯(HPMA)[21]、PEG(Greenwald等, J Med Chem, 1996年)和聚谷氨酸(PGA)。严格来说,这些聚合物中只有PGA是生物可降解的,它可被溶酶体巯基酶水解成二谷氨酰基衍生物(de Vries 等, Clin Cancer Res, 2000年)。尽管PEG和HPMA无免疫原性,但它们不可生物降解,只有当分子质量低于肾脏截留阈值时它们才是安全的。鉴于此,并考虑到商业化产品供应的实际情况(市售PEG的分子质量多为200~20 000 g·mol-1),用PEG设计和制备前药或递药系统时,目前大多采用分子质量小于20 000 g·mol-1的PEG产品。
当然,选用的PEG分子质量也并非越小越好。Veronese等[5]设计制备了多种PEG-肽链-DOX共轭物,并考察了不同分子质量(5 000、10 000和20 000 g ·mol-1)PEG修饰的共轭物在血液循环中消除和在肿瘤中聚集的特性。结果发现,所用PEG的分子质量越大,共轭物的血浆滞留时间越长,肿瘤聚集效应越好;而且,与DOX相比,该共轭物具有更好的肿瘤靶向作用和更低的心脏毒性;然而,该共轭物的生物分布并不呈现明显的PEG分子质量依赖性。
为了同时实现PEG材料的体内长循环和生物消除,Andersson等[6]设计制备了马来酸二丁酯(DBM)-PEG4000-S-PEG3000-肽键-DOX抗肿瘤共轭物,实验发现,其释药行为并不理想,但DBM-PEG4000-S-PEG3000链在pH7.4和温度为37 ℃的条件下可生物降解为低分子质量链段,进而在体内消除。
Pawar等[22]则设计合成了N-乙酰基葡糖胺(NAG)-聚乙二醇-DOX(NAG-PEG-DOX)共轭物,用于DOX的主动靶向转运,其中PEG起到延长药物的血浆循环时间的作用,而NAG为肿瘤主动靶向基团,靶向作用于肿瘤细胞上过度表达的NAG受体(NAGR)。研究显示,该靶向共轭物结构稳定,且相对于单纯DOX,对肿瘤具有更高的渗透性和滞留效应。
总的来说,近年来对PEG-DOX前药的研究并不多,但采用结构相对简单、可控的共价结合物形式来改善药物的体内转运,具有良好的应用前景。
4 递药系统
相比于结构相对简单的DOX-PEG前药,PEG化的其他DOX递药系统,如脂质体、胶束、纳米粒和水凝胶,其结构更具灵活性和可修饰性,所用材料的选择也更广泛,并可进行不同的功能化修饰。
4.1 脂质体
药剂学定义的脂质体是指将药物包封于类脂质双分子层内而形成的微型泡囊体,其双分子层结构将所在空间划分成3个部分:外层水相、双分子层疏水区域和亲水内核,因此脂溶性或水溶性药物它均可包载。选用适宜材料制备的脂质体可使被包封药物具有肿瘤靶向性、淋巴定向性、缓释性、细胞亲和性和组织相容性,并降低药物毒性,提高药物稳定性。通常情况下,亲水性材料PEG大多被用于组成脂质体的外层水相,并将药物通过物理包裹的方式直接制得药物脂质体,或者将脂质体经适宜的配体基团修饰后再与药物的相应位点(如DOX的14-OH、3'-NH2和13-C O)共价结合而制得共轭物,进而在水相中形成相应的PEG-药物脂质体。
Doxil即是一种经PEG修饰的DOX脂质体注射制剂,于2005年1月获美国FDA批准,用于治疗卵巢癌、多发性骨髓瘤以及经铂类化疗后病情仍进展或复发的卵巢癌病人和艾滋病相关的卡波西肉瘤。Doxil采用了一种称为“隐蔽技术”(stealth technology)的方法,将DOX脂质体表面与mPEG结合,获得隐蔽DOX脂质体。而mPEG的结合与包裹对该隐蔽脂质体起到保护作用,可使其免受单核巨噬细胞系统的吞噬,延长药物的血液循环时间,并降低药物的心脏毒性,促进肿瘤靶组织对药物的吸收[9]( 又见:Dorr, Semin Oncol, 1996年; Ewer等, Semin Oncol, 1999年)。
不过,mPEG涂层导致Doxil优先聚集在皮肤,增添了该制剂诱发肢端红肿症等副作用。临床试验显示,若每4周给予50 mg·m-2剂量的Doxil,会导致50.6%的受试者产生手足综合征。DOX虽然经脂质体包裹后的心脏毒性较未包裹时降低许多,但Doxil所致手足综合征副作用限制了其与DOX联用或替代DOX用于治疗。而且,值得一提的是,从理论上来说,蒽环类药物如DOX或Doxil,应能安全地与其他具有心脏毒性的化疗药物(如曲妥珠单抗)同时使用,但美国FDA发布的黑框警告提示,曲妥珠单抗不能与蒽环类药物联用,只能单独使用。这是因为,虽然曲妥珠单抗与蒽环类药物联用在临床研究中获得较好的抗肿瘤疗效,但却会产生无法承受的心脏毒性,包括心脏衰竭所致充血性心衰(CHF)[9]( 又见:Dorr, Semin Oncol, 1996年; Ewer等, Semin Oncol, 1999年)。
Doxil虽能提高DOX的抗肿瘤效果和降低心脏毒性,但对肿瘤组织和细胞缺乏主动靶向功能。MCC-465是一种包载DOX的免疫脂质体制剂,这种脂质体同时被PEG和人单抗GAH的 F(ab')2片段所修饰,其中PEG可使脂质体在体内长循环,并能增强脂质体在肿瘤组织中的通透性和滞留效应(EPR效应),而人单抗GAH的F(ab')2片段可特异性识别90%以上的胃癌组织,对胃部肿瘤具有主动靶向作用。研究表明,与DOX或Doxil相比,MCC-465的耐受性更好。一项为期3周的Ⅱ期临床研究显示, MCC-465在推荐剂量(相当于DOX的32.5 mg·m-2)下的耐受性好于DOX[1]。
除了MCC-465采用人单抗作为主动靶向配体之外,Yokoe等[23]和Wang等[24]还分别用人重组血清白蛋白和半乳糖/琥珀酸双重修饰DOX-PEG脂质体,实验研究发现,与DOX相比,该脂质体在肿瘤组织中的蓄积量增加,而在心脏的分布量减少,对心脏的毒副作用更低。
4.2 胶束
胶束是指表面活性剂在溶液中的浓度超过一临界值后,其离子或分子缔合形成的缔合胶体,呈球状结构。在溶液中,表面活性剂的疏水性尾端团簇而组成胶束内核,可包载疏水性药物,而亲水性尾端在与周围液体相接触后,发生溶剂化,形成稳定的胶体粒子。在构建两亲性胶束时,人们也大多采用PEG作为亲水尾端,从而赋予胶束粒子长循环性质,并通过EPR效应实现在实体瘤中蓄积,且获得对药物的缓控释性能[25-26](又见:Maeda等, J Controlled Release, 2000年)。近年来,经PEG修饰、包载DOX的胶束递药系统大致可分为3类,即PEG修饰的胶束、经靶向配体修饰的PEG胶束和结构特异的PEG胶束。
4.2.1 被动靶向胶束 在DOX胶束递药系统的研究初期,人们将着眼点放在了系统构建材料的选择和药物释放敏感性的设计方面,其中亲水链段均采用PEG,而疏水链段的材料则有多种选择,可采用聚乳酸-羟基乙酸共聚物(PLGA)、聚己酸内酯(PCL)、聚酰胺(PAA)等;对药物的包载形式有物理包埋和共价键合两类。
采用溶剂蒸发法制备的载有DOX的PEG-PCL胶束中,PEG与PCL通过酯键相连而形成双嵌段聚合物PEG-PCL,从而可促进K562肿瘤细胞耐药株(一种P糖蛋白过度表达的人类白血病细胞)对载药胶束的摄取,增强药物对肿瘤细胞的杀伤力。该载药胶束的粒径约为36 nm,略带正电(+13.8 mV),DOX的包载量和包载效率分别为12.6%和48.6%。实验结果表明,该载药胶束除了具有体内长循环和持续释药能力以外,还可有效减少肿瘤细胞多药耐药性的产生;与单纯DOX相比,该载药胶束的耐药细胞摄取量明显增加,减少了耐药细胞对DOX的外排,增强了DOX对肿瘤细胞的杀灭作用[8]。Cuong等[27]也通过物理包埋法制备了性质相似的载有DOX的mPEG-PCL-mPEG胶束,其中mPEG-PCL-mPEG为mPEG-PCL-OH和mPEG-COOH偶合而生成的线性三嵌段共聚物,其载药量为8.5%。实验显示,此载药胶束能延长DOX的体内循环时间,提高DOX的抗肿瘤疗效。
为了提升胶束聚合物材料在体内的生物降解和在靶部位的释药能力,人们尝试在材料结构中引入局部敏感的化学共价键,以使胶束在靶部位易于发生崩解而释放出药物,同时也有助于聚合物材料降解成分子质量较小的片段而便于排出体外。Sun等[28]使用8种不同摩尔配比的PAA和PEG(PEG的分子质量有两种,分别为2 000和5 000 g·mol-1)设计并制备了还原敏感型PAA-g-PEG共聚物胶束,其中PAA和PEG间通过氧化还原敏感的二硫键连接。由于DOX的芳香基团与共聚物疏水片段中的苯基之间可产生π-π共轭和疏水性相互作用,使得DOX能高效包载入PAA-g-PEG胶束中。实验显示,这8种胶束的平均DOX包载量为11%~25%,而最大载药量则可达50 %,载药效率为65.9%~150%,其粒径在16.2~59 nm范围内。可见,相较于其他DOX递药系统来说,这8种胶束对DOX的包载量和包载效率优势明显。而且,体外实验证明,这类载药胶束可通过氧化还原敏感的二硫键的断裂来实现DOX的释放,并对小鼠乳腺癌细胞4T1产生良好的抑制作用。在携有4T1肿瘤的小鼠体内实验中,模型小鼠肿瘤体积和体质量的改变以及生存期数据均表明,这类DOX胶束相较于DOX,具有更高的抗肿瘤药效和更低的系统毒性。
制备DOX胶束的方法除了物理包埋法以外,还可将药物直接共价结合于聚合物载体内核链段,制得类似于前药的共轭物,其在溶液中即能自组装而成胶束聚集体。Hyuk等[29]将DOX通过pH敏感的腙键连接于双嵌段PLGA-PEG聚合物内核的PLGA部分,制得的共轭物在水溶液中即自发形成胶束型递药系统。实验显示,相比于物理包埋法制得的载药PLGA-PEG胶束,这种胶束进入体内后,所载药物的稳定性不会受到血液稀释作用的影响,即便在低于临界胶束浓度的条件下,药物仍然可以共轭物形式在较长时间内稳定存在,只有在进入肿瘤微酸环境后才会持续释放出药物。
4.2.2 主动靶向胶束 与脂质体类似,对胶束系统进行靶向修饰,可以获得具有主动靶向功能的DOX胶束,有利于药物在肿瘤组织和细胞内聚集,而修饰后的胶束体系其靶向性能与修饰所用靶向配体类型和性质密切相关。
叶酸(folic acid,FA)也叫维生素B9,是对身体机能调节至关重要的一种营养物质。有研究报道,多种肿瘤细胞表面过度表达FA受体。因此,修饰有FA的载体能选择性识别高表达FA受体的肿瘤细胞,提高了其靶向作用的准确性。Hami等[30]设计合成了经由FA修饰的PLA-PEG共聚物,并将DOX通过pH敏感的腙键连接到经乙胺修饰的FA上,制得DOX-PLAPEG-FA胶束,其粒径为188 nm,临界胶束浓度为9.55 mg·L-1。相比于物理包埋法,该胶束中DOX是通过化学键连接方式而载入,可使药物和胶束的结合更稳定,阻止了药物在血液循环中的过早释放,确保药物能够更高效地转运到肿瘤部位。对SKOV3卵巢癌细胞进行的实验显示,DOX-PLA-PEG-FA胶束对癌细胞可产生有效的毒性作用(IC50=4.65 mg·L-1)。
由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体,称为单克隆抗体。一些具有独特生化性质的单克隆抗体可被肿瘤细胞特异性识别。Perche等[7]通过对DOX耐药的卵巢癌细胞进行的实验研究了具有抗体靶向、载有DOX的PEG-磷脂酰乙醇胺(PE)胶束在肿瘤组织中的聚集和细胞毒性作用,该胶束中DOX是通过物理包埋而载入,载有DOX的PEG-PE胶束(MDOX)则通过吸附作用而连接上具有肿瘤细胞特异的抗核小体单克隆抗体2C5,进而获得具有抗体靶向的DOX-PEG-PE胶束(2C5-MDOX)。实验结果显示,2C5-MDOX相比于DOX或者MDOX,更易被肿瘤细胞摄取而聚集于其中。
4.2.3 具有特殊结构和形态的胶束 除了上述类型的DOXPEG胶束外,人们还开发出一些在结构和形态上特异的DOX-PEG胶束,主要包括树枝状、星状和Y型聚合物胶束,由于结构上的特点使得这些载药系统的稳定性和释药特性更为优越。
Xiao等[31]设计合成了一系列PEG-寡聚胆酸(CA)树枝状聚合物,它们在水溶液中能自组装成胶束并包载DOX。该研究小组主要考察了其中两种载药量最高的胶束PEG5K-CA8和PEG2K-CA4(胶束名称中,5K和2K为PEG的摩尔质量,8和4为胆酸分子个数),二者载药量分别为14.8%和8.2%。体外实验表明,与DOX相比,此类胶束在生理学条件下具有更好的稳定性和持续释药特性,能更有效地进入Raji 淋巴瘤细胞中,提高DOX对T-和B-淋巴瘤细胞的毒性作用。体内实验结果显示,由PEG5K-CA8和PEG2K-CA4构建的载药胶束都具有更长的血液循环时间,可被动靶向转运并聚集至淋巴瘤组织中;载有DOX的PEG2KCA4胶束相比于DOX和Doxil,在同等剂量下,对荷瘤小鼠模型具有更强的抗肿瘤效力,并明显延长其生存时间;模型小鼠对DOX-PEG2K-CA4胶束的耐受剂量为15 mg·kg-1,是DOX的1.5倍。且肌酸激酶和乳酸脱氢酶分析数据表明,此类胶束制剂比DOX具有更低的心脏毒性。
基于星状多聚体胶束在稀释后具有更高稳定性,Gao等[32]设计制备了具有星状结构(SS)的SSmPEGPCL胶束,平均粒径约为25 nm,单分散系数(PI)为0.11;再将DOX通过一种pH诱导的自组装方法载入SSmPEG-PCL胶束中,形成载有DOX的星状胶束DOX/SSmPEG-PCL,而DOX的载入对于胶束粒径的影响并不大。释放实验显示,DOX能从DOX/SSmPEGPCL胶束中缓慢释放,且其释放行为具有pH依赖性。此外,Sui等[33]设计制备了载有DOX的Y型PEGPGA胶束,其间,先将mPEG的一端通过2个氨基的修饰分别与PGA连接,形成Y型PEG-PGA,再通过pH敏感的腙键将DOX与Y型PEG-PGA多聚体相连接。实验发现,当载药量固定的时候,Y型胶束与线性胶束相比,由于Y型聚合物的疏水链更短,因此形成的胶束具有更小的粒径,且具有更好的缓释特性以及更高的细胞摄取效率和细胞毒性。
因此,利用PEG材料,通过对载体的设计和修饰,可以获得更多具有不同形状和结构的胶束。而且,作为载体,这类胶束无论是采用共价连接还是物理包埋方式载药,其所用PEG材料均可发挥以下作用:1)稳定载体结构,提高载体的水溶性和生物相容性;2)通过调节载体的稳定性来控制对药物的缓释行为;3)赋予载体体内长循环性质,并通过EPR效应实现在肿瘤部位的蓄积;4)通过与不同的疏水性链段配合使用,优化胶束的载体性质,提高所载药物的治疗指数,降低其毒副作用。
4.3 纳米转运体
相比于脂质体和胶束,基于PEG构建的纳米转运体具有更高的稳定性,而且其选用材料更为广泛和多样化,性质也更为优异。
Yoo等[3]设计制备了DOX-PEG-FA共轭物纳米粒递药系统,其中FA和DOX分别通过化学键与PEG的两端相连,脱质子的DOX位于纳米粒的疏水内核,FA配体位于纳米粒表面。该载药纳米粒平均粒径为200 nm,具有FA受体靶向作用,且因PEG修饰而具有长循环性质。KB肿瘤细胞实验表明,该载药纳米粒与DOX相比,具有更高的细胞毒性。小鼠肿瘤模型实验显示,与DOX相比,该载药纳米粒的抑瘤作用更显著,且毒副作用小,治疗指数高。Yadav等[34]设计制备了透明质酸(HA)-PEG-PCL共轭物,并将其包裹DOX,制得核-壳型纳米粒HA-PEG-PCL-DOX。该研究小组采用mPEG-PCL-DOX纳米粒作为对照,考察了HA-PEG-PCL-DOX纳米粒的体外释药特性,结果表明,由于PEG的作用,两种纳米粒都能很好地缓慢释放药物,HA-PEG-PCL-DOX和mPEG-PCL-DOX可分别持续释药达17和14 d。而且,血液毒性实验表明,这两种纳米粒都具有很好的安全性和稳定性。动物实验显示,HA-PEG-PCL-DOX相比于mPEG-PCL-DOX,具有更好的肿瘤摄取效应,这应是基于受体介导的内吞效应造成的。实验结果表明,对于HA-PEG-PCL-DOX纳米粒,PEG的修饰使其具有被动靶向和延长血液循环的作用,而HA的连接使其具有主动靶向作用。
另外,Liu等[35]考虑到PEG的被动靶向和长循环特性,经进一步改进,设计合成了结构复杂、多功能、共轭连接有DOX的聚乙烯亚胺(PEI)-PEG纳米粒。
针对多种肿瘤组织中基质金属蛋白酶(MMP)表达上调的特点,Nazli等[36]设计制备了一种MMP敏感的PEG水凝胶包覆的氧化铁纳米粒,用于DOX的靶向转运。该纳米粒包覆有靶向整联蛋白和MMP敏感的PEG水凝胶支架片段,而这种PEG水凝胶支架能够更好地包裹和释放DOX,更为有效地被肿瘤细胞所摄取。共聚焦激光扫描电镜显示,在2 h内,该纳米粒能有效转运和释放DOX进入HeLa细胞的细胞核。而且,实验研究显示,外层包裹有经过特殊处理的PEG水凝胶片段的这种氧化铁纳米粒更具肿瘤细胞靶向性,易被肿瘤细胞摄取,并具有更佳的药物释放特性。提示,覆以外表的PEG支架片段经合理修饰和改造,可使这种纳米粒获得更为优良的药物载体特性。
采用一个载体系统同时转运两种抗肿瘤药物——疏水性药物紫杉醇(PTX)和亲水性药物DOX,可减少每种药物的用量,因而可减轻药物的毒副作用,并克服肿瘤细胞耐药性的产生,还有助于两种药物发挥协同作用。鉴于此,Wang等[4]设计并合成了两亲性的mPEGPLGA纳米粒,用于同时转运DOX和PTX。与其他纳米递药系统相比,mPEG-PLGA纳米粒制备简单,生物相容性好,载药效率更高,更为重要的是它能够同时装载疏水性和亲水性药物。实验发现,这种载药mPEGPLGA纳米粒具有良好的多分散性质,粒径分布更易控制,药物释放特性优良,肿瘤细胞摄取效率较高,其整体治疗指数优于单纯PTX和DOX。
Lv等[37]也设计合成了一种两亲性、修饰有脱氧胆酸(DOCA)的mPEG-b-聚-L-谷氨酸(PLG)-b-聚-L-赖氨酸(PLL)三嵌段共聚物,即mPEsG-b-PLG-b-PLL/DOCA,其能在水溶液中自我聚合而形成胶束型纳米粒,具有极好的稳定性,并将其同时荷载PTX和DOX,用于治疗非小细胞肺癌。该纳米粒的PEG外壳赋予纳米粒长循环性质,中间层亲水性PLG具有良好的生物可降解性,并可通过静电作用与DOX结合,而经疏水性DOCA修饰的PLL则可用来容纳PTX,因此该纳米粒能稳定荷载PTX和DOX。体内外实验结果表明,这种同时荷载PTX和DOX的三嵌段共聚物纳米粒,可使所载两种药物靶向聚集于肿瘤组织,并发挥很好的协同作用,提高抗瘤活性,降低毒副作用。
人们开发出的基于PEG的DOX纳米转运系统,除了上述常见的纳米粒之外,还有多种形态的纳米纤维(纳米棒)、纳米球等。
Xu等[38]便设计制备了一种超细的PEG-PLA纳米纤维,这种纳米纤维可以同时装载有PTX和DOX,起到协同治疗的作用。其中药物的释放取决于药物的水溶性和在纳米纤维上的分布状态,DOX的水溶性高于PTX,因此DOX更易从纳米管上释放,而且随着DOX的释放,也加速了PTX从纳米纤维上的解离,所以两药不仅在药效上具有协同作用,还具有协同释放效应。体外实验表明,装载有PTX和DOX的这种PEG-PLA纳米纤维对肿瘤具有更好的治疗指数,即抗瘤活性高,而毒副作用小。
Hariharan等[39]设计制备了一种基于ZnO/PEG的纳米球,用于转运DOX,其中纳米级ZnO是一种光敏感剂,具有光催化活性。该研究小组还考察了这种纳米球的光动力学性质,证实载药纳米球具有光促治疗作用。实验表明,该载药纳米球的抗肿瘤活性相比于DOX有了显著增强,其在紫外线照射下,通过活性氧介导,可显著增加对癌细胞的损伤;而且,ZnO/PEG纳米球能显著增加肿瘤细胞对DOX的摄取,增强DOX的抗肿瘤活性,这可能和PEG的EPR效应和ZnO的相关性质有关。且体外实验显示,在酸性环境下,该载药纳米粒在26 h内能够释放91%的DOX,具有良好的释药性质。
Zhang等[40]也设计制备了一种基于PEG的ABA型三嵌段共聚物,其可自组装成纳米球。实验结果表明,这种纳米球对DOX具有较高的载药量和包载效率,并具有良好的释药行为。
4.4 水凝胶
常用的PEG水凝胶载药系统多为智能温敏型水凝胶,它可随温度改变而发生溶胶-凝胶的相变。水凝胶在常温下呈液态,而注射到动物体/人体后,即在37 ℃左右时其在注射部位形成原位凝胶。我们可以利用水凝胶的这一温敏特性,将其用作药物载体,当其在室温下呈液态时,可将其与药物配制成液体制剂,并用于在病变部位皮下注射,随后遭遇37 ℃左右时,即在注射部位形成载药凝胶,此时可将其视为一个药物储库,并能持续释药[41]。
水凝胶递药系统具有稳定药物和持续释药的特性,与前述纳米粒和脂质体相比,其在药物缓释方面优点尤为突出,其稳定缓释药物的时间一般都超过20 d(Jeong等, J Biomed Mater Res, 2000年),而且它能够改善病人用药的顺应性[42],并提供了一种定位施药的选择[43]。
普流尼克(环氧乙烷与环氧丙烷共聚物)[44-45]和两亲性PEG-PLGA嵌段聚合物[46](又见: Jeong等, Macromolecules, 1999年)是典型的温敏型多聚体凝胶,其中PLGA-PEG-PLGA三嵌段聚合物应用最为广泛,其合成方便,且生物可降解,安全无毒[42,47],常用于抗癌药物的定点转运。例如,包载有PTX的PLGA-PEGPLGA水凝胶(ReGel)其体外持续释放药物的时间超过50 d,且临床试验表明,与市售的泰素(紫杉醇注射液)相比,其在抗肿瘤活性和安全性方面都具有显著优势[48]。
然而,对于温敏型凝胶递药系统来说,所载药物的种类对于其溶胶-凝胶两相转化的影响很大[49]。水凝胶一般用作水不溶性疏水小分子药物或水溶性大分子药物的转运体,很少用于水溶性小分子药物的转运。而DOX作为一种水溶性小分子药物,其又会对水凝胶的相变化产生什么影响。鉴于此,Yu等[41]研究了包裹有DOX的PLGA-PEG-PLGA水凝胶系统的相关性质,如DOX的加入会不会导致溶胶-凝胶两相转化的失败以及含有DOX的多聚体水凝胶溶液的可注射性质(水凝胶的可注射性和溶胶的黏度有关)如何等等。结果发现,DOX的加入并没有对水凝胶的上述性质产生明显影响,且含有DOX的水凝胶溶液的可注射性良好,其相变化性质依然存在,持续释药时间为20 d;相比于DOX,该载药水凝胶具有更高的肿瘤治疗效应和更低的毒副作用。
对于线性嵌段聚合物水凝胶递药系统,只有当其聚合物的相对分子质量为4 000~5 000时,才能在37 ℃左右的温度下发生溶胶-凝胶的相变化。为了克服这一缺点,Lee等[50]研究了星状嵌段共聚物PLGA-PEG的凝胶性质,结果发现,这类共聚物水凝胶发生温敏性相变化所要求的相对分子质量范围更宽泛。且体内外实验证明,这类共聚物水凝胶包载DOX后,相较于DOX,抗肿瘤疗效有所提高,毒副作用降低。
Ma等[51]还考察了温敏型PLGA-PEG-PLGA水凝胶同时包载DOX和Polo样激酶1(PLK1)shRNA用于治疗骨肉瘤的效果。PLK1是一种参与有丝分裂调控的重要激酶,在大多数恶性肿瘤中呈现过表达,并与某些肿瘤的生物学行为及预后密切相关。体内外实验结果显示,该凝胶除了具有载药水凝胶本身所具备的缓释特性外,其所载DOX和PLK1shRNA对骨肉瘤还可产生很好的协同治疗作用,其在16 d内几乎可以完全抑制肿瘤的生长,具有较高的抗肿瘤活性和较低的毒副作用。
由上述研究结果可见,因具有长久持续释放药物和可定点给药的特性,基于PEG的温敏型水凝胶作为一种优良的药物载体,在递药系统中展示了独特作用。
5 结语
综上所述,PEG在抗肿瘤药物前药和递送系统中的应用,展现出多重优势。PEG的修饰可增加药物的水溶性,赋予药物或载体良好的生物相容性,延长药物在血液中的循环时间,并能使药物通过EPR效应而实现对肿瘤的被动靶向作用,进而致使更多的药物聚集和进入病变部位。然而,值得注意的是,PEG修饰的DOX脂质体制剂Doxil虽在2005年1月获美国FDA批准上市,但其后有研究显示,PEG修饰的DOX脂质体在重复注射给药后,会出现加速血液清除(Accelerated Blood Clearance,ABC)现象,影响多次给药后的疗效[52]。因此,今后在涉及PEG材料的化疗药物成药性研究中,应探讨克服ABC现象。
[1]Matsumura Y, Gotoh M, Muro K, et al.Phase I and pharmacokinetic study of MCC-465, a doxorubicin (DXR) encapsulated in PEG immunoliposome, in patients with metastatic stomach cancer[J].Ann Oncol, 2004, 15(3): 517-525.
[2]Hatakeyama H, Akita H, Ishida E, et al.Tumor targeting of doxorubicin by anti-MT1-MMP antibody-modifed PEG liposomes[J].Int J Pharm, 2007, 342(1/2): 194-200.
[3]Yoo H S, Park T G.Folate-receptor-targeted delivery of doxorubicin nano-aggregates stabilized by doxorubicin-PEG-folate conjugate[J].J Controlled Release, 2004, 100(2): 247-256.
[4]Wang H, Zhao Y, Wu Y, et al.Enhanced anti-tumor efficacy by codelivery of doxorubicin and paclitaxel with amphiphilic methoxy PEGPLGA copolymer nanoparticles[J].Biomaterials, 2011, 32(32): 8281-8290.
[5]Veronese F M, Schiavon O, Pasut G, et al.PEG-doxorubicin conjugates: influence of polymer structure on drug release, in vitro cytotoxicity, biodistribution, and antitumor activity[J].Bioconjug Chem, 2005, 16(4): 775-784.
[6]Andersson L, Davies J, Duncan R, et al.Poly(ethylene glycol)-poly(ester-carbonate) block copolymers carrying PEG-peptidyldoxorubicin pendant side chains: synthesis and evaluation as anticancer conjugates[J].Biomacromolecules, 2005, 6(2): 914-926.
[7]Perche F, Patel N R, Torchilin V P.Accumulation and toxicity of antibody-targeted doxorubicin-loaded PEG-PE micelles in ovarian cancer cell spheroid model[J].J Controlled Release, 2012, 164(1): 95-102.
[8]Diao Y Y, Li H Y, Fu Y H, et al.Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells[J].Int J Nanomed, 2011, 6: 1955-1962.
[9]Hofheinz R D, Gnad-Vogt S U, Beyer U, et al.Liposomal encapsulated anti-cancer drugs[J].Anticancer Drugs, 2005, 16(7): 691-707.
[10]Cheng Y Y, Wang J R, Rao T L, et al.Pharmaceutical applications of dendrimers: promising nanocarriers for drug delivery[J].Front Biosci, 2008, 13: 1447-1471.
[11]Fenske D B, Cullis P R.Liposomal nanomedicines[J].Expt Opin Drug Deliv, 2008, 5(1): 25-44.
[12]Dreis S, Rothweller F, Michaelis A, et al.Preparation, characterisation and maintenance of drug effcacy of doxorubicin-loaded human serum albumin (HSA) nanoparticles[J].Int J Pharm, 2007, 341(1/2): 207-214.
[13]Zheng F, Shi X W, Yang G F, et al.Chitosan nanoparticle as gene therapy vector via gastrointestinal mucosa administration: results of an in vitro and in vivo study[J].Life Sci, 2007, 80(4): 388-396.
[14]Nath S, Kaittanist C, Tinkharn A, et al.Dextran-coated gold nanoparticles for the assessment of antimicrobial susceptibility[J].Anal Chem, 2008, 80(4): 1033-1038.
[15]Xie Z G, Lu T C, Chen X S, et al.Triblock poly(lactic acid)-bpoly(ethylene glycol)-b-poly(lactic acid)/paclitaxel conjugates: synthesis, micellization, and cytotoxicity[J].J Appl Polym Sci, 2007, 15(4): 2271-2279.
[16]Zhi X, Fang H L, Bao C C, et al.The immunotoxicity of graphene oxides and the effect of PVP-coating[J].Biomaterials, 2013, 21(34): 5254-5261.
[17]Huang J, Xue Y, Cai N, et al.Effcient reduction and pH co-triggered DOX-loaded magnetic nanogel carrier using disulfde crosslinking[J].Mater Sci Eng C Mater Biol Appl, 2015, 46: 41-51.
[18]Sorensen K, Levitt G A, Bull C, et al.Late anthracycline cardiotoxicity after childhood cancer-A prospective longitudinal study[J].Cancer, 2003, 97(8): 1991-1998.
[19]Longhi A, Ferrari S, Bacci G, et al.Long-term follow-up of patients with doxorubicin-induced cardiac toxicity after chemotherapy for osteosarcoma[J].Anticancer Drugs, 2007, 18(6): 737-744.
[20]Kremer L C, Caron H N.Anthracycline cardiotoxicity in children[J].N Engl J Med, 2004, 351(2): 120-121.
[21]Duncan R.Polymer-Drug Conjugates[M]//Budman D, Calvert H, Rowinsky E.Handbook of anticancer drug development.Philadelphia: Lippincott Williams & Wilkins, 2003: 239-260.
[22]Pawar S K, Badhwar A J, Kharas F, et al.Design, synthesis and evaluation of N-acetyl glucosamine (NAG)-PEG-doxorubicin targeted conjugates for anticancer delivery[J].Int J Pharm, 2012, 436(1/2): 183-193.
[23]Yokoe J I, Sakuragi S, Yamamoto K, et al.Albumin-conjugated PEG liposome enhances tumor distribution of liposomal doxorubicin in rats[J].Int J Pharm, 2008, 353(1/2): 28-34.
[24]Wang S N, Xu H, Xu J H, et al.Sustained liver targeting and improved antiproliferative effect of doxorubicin liposomes modified with galactosylated lipid and PEG-lipid[J].AAPS PharmSciTech, 2010, 11(2): 870-877.
[25]Li Y Y, Zhang X Z, Kim G C, et al.Thermosensitive Y-shaped micelles of poly(oleic acid-Y-N-isopropylacrylamide) for drug delivery[J].Small, 2006, 2(7): 917-923.
[26]Lee E S, Na K, Bae Y H.Doxorubicin loaded pH-sensitive polymeric micelles for reversal of resistant MCF-7 tumor[J].J Controlled Release, 2005, 103(2): 405-418.
[27]Cuong N V, Jiang J L, Li Y L, et al.Doxorubicin-loaded PEG-PCLPEG micelle using xenograft model of nude mice: effect of multiple administration of micelle on the suppression of human breast cancer[J].Cancers, 2010, 3(1): 61-78.
[28]Sun Y, Zou W, Bian S, et al.Bioreducible PAA-g-PEG graft micelles with high doxorubicin loading for targeted antitumor effect against mouse breast carcinoma[J].Biomaterials, 2013, 34(28): 6818-6828.
[29]Hyuk S Y, Tae G P.Biodegradable polymeric micelles composed of doxorubicin conjugated PLGA-PEG block copolymer[J].J Controlled Release, 2001, 70(1/2): 63-70.
[30]Hami Z, Amini M, Ghazi-Khansari M, et al.Doxorubicin-conjugated PLA-PEG-Folate based polymeric micelle for tumor-targeted delivery:synthesis and in vitro evaluation[J].Daru, 2014, 22: 30.
[31]Xiao K, Luo J T, Li Y P, et al.PEG-oligocholic acid telodendrimer micelles for the targeted delivery of doxorubicin to B-cell lymphoma[J].J Controlled Release, 2011, 155(2): 272-281.
[32]Gao X, Wang B, Wei X, et al.Preparation, characterization and application of star-shaped PCL/PEG micelles for the delivery of doxorubicin in the treatment of colon cancer[J].Int J Nanomed, 2013, 8: 971-982.
[33]Sui B, Xu H, Jin J, et al.Self-assembled micelles composed of doxorubicin conjugated Y-shaped PEG-poly(glutamic acid)2 copolymers via hydrazone linkers[J].Molecules, 2014,19(8): 11915-11932.
[34]Yadav A K, Mishra P, Jain S, et al.Preparation and characterization of HA-PEG-PCL intelligent core-corona nanoparticles for delivery of doxorubicin[J].J Drug Target, 2008, 16(6): 464-478.
[35]Liu C X, Liu F X, Feng L X, et al.The targeted co-delivery of DNA and doxorubicin to tumor cells via multifunctional PEI-PEG based nanoparticles[J].Biomaterials, 2013, 34(10): 2547-2564.
[36]Nazli C, Demirer G S, Yar Y, et al.Targeted delivery of doxorubicin into tumor cells via MMP-sensitive PEG hydrogel-coated magnetic iron oxide nanoparticles (MIONPs)[J].Colloids Surf B Biointerfaces, 2014, 122: 674-683.
[37]Lv S X, Tang Z H, Li M Q, et al.Co-delivery of doxorubicin and paclitaxel by PEG-polypeptide nanovehicle for the treatment of nonsmall cell lung cancer[J].Biomaterials, 2014, 35(23): 6118-6129.
[38]Xu X, Chen X, Wang Z, et al.Ultrafine PEG-PLA fibers loaded with both paclitaxel and doxorubicin hydrochloride and their in vitro cytotoxicity[J].Eur J Pharm Biopharm, 2009, 72(1): 18-25.
[39]Hariharan R, Senthilkumar S, Suganthi A, et al.Synthesis and characterization of doxorubicin modifed ZnO/PEG nanomaterials and its photodynamic action[J].J Photochem Photobiol B, 2012, 116: 56-65.
[40]Zhang L, Feng Y K, Tian H, et al.Controlled release of doxorubicin from amphiphilic depsipeptide-PDO-PEG-based copolymer nanosized microspheres[J].React Funct Polym, 2013, 73(9): 1281-1289.
[41]Yu L, Ci T Y, Zhou S C, et al.The thermogelling PLGA-PEG-PLGA block copolymer as a sustained release matrix of doxorubicin[J].Biomater Sci., 2013, 1(4): 411-420.
[42]Yu L, Ding J D.Injectable hydrogels as unique biomedical materials[J].Chem Soc Rev, 2008, 37(8): 1473-1481.
[43]Shim W S, Kim J H, Kim K, et al.pH- and temperature-sensitive, injectable, biodegradable block copolymer hydrogels as carriers for paclitaxel[J].Int J Pharm, 2007, 331(1): 11-18.
[44]Loh X J, Guerin W, Guillaume S M.Sustained delivery of doxorubicin from thermogelling poly(PEG/PPG/PTMC urethane)s for effective eradication of cancer cells[J].J Mater Chem, 2012, 22(39): 21249-21256.
[45]Chung H J, Lee Y H, Park T G.Thermo-sensitive and biodegradable hydrogels based on stereocomplexed Pluronic multi-block copolymers for controlled protein delivery[J].J Controlled Release, 2008, 127(1): 22-30.
[46]Yu L, Zhang Z, Ding J D.Influence of LA and GA sequence in the PLGA block on the properties of thermogelling PLGA-PEG-PLGA block copolymers[J].Biomacromolecules, 2011, 12(4): 1290-1297.
[47]Park M H, Joo M K, Choi B G, et al.Biodegradable thermogels[J].Acc Chem Res, 2012, 45(3): 424-433.
[48]Zentner G M, Rathi R, Shih C, et al.Biodegradable block copolymers for delivery of proteins and water-insoluble drugs[J].J Controlled Release, 2001,72(1/2/3): 203-215.
[49]Lee D S, Shim M S, Kim S W, et al.Novel thermoreversible gelation of biodegradable PLGA-block-PEO-block-PLGA triblock copolymers in aqueous solution[J].Rapid Commun, 2001, 22(8): 587-592.
[50]Lee S J, Bae Y, Kataoka K, et al.In vitro release and in vivo anti-tumor effcacy of doxorubicin from biodegradable temperature-sensitive starshaped PLGA-PEG block copolymer hydrogel[J].Polym J, 2008, 2(40): 171-176.
[51]Ma H C, He C L, Cheng Y L, et al.PLK1shRNA and doxorubicin coloaded thermosensitive PLGA-PEG-PLGA hydrogels for osteosarcoma treatment[J].Biomaterials, 2014, 35(30): 8723-8734.
[52]Judge A, McClintock K, Phelps J R, et al.Hypersensitivity and loss of disease site targeting caused by antibody responses to PEGylated liposomes[J].Mol Ther, 2006, 13(2): 328-337.
A pplication of Polyethylene Glycol in the Druggability Research for Chemotherapy Drugs——in the Case of Doxorubicin
WANG Lin1,2, DING Ya1, ZHANG Can2(1.Key Laboratory of Drug Quality Control and Pharmacovigilance of Ministry of Education, China Pharmaceutical University, Nanjing 210009, China; 2.Drug Research Institute, China Pharmaceutical University, Nanjing 210009, China)
The main problems in clinical application for most anticancer drugs include poor water-solubility, systemic toxicity and multi-drug resistance.It has attracted much interest from the pharmaceutical researchers that these problems are overcome by the construction of prodrugs or effective drug delivery systrems using polyethylene glycol(PEG) material.The application of PEG in the druggability research involved with the construction and preparation of prodrugs and drug delivery systems for chemotherapy drugs was reviewed, using doxorubicin(DOX) having good antitumor activity and molecular fuorescence property as an example so as to provide references for the further research and development of the antitumor drugs with high effcacy and low toxicity.
polyethylene glycol; doxorubicin; chemotherapy drug; druggability; prodrug; drug delivery system
R94;R979.1
A
1001-5094(2015)01-0048-09
接受日期:2014-11-13
*通讯作者:丁娅 , 副教授 ;
研究方向:纳米药物分析 ;
Tel:025-83271171;E-mail:ayanju@163.com
**通讯作者:张灿 , 教授 ;
研究方向:药用高分子材料 ;
Tel:025-83271171;E-mail:zhangcan@cpu.edu.cn
