吡咯并[4,3,2-de]喹啉类天然产物的研究进展
2015-02-01亓晨晓杨圣伟孙丽萍
亓晨晓,杨圣伟,孙丽萍
(中国药科大学药物化学教研室,江苏 南京 210009)
吡咯并[4,3,2-de]喹啉类天然产物的研究进展
亓晨晓,杨圣伟,孙丽萍*
(中国药科大学药物化学教研室,江苏 南京 210009)
吡咯并[4,3,2-de]喹啉类生物碱是从蟾蜍以及海洋生物等中提取出来的次级代谢物,具有抗寄生虫、抗病毒、抗肿瘤等多种生物活性,是一类有成药潜力的天然产物。综述部分吡咯并[4,3,2-de]喹啉类天然产物的生物活性、生物合成以及化学合成的研究进展,并对其现存问题和发展方向进行分析和展望。
吡咯并[4,3,2-de]喹啉;生物碱;天然产物;次级代谢物;抗肿瘤活性;合成
1930年,Wieland等(Ann Chem)首次从南美蟾蜍Bufo arenarum的皮肤分泌物中分离出具有吡咯并[4,3,2-de]喹啉(pyrrolo[4,3,2-de]quinoline,1)母核的生物碱bufothionine(2)。目前已有100多个具有类似母核结构的天然产物被分离并命名,包括具有三环结构的batzelline(如化合物3)、makaluvamine(如化合物4)、damirone(如化合物5)等系列以及具有更复杂环系结构的discorhabdin(如化合物6)系列、prianosin(如化合物7)系列、tsitsikammamine(如化合物8)系列等,其中大部分为海洋生物的次级代谢产物。
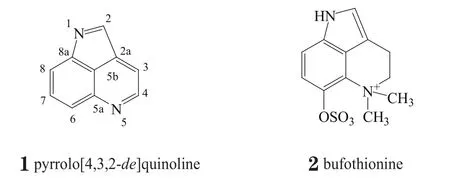
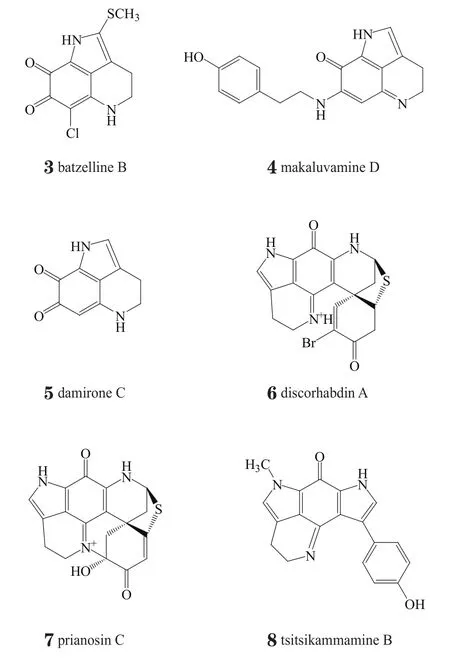
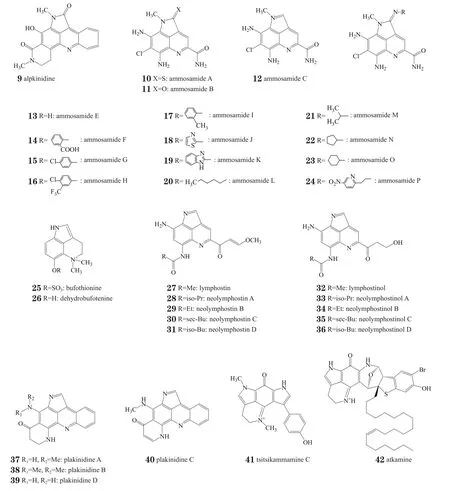
按照母核喹啉苯环上是否具有被氧化后的羰基(或羟基),可将上述天然产物分为含醌的结构和不含醌的结构,其中含醌的结构也被称为吡咯并亚氨基醌类(pyrroloiminoquinone),如化合物3~8。本文将主要对非氧化的吡咯并[4,3,2-de]喹啉类天然产物及其生物活性和全合成方面的研究进展作一综述,亦是首次在国内对该类天然产物的研究近况进行梳理,内容包含以下5个系列的非氧化类化合物:alpkinidine(9),ammosamide(10~24),bufothionine(25~26),lymphostin(27~36)和plakinidine(37~40);另外也简要介绍了2个近期报道的吡咯并亚氨基醌类化合物tsitsikammamine C(41)和atkamine(42)。
本文综述的7个系列的天然产物除了较早时期从蟾蜍皮肤分泌物中发现的bufothionine(25~26)系列(Jensen等,J Am Chem Soc,1935年;Ghosal等,J Med Chem,1969年)[1]外,其他均首先从海洋生物中提取得到,大部分来源于海洋放线菌和海绵,这为新药发现中传统的天然产品提取分离方法提供了新的方向和途径,且这些来源于海洋生物次级代谢产物的全新结构也是对化合物库的有益补充,这在一定程度上扩大了药物高通量筛选的范围。
具体来说,在ammosamide系列中,除ammosamide F-P(14~24)[2]是人工利用海洋放线菌发酵的产物之外,其他化合物均从海洋微生物中提取得到,ammosamide A-C(10~12)[3]从海洋链霉菌Streptomyces CNR-698中分得,ammosamdie E(13)[2]从海洋放线菌Streptomyces variabilis SNA-020中分得。从海洋放线菌中分离出的此类天然产物还有lymphostin系列(27~36)[4]的所有化合物,其中lymphostin(27)[4]同样也可从链霉菌Streptomyces sp.KY11783和热带盐水孢菌Salinispora tropica CNB-440中分离出来。此外,海绵类生物也是吡咯并[4,3,2-de]喹啉的主要生物来源之一,alpkinidine(9)[5]和plakinidine(37~40)[5](Ford等,J Nat Prod,2007年)系列均从海绵中提取得到,且近年报道的2个吡咯并[4,3,2-de]喹啉类天然产物,即tsitsikammamine C(41)[6]和atkamine(42)[7]的生物来源也分别是海绵生物Zyzzya sp.和Latrunculia sp.。上述吡咯并[4,3,2-de]喹啉类天然产物的生物来源见表1。
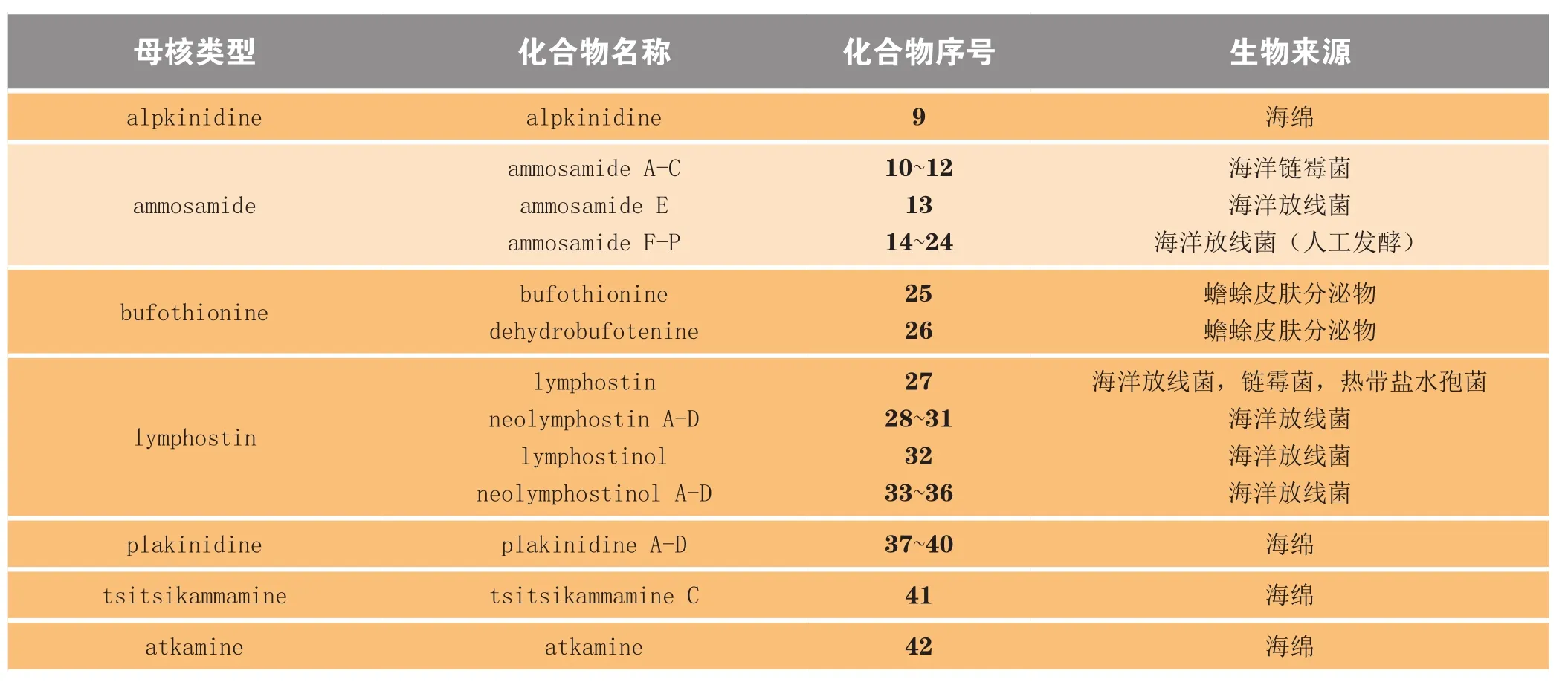
表1 吡咯并[4,3,2-de]喹啉类天然产物的生物来源Table1 Biological sources of pyrrolo[4,3,2-de]quinolines
1 吡咯并[4,3,2-de]喹啉类天然产物的生物活性
吡咯并[4,3,2-de]喹啉类天然产物大多具备有潜在利用价值的生物活性,已证实的活性有抗寄生虫[6,8-9]、抗病毒[10]、抗肿瘤[4,11-13](Moro-oka等,Tetrahedron Lett,1999年)等。尤其值得注意的是,体外细胞毒性试验更进一步证明此类天然产物中有一部分是拓扑异构酶Ⅱ的有效抑制剂[9],这为抗癌新药的发现及优化提供了大量先导化合物,同时也可作为工具药物促进细胞机制的阐明。
近些年来,一些课题组对部分吡咯并[4,3,2-de]喹啉类天然产物的活性筛选大多集中在抗肿瘤活性上,从作用于特定的细胞系或酶系得出的结果看,有些化合物的生物活性表现格外引人注意,主要为ammosamide系列和lymphostin系列化合物。根据目前已获得的为数不多的活性数据,ammosamide A(10)和ammosamide B(11)对人结肠癌细胞系HCT-116具有很好的细胞毒性,IC50均为0.32 μmol·L-1[13],两者对在某些癌症中表达有显著升高的苯醌还原酶2酶系(QR2)也有较强的抑制作用,IC50分别为0.023 μmol·L-1[2]和0.061 μmol·L-1[14]。活性测试结果表明,ammosamide L(20)和ammosamide M(21)比前两者对癌症相关的酶及多个癌细胞系具有更突出的生物活性,也意味着可能具有更强的成药潜力。其中,ammosamide L对QR2以及人非小细胞肺癌细胞系HCC44、HC4017和Calu-3的IC50分 别 为0.017、1.1、2.87和0.86 μmol·L-1;ammosamide M的活性优于ammosamide L,对上述酶或细胞系的IC50分别是0.020、0.50、0.48、0.77 μmol·L-1。另据Miyanaga课题组[4]报道,lymphostin系列的几个天然产物对与细胞生长和增殖的重要调节因子如雷帕霉素靶蛋白(mTOR)以及几株人类常见癌症的细胞系也都有很强的抑制作用,例如,lymphostin(27) 及neolymphostin A-D(28~31) 对 mTOR的IC50分别为1.7、0.8、1.5、1.8和1.8 nmol·L-1,其中lymphostin及neolymphostin A和B对人雄激素依赖性前列腺癌细胞(LNCap)和人乳腺癌细胞(MDA-468)的细胞毒性数据也较理想,三者对LNCap的IC50为38、22和48 nmol·L-1,对MDA-468的IC50为14、58和85 nmol·L-1。
此外,除了以上列举的化合物,plakinidine系列化合物在抗肿瘤活性筛选方面也得到了不错的结果,West等(Tetrahedron Lett,1990年)报道,plakinidine A、B和C(37、38、40)对小鼠淋巴细胞白血病细胞株L1210的细胞毒性IC50分别为0.33、0.95和2.3 μmol·L-1;且plakinidine A对人结肠癌细胞系HCT-116也有生物活性,IC50为0.76 μmol·L-1[5]。
吡咯并喹啉类天然产物不仅在抗肿瘤方面有发展成为药物的潜力,对于寄生虫、细菌、病毒等也有很好的抑制作用,例如,2012年Davis等[6]提取分离得到的tsitsikammamine C(41)就具有良好的抗疟活性,其对恶性疟原虫氯喹敏感株3D7和恶性疟原虫氯喹抗性株Dd2的活性数据(IC50)分别达0.013 和0.018 μmol·L-1,使得其作为先导化合物进行抗疟药设计的价值大大增加。
2 吡咯并[4,3,2-de]喹啉类天然产物的生物合成路线
吡咯并[4,3,2-de]喹啉类天然产物结构复杂多样,但普遍认为多数是在色氨酸衍生的母核的基础上进行取代的结果。现已报道的此类化合物可能的生物体内合成路线并不多,其中Miyanaga等[4]以neolymphostin A为例通过一系列生物信息学分析实验,推断出lymphostin及其衍生物在Salinispora pacifca DPJ-0019菌株中可能的部分生物合成路线(见图1)。此路线涉及的关键酶为一组氢化非核糖体肽合成酶-酮聚合酶(NRPS-PKS),编码这组酶的基因为lym基因。Lym基因中起核心作用的为lymA基因,其编码了1个含有7个功能区域的合成酶,可能起到的作用是:将肽基运载蛋白(PCP)结合的色氨酸衍生的残基进行丙二酸化延伸,以及将酰基运载蛋白(ACP)结合的中间体以醛的形式还原性地释放为N-乙酰化二酮产物;然后lymB基因上甲基转移酶(MT)发挥甲基化作用,使lymphostin类产物被氧化后得到的醛基以甲氧烯醇的形式得以保留。通过加入一些同位素标记的前体物质,可推断出产物中部分片段的来源(见图1):如加入15N同位素标记的色氨酸(15N2-L-tryptophan),利用相关技术分析可得知lymphostin类产物中来源于色氨酸的氮原子为N1和N5;同理,剩余的氮原子则来源于天冬氨酸(15N-L-glutamine),这种在合成产物时加入芳胺片段的步骤(天冬氨酸参与的步骤)可能是由保守的酰胺转移酶所控制;而产物中由于酰胺部分的不同导致出现lymphostin的多种类似物即neolymphostin A-D,Miyanaga等推测是由lymA基因中N-酰基转移酶(NAT)的底物差异所造成,这项推测也已从加入13C同位素标记的异丁酸从而得出其正是neolymphostin A中N-异丁酰基的来源得到验证。
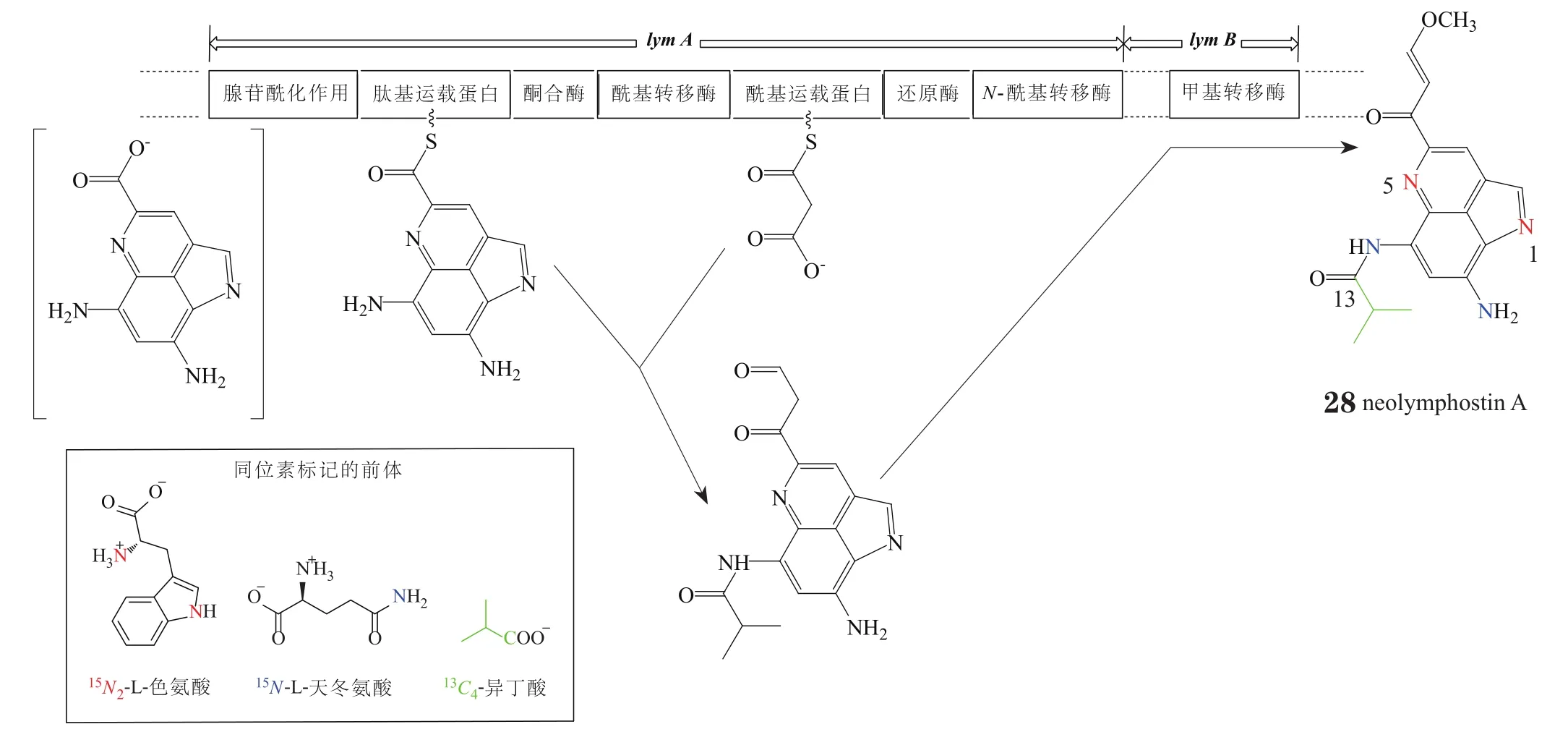
图1 以neolymphostin A为例推断lymphostin及其衍生物的可能生物合成路线Figure 1 Proposed biosynthesis of lymphostin and related derivatives by taking neolymphostin A as an example
另外,Pan课题组[2]在通过加入多种含不同取代基的氨类前体人工发酵制得ammoamide F-P的过程中,也对Streptomyces variabilis SNA-020菌株产生ammosamide的脒基类似物(ammosamide F-P)的机制做出了推测(见图2),认为这是一个非酶催化的胺对ammosamide C(12)亚胺离子的亲核取代过程,随后在产生的苄位发生脱氢氧化得到脒。这项推测已被实验证实,然而反应中pH和金属离子的作用尚未得知,进一步的探索还需后续的假设和论证。
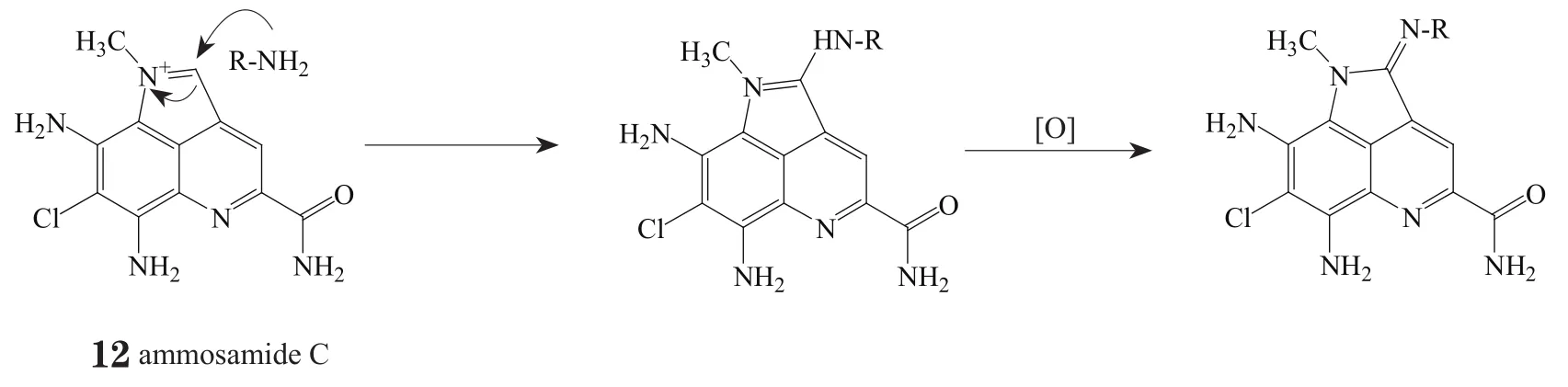
图2 产生ammosamide脒基类似物的可能生物来源路线Figure 2 Possible biogenic routes to amidine analogs of ammosamide
3 吡咯并[4,3,2-de]喹啉类天然产物的化学合成方法
对这些已分离并确证结构的吡咯并[4,3,2-de]喹啉类天然产物,开发其全合成路线,使其作为先导化合物,对特定官能团进行修饰从而改善其生物活性及药动学性质成为新的挑战。由于对此类天然产物的系统研究起步较晚,因此只有早期分离得到的天然产物有为数不多的全合成路线报道,在这些路线中,基本都是以取代苯(苯胺或硝基苯)或吲哚衍生物为起始原料进行目标产物的合成,现分别综述如下。
3.1 Ammosamide的全合成
Hughes等[3,15]首先报道了一种全合成ammosamide A、B和C的方法,该法以吲哚酮类化合物4-氯靛红(43)为起始原料经17步反应制得ammosamide B(见图3)。此合成方法的亮点是:起始原料中的氯原子很容易发生芳环亲核取代引入后续反应所需的官能团,在环上相应位置引入硝基可以克服芳胺水溶性不足的问题,第3个环的合成利用了已有的羰基发生Wittig反应。在随后的硝基还原过程中使用了三氟乙酸酐(TFAA)将氨基酰化,可提高产率也可方便纯化。在制备ammosamide B(11)的过程中,也可产生脱氯ammosamide B(即7位无氯取代的ammosamide B),但很容易在空气和光照的条件下发生氧化降解,故推断7-氯取代可稳定此类物质。Ammosamide B可与Lawesson ' s试剂反应简便地制成ammosamide A(10),后者又可通过S-甲基化作用以及NaBH4还原制得ammosamide C(12)。不过,此路线涉及多种较危险或有毒的试剂,如:HI、POCl3、CuCN等,对操作有较高的要求,且不利于环境保护。
随后,Reddy等[16]也报道了ammosamide B的另一种全合成方法,该法的设计基于通过一步简易反应同时构建吡咯和喹啉环的设想。从廉价易得的原料(49)起始,经9步简单的反应得到目标化合物(总产率6.9%),反应的步骤较少,且不必像上述合成路线一样需在形成喹啉环之前进行预官能团化,用到了如Boc保护剂、NCS等较为温和的试剂(见图4)。这为此类化合物的全合成提供了一种全新的策略。
此外,Wu等[17]也对ammosamide系列化合物的全合成进行了相似的报道。
2013年,Takayama等[18]开发了一种使用串联的傅-克反应实现ammosamide B的全合成的新方法(见图5)。此路线的设计也借鉴了一步成环的思路,起始原料53可通过硝化和亲核取代氨化2步反应很方便地从间二氯代苯制得,然后经历一步关键的由BF3·Et2O参与的串联傅-克反应实现吡咯并喹啉三环的合成,随后通过一系列的母核取代修饰得到目标产物。该法使用了经典的傅-克反应,除了为合成吡咯并[4,3,2-de]喹啉类化合物打开新的思路外,其亮点更在于反应的中间产物54具有能够应用于ammosamide家族其他成员制备的潜力,更加拓宽了此路线的应用价值,为发展更多的ammosamide系列化合物的全合成方法奠定了基础。
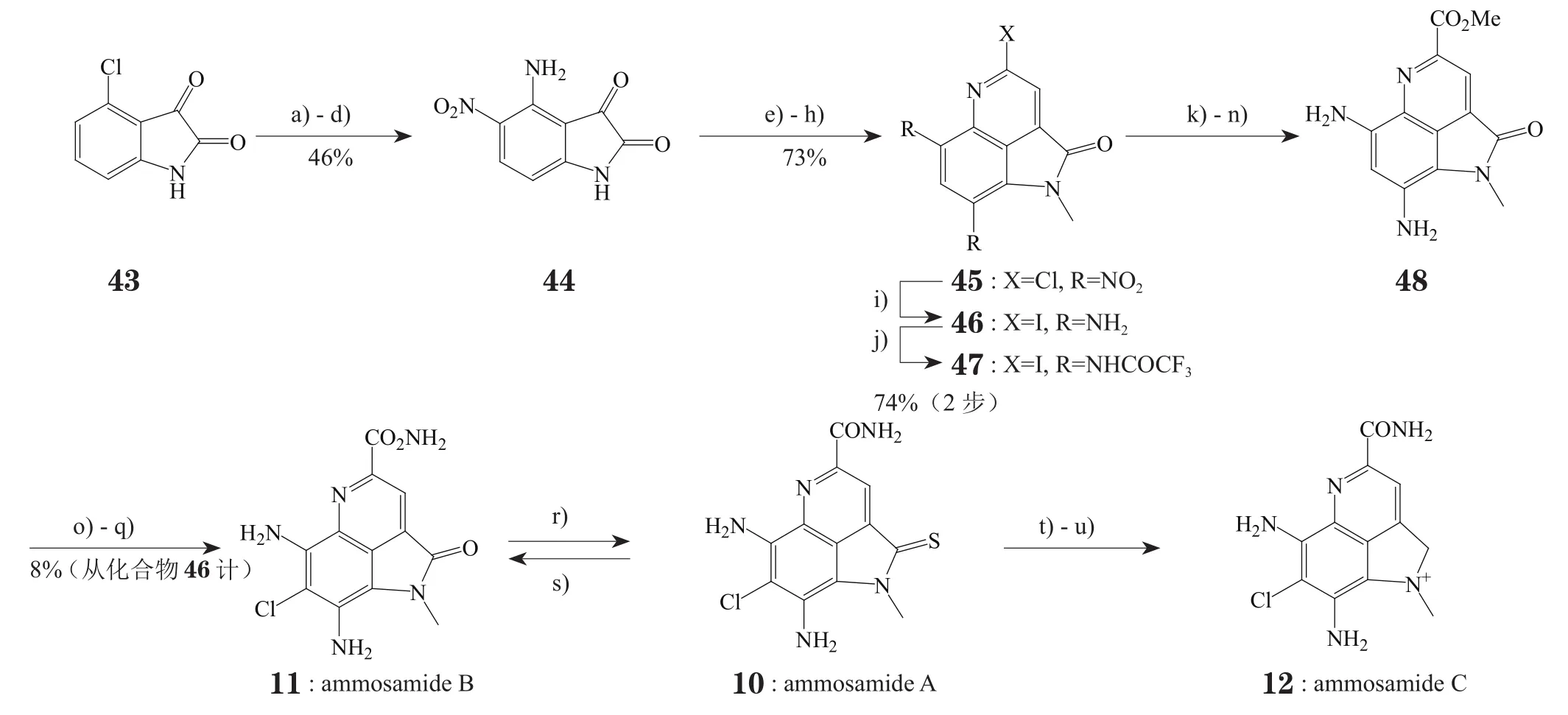
图3 Hughes等报道的全合成ammosamide A, B和C的路线Figure 3 Total synthesis of ammosamide A, B and C reported by Hughes et al
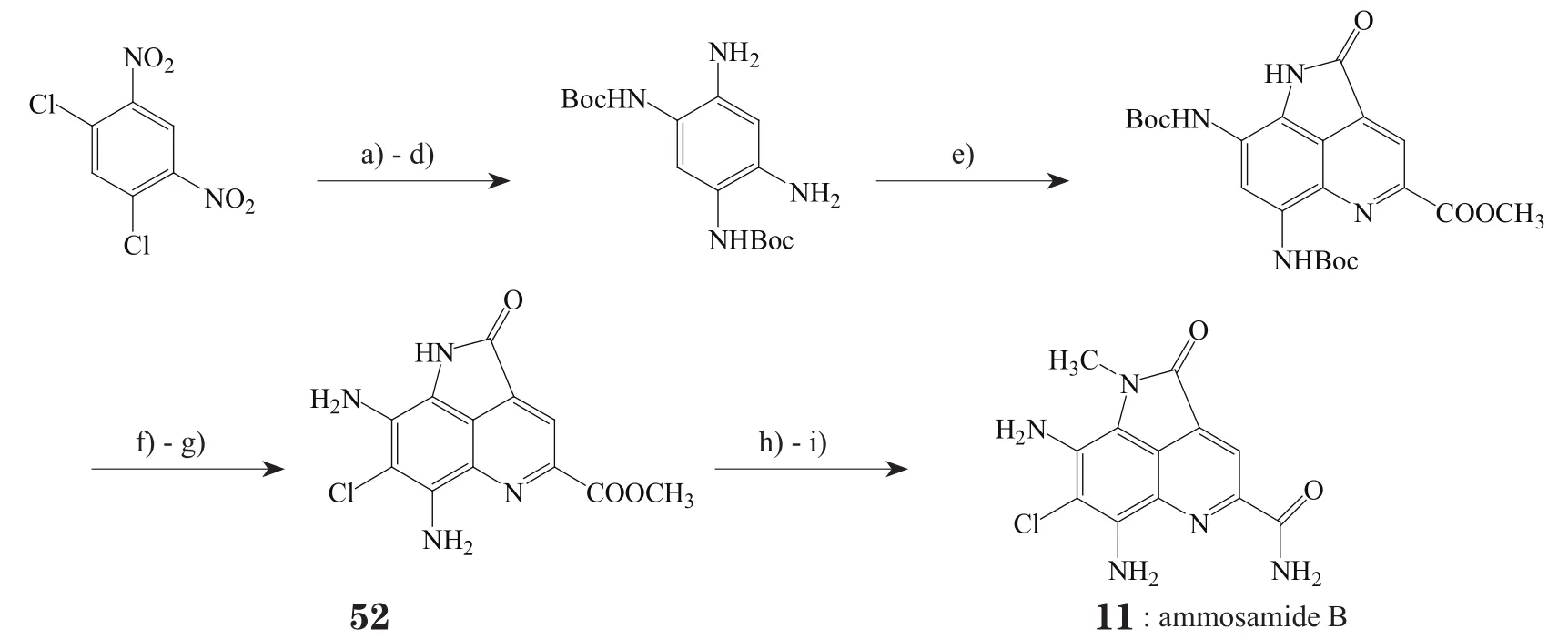
图4 Reddy等报道的全合成ammosamide B的路线Figure 4 Total synthesis of ammosamide B reported by Reddy et al
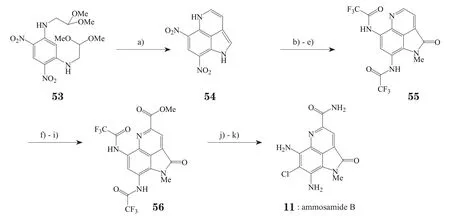
图5 Takayama等报道的全合成ammosamide B的路线Figure 5 Total synthesis of ammosamide B reported by Takayama et al
3.2 Dehydrobufotenine的全合成
Nakamura等[19](Peat等,J Am Chem Soc,1996年;Wolfe等,Acc Chem Res,1998年)将化合物57作为起始原料对dehydrobufotenine进了全合成(见图6),整个路线可大致分为两部分,即:由取代苯胺合成吲哚和在吲哚母核的基础上进行六元环合形成喹啉。合成过程中使用了多种催化剂,如:二茂锆用来稳定苯炔中间体,DBU催化脱除卤化氢,(Ph3P)4Pd催化三环的环合等。在合成化合物60的过程中,使用了K2CO3以及200 ℃的高温,由于更强的碱会脱除吲哚环上氮的保护基,因此采取提高反应温度的方法进行环合,随后发生脱保护基与去甲基化反应,进行季铵化得到目标化合物。
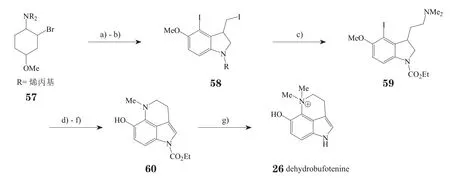
图6 Nakamura等报道的全合成dehydrobufotenine的路线Figure 6 Total synthesis of dehydrobufotenine reported by Nakamura et al
Stoffman课题组[20]则从其之前合成的碘代血清素衍生物出发,采用类似的方法合成了dehydrobufotenine。
3.3 Lymphostin的全合成
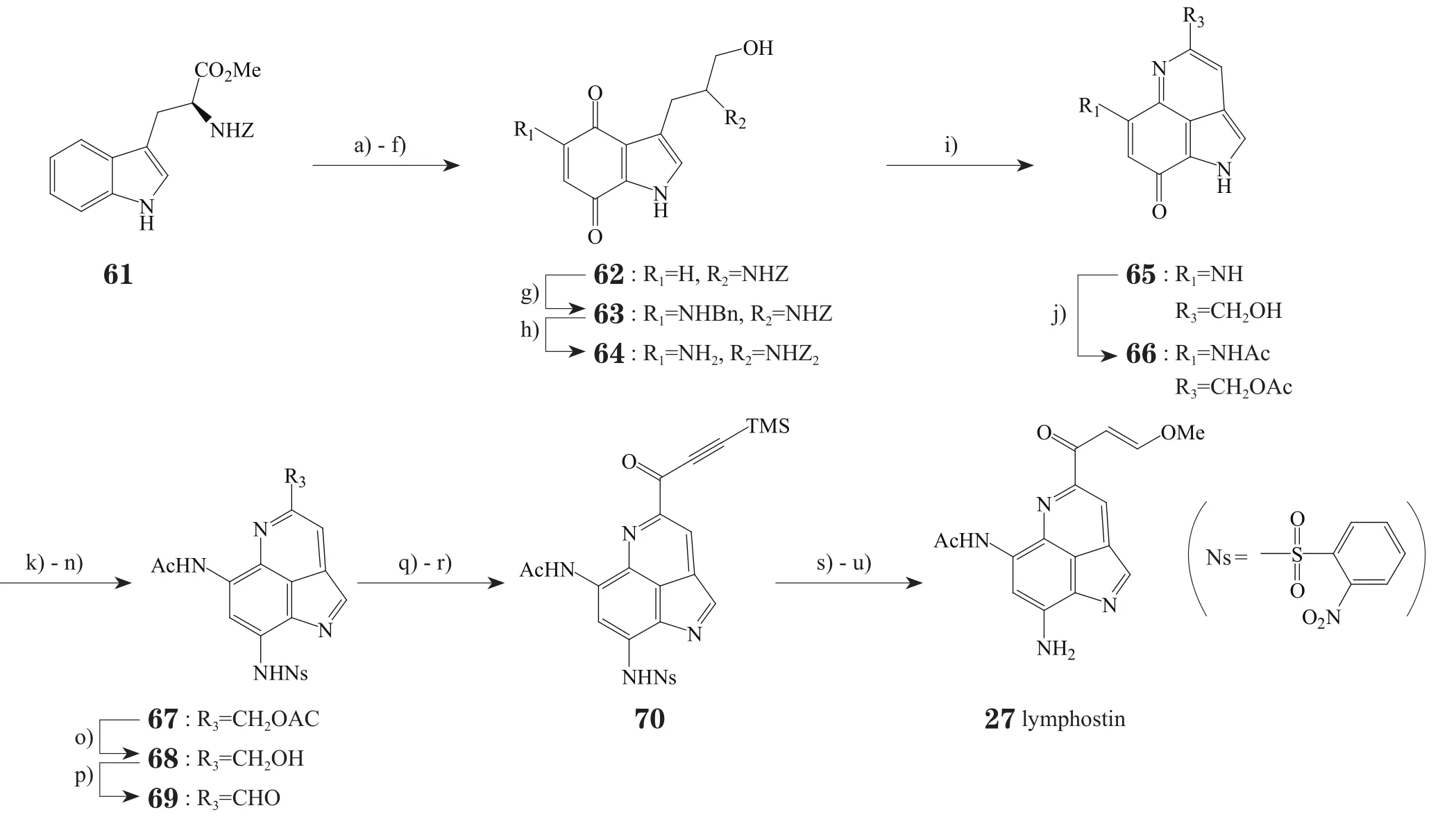
图7 Tatsuta等报道的全合成lymphostin的路线Figure 7 Total synthesis of lymphostin reported by Tatsuta et al
4 总结与展望
天然产物来源广泛多样,结构新颖独特,在现代药物研究中举足轻重。自吡咯并[4,3,2-de]喹啉结构被发现以来,药物研究领域内的许多课题组都在这方面进行了富有开创意义的探索工作,从最初只有几个具有这类母核的天然产物被分离确证到现在接近20个系列100多个具有此全新结构的化合物被纳入新化学实体(NCE)库,且其中有很大一部分结构已被证明有多种多样的生物活性,充分说明天然产物是药物研发的重要资源。但目前此类天然产物的研究还仅限于体外生物活性的测定以及一小部分天然产物的全合成探索,尚未完全明确这类化合物与特定酶和细胞的作用机制及构效关系,也尚未有候选化合物显示出较高的成药性从而进入更深层次的药物开发阶段。因此,今后这一领域的工作将主要集中在实现更多此类天然产物的全合成,并在此基础上以吡咯并[4,3,2-de]喹啉结构为骨架开发生物活性更强、毒副作用更低、药动学性质更好的化合物以及阐明其作用机制、构效关系等方面。笔者所在课题组所开展的研究亦以ammosamide类化合物的结构为基础,探索新的思路构建吡咯并喹啉母核,并设计合成一系列具有潜在活性的衍生物,目前已取得一定成果,相关的化合物合成及活性测定工作仍在进行中。可以认为,吡咯并[4,3,2-de]喹啉类天然产物的发现及发展,为未来的药物研究提供了一个前景广阔的探索方向,一定会将新药特别是抗肿瘤新药的开发及筛选工作推上一个新的台阶。
[参 考 文 献]
[1]Hu J F, Fan H, Xiong J, et al.Discorhabdins and pyrroloiminoquinonerelated alkaloids [J].Chem Rev, 2011, 111(9): 5465-5491.
[2]Pan E, Oswald N W, Legako A G, et al.Precursor-directed generation of amidine containing ammosamide analogs: ammosamides E-P [J].Chem Sci, 2013, 4(1): 482-488.
[3]Hughes C C, Fenical W.Total synthesis of the ammosamides [J].J Am Chem Soc, 2010, 132(8): 2528-2529.
[4]Miyanaga A, Janso J E, McDonald L, et al.Discovery and assemblyline biosynthesis of the lymphostin pyrroloquinoline alkaloid family of mTOR inhibitors in Salinispora bacteria [J].J Am Chem Soc, 2011, 133(34): 13311-13313.
[5]Ralifo P, Sanchez L, Gassner N C, et al.Pyrroloacridine alkaloids from Plakortis quasiamphiaster: structures and bioactivity [J].J Nat Prod, 2007, 70(1): 95-99.
[6]Davis R A, Buchanan M S, Duffy S, et al.Antimalarial activity of pyrroloiminoquinones from the Australian marine sponge Zyzzya sp.[J].J Med Chem, 2012, 55(12): 5851-5858.
为进一步弘扬优秀传统文化,激发干部职工对中国传统文化的热爱和传承,营造团结、和谐的良好氛围。12月4日,十师一八四团组织机关、事业单位、连队“两委”带着他们的“亲戚”开展了“手拉手 学国语‘民族团结一家亲’”趣味活动。
[7]Zou Y, Hamann M T.Atkamine: a new pyrroloiminoquinone scaffold from the cold water Aleutian Islands Latrunculia sponge [J].Org Lett, 2013, 15(7): 1516-1519.
[8]Hu J F, Schetz J A, Kelly M, et al.New antiinfective and human 5-HT2receptor binding natural and semisynthetic compounds from the Jamaican sponge Smenospongia a urea [J].J Nat Prod, 2002, 65(4): 476-480.
[9]Oshiyama T, Satoh T, Okano K, et al.Total synthesis of makaluvamine A/D, damirone B, batzelline C, makaluvone, and isobatzelline C featuring one-pot benzyne-mediated cyclization-functionalization [J].Tetrahedron, 2012, 68(46): 9376-9383.
[10]Chang L C, Otero-Quintero S, Hooper J N, et al.Batzelline D and isobatzelline E from the Indopacifc sponge Zyzzya f uliginosa [J].J Nat Prod, 2002, 65(5): 776-778.
[11]Antunes E M, Beukes D R, Kelly M, et al.Cytotoxic pyrroloiminoquinones from four new species of South African latrunculid sponges [J].J Nat Prod, 2004, 67(8): 1268-1276.
[12]Dijoux M G, Schnabel P C, Hallock Y F, et al.Antitumor activity and distribution of pyrroloiminoquinones in the sponge genus Zyzzya [J].Bioorg Med Chem, 2005, 13(21): 6035-6044.
[13]Hughes C C, MacMillan J B, Gaudencio S P, et al.The ammosamides: structures of cell cycle modulators from a marine-derived Streptomyces species [J].Angew Chem, 2009, 48(4): 725-727.
[14]Reddy P V, Jensen K C, Mesecar A D, et al.Design, synthesis, and biological evaluation of potent quinoline and pyrroloquinoline ammosamide analogues as inhibitors of quinone reductase 2 [J].J Med Chem, 2012, 55(1): 367-377.
[15]Zurwerra D, Wullschleger C W, Altmann K H.Treasures from the sea: discovery and total synthesis of ammosamides [J].Angew Chem Int Ed, 2010, 49(39): 6936-6938.
[16]Reddy P V, Banerjee B, Cushman M.Efficient total synthesis of ammosamide B [J].Org Lett, 2010, 12(13): 3112-3114.
[17]Wu Q, Jiao X, Wang L, et al.Short and straightforward total synthesis of ammosamide B [J].Tetrahedron Lett, 2010, 51(37): 4806-4807.
[18]Takayama Y, Yamada T, Tatekabe S, et al.A tandem Friedel-Crafts based method for the construction of a tricyclic pyrroloquinoline skeleton and its application in the synthesis of ammosamide B [J].Chem Commun (Camb), 2013, 49(58): 6519-6521.
[19]Nakamura I, Yamamoto Y.Transition-metal-catalyzed reactions in heterocyclic synthesis [J].Chem Rev, 2004, 104(5): 2127-2198.
[20]Stoffman E J L, Clive D L J.Synthesis of 4-haloserotonin derivatives and synthesis of the toad alkaloid dehydrobufotenine [J].Tetrahedron, 2010, 66(25): 4452-4461.
[21]Tatsuta K, Imamura K, Itoh S, et al.The first total synthesis of lymphostin [J].Tetrahedron Lett, 2004, 45(13): 2847-2850.
[22]Tatsuta K, Hosokawa S.Total synthesis of selected bioactive natural products: illustration of strategy and design [J].Chem Rev, 2005, 105(12): 4707-4729.
[23]Tatsuta K, Hosokawa S.Total syntheses of polyketide-derived bioactive natural products [J].Chem Rec, 2006, 6(4): 217-233.
Research Progress of Natural Products Based on Pyrrolo[4,3,2-de]quinoline Skeleton
QI Chenxiao, YANG Shengwei, SUN Liping (Department of Medicinal Chemistry, China Pharmaceutical University, Nanjing 210009, China)
Pyrrolo[4,3,2-de]quinoline alkaloids are a series of secondary metabolites which are isolated from toads, marine organisms, etc.possessing signifcant physiological activities of anti-parasite, antivirus, anti-tumor and so on, thus having the potential of being developed into drugs.In this paper, some recent progress on bioactivities, biosynthesis and chemosynthesis of part of these compounds are mainly reviewed.The problems and prospects of such natural products are also provided.
pyrrolo[4,3,2-de]quinoline;alkaloid;natural product;secondary metabolite; anti-tumor activity; synthesis
R914
A
1001-5094(2015)01-0023-09
接受日期:2014-12-20
项目资助:国家自然科学基金资助项目(No.21472243);通讯作者:孙丽萍,教授;
研究方向:新药分子设计与合成研究;
Tel:025-83271414; E-mail:chslp@cpu.edu.cn
