一氧化氮与神经血管单元的关联性及相关药物研究进展
2015-02-01倪远宁季晖王琳娜许昂陈亚琼
倪远宁,季晖,王琳娜,许昂,陈亚琼
(中国药科大学药理学教研室,江苏 南京210009)
·前沿与进展·
ADVANCES IN PHARMACEUTICAL SCIENCES
一氧化氮与神经血管单元的关联性及相关药物研究进展
倪远宁,季晖*,王琳娜,许昂,陈亚琼
(中国药科大学药理学教研室,江苏 南京210009)
一氧化氮(NO)作为一种重要的信号分子,对中枢神经系统具有重要影响。神经血管单元是近年来提出的从整体上描述中枢神经系统的新概念,NO对中枢系统的作用是多层次多角度的,NO与神经血管单元这个整体及其各组成单元均密切相关。综述NO及其合成酶的功能,在中枢神经系统疾病中NO与神经血管单元的相互作用关系及以NO信号通路为靶点的相关药物研究进展。
一氧化氮;一氧化氮合成酶;神经血管单元;氧化应激;血管损伤;脑卒中;阿尔茨海默病;帕金森病
一氧化氮(nitric oxide, NO)是体内重要的信使分子,生理浓度下具有扩张血管、抑制血小板聚集与黏附、信号传递等重要生理作用,但高浓度下则具有炎症介质和细胞毒性作用。神经血管单元(neurovascular unit,NVU)是近年来新提出的一个概念,强调从整体上考虑中枢神经系统的改变,以及多个因素对疾病进程的影响。NO作为中枢神经系统中重要信号分子,与神经血管单元的各个组成部分均有密切关联。本文就一氧化氮及其合成酶的功能、在中枢神经系统疾病中NO信号通路与神经血管单元的关联性及相关药物的研究进展作一综述,旨在为其进一步研究提供参考。
1 一氧化氮及其合成酶
1.1 一氧化氮
NO在体内由L-精氨酸在一氧化氮合成酶(nitric oxide synthase,NOS)的催化作用下生成。NO是血管系统中一种重要的促进血管扩张剂,是中枢神经系统中一种重要的信号分子,另外NO在炎症反应中起关键性的介质作用[1]。在中枢神经系统中,NO作为逆信使,参与突触间信号传递,但其并不储存于突触囊泡内,也并非以胞吐方式释放,而是从神经末梢扩散,故为一种非经典的神经递质[2]。在神经退行性疾病中,NO于疾病早期可起扩张血管、抑制血小板聚集等保护作用,疾病晚期过量表达的NO则与炎症反应相关联,产生神经毒性。神经元活动需要消耗大量的能量,脑部循环为脑组织提供了氧,因此,脑血流的调控对中枢神经系统至关重要。NO可从血管和细胞两个水平,通过多条信号通路来影响中枢神经系统,同时无论在生理还是病理状态下,NO信号通路对脑血流均具有非常重要的调控作用。NO调控脑血流主要通过两条途径,一条是通过自动调控,另一条是通过神经血管偶联调控。神经血管偶联是指神经活动与脑血流的调控相关,从而保证了氧气的供应量可时刻满足实际需要;同时该过程是通过神经血管单元这个整体来实现调控,但在许多脑部疾病中,神经血管偶联通常已遭到破坏[3]。
1.2 一氧化氮合成酶
一氧化氮合成酶是NO合成过程中的重要限速因素,体内NO的生物作用完全依赖于NOS的活性。NOS是一种同工酶,有三种亚型,分别是神经元型一氧化氮合成酶(nNOS)、诱导型一氧化氮合成酶(iNOS)和内皮型一氧化氮合成酶(eNOS)。其中,nNOS和eNOS在生理条件下可正常表达,而iNOS在生理条件下不表达,只在病理条件下诱导表达;nNOS和eNOS具有钙离子和钙调蛋白依赖性,而iNOS具有非钙依赖性,需诱导激活,激活后会长时间大量合成NO[4]。
血管内皮中的NO主要由eNOS催化生成,但在生理条件下,神经系统中神经元细胞主要表达nNOS,因此,当eNOS活性受损时,NO合成即会减少,这也是许多神经损伤疾病的影响因素之一[5]。此外,在病理条件下,还会由于eNOS的重要辅因子四氢生物蝶呤(BH4)分泌不足、L-精氨酸的耗竭、内源性NOS抑制剂非对称性二甲基精氨酸(ADMA)的堆积等多种原因,导致eNOS解偶联(见图1)。eNOS解偶联是指某些病理条件下,eNOS不再促进合成生理活性物质NO,转而生成超氧化物的现象[4]。这并不是一种“全或无”的现象,在病理情况下,会发生部分的eNOS解偶联,这部分解偶联的eNOS和功能正常的eNOS是并存的[6]。eNOS解偶联生成的超氧阴离子(O2-)进一步消耗具有生理活性的NO,生成过氧化亚硝基(ONOO-)等神经毒性更强的物质。因此,在中枢神经系统受损时,eNOS的解偶联一方面减少了正常的NO含量,另一方面却增加了超氧化物的累积,从两个方面加剧了神经损伤。在病理条件下,iNOS才被诱导激活,在中枢神经系统中,iNOS主要表达于小胶质细胞、神经元和星形胶质细胞中[7]。当iNOS被诱导激活后,会持续、大量地产生NO。
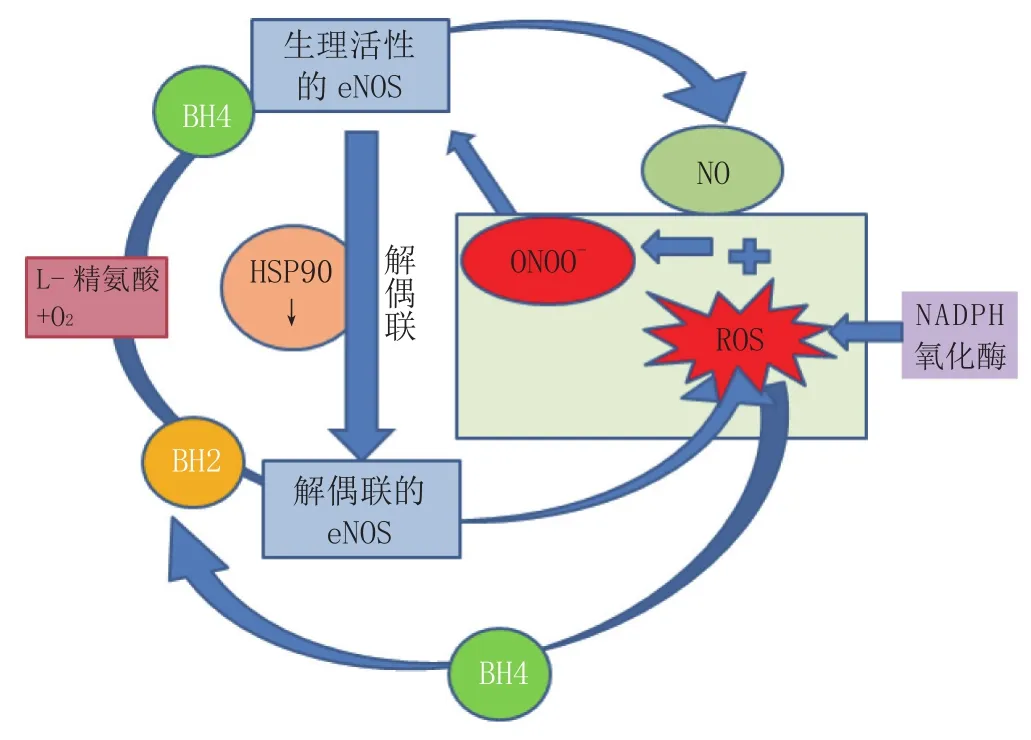
图1 eNOS解偶联机制Figure1 Mechanism of eNOS uncoupling
2 一氧化氮与神经血管单元
近年来,神经血管单元这个概念受到越来越多人的重视。神经血管单元是指以神经元、血脑屏障、胶质细胞及细胞外基质构成的一个整体性概念[8]。NVU强调中枢神经系统中多种细胞的功能及其相互联系,而NO信号通路对整个中枢神经系统均有重要影响,因此与NO相关的因素涉及到神经血管单元这个整体的方方面面。
2.1 一氧化氮与神经元
当机体遭受有害刺激时,体内的活性氧自由基、活性氮自由基等高活性分子生产过量,即引起氧化/硝化应激反应;当自由基产量超出机体自身的自由基清除能力时,氧化和抗氧化系统即会失衡进而损伤神经元细胞。在这种应激条件下,对机体造成损伤的除了NO本身,还有NO与过多的超氧阴离子反应而产生毒性更强的ONOO-,NO也被进一步消耗,故而影响NO的正常生理功能的发挥[9]。目前普遍认为,ONOO-引发的氧化损伤是NO导致中枢神经损伤的重要途径[10]。神经元损伤为脑卒中、帕金森病、阿尔茨海默病等一系列中枢神经系统疾病的关键影响因素。此外,在谷氨酸兴奋性递质释放增多、线粒体功能障碍和L-精氨酸缺乏的情况下,神经元细胞自身也会产生ONOO-[11],从而造成恶性循环,加重中枢神经损伤。
2.2 一氧化氮与血脑屏障
血脑屏障是指由星形胶质细胞、血管内皮细胞、周细胞和基底膜等组成的复杂结构,它是NVU的核心结构[12],血脑屏障对于维持中枢神经系统的正常功能具有重要作用。在各种脑损伤疾病中,均伴有血脑屏障通透性的变化,而NO与血脑屏障的通透性变化息息相关。具有不同于外周血管内皮细胞的特殊形态及功能的脑微血管内皮细胞组成了血脑屏障的基本框架,在此框架基础上,星形胶质细胞附着于内皮细胞之上,且在周细胞和基底膜等结构的辅助下,共同起到屏障的功能。血脑屏障是一个非常重要的结构,它把中枢神经系统和外周的血液循环系统分隔开,有效地阻止了血液中对脑组织有害的物质进入脑中,起保护和维持中枢神经系统正常功能的重要作用。当血脑屏障被破坏时,血液中的有害物质会进入中枢神经系统,同时离子平衡遭到破坏,血管中液体进入血管外间隙,进而引发脑水肿等一系列危及生命的严重问题。在生理条件下,NO通过激活可溶性鸟苷酸环化酶(sGC)影响Na+和K+水平,催化三磷酸鸟苷(GTP)转化成环磷酸鸟苷(cGMP)来改变内皮细胞的形态结构,进而改变血管的通透性[13]。而机体发生氧化应激时,NO大量产生,NO与超氧阴离子反应进一步生成的ONOO-破坏内皮细胞膜,增加内皮细胞以及血脑屏障的通透性。研究表明,通过清除自由基可有效抑制血脑屏障的通透性增加(Weisbrot-Lefkowitz等,Brain Res Mol Brain Res,1998年)。
2.3 一氧化氮与胶质细胞
胶质细胞对神经元起支持、营养作用,对维持神经系统正常功能也十分重要,同时胶质细胞还是中枢神经系统中具有免疫功能作用的细胞。正常情况下,小胶质细胞处于静息状态,当周围环境发生病理性改变时,小胶质细胞迅速活化增殖,参与免疫反应,且能引起吞噬作用。小胶质细胞还可通过分泌多种细胞因子,参与病理进程。当中枢神经系统受损时,激活的小胶质细胞会产生包括NO在内的多种物质,如自由基、超氧化物阴离子等,诱导细胞凋亡,对神经系统产生一系列的损伤作用。
3 在疾病进程中一氧化氮与神经血管单元的关联性及其相关治疗药物
在涉及中枢神经系统的疾病中,脑功能并不仅是某个局部受损,而是从整体上均被影响,神经血管单元作为一个整体,其各个部分均参与了疾病的发生发展过程,包括神经元的损伤、胶质细胞产生炎症因子和细胞毒性物质、血脑屏障通透性改变等。NO与这些因素相互作用,影响了疾病的进程。
3.1 缺血性脑卒中及其治疗药物
缺血性脑卒中是一种由脑部供血受阻而迅速发展的脑功能损伤,占脑卒中发病率的70%~80%。大脑中动脉是缺血性脑卒中的易发部位,当脑动脉形成血栓后,脑血流受阻变慢,脑组织缺氧缺血,继发的各种级联反应导致了脑组织的受损。与脑缺血及再灌注导致的损伤相关作用机制有兴奋性毒性、离子失衡、氧化/硝化应激、皮层扩散性去极化、炎症反应等[14]。缺血性脑卒中不是简单的神经元损伤,而是在疾病进程中星形胶质细胞和小胶质细胞、神经轴突、微血管等结构均受损伤,这些因素相互关联影响,引起一系列的级联损伤反应[15]。
脑缺血后再灌注会导致血管损伤、血脑屏障通透性增加进一步加重。该损伤机制包括磷脂酶A2被激活而产生大量花生四烯酸,腺嘌呤核苷酸分解产生黄嘌呤和次黄嘌呤,这些物质在缺血再灌注时代谢产生大量的超氧阴离子。脑缺血后再灌注还会导致细胞内Ca2+浓度增加,受钙离子调控的NOS被激活,NO产量增加。在之前已有氧化应激损伤产生大量自由基的情况下,NO与超氧阴离子结合产生细胞毒性更强的ONOO-,加重对脑组织的损伤。同时,NO还会导致蛋白的S-亚硝基化,即NO与半胱氨酸硫醇基发生共价结合。NO在脑中可使类固醇受体辅活化因子Src同源区域2-蛋白酪氨酸磷酸酶-2(SHP-2)S-亚硝基化,生成S-亚硝基化的SHP-2(SNO-SHP-2),脑缺血后体内SNO-SHP-2含量增加。这种反应会抑制SHP-2的磷酸化,进而抑制下游的细胞外调节蛋白激酶ERK1/2通路,该神经保护通路的阻断会增加缺血性脑卒中的兴奋性毒性损伤[16]。在脑缺氧模型中还观察到NO诱导线粒体中的促凋亡蛋白Bax表达上调,改变膜通透性,使钙离子内流,从而导致线粒体的DNA断裂[17]。低氧环境下,NO还会影响自噬体的形成,而自噬体是在缺氧条件下具有保护机体、降低自由基损伤的重要细胞器。因此,NO对神经的损伤还与抑制自噬作用有关[7]。
脑缺血及其再灌注过程与NO的含量及其相关信号通路密切相关(见图2)。在大脑的动脉阻塞(MCAO)模型中,NO的产生量在30 min内提高了20倍,但在造模7 d后,脑组织的NO含量大幅降低(Malinski等, J Cereb Blood Flow Metab,1993年)。表明,在脑缺血初期NO含量大幅升高,但长期缺血损伤后脑组织会出现NO供应不足。不同的是,在缺血后再灌注时,NO的含量会在再灌注损伤的30 min内暂时性地上升50%(Uetsuka等,J Neurotrauma,2002年)。在MCAO模型中,NOS的表达量也在变化,研究表明造模最初的短时间内eNOS和nNOS含量上升,但很快就会下降(Kader等,Stroke,1993年)。而iNOS则在脑缺血的中后期表达,即在MCAO造模12 h后直至d 7这段时间内,iNOS的表达有所上调[18-19]。血脑屏障的损伤以及由此引发的脑水肿对急慢性脑缺血均具有重要影响[20]。
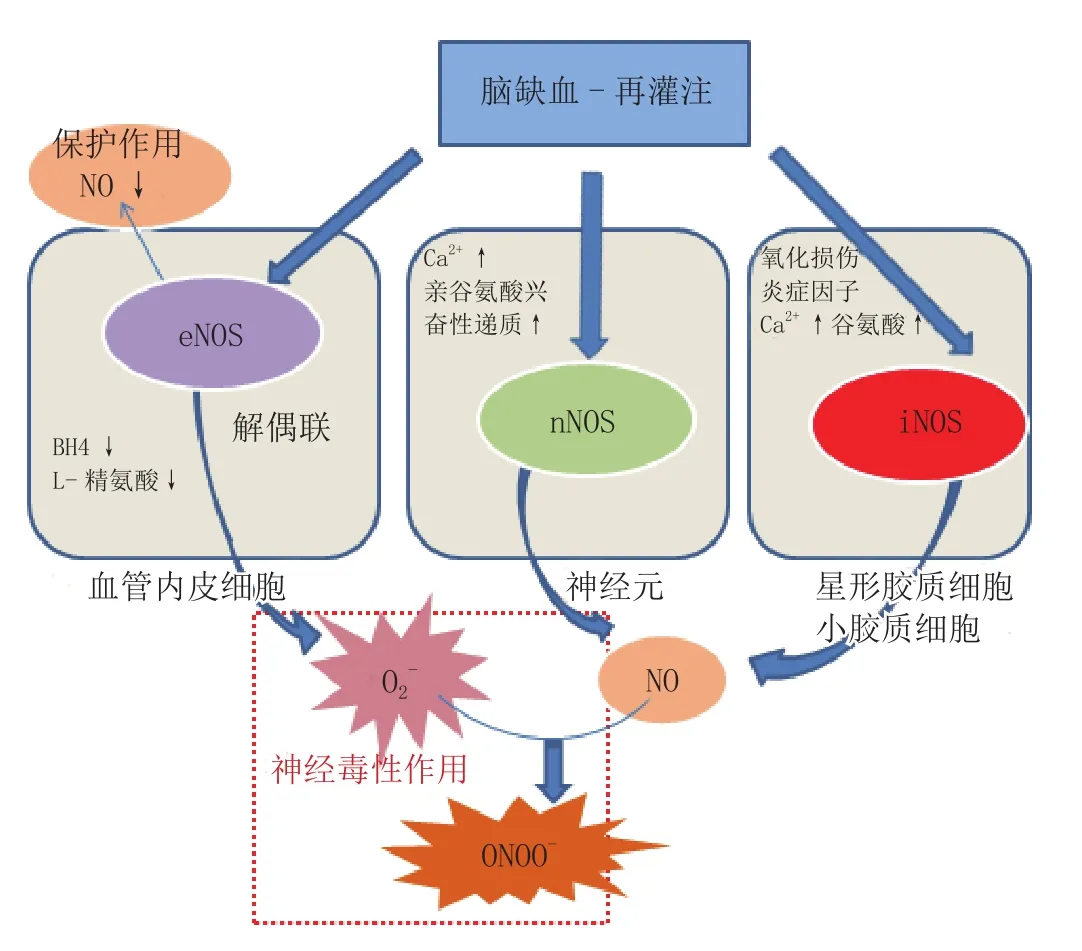
图2 NO及NOS在脑缺血再灌注过程中的作用Figure 2 Roles of NO and NOS in the pathophysiology of stroke
以NO信号通路为靶点治疗缺血性脑卒中的药物目前已有较多研究。缺血性脑卒的病理进程中,脑内NO存在过度表达,NOS抑制剂可起一定的保护作用。有研究发现,nNOS对局部脑缺血早期的血脑屏障损伤有影响,nNOS抑制剂7-硝基吲唑(7-nitroindazole,7-NI)和N-丙基-L-精氨酸(N-propyl-L-arginine,L-NPA)可减轻缺血再灌注期间血脑屏障的损伤[21]。选择性iNOS抑制剂,例如3-溴-7-硝基吲唑也可显著改善脑缺血引起的损伤[22]。但由于目前缺少高度选择性的NOS抑制剂,现有NOS抑制剂往往会影响eNOS的正常生理功能,因此该类药物尚未在临床广泛应用,有待进一步开发。作为羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂的他汀类药物,被发现在临床上对缺血性脑卒中具有预防作用。他汀类药物可降低血脂,且有多重的血管保护作用,其中包括对NO的影响。有研究表明,在脑卒中模型中,长期给予HMG-CoA还原酶抑制剂类药物,可上调eNOS的表达(Laufs等,Brain Res,2002年)、降低梗塞面积、减轻脑水肿(Prinz等,Stroke,2008年;Mariucci,Eur J Pharmacol,2011年)等。他汀类药物对缺血性脑卒中的作用机制主要是通过增加eNOS的活性,以及通过PI3K/AKT通路激活eNOS蛋白磷酸化,从而发挥抗炎作用。虽然他汀类药物对缺血性脑卒中有效,但多数研究表明该类药物对缺血性脑卒中主要表现为预防作用。L-精氨酸是体内合成NO的原料,在体内NO供体类药物可通过代谢而产生NO,故L-精氨酸和NO供体类药物可增加体内NO的含量,在脑缺血模型中具有改善脑血流、降低梗塞面积的神经保护作用[23]。本课题组以丁苯酞(NBP)为先导物,设计合成了一系列NBP的开环衍生物,并对其进行了药效学和相关机制的研究。其中NO供体类药物ZJM-289在进入体内后,可透过血脑屏障,在酯酶的作用下释放NBP前体,进一步环合成(S)-NBP,同时释放NO,该药类物可通过呼吸链保护、改善线粒体功能障碍、抑制线粒体相关凋亡途径,从而对脑缺血再灌注损伤起保护作用[24]。在脑缺血模型和缺氧缺糖细胞模型中,用ZJM-289进行预处理也可起保护作用[25]。此外,本课题组在对代号为10b的NO供体型6-氨基丁苯酞衍生物的体外研究中发现,其具有抑制血小板聚集、释放适量NO的作用[26]。NO作为一种具有双重作用的分子,在生理浓度时eNOS合成的NO具有神经保护作用,而高浓度NO则具有一定的神经毒性作用。NO供体类药物主要通过少量补充NO,弥补eNOS功能障碍造成的NO不足,从而发挥多层次的神经保护作用。虽然NO供体类药物的长期疗效及耐受性是其临床广泛应用尚待解决的问题,但该类化合物在治疗缺血性脑卒中方面仍具有广阔的开发前景。
3.2 帕金森病及其治疗药物
帕金森病(Parkinson's disease,PD)是一种神经退行性疾病,其病理特征为脑黑质致密部含有黑色素的多巴胺(DA)能神经元大量变性坏死。引起黑质多巴胺能神经元特异性变性的病因有环境因素、遗传因素、衰老、氧化应激、兴奋性氨基酸毒性、线粒体功能障碍、外源性神经毒素等。NO相关的信号通路与PD发病的分子机制密切相关。
兴奋性中毒对帕金森患者的神经细胞坏死起关键性作用,该过程主要由谷氨酸及其受体引起。人体内有N-甲基-D-天冬门氨酸受体(NMDAR)、α-氨基羟甲基恶唑丙酸受体(AMPAR)、海人藻酸受体(KAR)三种兴奋性氨基酸受体,其中主要是NMDAR介导兴奋性毒性作用,这与多巴胺能神经元的变性相关[27]。当谷氨酸浓度增高时,NMDAR被激活致使钙离子内流,激活nNOS产生过量NO[28],进而产生ONOO-导致神经元变性和坏死。在脑组织的多巴胺能神经元周围存在大量胶质细胞。目前认为,人脑黑质中的NO主要来源于星形胶质细胞和小胶质细胞中iNOS的诱导激活,研究表明黑质神经元的损伤可导致星形胶质细胞中iNOS的过度表达(Wallacc等,J Neurosci Lett,1996年)。帕金森患者脑组织的多巴胺能神经元周围的胶质细胞大量表达iNOS,进而产生高浓度的NO,导致多巴胺能神经元的死亡(Hirch等,Ann Neurol,1998年)。
1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)是一种能诱发类似PD的症状,影响疾病进程及病理变化的神经毒性物质。MPTP代谢生成的甲基-苯基吡啶离子(MPP+)可导致多巴胺能神经元的变性坏死。MPTP/ MPP+模型可用于模拟PD。有研究发现,用免疫组化法观察到黑质中的nNOS阳性神经元和TH-阳性神经元分布呈相关性,证明NO与黑质细胞的损伤有关,后续实验中向纹状体注入MPP+,发现MPP+逆行至黑质导致了神经元的变性(Mattews等,Nuerobiol Dis,1997年)。有关nNOS对PD的作用研究中,将MPTP分别给予野生型鼠和nNOS基因敲除的变异型鼠,nNOS敲除的变异型与野生型相比,多巴胺能神经元的减少现象显著减轻(Padovan-Neto等,Neuroscience,2009年)。上述研究结果均表明,NO参与了MPTP导致的神经毒性作用,对帕金森病的形成具有重要影响。
NO在PD发病过程中的作用机制,为以NO相关通路为靶点的帕金森治疗药物的开发提供了理论依据。NO对于多巴胺在基底神经节的传递具有重要作用,因而被认为与帕金森的发病机制有关。NO/cGMP信号通路会影响左旋多巴(L-DOPA)诱导的Pitx3(-/-)小鼠运动障碍,7-NI可减轻该运动障碍,是一种有前景的PD治疗药物[29]。他汀类药物辛伐他汀具有逆转多巴胺纹状体的缺失以及亚硝基自由基产生的作用[30],持续使用亲脂性的他汀类药物可降低PD的发病率[31]。红景天苷可通过抑制ROS和NO的生成,从而对MPTP/ MPP+诱导的帕金森模型起保护作用[32]。上述均为帕金森病治疗药物的研发提供了新思路。
3.3 阿尔茨海默病及其治疗药物
阿尔茨海默病(Alzheimer's disease,AD)是一种严重的神经系统退行性疾病,临床表现为认知和记忆功能不断恶化,日常生活能力进行性减退,并伴有各种神经精神症状和行为障碍。AD患者的病理特征为脑中广泛的神经元纤维缠结,轴突缠结形成老年斑以及神经元的变性和缺失。研究发现,导致老年斑和神经元纤维缠结的主要因素是β淀粉样蛋白(β-amyloid,Aβ)的异常代谢和沉积以及tau蛋白的异常过度磷酸化[33]。NO在整个AD疾病进程具有重要的作用。
NOS的表达及NO的产生与Aβ密切相关。Aβ可通过细胞因子、转录因子、膜受体、信号通路等一系列机制共同调控NOS的表达。在AD动物组织观察中发现,Aβ沉积的斑块四周有大量活化的星形胶质细胞和小胶质细胞(Itagaki等, J Neuroimmunol,1989年),胶质细胞激活后会导致iNOS的高表达,进而释放大量NO。在大鼠的单侧纹状体注入纤维性Aβ1-40后发现,注射部位周围的星形胶质细胞和小胶质细胞含量增加;30 d后注射部位附近iNOS的免疫阳性反应增加,且已证明iNOS位于星形胶质细胞和小胶质细胞中(Weldon等,J Neurosci,1998年)。在AD患者脑内海马及内嗅皮层星形胶质细胞中,有nNOS的免疫阳性反应(Simic等,Exp Neurol,2000年)。以上结果证明,AD患者脑内Aβ与胶质细胞的激活相关,胶质细胞激活引起iNOS和nNOS的表达上调、NO含量增加,进而导致神经元的变性和受损。
NO与导致神经元纤维缠结的过度磷酸化tau蛋白同样有关。将仅表达Aβ沉积的APPswDI转基因小鼠与NOS2-/-小鼠杂交后,子代脑组织中除Aβ沉积外还存在高度磷酸化的tau蛋白(Colton等,J Alzheimers,2008年)。在AD脑组织中,NO-鸟苷酸环化酶-cGMP-Akt通路抑制糖原合成酶激酶3β的活性,从而使tau蛋白的异常过度磷酸化(Magrane等,J Neurosci,2005年)。由NO反应产生的ONNO-还会抑制tau蛋白分解,同时阻碍tau蛋白正确剪切和聚集,促使神经元纤维缠结形成。此外,近年来有观点认为,与神经元损伤相比,突触的消失与脑功能的损伤联系更大,由NOS产生的过氧化亚硝酸盐能从化学结构上修饰突触膜蛋白,从而影响AD的疾病进程[34]。
AD患者还存在脑血管的结构和功能异常。在AD患者脑组织中,Aβ沉积在血管上,会导致血小板聚集、黏附分子黏附从而诱发血管损伤。Aβ42能抑制eNOS的功能(Gentile等,J Bio Chem,2004年),从而影响血管的舒张,导致脑血流的慢性减退、血管内皮细胞发生氧化应激等一系列损伤作用。同时,脑血流减退还会促使淀粉样前体蛋白异常分解,从而产生更多Aβ,进一步加重损伤(Li等,Neurosci,2010年)。生理浓度的NO具有扩张血管、抑制血小板聚集、保护血管功能的作用,对于AD中的微血管损伤是有益的。但另一方面,AD的进程伴随一些炎症因子和自由基水平的升高,这些均易造成神经损伤作用。慢性的灌注不足会导致阿尔茨海默病的发生发展,在这个过程中体内氧化应激反应被激活,活性氧ROS和活性氮RNS水平上升[35]。研究表明,AD患者的神经损伤与NO通路相关,促炎因子如干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)的水平可影响NO的水平[36]。
在临床上目前主要应用于治疗AD的药物是胆碱酯酶抑制剂类药物,近期有研究表明,类胆碱药物也表现出较好的AD治疗效果[37]。以NO相关通路为靶点的药物也有一些研究。他汀类药物可上调HO-1和BVR-A的表达,有效地减轻AD病程中的iNOS激活和氧化/硝化应激损伤[38],具有降低老年痴呆疾病风险的作用[39]。NO和H2S等气体信号分子正成为近年来神经系统退行疾病的研究热点,一种新型的促NO和H2S释放药物已证实可通过降低炎症反应中星形胶质细胞和小胶质细胞的活化,从而阻止神经炎性反应,是治疗神经系统退行性疾病的理想候选药物[40]。
3.4 以一氧化氮相关通路为靶点的其他疾病治疗药物
[41-43],总结以NO相关通路为靶点的其他疾病治疗药物研发情况见表1。
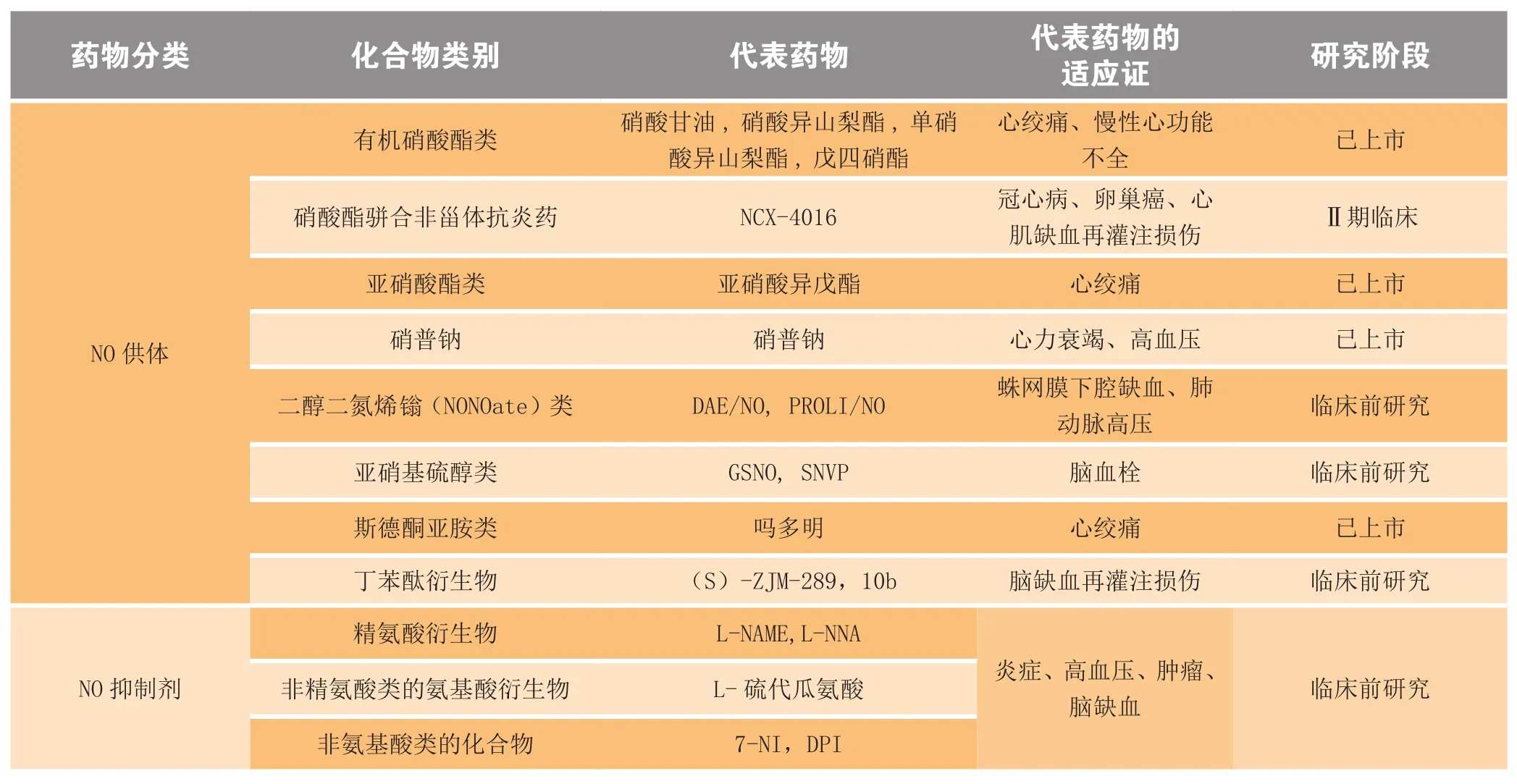
表1 NO信号通路相关药物分类及其代表药物Table1 Representative drugs related with NO signaling pathway
4 结语
NO在中枢神经系统中,是一个从多方面多角度具重要作用的小分子物质。近年来新提出的神经血管单元的概念,转变了以往零散、不成体系地从某个点看待疾病的方式,而是把关注点放在一个整体结构上进行研究。在中枢神经系统的各种主要疾病中,NO通过影响神经血管单元的各个要素,进而影响整个疾病的进程。同时,针对NO相关信号通路这个靶点,有较多药物亦开展相关研究,这些均为中枢神经系统疾病治疗药物的开发提供了新的思路。
[参 考 文 献]
[1]Virarkar M, Alappat L, Bradford P G, et al.L-arginine and nitric oxide in CNS function and neurodegenerative diseases[J].Crit Rev Food Sci Nutr, 2013, 53(11): 1157-1167.
[2]Watkins L R, Milligan E D, Maier S F.Glial activation: a driving force for pathological pain[J].Trends Neurosci, 2001, 24(8): 450-455.
[3]Piknova B, Kocharyan A, Schechter A N, et al.The role of nitrite in neurovascular coupling[J].Brain Res, 2011, 1407: 62-68.
[4]Förstermann U, Sessa W C.Nitric oxide synthases: regulation and function[J].Eur Heart J, 2012, 33(7): 829-837.
[5]Srivastava K, Bath P M, Bayraktutan U.Current therapeutic strategies to mitigate the eNOS dysfunction in ischaemicstroke[J].Cell Mol Neurobiol, 2012, 32(3): 319-336.
[6]Ponnuswamy P, Schröttle A, Ostermeier E, et al.eNOS protects from atherosclerosis despite relevant superoxide production by the enzyme in apoE-/-mice[J].PloS One, 2012, 7(1): e30193.
[7]Benavides G A, Liang Q, Dodson M, et al.Inhibition of autophagy and glycolysis by nitric oxide during hypoxia-reoxygenation impairs cellular bioenergetics and promotes cell death in primary neurons[J].Free Radic Biol Med, 2013, 65: 1215-1228.
[8]Muoio V, Persson P B, Sendeski M M.The neurovascular unit-concept review[J].Acta Physiol, 2014, 210(4): 790-798.
[9]Radi R.Peroxynitrite, a stealthy biological oxidant[J].J Biol Chem, 2013, 288(37): 26464-26472..
[10]Pacher P, Beckman J S, LiaudetL.Nitric oxide and peroxynitrite in health and disease[J].Physiol Rev, 2007, 87(1): 315-424.
[11]Torreilles F, Salman-Tabcheh S, Guérin M, et al.Neurodegenerative disorders: the role of peroxynitrite[J].Brain Res Rev, 1999, 30(2): 153-163.
[12]Lo E H, Dalkara T, Moskowitz M A.Mechanisms, challenges and opportunities in stroke[J].Nat Rev Neurosci, 2003, 4(5): 399-415.
[13]Janigro D, West G A, Nguyen T S, et al.Regulation of blood-brain barrier endothelial cells by nitric oxide[J].Circ Res, 1994, 75(3): 528-538.
[14]Moskowitz M A, Lo E H, Iadecola C.The science of stroke: mechanisms in search oftreatments[J].Neuron, 2010, 67(2): 181-198.
[15]Xing C, Arai K, Lo E H, et al.Pathophysiologic cascades in ischemic stroke[J].Int J Stroke, 2012, 7(5): 378-385.
[16]Shi Z Q, Sunico C R, McKercher S R, et al.S-nitrosylated SHP-2 contributes to NMDA receptor-mediated excitotoxicity in acute ischemic stroke[J].Proc Natl Acad Scie U S A, 2013, 110(8): 3137-3142.
[17]Mishra O P, Randis T, Ashraf Q M, et al.Hypoxia-induced Bax and Bcl-2 protein expression, caspase-9 activation, DNA fragmentation, and lipid peroxidation in mitochondria of the cerebral cortex of newborn piglets: the role of nitric oxide[J].Neuroscience, 2006, 141(3): 1339-1349.
[18]Zhou M, Wang C M, Yang W L, et al.Microglial CD14 activated by iNOS contributes to neuroinfammation in cerebral ischemia[J].Brain Res, 2013, 1506: 105-114.
[19]Zhang L, Dong L Y, Li Y J, et al.The microRNA miR-181c controls microglia-mediated neuronal apoptosis by suppressing tumor necrosis factor[J].J Neuroinfammation, 2012, 9: 211.
[20]Yang Y, Rosenberg G A.Blood-brain barrier breakdown in acute and chronic cerebrovascular disease[J].Stroke, 2011, 42(11): 3323-3328.
[21]Jiang Z, Li C, Arrick D M, et al.Role ofnitric oxide synthases in early blood-brain barrier disruption following transient focal cerebral ischemia[J].PloS One, 2014, 9(3): e93134.
[22]Srinivasan K, Sharma S S.3-Bromo-7-nitroindazole attenuates brain ischemic injury in diabetic stroke via inhibition of endoplasmic reticulum stress pathway involving CHOP[J].Life Sci, 2012, 90(3/4): 154-160.
[23]Jung K H, Chu K, Ko S Y, et al.Early intravenous infusion of sodium nitrite protects brain against in vivo ischemia-reperfusion injury[J].Stroke, 2006, 37(11): 2744-2750.
[24]Zhao Q, Zhang C, Wang X, et al.(S)-ZJM-289, a nitric oxide-releasing derivative of 3-n-butylphthalide, protects against ischemic neuronal injury by attenuating mitochondrial dysfunction and associated cell death[J].Neurochem Int, 2012, 60(2): 134-144.
[25]Zhang C, Zhang Z, Zhao Q, et al.(S)-zjm-289 preconditioning induces a late phase protection against nervous injury induced by transient cerebral ischemia and oxygen-glucose deprivation[J].Neurotox Res, 2014, 26(1): 16-31.
[26]Wang X, Wang L, Huang Z, et al.Synthesis and biological evaluation of nitric oxide releasing derivatives of 6-amino-3-n-butylphthalide as potential antiplatelet agents[J].Bioorg Med Chem Lett, 2013, 23(7): 1985-1988.
[27]Chaffey H, Chazot P L.NMDA receptor subtypes: Structure, function and therapeutics[J].CurrAnaesth Critical Care, 2008, 19(4): 183-201.
[28]Zweifel L S, Argilli E, Bonci A, et al.Role of NMDA receptors in dopamine neurons for plasticity and addictive behaviors[J].Neuron, 2008, 59(3): 486-496.
[29]Solís O, Espadas I, Del-Bel E A, et al.Nitric oxide synthase inhibition decreases l-DOPA-induced dyskinesia and the expression of striatal molecular markers in Pitx3-/-aphakia mice[J].Neurobiol Dis, 2015, 73: 49-59..
[30]Xu Y Q, Long L, Yan J Q, et al.Simvastatin induces neuroprotection in 6-OHDA-lesioned PC12 via the PI3K/AKT/caspase 3 pathway and antiinfammatory responses[J].CNS Neurosci Ther, 2013, 19(3): 170-177.
[31]Lee Y C, Lin C H, Wu R M, et al.Discontinuation of statin therapy associates with Parkinson disease : a population-based study[J].Neurology, 2013, 81(5): 410-416.
[32]Wang S, He H, Chen L, et al.Protective effects of salidroside in the MPTP/MPP+-induced model of parkinson'sdisease through ROS-NO-related mitochondrion pathway[J].Mol Neurobiol, 2014: 1-11.
[33]Benilova I, Karran E, De Strooper B.The toxic Aβ oligomer and Alzheimer's disease: an emperor in need of clothes[J].Nat Neurosci, 2012, 15(3): 349-357.
[34]Jones G R.The Alzheimer pandemic: is paracetamol to blame?[J].Infamm Allergy Drug Targets, 2014, 13(1): 2-14.
[35]Kim H A, Miller A A, Drummond G R, et al.Vascular cognitive impairment and Alzheimer’s disease: role of cerebral hypoperfusion and oxidative stress[J].Naunyn Schmiedebergs Arch Pharmacol, 2012, 385(10): 953-959.
[36]Belkhelfa M, Rafa H, Medjeber O, et al.IFN-γ and TNF-α are involved during Alzheimer disease progression and correlate with nitric oxide production: a Study in Algerian patients[J].J Interferon Cytokine Res, 2014, 34(11): 839-847.
[37]Fisher A.Cholinergic modulation of amyloid precursor protein processing with emphasis on M1 muscarinic receptor: perspectives and challenges in treatment of Alzheimer’s disease[J].J Neurochem, 2012, 120(Suppl1): 22-33.
[38]Barone E, Di Domenico F, Mancuso C, et al.The Janus face of the hemeoxygenase/biliverdin reductase system in Alzheimer disease: it's time for reconciliation[J].Neurobiol Dis, 2014, 62: 144-159.
[39]Corrao G, Ibrahim B, Nicotra F, et al.Long-term use of statins reduces the risk of hospitalization for dementia[J].Atherosclerosis, 2013, 230(2): 171-176.
[40]Lee M, McGeer E, Kodela R, et al.NOSH-aspirin (NBS-1120), a novel nitric oxide and hydrogen sulfide releasing hybrid, attenuates neuroinflammation induced by microglial and astrocytic activation: a new candidate for treatment of neurodegenerative disorders[J].Glia, 2013, 61(10): 1724-1734.
[41]Miller M R, Megson I L.Recent developments in nitric oxide donor drugs[J].Br J Pharmacol, 2007, 151(3): 305-321.
[42]Mason R P, Cockcroft J R.Targeting nitric oxide with drug therapy[J].J Clin Hypertens, 2006, 8(s12): 40-52.
[43]Serafm R A M, Primi M C, Trossini G H G, et al.Nitric oxide: state of the art in drug design[J].Curr Med Chem, 2012, 19(3): 386-405.
Research Progress in Relationship between Nitric Oxide and Neurovascular Unit as well as in Related Drugs
NI Yuanning, JI Hui, WANG Linna, XU Ang, CHEN Yaqiong
(Department of Pharmacology, China Pharmaceutical University, Nanjing 210009, China)
Nitric oxide, as an important signaling molecule, plays an important role in the central nervous system.Neurovascular unit is a new concept proposed in recent years, which takes the central nervous system as a whole unit.Nitric oxide affects the central nercous system from different aspects, and it is closely related with the neurovascular unit as well as main components of it.The function of nitric oxide and nitric oxide synthase, as well as the relationship between nitric oxide and neurovascular unit in the central nervous system were reviewed.Diseases in central nervous system and drug research related with nitric oxide were also discussed in this review.
nitric oxide; nitric oxide synthase; neurovascular unit; oxidative stress; vascular injury; stroke; Alzheimer’s disease; Parkinson’s disease
R965
A
1001-5094(2015)01-0005-08
接受日期:2014-12-20
项目资助:国家自然科学基金(No.81373419);高等学校博士学科点专项科研基金(No.20130096110005)
*通讯作者:季晖,教授;
研究方向:老年药理学;
Tel:025-86205849;E-mail:huijicpu@163.com
