濒危药用植物三叶青ISSR分子标记的建立
2015-01-16吉庆勇李玉兰张煜炯
彭 昕, 吉庆勇, 李玉兰*, 张煜炯
(1.浙江医药高等专科学校,浙江宁波315100;2.丽水市农业科学研究院,浙江丽水323000)
濒危药用植物三叶青ISSR分子标记的建立
彭 昕1, 吉庆勇2, 李玉兰1*, 张煜炯1
(1.浙江医药高等专科学校,浙江宁波315100;2.丽水市农业科学研究院,浙江丽水323000)
目的对三叶青的简单重复序列-聚合酶链式反应 (ISSR-PCR)体系和扩增程序进行优化,并将其应用于野生三叶青种质资源的遗传分子标记。方法采用单因素试验,对三叶青ISSR-PCR反应条件中的Mg2+、dNTP、引物、模板DNA、TaqDNA聚合酶浓度和退火温度等因素进行筛选,之后结合正交试验来选择多态性高、重复性好的ISSR引物。结果建立了ISSR-PCR最佳反应体系,为25μL反应体系中含有2.5 mmol/L Mg2+、0.2μmol/L引物、0.25 mmol/L dNTP、50 ng DNA模板、0.5U TaqDNA聚合酶,并利用U810等16条引物,初步构建了15份三叶青种质资源的ISSR指纹图谱,平均多态条带百分率达57.0%。结论该反应体系的稳定性和多态性良好,可满足对三叶青野生资源的遗传变异水平和结构分析的研究考察。
三叶青;ISSR;单因素试验;正交试验;遗传多样性
三叶青Tetrastigma hemsleyanum Diels et Gilg是我国特有的葡萄科崖爬藤属珍稀药用植物,主要分布于浙江、广西、江西等少数省份[1],以地下块根或全草入药。它可用于治疗高热、肝炎、风湿性关节炎及病毒性脑膜炎等多种疾病,而且其主要活性成分黄酮对肝癌、肠癌、胃癌和血癌细胞株具有促凋亡作用[2-3]。目前,三叶青的野生资源濒临灭绝,亟待保护,其组培快繁和栽培技术虽已有一些探索[4-7],但技术尚未完全成熟,远不能满足临床需求。研究物种居群间的遗传变异水平可为基因资源保护策略的制定、品种鉴别、良种选育等提供科学依据,而目前关于三叶青种质资源保护方面的研究尚未见报道。
如今,在遗传多样性评价中使用最广泛的DNA标记技术有RFLP、RAPD、SSR、ISSR、AFLP、SRAP和SNP。其中,简单重复序列ISSR(inter-simple sequence repeats)标记是利用锚定的微卫星DNA为引物,在SSR序列的3′端或5′端加上2~4个随机核苷酸,对锚定引物互补的间隔不大的SSR基因片段进行聚合酶链式反应 (PCR)扩增[7]。该技术具有操作简便、多态性好、重复性高、无需预先知道任何靶序列的DNA背景信息、模板需要量少等优点,广泛应用于遗传图谱构建、遗传多样性分析等方面的研究[8-10],但作为一种基于PCR技术的分子标记,其反应条件受到模板DNA及Taq DNA聚合酶用量、Mg2+、dNTP、引物浓度、退火温度等因素的影响,故为了实现分析结果的可靠性和重复性,进行ISSR-PCR反应体系的优化是非常必要的。本实验利用单因子和正交试验相结合的方法,对以上各因素进行系统研究,并筛选出一批多态性好、重复性高的引物,建立了一套稳定的三叶青ISSR-PCR反应体系,并对其稳定性和重复性进行了检测,为关于三叶青的遗传多样性分析和物种保护研究奠定技术基础。
1 材料与仪器
1.1 材料 所用试剂及DNA Marker S plus(包括100、250、500、750、1 000、1 500、2 000、3 000、5 000 bp 9个条带)均购自上海生工生物工程有限公司;100条UBC 801-UBC900 ISSR引物(加拿大哥伦比亚大学公布其序列及编号),上海生工生物工程有限公司合成。
本实验所用的三叶青药材均为野生品种,经丽水市农科院吉庆勇高级农艺师和浙江医药高等专科学校杨雄志教授鉴定为三叶青Tetrastigma hemsleyanum Diels et Gilg。然后,利用表1中编号为jx1的材料对反应体系进行优化,并选取外观性状及居群生境差异较大的zj2、gx1和jx1材料用于有效引物的筛选,所有材料均用于优化后反应体系的稳定性检测。
1.2 仪器 Eppendorf Master cycler PCR仪(德国Eppendorf公司);Gel Doc XR+紫外凝胶成像分析仪、Sub-Cell系统水平电泳槽(美国Bio-Rad公司);高速冷冻离心机 (浙江纳德科学仪器有限公司)。
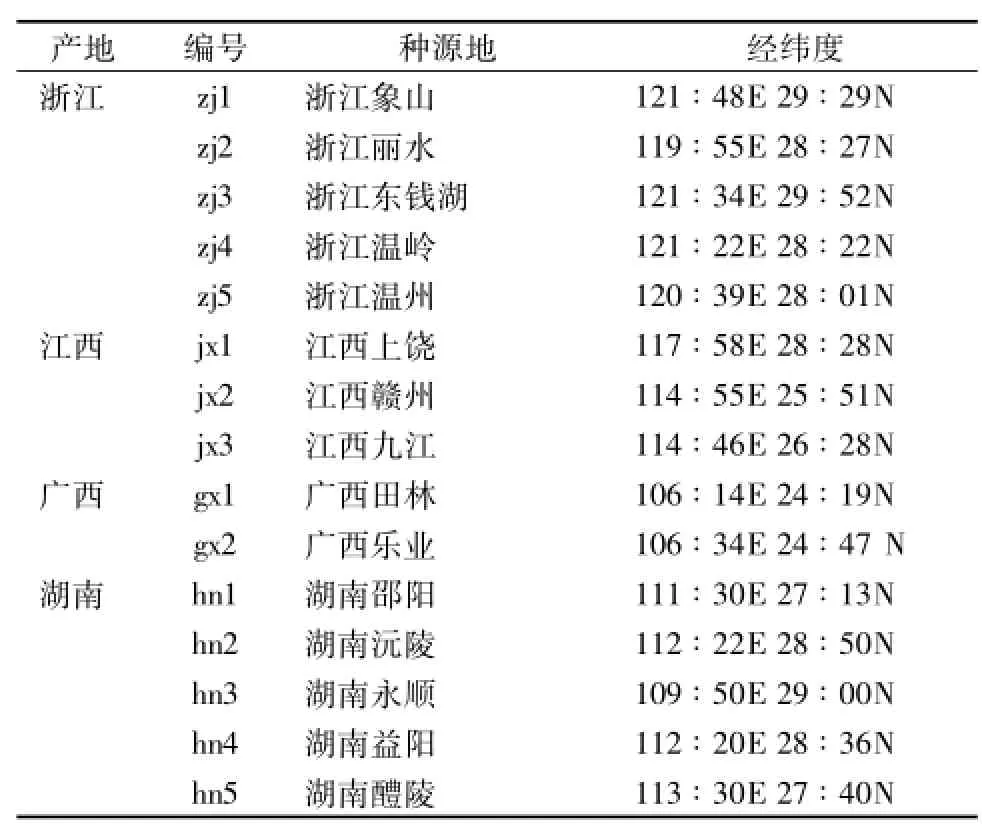
表1 材料来源Tab.1 Sources ofmaterials
2 方法
2.1 植物材料采样及DNA提取 每种药材取样5株,每株取4~6 g新鲜叶片放入密封塑料袋,硅胶干燥,冷藏于-80℃超低温冰箱中,供提取DNA用。总DNA提取采用改良CTAB法[11],0.8%琼脂糖凝胶电泳和核酸检测仪检查总DNA的完整性及纯度,并将其浓度稀释至50 ng/μL备用。
2.2 PCR扩增及引物筛选 ISSR原初扩增反应的体系为25μL PCR反应体积中含10×Taq酶配套缓冲液2.5μL、MgCl22.5 mmol/L、Taq酶2U、模板DNA 50 ng、引物0.3μmol/L、dNTP 0.1 mmol/L。原初扩增程序为95℃下预变性5 min(95℃45 s、50℃60 s、72℃60 s),进行40个循环,72℃下延伸10 min。PCR产物经含有5 mg/L溴化乙锭(EB)的2%琼脂糖凝胶电泳分离,在紫外凝胶成像分析仪内观察并拍照。
2.2.1 单因素试验 先根据原初的PCR反应条件进行引物初筛,选择能看到清晰条带的引物U810(序列为GAG AGA GAG AGA GAG AT),对其退火温度 (采用梯度PCR仪自动生成的8个梯度)、Mg2+浓度、引物浓度、dNTP浓度、模板DNA量、TaqDNA聚合酶用量这6个因素逐一设计单因素试验,见表2。在对某单一因素进行试验时,其他因素均保持不变,以探讨各因素对反应体系的影响,并筛选出最佳条件,每个试验重复3次。
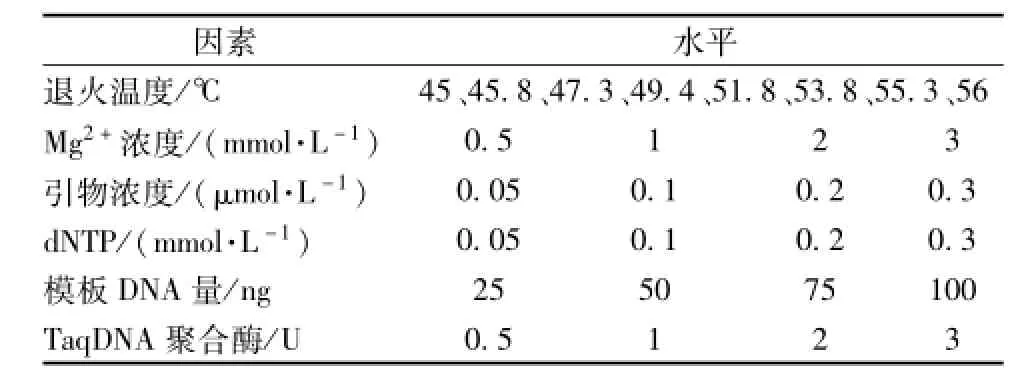
表2 单因素试验中所采用的各因素和水平 (25μL反应体系)Tab.2 Single factor test design for the factors and levels of ISSR-PCR reaction
2.2.2 正交试验 优化PCR反应体系时采用L9(34)设计,根据 “2.2.1”项下方法初步筛选合理的范围,对Mg2+、引物、dNTP和模板DNA进行4因素3水平筛选,见表3。本试验设计9个处理,每个处理重复3次,利用Quantity one分析软件,并按照特异性条带强弱,对试验结果进行标记处理。其中,条带数量丰富、清晰度高、特异条带最强的记为1分,最差的记为9分,其他情况与其相比,取整数值,从低到高依次打分[12-13]。
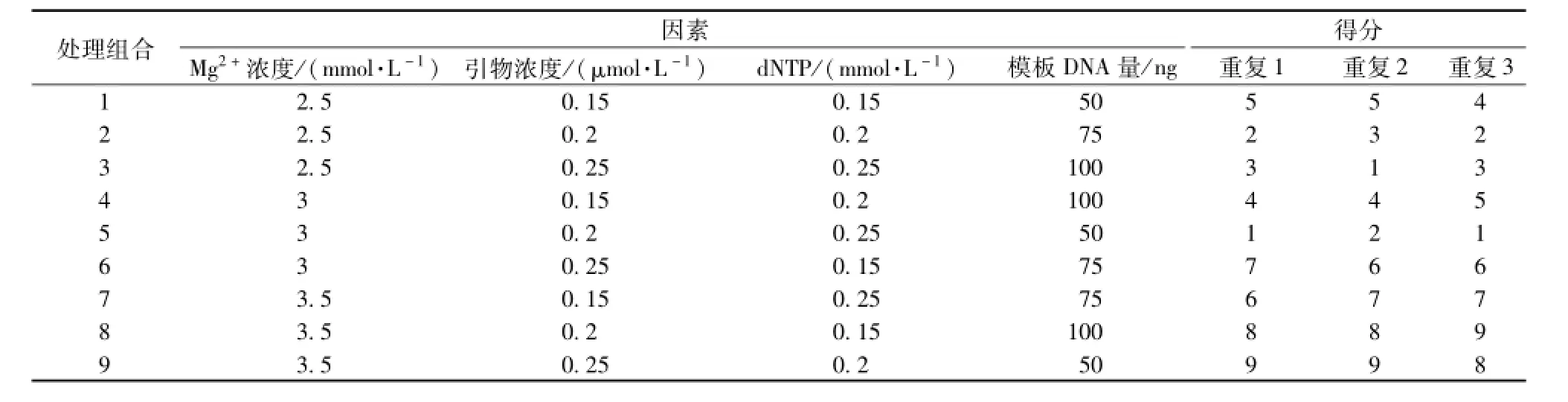
表3 ISSR-PCR反应L9(34)正交设计Tab.3 L9(34)orthogonal design for the factors and levels of ISSR-PCR reaction
2.2.3 引物筛选 采用 “2.2.2”项下优化的扩增条件 (除退火温度项需对每个引物逐一筛选外),对100条 ISSR引物进行筛选。以扩增出的条带数量多、多态性好、清晰度高、重复性好为原则,确定有效引物。
2.3 体系稳定性验证及ISSR图谱建立 将“2.2.3”项方法筛选出的引物采用 “2.2.2”项下优化的扩增条件,对15份三叶青材料反应体系的稳定性进行验证,每个材料重复3次,建立ISSRPCR扩增图谱。
3 结果与分析
3.1 单因素试验结果 本实验先根据原初的PCR反应条件进行引物初筛,选择能看到清晰条带的引物U810来确定退火温度,其对扩增结果的影响见图1。由图可知,虽然各温度均能扩增出条带,但其数量及清晰度有明显区别。45℃时虽然能扩增出较多条带,但均非常弥散;53.8~56℃时虽然一些条带亮度增加,但中分子质量区的条带数明显减少,之间出现弥散现象,而且大分子质量区出现了一些非特异性弱带,背景较高;49.4~51.8℃时扩增出的条带数量最多,而且其清晰度和亮度较高。考虑到较高退火温度有利于减少杂带的产生,因此本实验选择52℃为引物U810用于三叶青ISSR扩增的最佳退火温度。
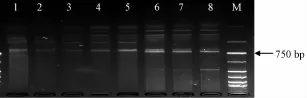
图1 退火温度对三叶青ISSR扩增的影响Fig.1 Effect of annealing tem perature on T.hem sleyanum ISSR amplification
确定退火温度后,逐一改变Mg2+浓度、引物浓度、dNTP浓度、模板DNA量、TaqDNA聚合酶用量这5种因素的水平,结果见图2。由图可知,当Mg2+浓度小于2 mmol/L时,不能扩增出条带;浓度为3 mmol/L时,扩增出的条带多,而且背景清晰。当dNTP浓度上升时,其PCR扩增产物的量增加,但达到0.3 mmol/L时,高分子质量区的主带旁边出现1条杂带,因此选择0.2 mmol/L为最佳浓度。当引物浓度低于0.2μmol/L时,虽然扩增出的条带较清晰,但中等及低相对分子质量区扩增出的条带数目明显减少,亮度降低,而且高分子质量区出现较多杂带;浓度为0.3μmol/L时,低分子质量区出现疑似引物二聚体的杂带,因此选择0.2μmol/L的引物浓度为PCR反应体系的最佳浓度。当模板DNA用量在50~75 ng时,条带数目最多,清晰度高;用量在50 ng以下时,条带清晰度和产量明显提高;用量在100 ng时,扩增产物的产量虽然也明显提高,但高分子及低分子质量区分别出现1条非特异性杂带。
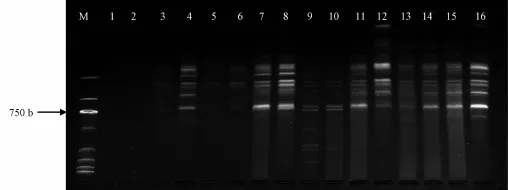
图2 M g2+、引物、dNTP和模板DNA浓度对三叶青ISSR扩增的影响Fig.2 E ffect of M g2+,dNTP,primer and tem p late DNA concentration on T.hemsleyanum ISSR am p lification
从图3可以清晰地看出,在所选择的4个浓度范围内,Taq酶对条带数量及清晰度没有明显影响,故从实验成本考虑,选择0.5 U为最佳用量。
3.2 PCR正交设计结果 图4为正交设计ISSR扩增结果,用SPSS 13.0统计软件对其进行方差分析,见表4。由表可知,Mg2+浓度、dNTP、引物浓度对实验结果有显著影响 (P<0.05),而模板DNA浓度的影响不明显 (P>0.05)。均方差结果显示,这4个因素对其影响的主次顺序依次为Mg2+浓度>dNTPs>引物浓度>DNA模板浓度,与极差分析的结果相同。然后,进一步对各因素的不同水平进行多重比较,发现Mg2+浓度在3个水平之间的差异均有统计学意义,P值分别为0.011(2.5和3.0 mmol/L之间)、0.000(2.5和3.5 mmol/L之间)和0.000(3.5和2.5 mmol/L之间),结合表5中的PCR结果均值可知,Mg2+浓度在2.5 mmol/L下最适合;引物浓度在0.2μmol/L时,与其他两个水平之间有显著差异,P值分别为0.000(0.2和0.25μmol/L之间)和0.001(0.2和0.15μmol/L之间),结合表5可知,引物浓度在0.2μmol/L下最适合;dNTP浓度在3个水平间均有显著性差异,P值均为0.000,结合表5中可知,dNTP浓度0.25 mmol/L下最适合。同时,模板DNA浓度在3个水平间均无显著性差异,P值分别为0.728(50和100 ng、75和100 ng之间)、0.489(50和75 ng之间)。综上所述,Mg2+浓度2.5 mmol/L、引物浓度0.2μmol/L、dNTPs浓度0.25 mmol/L、DNA模板浓度50~100 ng为三叶青ISSR-PCR的最佳反应体系。
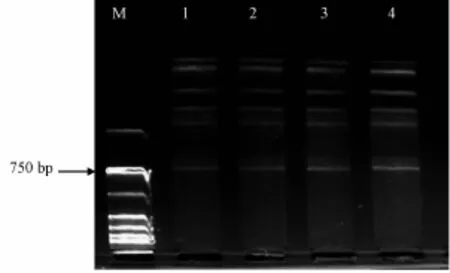
图3 Taq DNA聚合酶对三叶青ISSR扩增的影响Fig.3 Effect of Taq DNA polymerase dosage on T.hemsleyanum ISSR am plification
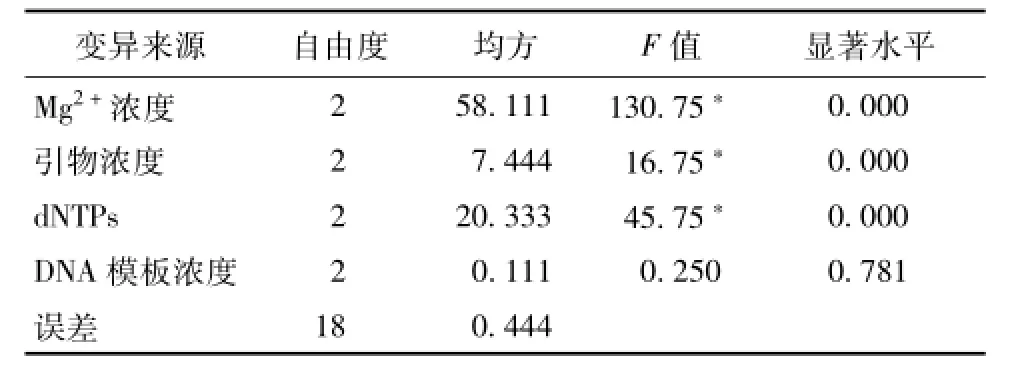
表4 正交试验中各因素方差分析Tab.4 Analysis of variance for factors of orthogonal design

表5 各因素不同处理水平结果均值差异显著性Tab.5 Significance among themeans of different factor levels
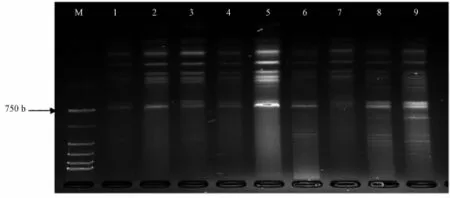
图4 L9(34)正交设计ISSR扩增结果Fig.4 Electrophoresis of L9(34)orthogonal design
3.3 体系稳定性验证及ISSR图谱多态性分析 经筛选确定的有效引物见表6,而且从图5和图6可知,U810和U811引物能从表1所列的15份种质材料中扩增出清晰度高、多态性丰富、重复性好的DNA条带,表明优化后的ISSR-PCR反应体系稳定可靠,在此基础上,以扩增出的条带数量多、多态性好、清晰度高、重复性好为原则,从100个ISSR引物中筛选出16个扩增稳定、多态性高的引物(表6)。同时,它们又共扩增出135个条带,长度为200~2 000 bp,每条引物平均产生8.4个条带,其中多态性带77条,平均多态率达57.0%。由此可知,ISSR指纹能在居群水平中提供适量的多态性,可满足对三叶青资源遗传多样性、遗传结构分析和种质资源鉴定的研究考察。
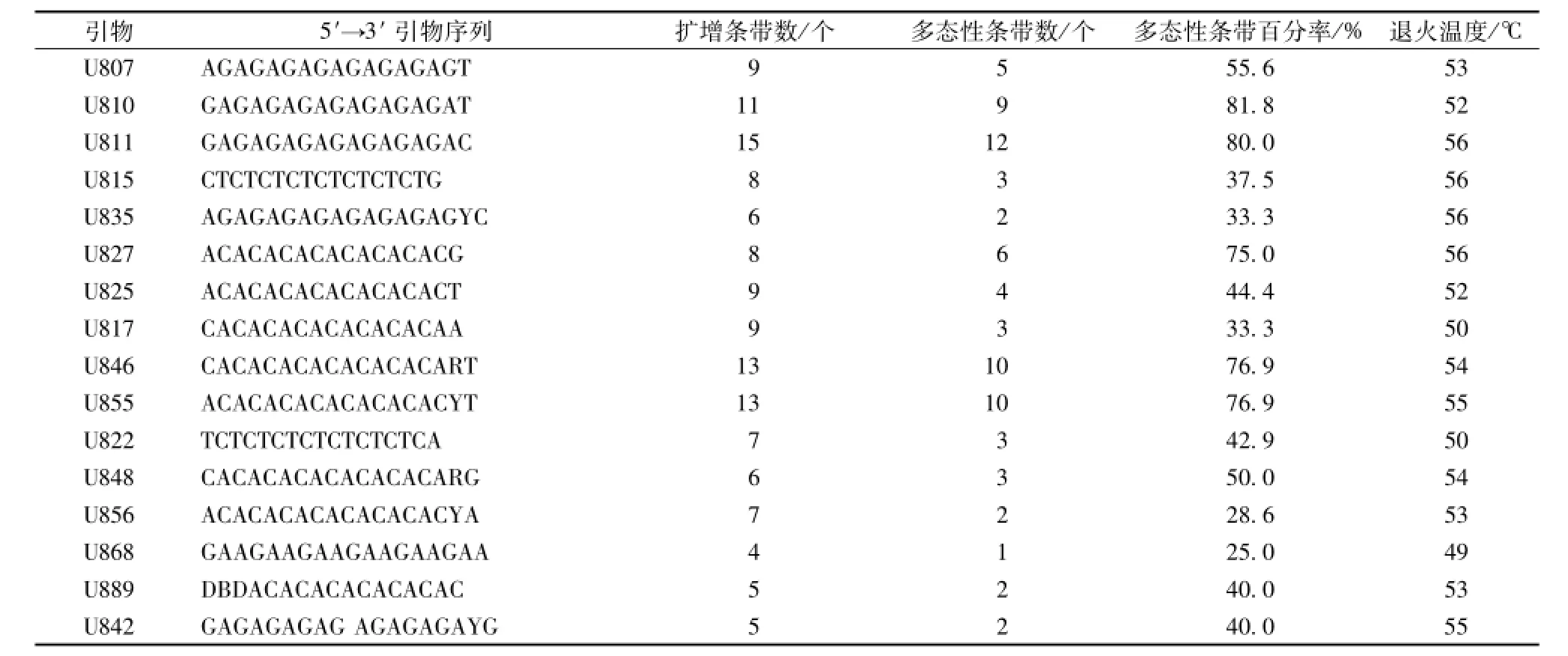
表6 筛选出的三叶青ISSR标记分析的引物序列及其扩增结果Tab.6 Primer sequence screened for ISSR analysis of T.hemsleyanum and their amplification results
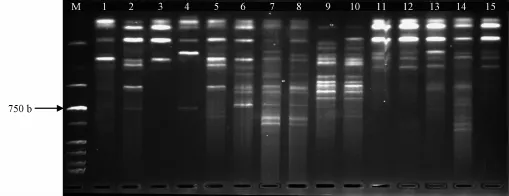
图5 引物U810对15份三叶青DNA扩增结果Fig.5 Amplification results of 15 DNA samp les from T.hemsleyanum with primer U810
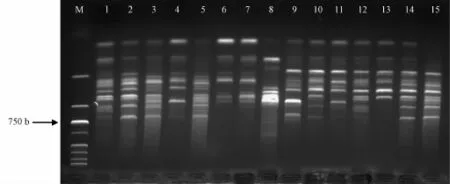
图6 引物U 811对15份三叶青DNA扩增结果Fig.6 Am p lification results of 15 DNA sam p les from T.hemsleyanum w ith primer U811
4 讨论
ISSR是在基因组中由1~6个核苷酸组成的,基本单位重复多次构成的DNA无意义区域片段,广泛分布于基因组的不同位置,容易受气温、日照等环境条件的影响而出现变异,并且进化变异速度快,蕴含的多态性位点多,具有很高的多态性检测效率[8]。目前,ISSR分子标记技术被广泛应用于遗传多样性的评价[14]、品种鉴别[15]、指纹图谱库建立[16]、物种间亲缘关系及系统进化[17]等领域。
PCR扩增容易受到Mg2+、引物、dNTP、DNA模板的浓度与纯度,以及扩增程序等诸多因素影响。Mg2+浓度过低会降低Taq酶活性,而过高则会引起非特异性扩增,而且它还能与体系中的dNTP、引物、模板结合,影响模板与引物的结合率,产生非特异性条带[12],本实验也发现Mg2+是对扩增结果影响最大的因素,这与东方百合ISSR反应体系相似[18]。dNTP是PCR反应中的原料,浓度过低导致扩增产量不足,而浓度过高则导致PCR错配,出现非特异性扩增,而且会对Mg2+产生拮抗作用,使反应中的有效Mg2+浓度下降,从而影响聚合酶活力[19],本实验中dNTP浓度上升时,其PCR扩增产物随之增加,但浓度达到0.3 mmol/L时产生非特异性扩增。一般认为,引物浓度过低时,扩增的条带较弱,数量也比较少,但浓度过高时会产生引物二聚体和非特异性扩增[18],但本实验中引物浓度过低时也产生了非特异性扩增,推测可能是因为过低的引物浓度与模板目标片段结合的竞争力不足,扩大了引物在基因组上配对的随机性,从而形成了一些分子质量较大的非特异性产物。研究[18,20-21]表明,模板DNA的浓度适用范围较宽,对ISSR-PCR反应的影响不大,25~200 ng之间均能扩增出较清晰的条带,本实验中虽然DNA模板浓度在一定范围内对条带的产量及多态性影响不大,但浓度达到100 ng时会产生非特异性扩增,与夏枯草ISSR-PCR反应体系[13]相似,而且在所选择的用量范围内,Taq酶对PCR产物量及条带数量几乎没有影响,这与一些研究[12,19]相一致,而东方百合ISSR体系[18]中的Taq酶对结果影响非常显著,可能与所使用酶的生产质量等因素有关。一般认为,退火温度过高时,引物不能与模板牢固结合,DNA扩增效率下降,产生的条带较少;温度过低时,可造成引物与模板错配,非特异性产物增加[12]。本实验发现,退火温度过低时,条带弥散,目标产物的产量低,而退火温度过高时,虽然产生的条带有一部分缺失,但同时也出现个别非特异性条带。在实际操作过程中,一般参考引物理论Tm值来确定最佳退火温度,但同一引物对于不同物种时,退火温度可能不同,甚至差异较大,如瓜蒌ISSR分析时[22],引物810所采用的退火温度为53.6℃;王玉山等[23]用引物810对长叶红砂ISSR分析时发现,最佳退火温度为48℃;本实验三叶青ISSR体系中,引物810的最佳退火温度为52℃。因此,退火温度需要在参考引物理论Tm值的基础上加以适当调整,以期得到稳定可靠的实验结果。
与多因素试验相比,单因素试验可较为直观地分析各因素对试验结果的影响,易筛选出各因素的最佳水平,但可能会遗漏各因素之间的互作效应,根据其优化组合而形成的试验体系可能在某种程度上偏离真正的最佳条件[19]。而且,单因素试验无法考察各因素不同水平对扩增结果影响的差异显著性,而正交试验设计在同时检验多个因素的同时,能缩小试验规模,并可通过方差分析来统计各因素对结果影响的差异,但仍存在对各种因素的水平设计是否适当以及对试验结果进行评价时有较大主观性等局限。因此,本实验结合单因素和正交两种试验设计,先通过单因素试验来选定各因素的适宜水平范围,然后参照选出的水平范围进行正交设计,从而筛选出最佳反应体系。结果发现,ISSR指纹图谱能够在居群水平上提供丰富的多态性,表明经过优化后建立的ISSR-PCR反应体系具有较好的稳定性,可以满足对三叶青野生资源的遗传变异水平和结构分析的研究考察。
[1]韦树根,董青松,韦 莹,等.广西濒危珍稀中药材三叶青资源调查研究[J].北方园艺,2011,(21):162-164.
[2]Xu C J,Ding G Q,Fu JY,et al.Immunoregulatory effects of ethyl-acetate fraction of extracts from Tetrastigma hemsleyanum Diels et.Gilg on immune functions of ICR mice[J].Biomed Fnviron Sci,2008,21(4):325-331.
[3]王小莉,曾 娟,周 辉.三叶青提取物对肺癌细胞株A549的影响[J].肿瘤药学,2012,2(5):347-349.
[4]Dai Y J,Shen ZG,Liu Y,etal.Effectsof shade treatmentson the photosynthetic capacity,chlorophyll fluorescence,and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J]. Fnviron Fxp Bot,2009,65(2-3):177-182.
[5]彭 昕,张 剑,何军邀,等.三叶青松散型和致密型愈伤组织悬浮培养及黄酮积累的比较研究[J].中草药,2012,43(3):577-580.
[6]Peng X,Zhou SL,He JY,et al.Influence of rare earth elements on metabolism and related enzyme activity and isozyme expression in Tetrastigma hemsleyanum cell suspension cultures[J].Biol Trace Flem Res,2013,152(1):82-90.
[7]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprintingby simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[8]Wang Z,Wang JE,Wang X M,et al.Assessment of genetic diversity in Galega officinalis L.using ISSR and SRAPmarkers[J].Genet Resour Crop Fvol,2012,59(5):865-873.
[9]郑道君,谢良商,曾建华,等.海南龙血树ISSR-PCR反应体系建立与有效引物筛选[J].热带亚热带植物学报,2011,19(2):177-183.
[10]陈大霞,王 钰,张 雪,等.ISSR分析3种类型黄连的遗传多样性和遗传结构[J].中草药,2012,43(8):1595-1598.
[11]Wang M,Oppedijk B J,Lu X,et al.Apoptosis in barley aleurone during germination and its inhibition by abscisic acid[J]. Plant Mol Biol,1996,32(6):1125-1134.
[12]孙清信,陈 坚,张 辉,等.紫云英ISSR引物的筛选及PCR反应体系的优化[J].植物遗传资源学报,2012,13(5):870-878.
[13]廖 丽,郭巧生.夏枯草ISSR分子标记技术的建立与体系优化[J].中草药,2009,40(7):1131-1135.
[14]卜 静,王冬梅,李登武.不同产地野生玉竹种质资源多样性与亲缘关系的 ISSR分析[J].中草药,2012,43(9):1824-1828.
[15]王 翀,周天华,杨 雪,等.ISSR-PCR鉴别绞股蓝属7种植物[J].中草药,2008,39(4):588-5911.
[16]张 林,徐迎春,成海钟,等.基于ISSR标记的62个朱顶红品种的遗传关系分析及指纹图谱构建[J].植物资源与环境学报,2012,21(4):48-54.
[17]徐晓波,蒋冬花,李 杰,等.应用ISSR分子标记探讨酵母菌种间亲缘关系[J].浙江师范大学学报:自然科学版,2010,33(1):89-94.
[18]丁信誉,邱 帅,席梦利,等.东方百合ISSR-PCR反应体系的正交优化[J].南京林业大学学报:自然科学版,2012,36(5):42-46.
[19]李娟玲,刘国民,曹嵩晓,等.利用单因子和正交设计双重实验法优化鹧鸪茶RAPD-PCR反应体系[J].农学学报,2011,4(6):14-21.
[20]陈莉娉,张小平,李晓红.青檀SRAP-PCR体系优化设计方案[J].生物学杂志,2012,29(5):87-91.
[21]桂腾琴,孙 敏,乔爱民,等.正交设计优化果梅ISSR反应体系[J].果树学报,2009,26(1):108-112.
[22]王真真,韩琳娜,郭庆梅,等.瓜蒌ISSR-PCR最佳反应体系的研究[J].辽宁中医杂志,2013,40(10):2094-2096.
[23]王玉山,张颖娟.濒危植物长叶红砂ISSR扩增条件的优化与引物筛选[J].内蒙古师范大学学报:自然科学版,2008,37(3):417-421.
Construction of ISSR molecular marker system for endangered plant Tetrastigma hemsleyanum
PENG Xin1, JIQing-yong2, LIYu-lan1*, ZHANG Yu-jiong1
(1.Zhejiang Pharmaceutical College,Ningbo 315100,China;2.Lishui Academy of Agricultural Science,Lishui323000,China)
AIMTo construct a proper ISSR-PCR reaction system and amplification process for germplasm of wild Tetrastigma hemsleyanum.METHODSSingle factor testwas applied to the optimization of the influencing factors,including annealing temperature,Mg2+concentration,dNTP concentration,template DNA dosage,Taq DNA polymerase dosage,primer concentration.Orthogonal design was applied to the selection of stable and repeatable ISSR primers.RESULTSThe optimal reaction system for ISSR analysis contained 2.5mmol/LMgCl2,0.2 μmol/L ISSR primers,0.25 mmol/L dNTP,50 ng of template DNA,and 0.5 U of Taq DNA polymerase in 25 μL total volume.Based on 16 primers such as U810,the molecularmarker system of 15 samples of T.hemsleyanum was established withmore than 57.0%of average polymorphic bands.CONCLUSIONThe ISSR-PCR reaction system constructed in this study is highly polymorphic and has high reliability and stability,which could be used to detect the genetic diversity and investigate the genetic structure of T.hemsleyanum.
Tetrastigma hemsleyanum;ISSR;single factor test;orthogonal design;genetic diversity
R284.1
:A
:1001-1528(2015)07-1507-08
10.3969/j.issn.1001-1528.2015.07.024
2014-08-07
2013年浙江省公益性技术资助项目 (2013C32103);2013年浙江省教育厅高校科研项目 (Y201330174)
彭 昕(1980—),女,硕士,副教授,研究方向为药用植物分子生物学。E-mail:pengx@mail.zjpc.net.cn *通信作者:李玉兰(1963—),女,教授,研究方向为分子生物学。E-mail:LiyL@mail.zjpc.net.cn
