灯盏花素对1-甲基-4-苯基吡啶诱导的PC-12细胞周期阻滞的影响
2015-01-16肖吉元刘海鹏白银亮杨兴缨
肖吉元, 刘海鹏, 白银亮*, 杨兴缨
(1.兰州大学第二医院药学部,甘肃兰州730030;2.兰州大学第二医院普外三科,甘肃兰州730030)
灯盏花素对1-甲基-4-苯基吡啶诱导的PC-12细胞周期阻滞的影响
肖吉元1, 刘海鹏2, 白银亮1*, 杨兴缨1
(1.兰州大学第二医院药学部,甘肃兰州730030;2.兰州大学第二医院普外三科,甘肃兰州730030)
目的考察灯盏花素对1-甲基-4-苯基吡啶 (MPP+)诱导的大鼠嗜铬细胞瘤细胞株PC-12细胞周期阻滞的影响并探讨其机制。方法MTT法检测PC-12细胞存活率,流式细胞术检测细胞周期,Western blot技术检测ERK1/2磷酸化水平。结果灯盏花素预处理明显抑制MPP+诱导的PC-12细胞周期G2/M期阻滞,升高细胞存活率,增加ERK1/2磷酸化水平。ERK1/2抑制剂U0126预处理后,灯盏花素对细胞存活率和ERK1/2磷酸化水平无明显作用。结论灯盏花素的作用机制与增加ERK1/2磷酸化水平有关。
灯盏花素;1-甲基-4-苯基吡啶 (MPP+);PC-12细胞;周期阻滞;细胞外信号调节激酶1/2(ERK1/2)
帕金森病是老年人群中常见的中枢神经系统退行性疾病,其发病机制与神经元的凋亡密切相关,因此减少神经元的凋亡对治疗帕金森病至关重要[1-2]。细胞凋亡的发生由多种途径引起,其中细胞周期阻滞是诱导凋亡发生的一个重要原因[3]。作者前期研究结果显示,灯盏花素预处理可有效抑制1-甲基-4-苯基吡啶(1-methyl-4-phenylpyridinium,MPP+)诱导的大鼠嗜铬细胞瘤细胞株PC-12细胞调亡的发生[4],但其对MPP+诱导的PC-12细胞周期阻滞的影响尚不清楚,本实验将在前期研究基础上,进一步考察灯盏花素对MPP+诱导的PC-12细胞周期阻滞的影响及机制,以更深入地阐明灯盏花素对MPP+诱导的PC-12细胞损伤的保护作用机制。
1 材料与仪器
灯盏花素注射液 (10 mg/支,批号20120207-2,昆明龙津制药有限公司);DMEM培养基 (美国Gibco公司);1-甲基-4-苯基吡啶(MPP+)、ERK特异性抑制剂 U0126、四甲基偶氮唑盐(MTT)、碘化丙啶 (PI)、核糖核酸酶 (Rnase)(美国 Sigma公司);Phospho-p44/42 MAPK(ERK1/2),β-actin抗体(美国Santa Cruz公司);Complete蛋白酶抑制剂、PhosSTOP磷酸酶抑制剂(Roche公司)。大鼠嗜铬细胞瘤细胞株(PC-12细胞)由中科院上海细胞库提供。Multiskan Spectrum酶标仪(Thermo Fisher Scientific公司);Accuri C6流式细胞仪 (美国BD公司)。
2 方法
2.1 细胞培养及实验分组 参考前期研究方法[4]培养PC-12细胞,所有实验均在细胞对数生长期进行。实验分空白对照组、模型组和灯盏花素组(12.5、25、50μg/L),每组设3个复孔,所有试验均重复4次。各组分别如下处理:模型组,250 μmol/LMPP+处理细胞,建立帕金森病(PD)细胞模型;灯盏花素组,不同质量浓度灯盏花素分别预处理细胞24 h后再加入250μmol/L MPP+;空白对照组则只加等体积培养基。
2.2 细胞存活率检测 将细胞以1×104个/孔接种于培养板中培养24 h后,按 “2.1”项所述方法进行药物处理,待药物作用24 h后加入20μL 5 mg/mLMTT溶液,作用4 h后弃上清,每孔加入二甲基亚砜100μL,振荡后用酶标仪测量波长570 nm处各孔的吸光度值并计算相对细胞存活率值。
2.3 流式细胞仪检测细胞周期 按 “2.2”项所述方法处理细胞,待药物孵育24 h后收集细胞,用预冷的PBS制成细胞悬液,加入冷的无水乙醇,4℃固定过夜。离心除去固定液并用PBS洗涤2遍,配制含1%Triton X-100的PBS溶液,加入RNA酶和PI染色液,室温避光孵育30 min,染色后吹打均匀,用流式细胞仪进行周期检测。
2.4 Western blot检测ERK1/2磷酸化水平
2.4.1 灯盏花素对MPP+诱导的PC-12细胞ERK磷酸化水平的影响 按 “2.2”项所述方法处理细胞,待药物孵育24 h后,弃去培养液,后加入适量RIPA细胞裂解液(含4%蛋白酶抑制剂和10%磷酸酶抑制剂)冰上震摇裂解 30 min,离心(12 000 r/min,4℃)15 min,取上清。BCA法对样品中总蛋白进行定量,规定上样量为40μg。p-ERK1/2抗体和ERK1/2抗体均按1∶1 000稀释,β-actin抗体稀释浓度为1∶3000。
2.4.2 U0126对MPP+诱导的PC-12细胞ERK磷酸化水平的影响 将细胞以1×104个/孔接种于培养板中培养24 h后,实验设空白对照组、U0126组、U0126+MPP+组和灯盏花素组,各组处理如下:U0126组,1μmol/L U0126预处理48 h;U0126+MPP+组,1μmol/L U0126预处理24 h后加入250μmol/L的MPP+处理24 h;灯盏花素组,1μmol/L U0126预处理10 min后加入50μg/L灯盏花素预处理细胞24 h,加入250μmol/L的MPP+处理24 h,空白对照组则只加等体积培养基处理48 h。弃去培养液,按 “2.4.1”项所述方法检测各组的ERK1/2磷酸化水平。
2.5 统计学分析 结果以均数±标准差 (x±s)表示,采用SPSS 16.0统计软件进行单因素方差分析和LSD组间多重比较,P<0.05即认为有统计学意义。
3 结果
3.1 灯盏花素对MPP+诱导的PC-12细胞存活率的影响 图1可见,模型组细胞相对存活率为(43.3±8.1)%,与空白对照组比较,模型组细胞存活率明显下降 (P<0.001)。灯盏花素预处理能有效抑制MPP+诱导的PC-12细胞存活率降低(P<0.001)。该结果与前期研究结果[4]一致。
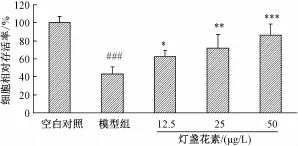
图1 灯盏花素对MPP+诱导的PC-12细胞存活率下降的影响(x±s,n=4)Fig.1 Effect of scutellarin on decreased cell viability in MPP+-induced PC-12 cells(x±s,n=4)
3.2 灯盏花素对MPP+诱导的PC-12细胞周期的影响 如表1所示,MPP+作用后,G2/M细胞比例为 (12.5±1.4)%,与空白对照组相比呈显著性增加 (P<0.001)。灯盏花素预处理能够抑制MPP+诱导的PC-12细胞G2/M期增加(P<0.01)。
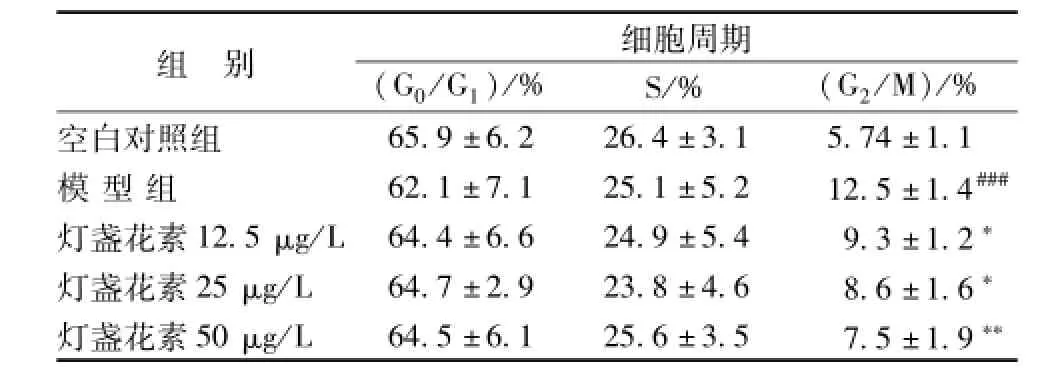
表1 灯盏花素对M PP+诱导的PC-12细胞周期的影响(x±s,n=4)Tab.1 E ffect of scutellarin on the PC-12 cell cycle induced by M PP+(x±s,n=4)
3.3 灯盏花素对MPP+诱导的PC-12细胞ERK1/2磷酸化水平的影响 如图2所示,与空白对照组相比,模型组ERK1/2磷酸化水平明显降低,差异具有统计学意义 (P<0.01)。与模型组比较,灯盏花素预处理能够升高ERK1/2磷酸化水平(P<0.05)(图2A)。各组之间总ERK1/2水平没有明显差异 (图2B)。
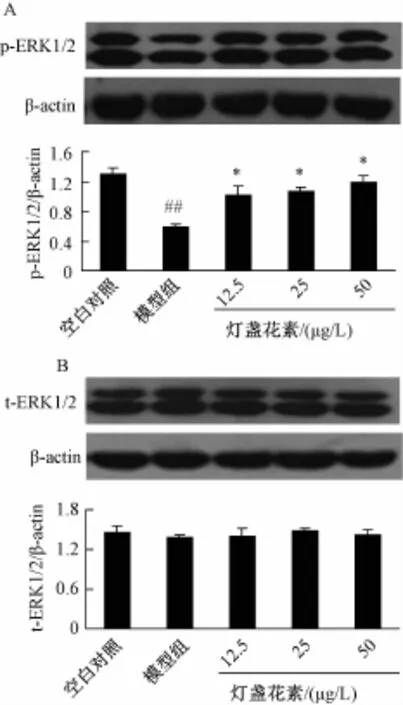
图2 灯盏花素对MPP+诱导的PC-12细胞ERK 1/2磷酸化水平的影响 (x±s,n=4)Fig.2 Effect of scutellarin on phosphorylated ERK1/2 level of PC-12 cells induced by MPP+(x±s,n=4)
3.4 U0126逆转灯盏花素对MPP+诱导的PC-12细胞损伤的保护作用 如图3所示,ERK抑制剂U0126单独预处理正常细胞后,细胞存活率显著下降(P<0.01),U0126和MPP+共处理细胞后,细胞存活率进一步下降 (P<0.001),与U0126组相比较,差异具有统计学意义 (P<0.05),U0126+灯盏花素+MPP+共处理细胞后,细胞存活率有所上升,但与U0126组相比较,差异无统计学意义(P>0.05);与50μg/L灯盏花素+MPP+组(图1)相比,细胞存活率明显降低 (P<0.05),可见U0126可逆转灯盏花素对MPP+诱导的PC-12细胞损伤的保护作用(图3A)。Western blot结果显示,U0126预处理后,细胞ERK1/2磷酸化水平明显降低。U0126和MPP+共处理细胞后,细胞ERK1/2磷酸化水平进一步降低 (P<0.01),U0126+灯盏花素+MPP+共处理细胞后,细胞ERK1/2磷酸化水平有所上升,与U0126组相比较,差异无统计学意义(P>0.05),与50μg/L灯盏花素+MPP+组相比,ERK1/2磷酸化水平明显降低(P<0.05)(图3B)。
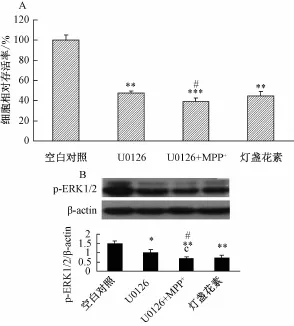
图3 U0126逆转灯盏花素对M PP+诱导的PC-12细胞损伤的保护作用 (x±s,n=4)Fig.3 U0 126 reversed the protectiveeffect of scutellarin on MPP+-induced injury in PC-12 cells(x±s,n=4)
4 讨论
MPP+诱导的PC-12细胞损伤模型是目前研究帕金森病的最常用的体外细胞模型[5]。大量研究显示,MPP+可诱导的PC-12细胞周期G2/M阻滞和凋亡的发生[6-7],课题组前期研究成果共同证实了这一点。众所周知,细胞的增殖周期和凋亡是相互伴随的过程,而且是在细胞内级联反应调控和细胞外信号共同影响下有序进行的[8-9]。在细胞周期中各个时相 (G0期、G1期、S期、G2期和M期)间存在有影响细胞周期进程的调控点,药物干预往往能够激活调控点调节机制,从而影响细胞周期的进行[9]。众多研究表明,帕金森病的发生与神经元增殖周期的改变密切相关,而且认为细胞周期的异常正是导致神经元凋亡的主要原因[10-11]。因此,针对神经元增殖周期异常的干预措施已成为治疗帕金森病的新的研究方向[11-12]。
细胞外信号调节激酶(extracellar signal-regulated kinase,ERK)作为丝裂原活化蛋白激酶(motigen-activated protein kinase,MAPK)家族中的重要成员,与细胞增殖、分化和凋亡等密切相关[13-14]。普遍认为,ERK是将胞外刺激信号转导进入细胞核的关键,它能通过作用于E1k-1、cmyc、c-fos等转录因子影响细胞的增殖与分化,而且很多药物能通过抑制ERK的活化引起细胞周期阻滞[15-17]。可见,ERK的活化 (磷酸化)对细胞增殖周期的顺利进行至关重要[18]。
本实验结果显示,灯盏花素能够抑制MPP+诱导的PC-12细胞周期G2/M阻滞并有效提高细胞存活率。Western blot结果显示,灯盏花素能够增加ERK1/2磷酸化水平,而且这种作用与其提高细胞存活率呈对应关系;当ERK1/2抑制剂U0126预处理后,灯盏花素对细胞存活率的并无明显升高作用。可见,ERK1/2的活化在灯盏花素提高细胞存活率作用中扮演重要角色。结合细胞周期实验结果,本实验认为灯盏花素通过增加ERK1/2磷酸化水平,从而抑制MPP+诱导的PC-12细胞周期G2/ M阻滞,并最终提高细胞存活率。
总之,本实验及前期研究成果共同表明灯盏花素能够通过抑制MPP+诱导的PC-12细胞周期G2/ M阻滞和凋亡,从而有效提高细胞存活率,发挥对MPP+诱导的PC-12细胞损伤的保护作用,该研究将为帕金森病的临床治疗提供一新的治疗思路和实验依据。
[1]Schapira A H,Jenner P.Etiology and pathogenesis of Parkinson's disease[J].Mov Disord,2011,26(6):1049-1055.
[2]Sulzer D,Surmeier D J.Neuronal vulnerability,pathogenesis,and Parkinson's disease[J].Mov Disord,2013,28(6):715-724.
[3]Höglinger G U,Breunig J J,Depboylu C,etal.The pRb/E2F cell-cycle pathway mediates cell death in Parkinson's disease[J].Proc Natl Acad SciU SA,2007,104(9):3585-3590.
[4]肖吉元,程月芳,李建雄,等.灯盏花素对MPP+诱导的PC-12细胞凋亡的保护作用[J].中成药,2014,36(6):1113-1117.
[5]Liu W B,Zhou J,Qu Y,et al.Neuroprotective effect ofosthole on MPP+-induced cytotoxicity in PC-12 cells via inhibition of mitochondrial dysfunction and ROS production[J].Neurochem Int,2010,57(3):206-215.
[6]Bai J,Nakamura H,Ueda S,et al.Proteasome-dependentdegradation of cyclin D1 in 1-methyl-4-phenylpyridinium ion(MPP+)-induced cell cycle arrest[J].J Biol Chem,2004,279(37):38710-38714.
[7]Zheng H,Fridkin M,Youdim M B.Novel chelators targeting cell cycle arrest,acetylcholinesterase,and monoamine oxidase for Alzheimer's therapy[J].Curr Drug Targets,2012,13(8):1096-1113.
[8]Vermeulen K,Berneman ZN,Van Bockstaele D R.Cell cycle and apoptosis[J].Cell Prolif,2003,36(3):165-175.
[9]Moore M J,Wang Q,Kennedy C J,et al.An alternative splicing network links cell-cycle control to apoptosis[J].Cell,2010,142(4):625-636.
[10]Moh C,Kubiak JZ,Bajic V P,etal.Cell cycle deregulation in the neurons of Alzheimer's disease[J].Results Probl Cell Differ,2011,53(3):565-576.
[11]Li C,Wang E,Cheng Y,et al.Oridonin:An active diterpenoid targeting cell cycle arrest,apoptotic and autophagic pathways for cancer therapeutics[J].Int J Biochem Cell Biol,2011,43(5):701-704.
[12]Lapenna S,Giordano A.Cell cycle kinases as therapeutic targets for cancer[J].Nat Rev Drug Discov,2009,8(7):547-566.
[13]Cargnello M,Roux P P.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases[J]. MicrobiolMol Biol Rev,2011,75(1):50-83.
[14]Chang F,Steelman L S,Shelton JG,et al.Regulation of cell cycle progression and apoptosis by the Ras/Raf/MEK/ERK pathway(Review)[J].Int JOncol,2003,22(3):469-480.
[15]Cagnol S,Chambard JC.ERK and cell death:mechanisms of ERK-induced cell death—apoptosis,autophagy and senescence[J].FFBS J,2010,277(1):2-21.
[16]Mebratu Y,Tesfaigzi Y.How ERK1/2 activation controls cell proliferation and cell death:Is subcellular localization the answer[J].Cell Cycle,2009,8(8):1168-1175.
[17]De Luca A,Maiello M R,D'Alessio A,et al.The RAS/RAF/ MEK/ERK and the PI3K/AKT signalling pathways:role in cancer pathogenesis and implications for therapeutic approaches[J].Fxpert Opin Ther Targets,2012,16(S2):17-27.
[18]Modi P K,Komaravelli N,Singh N,et al.Interplay between MEK-ERK signaling,cyclin D1,and cyclin-dependent kinase 5 regulates cell cycle reentry and apoptosis of neurons[J].Mol Biol Cell,2012,23(18):3722-3730.
Effect of scutellarin on 1-m ethyl-4-phenylpyridinium-induced PC-12 cell cycle arrest
XIAO Ji-yuan1, LIU Hai-peng2, BAIYin-liang1*, YANG Xing-ying1
(1.Department of Pharmacy,Lanzhou University Second Hospital,Lanzhou 730030,China;2.The3rd Department of General Surgery,Lanzhou University Second Hospital,Lanzhou 730030,China)
AIMTo investigate the effect of scutellarin on 1-methyl-4-phenylpyridinium(MPP+)-induced cell cycle arrest in pheochromocytoma cell line PC-12 and its relevantmechanism.METHODSCell viability was analyzed with MTT assay.Cell cycle wasmeasured by flow cytometry.The expression of phosphorylated ERK1/2 was analyzed by Western blot.RESULTSPretreatment with scutellarin significantly inhibited PC-12 cell cycle G2/M phase arrest induced by MPP+.It alsomarkedly increased the cell viability and the phosphorylated ERK1/2 level.These effects were abolished by ERK1/2 specific inhibitor U0126.CONCLUTIONScutellarin'smechanism of actionmay be correlated to the increase of phosphorylated ERK1/2.
scutellarin;1-methyl-4-phenylpyridinium(MPP+);pheochromocytoma cell line PC-12;cell cycle arrest;extracellular regulated protein kinases1/2(ERK1/2)
R966
:A
:1001-1528(2015)07-1407-04
10.3969/j.issn.1001-1528.2015.07.004
2014-07-08
甘肃省科技计划自然科学基金项目 (145RJZA143)
肖吉元(1972—),男,副主任中药师,研究方向为中药药理学。E-mail:lzuxjy@163.com
*通信作者:白银亮,男,医学硕士,讲师,研究方向为药理学。Tel:(0931)8942491,E-mail:lzubyl@163.com
