星点设计-效应面法优化青蒿素微囊的制备工艺
2015-01-16艾凤伟庄海涛
艾凤伟, 庄海涛, 凌 勇, 佟 雷, 王 杰*
(1.徐州医学院药学院,江苏徐州221004;2.临沂市沂水中心医院药学部,山东沂水276400;3.青岛大学附属医院药剂科,山东青岛266000;4.牡丹江医学院药学院,黑龙江牡丹江157000)
星点设计-效应面法优化青蒿素微囊的制备工艺
艾凤伟1, 庄海涛2, 凌 勇3, 佟 雷4, 王 杰1*
(1.徐州医学院药学院,江苏徐州221004;2.临沂市沂水中心医院药学部,山东沂水276400;3.青岛大学附属医院药剂科,山东青岛266000;4.牡丹江医学院药学院,黑龙江牡丹江157000)
目的优化青蒿素微囊的制备工艺,并对制备的青蒿素微囊进行质量评价研究。方法以明胶为囊材,单凝聚法制备青蒿素微囊,通过星点设计-效应面法优化其制备工艺,并对包封率、载药量、微囊的粒径分布、体外溶出进行研究。结果明胶制备青蒿素微囊的最佳工艺条件的明胶质量分数为5.06%,囊心囊材质量比为1∶3,搅拌速度为751 r/min。此最佳工艺制备的青蒿素微囊包封率为89.31%,平均粒径69.91μm,载药量为22.25%,体外溶出度测定0.5 h为25.8%,12 h累积释放达到95%以上。结论以最佳工艺条件制备青蒿素微囊工艺稳定,包封率高,同时体外释放试验表明,该微囊具有较好的缓释作用。
青蒿素微囊;星点设计-效应面法;包封率
疟疾是一种由蚊虫叮咬或者输入带疟原虫者的血液而感染疟原虫而引起的寄生虫疾病,是严重危害人类健康和生命安全的重大传染病之一,世界卫生组织 (WHO)把疟疾与艾滋病、结核病一起列为全球三大公共卫生问题[1]。化学疗法是治疗疟疾的最直接最有效的方法,在数十年的化学疗法治疗疟疾过程中,一部分化学药物如绿奎宁、磺胺多辛、乙胺嘧啶等对疟疾的治疗敏感性逐渐降低,化学疗法控制疟疾几乎变得难以实现[2-3]。我国科研人员从黄花蒿中提取的青蒿素成为新的替代强效抗疟药物,该类药物对简单疟疾和恶性疟疾都有良好的疗效,成为临床上治疗疟疾疾病的新选择。目前,以青蒿素类药物为基础的联合疗法逐渐成为化学疗法治疗疟疾的首选[4]。
青蒿素在水中的溶解度差,消除半衰期短,导致青蒿素的口服给药的生物利用度仅为30%左右[5],低水溶性、口服肝脏首过效应及生物半衰期短是影响青蒿素临床疗效的主要因素,也是研制青蒿素新制剂的关键。微囊是采用天然或合成的高分子材料为囊材,将固态或液态药物作为囊心物包裹形成的一种微型胶囊。通过微囊化方法形成缓控释制剂或靶向制剂;从而达到延缓目标药物在生物体内的释放速度或目标靶向性的目的,本研究以生物大分子明胶作为载体材料制备一种青蒿素缓释制剂,采用星点设计-效应面法对青蒿素明胶微囊的制备工艺进行优化,制备的微囊制剂可降低青蒿素在生物体里的溶出速率,减少患者服药次数,增加药物在生物体内的停留时间,提高青蒿素的生物利用度。
1 仪器与材料
1.1 仪器 OLYMPUS-CX21FS1显微镜;GY-5000生物显微镜 (南京广友光电仪器有限公司);DF-101S集热式恒温磁力搅拌器 (郑州长城科工贸公司);FA1004上皿电子天平 (上海精科仪器公司);ZRS-8智能溶出实验仪 (天津无线电厂);101-2-S电热恒温鼓风干燥箱 (上海跃进医疗器械厂);UV-2450紫外-可见分光度计 (日本岛津仪器公司);0.25μm微孔滤膜 (上海市新亚净化器件厂)等。
1.2 材料 青蒿素原料 (郑州荔诺生物制品有限公司,纯度>98%);明胶 (化学纯,中国医药上海化学试剂站,pH 5.5~7);青蒿素对照品 (批号100202-200803,中国食品药品检定研究院);无水乙醇 (分析纯,上海申翔化学试剂有限公司);液体石蜡、司盘-80、异丙醇等 (上海国药试剂有限公司)。
2 方法与结果
2.1 青蒿素微囊的制备方法 将含1%司盘-80的液体石蜡溶液在60℃下加热并以一定转速搅拌,作为制备青蒿素微囊的分散介质,称取适量的明胶溶解配制成设计浓度的明胶溶液,按试验设计条件加入青蒿素粉末并充分搅拌均匀,将药物的明胶溶液缓慢滴加入含1%司盘-80的液体石蜡溶液中,持续搅拌20 min,迅速冷却至4℃以下,保持20 min,加50 mL异丙醇脱水,再加30 mL甲醛冰箱冷藏5 h固化,抽滤并以异丙醇洗涤多次除去残留的甲醛,烘箱60℃充分干燥,备用。
2.2 青蒿素定量测定方法的建立[6]
2.2.1 标准曲线的绘制 精密称取干燥至恒定质量的青蒿素对照品10 mg,乙醇溶解定容于100mL量瓶中作为对照品贮备液备用。分别准确移取贮备液1.0、2.0、4.0、6.0、8.0 mL置于50 m L量瓶中,加入一定量的乙醇补充至10 mL,用0.2%的氢氧化钠溶液稀释至刻度即得 2、4、8、12、16 μg/mL的青蒿素标准溶液,在 (50±1)℃恒温水浴中放置30 min,取出以流水冷却至室温,以不含青蒿素的溶液为空白,用紫外分光光度计在292 nm处测定吸光度。以吸光度 (A)对质量浓度(C)进行线性回归,得青蒿素的标准曲线方程为A=0.045 4C+0.007 2(r2=0.999 4)。结果吸光度与质量浓度在2~16μg/mL范围内线性关系良好。
2.2.2 稳定性试验 精密移取贮备液5.0 m L于50 m L量瓶中,加入一定量的乙醇补充至10 m L,用 0.2%的氢氧化钠溶液稀释至刻度即得10 μg/mL的青蒿素溶液,在 (50±1)℃恒温水浴中放置30 min,取出以流水冷却至室温,以不含青蒿素的溶液为空白,于1、2、4、8、12、24 h在292 nm处测定吸光度,RSD为1.77%,表明青蒿素溶液的吸光度相对稳定。
2.2.3 精密度试验 精密移取1.0、4.0、8.0 m L贮备液到50 mL量瓶中,加入一定量的乙醇补充至10 mL,用0.2%的氢氧化钠溶液稀释至刻度即得2、8、16μg/mL的青蒿素溶液,在 (50±1)℃恒温水浴中放置30 min,取出以流水冷却至室温,5 d内每天分别测定溶液吸光度一次,2、8、16 μg/mL的青蒿素溶液吸光度的RSD分别为2.61%、1.01%、0.57%,精密度结果良好。
2.2.4 加样回收率试验 精密移取1.0、4.0、8.0 mL贮备液到50 mL量瓶中,加入一定量的乙醇补充至10 mL,加入适量的明胶 (按最佳微囊制备条件的比例),用0.2%的氢氧化钠溶液稀释至刻度即得 2、8、16μg/m L的青蒿素溶液,在(50±1)℃恒温水浴中放置30 min,取出以流水冷却至室温,过滤,取续滤液,在372 nm处测定吸光度,根据标准曲线计算溶液中青蒿素量,平均回收率为100.9%,RSD为1.76%,符合要求。
2.3 青蒿素微囊包封率、载药量及粒径分布测定
2.3.1 青蒿素微囊包封率、载药量测定 精密称取青蒿素微囊适量,研磨破坏微囊结构,以一定量乙醇60℃下水浴超声溶解青蒿素,冷却至室温后乙醇定容到25 mL量瓶中,精密移取5 mL溶液于25 mL量瓶中,加入0.2%的氢氧化钠溶液稀释至刻度,在(50±1)℃恒温水浴中放置30 min。取出以流水冷却至室温,以不含青蒿素的溶液为空白,在292 nm处测定吸光度。代入 “2.2”项下的标准曲线计算青蒿素的浓度,并根据式 (1)、式 (2)分别计算青蒿素微囊的包封率、载药量[7]。

2.3.2 青蒿素微囊外观及粒径分布测定[8]微囊的外观形态采用光学显微镜观察,采用软件Scopephoto 3.0测量软件计数500个微囊粒径大小,统计粒径分布情况。
2.4 星点设计-效应面法优化制备工艺 在单因素预试验的基础上,确定影响微囊制备的主要因素为X1明胶浓度、X2囊心囊材比及X3搅拌速度,进行3因素5水平的星点设计,各因素水平代码值及实际操作物理量值见表1;以Y1载药量、Y2包封率、Y3微囊平均粒径及 “归一值”(OD值)来体现各指标的综合效果,星点设计试验结果见表2。

表1 星点设计因素水平Tab.1 Factors and levels for CCD

表2 星点设计与结果Tab.2 Experiment results from CCD
观察指标的归一化处理采用Hassan方法,对于包封率、载药量等要达到最大化的指标,计算公式如下:
dimax=(Yi-Ymin)/(Ymax-Ymin) (3)
对于微囊的粒径要达到最小化的指标,其计算公式如下:
dimin=(Ymax-Yi)/(Ymax-Ymin) (4)
根据公式 (1)和公式 (2)计算出各指标的di值后,由式 (5)计算OD值。
OD=(d1d2…dk)1/k(K为指标数) (5)
2.5 数据分析 以明胶浓度、囊心囊材比、搅拌速度为自变量,载药量、包封率、微囊平均粒径及综合评价指标OD为因变量,采用Design-Expert 8.05软件进行多元线性和二次多项式回归,并以拟合优度r2和置信度P作为模型判定标准,拟合方程结果见表3。可见采用二项式方程拟合的4个指标拟合效果均较多元线性方程好,OD值二项式拟合方程P=0.000 4,相关系数r2=0.908 8,显示此拟合优化模型具有统计学意义,有较大可信度。

表3 回归方程拟合结果Tab.3 Equation fitting results
2.6 效应面优化和预测 3D效应面图只能表达含两个因素变量的函数,故固定3个变量中的一个为中值,先代入方程,再以拟合的目标函数为数学模型,绘制因变量效应面图。根据拟合方程,通过Design-Expert8.05软件绘制评价指标OD值随因素变化的效应面图(见图1)。图1显示OD值随明胶浓度的增大而逐渐减小,随着囊心囊材比、搅拌速度的增大先逐渐增大后又减小。X1取值范围在5.00%~6.03%,X2取值范围在0.32~0.40,X3取值范围在700~900时OD值可达到最大,通过Design-Expert 8.05软件预测分析,获得一组OD响应值最大的优化条件:X1=5.06%、X2=0.33、X3=751.62时,载药量为 22.25%、包封率为89.31%,平均粒径为69.91μm。
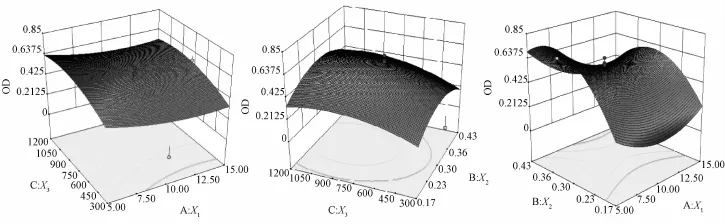
图1 OD对X1X3,X2X3及X1X2预测效应面Fig.1 Three-dimensional response surface of OD with X1X3,X2X3and X1X2
2.7 最优工艺验证试验 根据最佳组方制备3批青蒿素微囊,进行验证试验,测定载药量、包封率及平均粒径,带入OD的二次多项式方程计算OD值。结果见表4,最佳工艺条件的OD实测值与预测值间的偏差较小,表明本试验建立的预测模型可以预测青蒿素微囊的制备工艺。
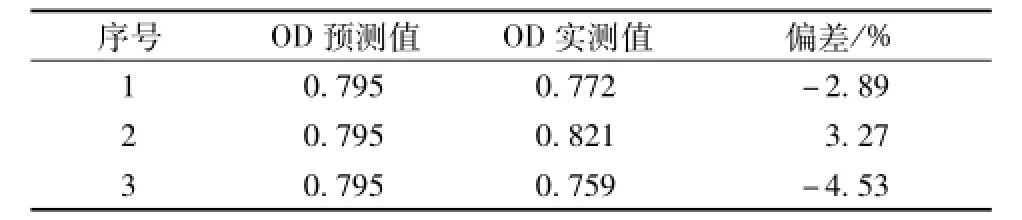
表4 最优工艺验证试验结果Tab.4 Com parison of pred icted and measured
2.8 青蒿素微囊质量评价
2.8.1 青蒿素微囊形态学考察 取青蒿素微囊少量置于白纸上,自然光下观察呈灰色粉末状;显微镜下观察微囊的形态见图2,由图可见青蒿素微囊外观形态圆整,囊外游离药物较少,粒径均匀,平均粒径为69.91μm。

图2 微囊形态(10 x 40)Fig.2 M orphology of m icrocapsule(10 x 40)
2.8.2 青蒿素微囊体外释药性试验 青蒿素微囊体外释药性试验按 《中国药典》2010年版溶出度测定法浆法进行,溶出温度为 (37±0.5)℃,搅拌速度50 r/min,溶出介质为1.5%SDS水溶液900 mL。精密称取一定量的青蒿素微囊撒于溶出杯内,分别于0.5、1.0、1.5、2.0、3.0、4.0、 5.0、6.0、8.0、10.0、12.0 h取样5 mL,并补充同体积1.5%SDS水溶液,取样液经微孔滤膜滤过,移取2 m L至10 mL量瓶中,加入含0.2%氢氧化钠的25%无水乙醇溶液定容至刻度,在(50±1)℃恒温水浴中放置30 min,取出以流水冷却至室温,以不含青蒿素的溶液为空白,紫外分光光度计在292 nm处测定吸光度,根据 “2.2”项下的标准曲线回归方程计算青蒿素质量浓度,计算青蒿素微囊的累积释放百分率 (见图3)。
由青蒿素微囊体外累积释放曲线可以看出,微囊在30 min的释放量为25.8%,符合 《中国药典》规定的微囊在开始0.5 h内累计释放百分率低于40%的要求。微囊在1 h后释放开始减慢,12 h累积释放百分率达到95%以上,与青蒿素原料药相比微囊制剂有较好的缓释作用。
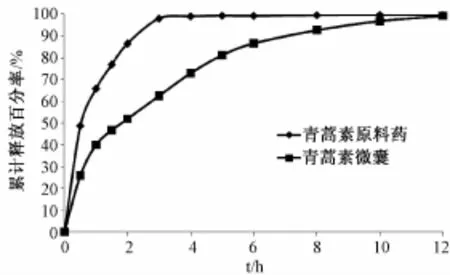
图3 体外累积释放曲线Fig.3 Curve of in vitro release
2.9 青蒿素微囊体外释药模型拟合 对青蒿素微囊体外释放曲线分别按零级、一级、Higuchi方程进行拟合,获得拟合方程及相关系数r2(见表5)。相关系数r2的数值越大,表示释药模型越符合相应的拟合方程,由表5得出青蒿素微囊体外释药按一级方程拟合最好,可以得出青蒿素微囊的体外释药行为更符合一级方程的描述,即恒速释放。

表5 体外释药模型拟合结果Tab.5 Fitting resu lts for in vitro releasem odel
3 讨论
目前,临床上应用的青蒿素制剂有口服片剂、直肠栓剂、静脉注射剂及肌肉注射剂等,由于青蒿素在水中的溶解度小,在生物体内的释放度低,生物半衰期较短,导致生物利用度很低,需要频繁给药,给临床治疗带来不利影响[9],本研究制备的微囊制剂可降低青蒿素在生物体里的溶出速率,减少患者服药次数,增加药物在生物体内的停留时间,提高青蒿素的生物利用度。
星点设计-效应面优化法通过描绘效应对考察因素的效应面,从效应面上选择较佳的效应区,从而推出自变量取值范围即最佳实验条件,使用起来直观、方便、效果较好。该方法较国内常用的均匀设计和正交设计优化法,实验精度高,建立的数学模型预测性更好[10-11]。
[1]高 琪.我国消除疟疾面临的机遇与挑战[J].中国血吸虫病防治杂志,2011,23(4):347-349.
[2]Winstanley P,Ward S.Malaria chemotherapy[J].Adv Parasitol,2006,61:47-76.
[3]Craft JC.Challenges facing drug development formalaria[J]. Curr Opin Microbiol,2008,11(5):428-433.
[4]German P I,Aweeka FT.Clinical pharmacology ofartemisininbased combination therapies[J].Clin Pharmacokinet,2008,47(2):91-102.
[5]Medhi B,Patyar S,Rao R S,et al.Pharmacokinetic and toxicological profile of artemisinin compounds:an update[J]. Pharmacology,2009,84(6):323-332.
[6]周 浓,段意梅,陈 强.青蒿素含量测定方法改进及黄花蒿植物质量评价[J].时珍国医国药,2008,19(4):911-912.
[7]舒 予,李小芳,刘 玲,等.五味子多糖微囊的制备及其体外释药特性考察[J].中国实验方剂学杂志,2014,20(5):27-31.
[8]艾凤伟,王佳瑜,李艳凤,等.芦丁微囊的制备及其质量评价[J].中国实验方剂学杂志,2010,17(16):32-35.
[9]陆 婷,张加伟,艾凤伟.高生物利用度的青蒿素类化合物给药系统及制剂技术研究进展[J].中成药,2015,37(1):180-183.
[10]吴 伟,崔光华.星点设计-效应面优化法及其在药学中的应用[J].国外医学药学分册,2000,27(5):292-299.
[11]符少莲,冯翠娟,李 沙.星点设计-效应面法优化脂溶性丹参提取物速释滴丸处方工艺[J].中成药,2013,35(4):690-695.
Optim izing preparation of artem isinin m icrocapsules by central com posite design and response surfacemethod
AIFeng-wei1, ZHUANG Hai-tao2, LING Yong3, TONG Lei4, WANG Jie1*
(1.School of Pharmacy,Xuzhou Medical College,Xuzhou 221004,China;2.Pharmacy Department,Yishui Central Hospital of Linyi,Yishui276400,China;3.Pharmacy Department,The Hospital Affiliated to Qingdao University,Qingdao 266000,China;4.School of Pharmacy,Mudanjiang Medical College,Mudanjiang 157000,China)
artemisinin microcapsules(AM);central composite design(CCD)and response surfacemethod(RSD);encapsulation efficiency
R944
:A
:1001-1528(2015)07-1457-05
10.3969/j.issn.1001-1528.2015.07.014
2014-08-17
徐州市科技计划项目 (KC14SH077,XM12B017)
艾凤伟 (1983—),男,实验师,主要从事药物新剂型研究。Tel:(0516)83262141,E-mail:afew2012@163.com
*通信作者:王 杰(1972—),男,高级实验师,主要从事中药药理学研究。Tel:(0516)83262141,E-mail:wangjie@xzmc.edu.cn
