土大黄不同提取物对银屑病小鼠模型的作用
2015-01-12热比姑丽伊斯拉木曼尔丹尼牙孜尤力都孜买买提斯拉甫艾白新疆医科大学基础医学院药理教研室乌鲁木齐830054新疆维吾尔医方剂学实验室乌鲁木齐830049新疆维吾尔自治区维吾尔医药研究所乌鲁木齐830049
热比姑丽·伊斯拉木,曼尔丹·尼牙孜,尤力都孜·买买提,斯拉甫·艾白*(1.新疆医科大学基础医学院药理教研室,乌鲁木齐 830054;2.新疆维吾尔医方剂学实验室,乌鲁木齐 830049;3.新疆维吾尔自治区维吾尔医药研究所,乌鲁木齐 830049)
土大黄不同提取物对银屑病小鼠模型的作用
热比姑丽·伊斯拉木1,2,3,曼尔丹·尼牙孜2,3,尤力都孜·买买提2,3,斯拉甫·艾白1,2,3*(1.新疆医科大学基础医学院药理教研室,乌鲁木齐 830054;2.新疆维吾尔医方剂学实验室,乌鲁木齐 830049;3.新疆维吾尔自治区维吾尔医药研究所,乌鲁木齐 830049)
目的 分别探讨土大黄醇提物、水提物对银屑病小鼠模型的作用。方法 采用小鼠鼠尾鳞片表皮模型、盐酸普萘洛尔致小鼠耳部皮肤银屑病样模型,观测土大黄醇提物(2,4和8g·kg-1)、水提物(2,4和8g·kg-1)灌胃给药后,小鼠一般状况、体质量、脾脏及胸腺指数,血清IL-10、IL-17、IL-23水平,尾部及耳部皮肤组织病理学变化。结果 土大黄醇提物、水提物(2,4和8g·kg-1)在实验期间小鼠一般状况、体质量变化无明显异常(P>0.05);土大黄醇提物(2和8g·kg-1)、水提物(4和8g·kg-1)能降低小鼠胸腺指数(P<0.05);土大黄醇提物、水提物各剂量组对小鼠血清IL-10、IL-17、IL-23无明显影响(P>0.05);同时,土大黄醇提物、水提物(2,4和8g·kg-1)能促进小鼠尾部鳞片表皮颗粒层形成,能改善对盐酸普萘洛尔致小鼠耳部皮肤银屑病样组织病理学变化。结论 土大黄醇提物、水提物均具有治疗实验性银屑病的作用。
土大黄;提取物;实验性银屑病
新疆维吾尔自治区民间蓼科酸模属的多种植物称为土大黄,习惯称为酸模;维吾尔药物名分别为阿提库拉克(Atkulak)、欧麻孜(Hummaz)、土日谢(Turux)、塔给库斯(Tagkusi);主治湿热性或血液质性疾病,如:热性肝虚、胃虚纳差、恶心呕吐、嗜食异物,湿性各种咽肿、耳后肿胀、淋巴结结核、牛皮癣、头癣等[1-3]。本文分别探讨土大黄醇提物、水提物对实验性银屑病小鼠模型的作用。
1 仪器与材料
1.1 仪器 TGL-5-A低速大容量离心机,上海安亭科学仪器厂;Anthos 2010酶标仪、Anthos IWO洗板机(郑州安图实验仪器有限公司);DM2500生物显微镜(德国莱卡公司);RM2235切片机(德国莱卡公司);KD-BM生物组织自动包埋机(浙江金华科迪仪器设备有限公司);KD-TS3D生物组织自动脱水机(浙江金华科迪仪器设备有限公司);KZPG-1A摊片烤片机(天津天利航空机电有限公司)。
1.2 试药 土大黄,由新疆华安中药饮片有限责任公司(GSP认证)提供,批号121101;由新疆大学资源与环境科学学院努尔巴依·阿布都沙力克教授鉴定为酸模,也就是民间命名为土大黄。土大黄醇提物(岀膏率为17.47%),土大黄水提物(岀膏率为27.39%),由新疆维吾尔自治区维吾尔医医院制剂室(GMP认证)按常规提取方法制备。甲氨蝶呤片(MTX),由上海信谊药厂有限公司提供,国药准字H31020644,批号:20130403。盐酸普萘洛尔片(心得安)常州康普药业有限公司,国药准字H32021276,批号:1203004。小鼠白介素-10(IL-10),国食药监械(准)字2009第3400951号;小鼠白介素-17(IL-17),国食药监械(准)字2012第3401164号;小鼠白介素-23(IL-23)试剂盒,国食药监械(准)字2012第3401163;批号201310,由乌鲁木齐西域医鸣商贸有限公司提供。
1.3 动物 健康昆明小鼠,200只,雌雄各半,SPF级,体质量18~22g,由新疆实验动物研究中心提供。实验动物合格证:SCXK-LAC2013-7-24。实验动物生产许可证号:SCXK(新)2011-0001。实验动物使用许可证号:SYXK(新)2011-0006。
2 方法
2.1 对小鼠鼠尾鳞片表皮模型的作用 因小鼠尾部表皮天然缺少颗粒层细胞,类似银屑病表皮角化不全病理改变,因而可作为银屑病角化异常的传统天然模型[45]。取90只小鼠,适应性饲养2d,合格后,小鼠雌雄分别按体质量随机分为8组,即溶媒对照组、阳性对照药甲氨蝶呤组(1.5mg·kg-1)、土大黄醇提物组(2,4和8g·kg-1)、土大黄水提物组(2,4和8g·kg-1),每组10只,雌雄各半。以0.02mL·g-1,1次·d-1,灌胃给予相应药物连续20d。给药第21d脱颈法处死小鼠,取鼠尾距离根部3cm皮肤标本,用150mL·L-1甲醛固定、脱水、石蜡包埋并HE染色后在光镜下观察。
2.2 对盐酸普萘洛尔致小鼠耳部皮肤银屑病样模型的作用 取110只小鼠,适应性饲养2d,合格后,小鼠雌雄分别按体质量随机分为9组,即溶媒对照组、模型组、阳性对照药甲氨蝶呤组(1.5mg·kg-1)、土大黄醇提物组(2,4和8g·kg-1)、土大黄水提物组(2,4和8g·kg-1),每组10只,雌雄各半。除溶媒对照组外,其余各组用50g·L-1心得安乳剂[6](取盐酸普萘洛尔5g用体积分数50%乙醇溶解,加入月桂氮卓酮作为透皮吸收促进剂,加入聚乙烯毗咯烷酮5g为成膜材料,再加体积分数50%乙醇至100mL,即得),均匀涂抹于小鼠双耳背部皮肤,每耳涂抹0.1mL,早晚各1次,连续涂抹20d,以小鼠耳部角质形成细胞过度增生从而出现角化过度、角化不全等症状为造模成功(详见参考文献[6],此模型在我们实验室小鼠造模已成功、成熟)。造模第21d开始,除模型组小鼠涂抹造模剂外,其余各给药组小鼠上午涂抹造模剂,下午灌胃给予相应药物,以0.02 mL·g-1,1日1次,连续20d。给药第21d,末次给药2h后,摘眼球法取血,随后取脾脏、胸腺及双侧耳廓。先称脾脏、胸腺,后与右侧耳廓一起迅速放入低温冰箱(-80℃),待测相关指标。左侧耳廓皮肤标本,用150mL·L-1甲醛固定、脱水、石蜡包埋、HE染色,在光镜下观察。分离血清,酶联免疫吸附法(ELISA)检测小鼠血清IL-17、IL-23、IL-10水平,操作步骤均严格按照试剂盒说明书进行。
2.3 统计处理方法 用SPSS17.0统计软件进行分析。检验水准α=0.05。
3 实验结果
3.1 一般情况 与溶媒对照组比较,甲氨蝶呤组、土大黄醇提物、水提物(2,4和8g·kg-1)组小鼠在实验期间,行为活动、皮毛、粪便、饮食等未见异常。
3.2 体质量 与溶媒对照组比较,甲氨蝶呤组、土大黄醇提物、水提物(2,4和8g·kg-1)组小鼠在实验期间体质量变化差异无统计学意义(P>0.05)。见表1和表2。
表1 造模期间小鼠体质量变化情况Tab.1 Body weight changes of mice during the modeling±s,n=10)
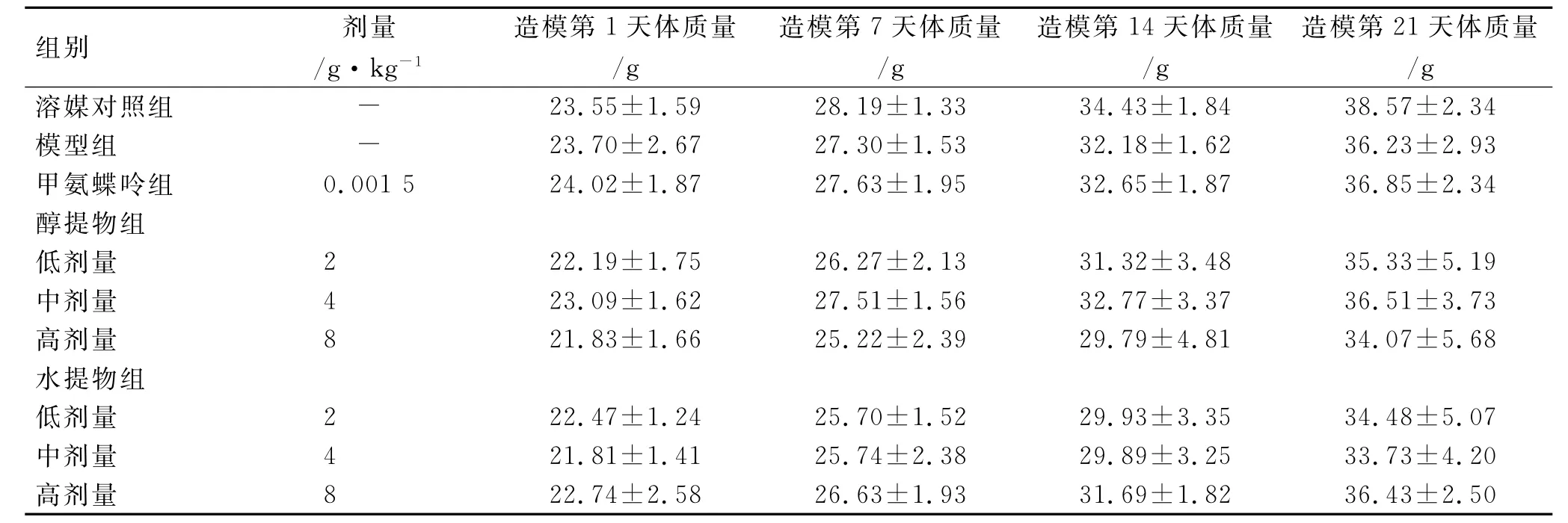
表1 造模期间小鼠体质量变化情况Tab.1 Body weight changes of mice during the modeling±s,n=10)
组别 剂量/g·kg-1造模第1天体质量/g造模第7天体质量/g造模第14天体质量/g造模第21天体质量/g溶媒对照组 - 23.55±1.59 28.19±1.33 34.43±1.84 38.57±2.34模型组 - 23.70±2.67 27.30±1.53 32.18±1.62 36.23±2.93甲氨蝶呤组 0.001 5 24.02±1.87 27.63±1.95 32.65±1.87 36.85±2.34醇提物组低剂量 2 22.19±1.75 26.27±2.13 31.32±3.48 35.33±5.19中剂量 4 23.09±1.62 27.51±1.56 32.77±3.37 36.51±3.73高剂量 8 21.83±1.66 25.22±2.39 29.79±4.81 34.07±5.68水提物组低剂量 2 22.47±1.24 25.70±1.52 29.93±3.35 34.48±5.07中剂量 4 21.81±1.41 25.74±2.38 29.89±3.25 33.73±4.20高剂量 8 22.74±2.58 26.63±1.93 31.69±1.82 36.43±2.50
表2 边造模、边给药期间小鼠体质量变化情况Tab.2 Body weight changes of mice during the modeling and ig administration (±s,n=10)
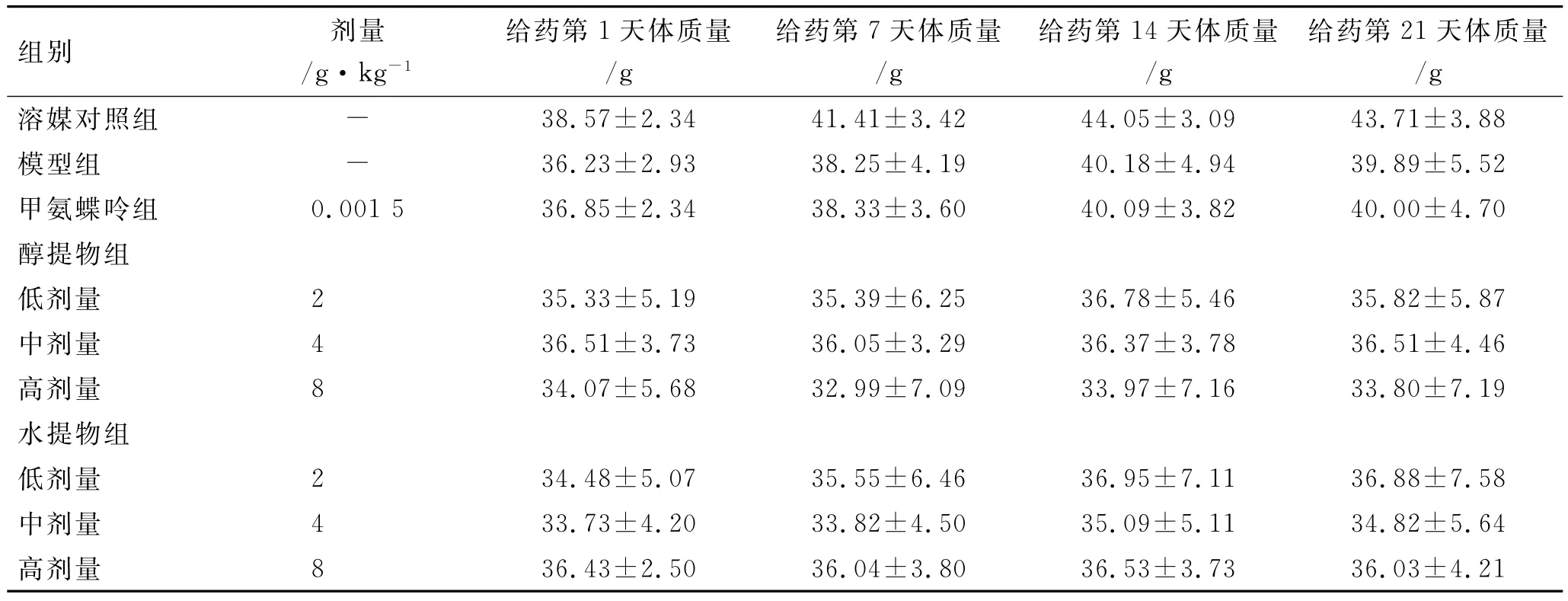
表2 边造模、边给药期间小鼠体质量变化情况Tab.2 Body weight changes of mice during the modeling and ig administration (±s,n=10)
注:与溶媒对照组比较P>0.05
组别 剂量/g·kg-1给药第1天体质量/g给药第7天体质量/g给药第14天体质量/g给药第21天体质量/g溶媒对照组 - 38.57±2.34 41.41±3.42 44.05±3.09 43.71±3.88模型组 - 36.23±2.93 38.25±4.19 40.18±4.94 39.89±5.52甲氨蝶呤组 0.001 5 36.85±2.34 38.33±3.60 40.09±3.82 40.00±4.70醇提物组低剂量 2 35.33±5.19 35.39±6.25 36.78±5.46 35.82±5.87中剂量 4 36.51±3.73 36.05±3.29 36.37±3.78 36.51±4.46高剂量 8 34.07±5.68 32.99±7.09 33.97±7.16 33.80±7.19水提物组低剂量 2 34.48±5.07 35.55±6.46 36.95±7.11 36.88±7.58中剂量 4 33.73±4.20 33.82±4.50 35.09±5.11 34.82±5.64高剂量 8 36.43±2.50 36.04±3.80 36.53±3.73 36.03±4.21
3.3 胸腺、脾脏指数 与溶媒对照组比较,模型组小鼠胸腺指数升高(P<0.05);模型组脾脏指数略升高(P>0.05)。与模型组比较,甲氨蝶呤组、土大黄醇提物组(2和8g·kg-1)、水提物组(4和8g·kg-1)能降低小鼠胸腺指数(P<0.05);对小鼠脾脏指数的影响,差异无统计学意义(P>0.05)。见表3。
表3 小鼠胸腺指数和脾脏指数Tab.3 Thymus and spleen index of mice ±s,n=10)
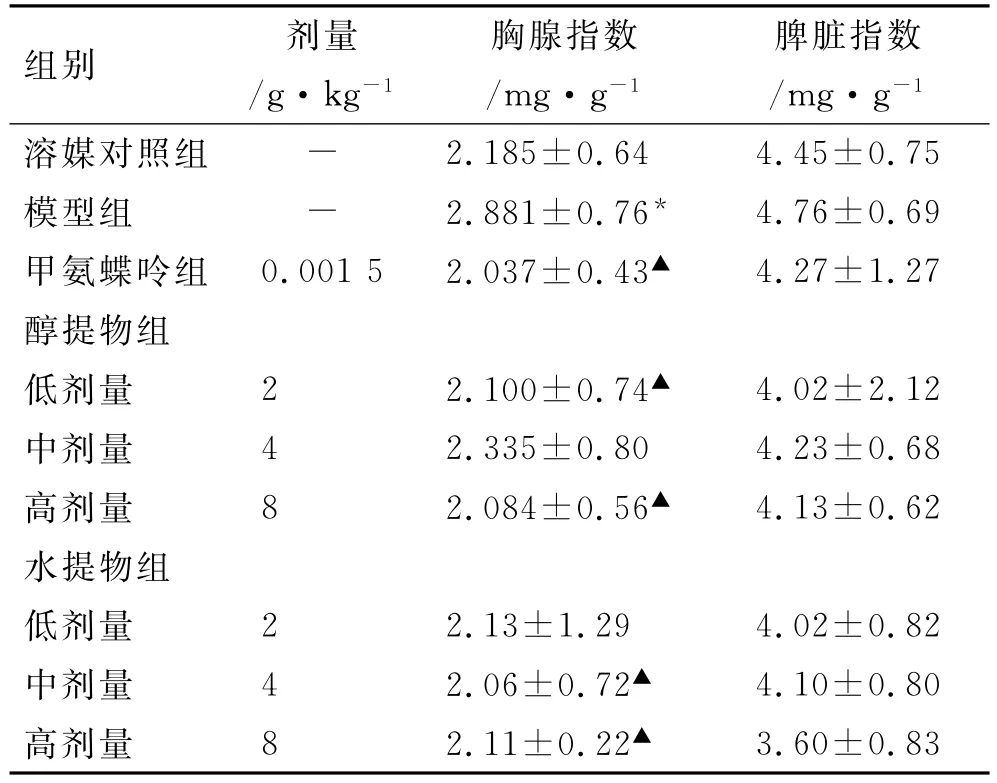
表3 小鼠胸腺指数和脾脏指数Tab.3 Thymus and spleen index of mice ±s,n=10)
注:与溶媒对照组比较*P<0.05;与模型组比较▲P<0.05
组别 剂量/g·kg-1胸腺指数/mg·g-1脾脏指数/mg·g-1溶媒对照组 - 2.185±0.64 4.45±0.75模型组 - 2.881±0.76* 4.76±0.69甲氨蝶呤组 0.001 5 2.037±0.43▲ 4.27±1.27醇提物组低剂量 2 2.100±0.74▲ 4.02±2.12中剂量 4 2.335±0.80 4.23±0.68高剂量 8 2.084±0.56▲ 4.13±0.62水提物组低剂量 2 2.13±1.29 4.02±0.82中剂量 4 2.06±0.72▲ 4.10±0.80高剂量 8 2.11±0.22▲3.60±0.83
3.4 小鼠血清IL-17、IL-23、IL-10水平 与溶媒对照组比较,模型组小鼠血清IL-10略降低,IL-17、IL-23略升高(P>0.05)。与模型组比较,甲氨蝶呤组、醇提物、水提物(2,4和8g·kg-1)对IL-10、IL-17、IL-23无明显影响(P>0.05)。见表4。
3.5 小鼠皮肤组织病理学变化
3.5.1 尾部皮肤组织病理学变化 溶媒对照组,无颗粒细胞层。即小鼠尾部皮肤组织天然缺乏颗粒细胞层[4-5]。与溶媒对照组比较,阳性对照药甲氨蝶呤组,个别区域内出现1~2层颗粒细胞层,但细胞内颗粒不明显。土大黄醇提、水提物组(2,4和8g·kg-1),部分区域内均出现1层颗粒细胞层,且细胞内颗粒较明显;但各剂量间无明显差异。见图1。
表4 小鼠血清IL-10、IL-17、IL-23水平Tab.4 Serum IL-10,IL-17and IL-23level in mice±s,n=10)
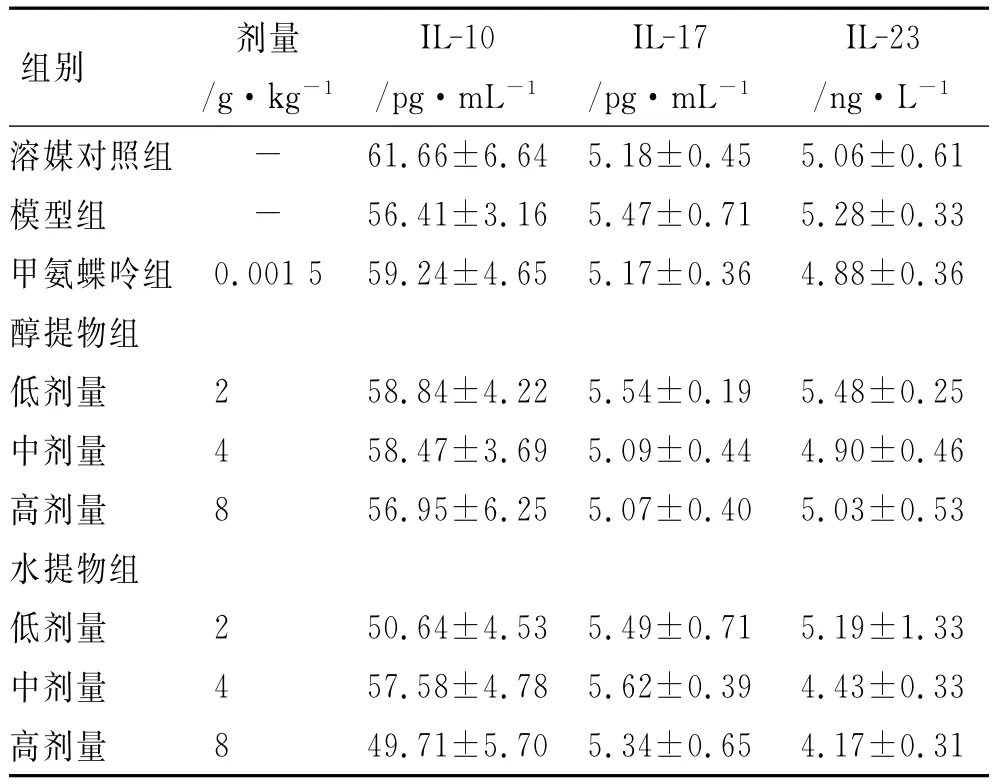
表4 小鼠血清IL-10、IL-17、IL-23水平Tab.4 Serum IL-10,IL-17and IL-23level in mice±s,n=10)
注:与溶媒对照组比较P>0.05;与模型组比较P>0.05
组别 剂量/g·kg-1IL-10/pg·mL-1IL-17/pg·mL-1IL-23/ng·L-1溶媒对照组 - 61.66±6.64 5.18±0.45 5.06±0.61模型组 - 56.41±3.16 5.47±0.71 5.28±0.33甲氨蝶呤组0.001 5 59.24±4.65 5.17±0.36 4.88±0.36醇提物组低剂量 2 58.84±4.22 5.54±0.19 5.48±0.25中剂量 4 58.47±3.69 5.09±0.44 4.90±0.46高剂量 8 56.95±6.25 5.07±0.40 5.03±0.53水提物组低剂量 2 50.64±4.53 5.49±0.71 5.19±1.33中剂量 4 57.58±4.78 5.62±0.39 4.43±0.33高剂量8 49.71±5.70 5.34±0.65 4.17±0.31
3.5.2 耳朵皮肤组织病理学变化 溶媒对照组,角质层为不全角化,上皮变薄。有颗粒细胞层,但颗粒不明显。真皮内无炎细胞浸润。皮脂腺、毛囊结构清晰。与溶媒对照组比较,模型组角质层增厚,角质层内有角栓和微小脓肿形成。有颗粒细胞层,且颗粒明显。棘层增厚。真皮内血管扩张充血,大量炎细胞浸润[7-9]。
与模型组比较,甲氨蝶呤组,角质层变薄、均匀,角质层内角栓和微小脓肿明显减少。有1~2层颗粒细胞层,且颗粒明显。棘层变薄3~4层。真皮内炎症明显减轻。土大黄醇提物、水提物组(2,4和8g·kg-1)能使角质层渐变薄,角质层内微小脓肿逐渐减少;有1~2层颗粒细胞层,且细胞内颗粒明显;棘细胞层变薄;真皮层内炎细胞逐渐减少;但各剂量间无明显差异。见图2。
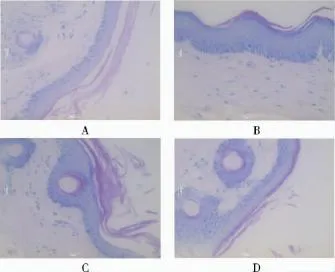
图1 鼠尾鳞片表皮模型小鼠尾部皮肤的组织病理变化HE×40;A.溶媒对照组;B.甲氨蝶呤组;C.醇提物组;D.水提物组Fig.1 Histopathological changes of the mouse tail skinHE×40;A.solvent control group;B.MTX group;C.alcohol extract group;D.aqueous extract group
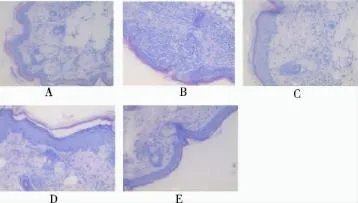
图2 银屑病样模型小鼠耳朵皮肤的组织病理变化HE×40;A.溶媒对照组;B.模型组;C.甲氨蝶呤组;D.醇提物组;E.水提物组Fig.2 Histopathological changes of the skin of mouse earsHE×40;A.solvent control group;B.model group;C.MTX group;D.alcohol extract group;E.aqueous extract group
3 讨论
银屑病[10]在世界各地不同人群中的患病率有明显差异,欧美报告的患病率约1%~3%,1984年我国银屑病的患病率为0.123%,2010年流行病学调查显示患病率为0.47%,男女分布相近,提示我国银屑病的患病率有升高趋势。银屑病是一种多基因遗传背景下的免疫性疾病,研究表明[11],银屑病皮损中浸润的T细胞是银屑病发病中主要的效应细胞,T细胞是维持银屑病疾病活动性的中心环节,与皮损的发生、发展和持续存在密切相关。银屑病发病机制的关键是T细胞过度活化与增生,由活化的T淋巴细胞产生的细胞因子刺激角质形成细胞的增殖。
近年来,Th17细胞和Treg细胞失衡与银屑病的关系日益被重视[12-13]。Th17细胞是一种辅助性T细胞,具有独立的分化途径。IL-17是Th17细胞分泌的重要细胞因子,主要生物学功能是促进炎性反应,可受到真皮树突状细胞分泌的IL-23调节。Treg细胞(调节性T细胞)是一组具有免疫抑制功能的T细胞亚群。
IL-10是Treg细胞分泌的一类重要的抑制性细胞因子,具有强大的抗炎作用,能有效抑制抗原提呈细胞等,在银屑病中发挥重要的保护作用。研究发现,Th17和Treg细胞可能在功能上相互拮抗,Th17细胞诱导自身免疫性疾病的发生,而Treg细胞能够控制免疫应答的强度、减轻机体对组织的损伤,二者相互拮抗,共同维持免疫状态的相对稳定。
土大黄的植物来源较多,中国大部分省区均有分布,药用资源丰富,在民间广泛使用。近几年,我们对新疆维吾尔自治区民间用药调查发现,土大黄用于治疗银屑病等各种皮肤病,并取得了一定的临床效果。本文分别探讨土大黄醇提物、水提物对实验性银屑病小鼠模型的作用,从而探索民间用药的科学含义。结果表明,土大黄醇提物、水提物对小鼠无明显毒副作用;此模型中,Th17和Treg细胞失衡可能不明显;但组织病理学结果显示,土大黄醇提物、水提物均可促进小鼠尾部鳞片表皮颗粒层形成,改善对盐酸普萘洛尔致小鼠耳部皮肤银屑病样组织病理学变化。因此,我们认为,新疆维吾尔自治区民间土大黄用于治疗银屑病有一定的意义,有待于深入研究。
[1]伊沙克江·马合穆德.中国医学百科全书:维吾尔医学[M].上海:上海科学技术出版社,2005:242.
[2]刘勇民.维吾尔药志:下册[M].乌鲁木齐:新疆科技卫生出版社,1999:319-323.
[3]吐尔洪·吾买尔.维吾尔医生药学:上册:维文[M].乌鲁木齐:新疆人民卫生出版社,2006:362-363.
[4]王琼玉,张爱军,马慧群,等.腺病毒介导的PML基因对银屑病样小鼠模型的作用[J].南方医科大学学报,2013,33(3):432-435.
[5]Bhatia A,Singh B,Wadhwa S,et al.Novel phospholipid-based topical formulations of tamoxifen:evaluation for antipsoriatic activity using mouse-tail model[J].Pharm Dev Technol,2014,19(2):160-163.
[6]李涛,李洪梅,李小芹,等.银屑平颗粒对豚鼠银屑病动物模型的影响[J].中国实验方剂学杂志,2010,16(16):137-139.
[7]孙建方,高天文.皮肤组织病理学[M].北京:人民卫生出版社,2013:53-54.
[8]吴钉红,袁小红,朱伟,等.半柔性分子对接预测中药治疗银屑病的活性成分[J].西北药学杂志,2012,27(4):299-302.
[9]张小娟,纪维,党文义,等.生物制剂治疗银屑病的研究进展[J].西北药学杂志,2007,22(3):44-45.
[10]丁晓岚,王婷琳,沈侠藏,等.中国六省市银屑病流行病学调查[J].中国皮肤性病学杂志,2010,24(7):598-601.
[11]Sano S,Chan K S,Carbajal S,et al.STAT3links activated keratinocytes and immunocytes required for development of psoriasis in a novel transgenic mouse model[J].Nat Med,2005,11(1):43-49.
[12]蒋延伟,王忠勇,邱会芬,等.Th17细胞和Treg细胞失衡与银屑病的关系的研究进展[J].滨州医学院学报,2012,5(3):226-229.
[13]Si qin,Ju wen,Xiao-Chun bai,et al.Endogenous n-3 polyunsaturated fatty acids protect against imiquimodinduced psoriasis-like inflammation via IL-17/IL-23axis[J].Mol Med Rep,2014,9:2097-2104.
Effect of different extracts of RumexacetosaL.on the mouse psoriasis model
Rabigul ISLAM1,2,3,Mardan NIYAZ2,3,Yultuz MAMAT2,3,Sirapil ABAY1,2,3*(Department of Pharmacology,Basic Medical College of Xinjiang Medical University,Urumqi 830054,China;2.Laboratory of Traditional Uyghur Medicine Prescription of Xinjiang,Urumqi 830049,China;3.Institute of Xinjiang Traditional Uyghur Medicine,Urumqi 830049,China)
Objective To observe the alcoholic and aqueous extracts of Rumex acetosa L.on the mouse model of psoriasis.Methods Healthy Kunming mice were used in this study.The mouse model of psoriasis was established by applying 5%propranol hydrochloride emulsion to the mouse ear.The tail and ear skin histology were examined by using HE staining,and the serum levels of IL-10,IL-17and IL-23were measured with ELISA.Results In the experiment,2,4,8g·kg-1alcoholic and aqueous extracts did not show obvious abnormalities in general conditions and body weights(P>0.05).2,8g·kg-1alcoholic extracts and 4,8g·kg-1aqueous extract decreased thymus index(P<0.05).2,4,8g·kg-1alcoholic and aqueous extracts did not show significant changes of the serum levels of IL-10,IL-17,and IL-23(P>0.05).and also 2,4,8g·kg-1alcoholic and aqueous extracts promoted the formation of epidermis granular layer in the mouse tail skin and improved the histological changes of the ear skin.Conclusion Alcoholic and aqueous extracts of Rumex acetosa L.have therapeutic effects on the experimental mouse model of psoriasis.
Rumex acetosa L.;extracts;experimental psoriasis
10.3969/j.issn.1004-2407.2015.01.013
R965
A
1004-2407(2015)01-0047-05
2014-07-02)
新疆维吾尔自治区公益性科研院所项目(编号:KY201302)
热比姑丽·伊斯拉木,女,副研究员,博士研究生*
斯拉甫·艾白,男,教授,博士生导师
