巴戟天对小鼠学习记忆障碍的影响
2015-01-08叶志雄肖柳英潘竞锵
叶志雄 肖柳英 潘竞锵
(1广州市番禺疗养院,广东 广州511490;2广州市中医医院 中医中药研究所,广东 广州510130)
近年来,随着对记忆障碍的脑生化机理的研究,认为其主要与中枢神经递质代谢有关,且累及多种神经递质[1]。记忆功能减退是认知障碍的标志症状,也是老年性痴呆的早期症状和主要特征。随着人口老龄化和痴呆患病率的逐年增加,寻找有效的延缓和改善痴呆的药物和方法显得尤为重要。中药巴戟天来源于茜草科植物巴戟天(Morinda Officinalis How,MOH)的干燥根,味甘、微涩,性微温。巴戟天是著名的“四大南药”之一,具有补肾阳、强筋骨、祛风湿的功效。2005年版中国药典收载的巴戟天炮制品为巴戟天、巴戟肉、盐制巴戟天和甘草制巴戟天4种[2]。巴戟天生用偏强筋骨,祛风湿;经盐制后,其功效主发生了改变,盐制巴戟天功专入肾,温而不燥,增强了补肾壮阳、强筋健骨作用之功效[3]。研究发现巴戟天具有抗疲劳、抗自由基、影响内分泌、抗抑郁及对D-半乳糖致衰老大鼠免疫功能影响等作用[4-5]。本实验进一步研究巴戟天对D-半乳糖致小鼠学习记忆障碍的改善,脑内单胺类神经递质变化,晚期糖基化代谢产物及其可能的作用机制,为其用于改善老年性记忆障碍,延缓痴呆等相关性疾病提供实验依据。
1 实验材料
1.1 实验药物
1.1.1 巴戟天的制备 巴戟天:购自广东省药材公司,经广东省药材质量监测站鉴定为正品巴戟天。按制剂工艺标准要求制成浓缩液,浓缩液含巴戟天2.25g/ml药液,置40C冰箱保存,由广州市中医中药研究所制备。
1.1.2 动物 2月龄昆明种小鼠60只,雌雄各半,体质量30±2 g,由广东省医学实验动物中心提供,生产许可证:SCXK(粤)2008-0002,使用许可证:SYXK(粤)2008-0002。
1.1.3 药品及试剂 D-半乳糖(Sigma公司,批号:119k0103);石杉碱甲(南京泽朗医药科技有限公司生产,批号20101205);多巴胺(DA)批号:100070);5-羟色胺(5-HT,批号:111656);5-羟基吲哚乙酸(5-HIAA,批号:140737);二羟苯乙酸(DOPAC,批号:101130);均购自中国药品生物制品检定所;水为超纯水,乙腈为色谱纯(德国默克公司),其余试剂均为分析纯。
1.1.4 仪器 Morris水迷宫(上海吉量有限公司);ES-2000型电子天平(沈阳龙腾电子称量仪器有限公司);SMART video-tracking system(Panla公司);紫外分光光度计(美国珀金埃尔默公司)。库仑阵列电化学高效液相色谱仪[Model 5600A-16通道检测器(美国 ESA公司),Model 582 solvent Delivery System,Model-542自动进样器,CoularrayWin工作站],Dionex Tcc-100型柱温箱(美国戴安公司);Thermo D-37520型高速冷冻离心机(德国Heraeus公司);pHS-25型pH计(上海精密科学仪器有限公司);GenPure超纯水(德国TKA公司);KQ-500型超声波清洗器(昆山市超声仪器有限公司);3 K超滤管(PALL公司);佳美SK-1快速混匀器(江苏金坛市佳美仪器厂);玻璃匀浆器。
1.2 实验方法
1.2.1 学习记忆障碍小鼠模型的建立[6]皮下(sc)注射D-半乳糖[500 mg/(kg·d)]连续8周,并以水迷宫测试确定学习记忆障碍模型的成立。注射容量为10 mL/kg体质量。
1.2.2 动物分组及给药 小鼠按体质量随机分为6组;正常对照组,模型对照组,石杉碱甲组0.4 mg/kg,巴戟天提取物高剂量组45 g/(kg·d),巴戟天提取物中剂量组22.5 g/(kg·d)和巴戟天提取物低11.25 g/kg。除正常对照组外,上述各组动物均给予D-半乳糖mg/(kg·d)造模,并于造模第5周开始给予上述药物灌胃,连续给药4周,给药容积同上。
1.2.3 Morris水迷宫测试[7]水迷宫直径 120 cm,高50 cm,站台直径9 cm,高30 cm,水面高于站台1 cm,水中加入适量墨汁,使小鼠看不到平台及池底。水池温度维持在22~24℃。实验主要分为两部分;一是定向航行实验,即设置平台,每天灌胃后1 h,每只小鼠训练4次,按东、西 、南、北4个方向入水,小鼠面对池壁投入水中,记录小鼠自入水到稳定爬上平台所需时间(即逃避潜伏期)。小鼠爬上站台后让其在上站立15 s,若入水后60 s内未能找到站台并站立15 s,可将动物放于站台站立15s后拿下来,休息30~60 s后进行下1次训练。二是空间探索实验,即撤除平台,观察小鼠在一定时间(30s)内穿越原平台次数和停留原平台所在象限时间百分比。从第7个实验日开始,进行空间探索实验,记录小鼠在原来位置站台的象限逗留的时间及站台穿越次数。
1.2.4 巴戟天提取物对模型小鼠白天自主行为的影响[6]实验装置为15 cm×30 cm×30 cm的箱 ,4周为黑色塑料板,箱底铺以铜栅,铜丝直径为2 mm,间距为5 mm,电流强度由一个可调变压器控制,通以36V电流,箱内右后侧放置一个高和直径均为415 cm的橡皮垫作为大鼠逃避电击的安全区。将小鼠放入箱中自由活动3 min,熟悉环境,然后箱底通以电流,其正常反应是跳上平台以躲避伤害性刺激。记录自放入至第1次跳下平台受电击的时间为潜伏期及5 min内跳下平台受电击的次数为错误数,作为学习成绩。24 h后,再将鼠置于平台上依上法记录作为记忆缩短休息时间和增加快运动成绩。
1.2.5 巴戟天提取物对模型小鼠夜间自主行为的影响[6]实验装置为15 cm×30 cm×30 cm的箱 ,四周为黑色塑料板,箱底铺以铜栅,铜丝直径为2 mm间距为5 mm电流强度由一个可调变压器控制,通以36V电流,箱内右后侧放置一个高和直径均为415 cm的橡皮垫作为大鼠逃避电击的安全区。实验夜间进行自主行为将小鼠放入箱中自由活动3 min熟悉环境,然后箱底通以电流,其正常反应是跳上平台以躲避伤害性刺激。记录自放入至第1次跳下平台受电击的时间为潜伏期及5 min内跳下平台受电击的次数为错误数,作为学习成绩。24 h后,再将鼠置于平台上依上法记录作为记忆夜间进行自主行为缩短休息时间和增加快运动成绩。
1.2.6 巴戟天提取物对模型小鼠脑内单胺类神经递质的关系[8]称小鼠大脑按1:9加入冷生理盐水匀浆,采用高效液相库仑阵列电化学检测系统检测小鼠脑内单胺类神经递质的含量,按试剂盒说明书操作进行测定5-HT、5-HIAA、DA、DOPAC 和 NE。
1.2.7 巴戟天提取物对D-半乳糖诱致小鼠学习记忆障碍的改善作用的抗糖基化机制[9]
处死小鼠获取血清及脑组织,按试剂盒说明书进行操作测定测定血清糖化血红蛋白(HbA1c)、果糖胺(FRA)、晚期糖基化终末产物(AGEs)和糖基化终末产物受体(RAGEs)以及醛糖还原酶活性水平(AR activity)。
1.3 统计方法
2 结果
2.1 巴戟天提取物对模型小鼠定向航行和空间探索实验的影响
模型组动物定向航行潜伏期明显延长(P<0.01);空间探索实验中,在原象限停留时间和站台穿越次数明显减少(P<0.01);巴戟天提取物和石杉碱甲处理后,定向航行潜伏期明显缩短(P<0.01),而在原象限停留时间与模型组比较略有增加,差异无统计学意义(P>0.05),但中、低剂量巴戟天提取物组明显增加站台穿越次数明显增加(P<0.05),结果见表1。
2.2 巴戟天提取物对模型小鼠白天自主行为的影响
与正常对照组相比,模型对照组小鼠白天自主行为平均活动速度变慢,休息时间增加,快运动时间缩短,慢运动时间延长(P <0.05,P <0.01)。巴戟天提取物处理后,平均活动速度略有增加,但与模型组比较差异无统计学意义(P>0.05),但可明显缩短休息时间和增加快运动时间(P<0.01),结果见表2。
表1 巴戟天提取物对模型小鼠定向航行和空间探索实验的影响(¯±s,n=10)

表1 巴戟天提取物对模型小鼠定向航行和空间探索实验的影响(¯±s,n=10)
注:与正常对照组比较:a P<0.01;与模型组比较:b P<0.05
组别 剂量(g·kg-1·d-1)定向航行潜伏期(s)空间探索原象限停留时间(s) 站台穿越(次)21.32 ±7.45 46.25 ±8.03 1.92 ±0.89模型组 - 41.57±4.69a 31.81±5.41a 0.72±0.59a石杉碱甲组 0.4 mg 33.38 ±9.10b 33.21 ±4.68 0.92 ±0.48b巴戟天(高) 45 37.31 ±7.18b 32.04 ±7.77 0.83 ±0.36巴戟天(中) 22.5 32.47 ±7.81b 35.44 ±5.31 1.02 ±0.59b巴戟天(低) 11.25 29.52 ±7.67b 37.47 ±7.45b 1.09.±0.41正常对照组 -b
2.3 巴戟天提取物对对模型小鼠夜间自主行为的影响
与正常对照组相比,模型组夜间平均速度明显减少,休息时间明显延长,快运动时间明显缩短(P<0.01)。与模型对照组相比,巴戟天提取物处理后,可增加平均速度,尤其是低剂量组作用明显(P<0.01),而对休息时间和快慢运动影响较小。结果见表3。
2.4 巴戟天提取物对模型小鼠脑内单胺类神经递质的影响
采用高效液相库仑阵列电化学检测系统检测小鼠脑内单胺类神经递质的含量变化,模型组与正常对照组相比脑内5-HT、5-HIAA、DA、DOPAC和 NE含量差异无统计学意义(P>0.05)。各给药组与模型对照组相比,上述单胺类递质含量亦无明显变化(P>0.05),结果见表4。
2.5 巴戟天提取物提取物对D-半乳糖诱致小鼠学习记忆障碍的改善作用的抗糖基化机制
模型组大鼠的AR活性明显高于正常组(P<0.01);巴戟天提取物给药后,均明显降低D-半乳糖处理后引起的AR活性增高(P<0.05)。同时,巴戟天提取物高、中、低剂量组明显降低晚期糖基化产物,如血清果糖胺、血清糖化血红蛋白水平和AGEs的形成及脑组织内的糖基化产物(P<0.01,P<0.05),结果见表5。
表2 巴戟天提取物对模型小鼠白天自主活动的影响(¯±s,n=10)
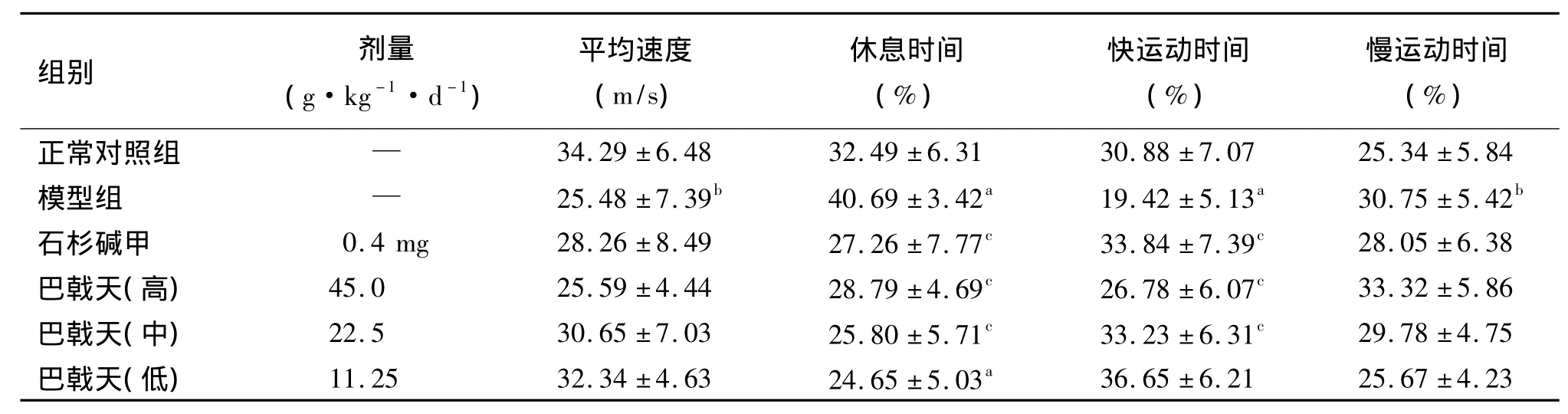
表2 巴戟天提取物对模型小鼠白天自主活动的影响(¯±s,n=10)
注:与正常对照组比较a P <0.01,b P <0.05;与模型组比较c P <0.01
组别 剂量(g·kg-1·d-1)平均速度(m/s)休息时间(%)快运动时间(%)慢运动时间(%)正常对照组 — 34.29±6.48 32.49±6.31 30.88±7.07 25.34±5.84 36.65 ±6.21 25.67 ±4.23模型组 — 25.48±7.39b 40.69±3.42a 19.42±5.13a 30.75 ±5.42b石杉碱甲 0.4 mg 28.26 ±8.49 27.26 ±7.77c 33.84 ±7.39c 28.05 ±6.38巴戟天(高) 45.0 25.59 ±4.44 28.79 ±4.69c 26.78 ±6.07c 33.32 ±5.86巴戟天(中) 22.5 30.65 ±7.03 25.80 ±5.71c 33.23 ±6.31c 29.78 ±4.75巴戟天(低) 11.25 32.34 ±4.63 24.65 ±5.03a
表3 巴戟天提取物对对模型小鼠夜间自主活动的影响(±s,n=10)

表3 巴戟天提取物对对模型小鼠夜间自主活动的影响(±s,n=10)
注:与正常对照组比较a P <0.01;与模型组相比b P <0.05,c P <0.01
组别 剂量(g·kg-1·d-1)平均速度(m/s)休息时间(%)快运动时间(%)慢运动时间(%)正常对照组 - 35.27±.3.60 16.28±5.01 41.59±.11 34.11±7.8.41c ±4.34 78模型组 - 25.03 ±4.42a 24.28±5.87a 34.60 ±5.84a 35.08 ±3.43石杉碱甲 0.4 mg 34.37 ±8.57c 20.77 ±4.08 37.21 ± .22 33.87 ±6.05巴戟天(高) 45 28..37 ±9.58 32.26 ±7.28 27.77 ±7.26 31.79 ±5.19巴戟天(中) 22.5 33.12c±6.39 23.33 ±5.38 40.13 ±6.20b 29.42 ±4.23c巴戟天(低) 11.25 36.08c±6.13 21.12c±5.37 42.11c±6.12 2
表4 巴戟天提取物对对模型小鼠脑内单胺类神经递质的影响(±s,n=10)
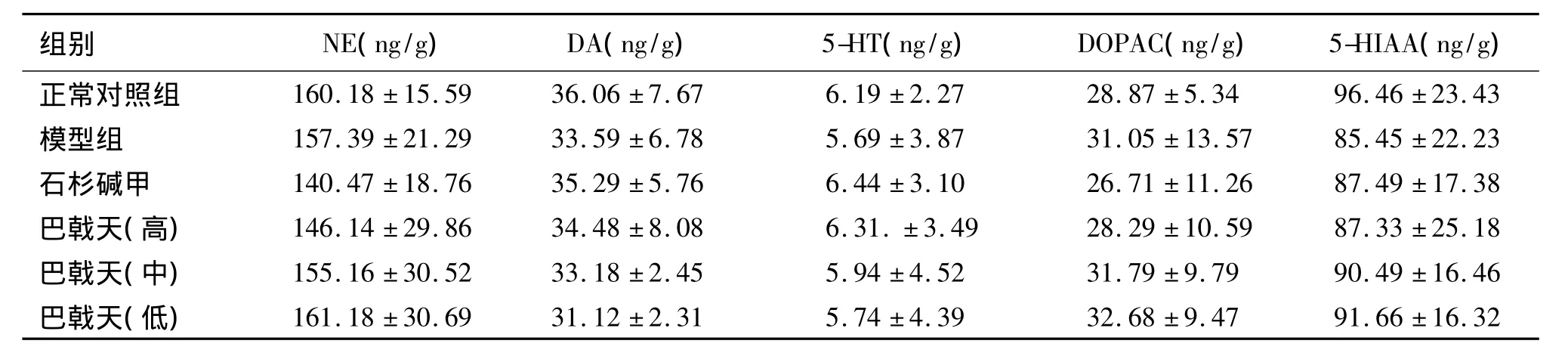
表4 巴戟天提取物对对模型小鼠脑内单胺类神经递质的影响(±s,n=10)
组别 NE(ng/g) DA(ng/g) 5-HT(ng/g) DOPAC(ng/g) 5-HIAA(ng/g)正常对照组 160.18 ±15.59 36.06 ±7.67 6.19 ±2.27 28.87 ±5.34 96.46 ±23.43模型组 157.39 ±21.29 33.59 ±6.78 5.69 ±3.87 31.05 ±13.57 85.45 ±22.23石杉碱甲 140.47 ±18.76 35.29 ±5.76 6.44 ±3.10 26.71 ±11.26 87.49 ±17.38巴戟天(高) 146.14 ±29.86 34.48 ±8.08 6.31.±3.49 28.29 ±10.59 87.33 ±25.18巴戟天(中) 155.16 ±30.52 33.18 ±2.45 5.94 ±4.52 31.79 ±9.79 90.49 ±16.46巴戟天(低) 161.18 ±30.69 31.12 ±2.31 5.74 ±4.39 32.68 ±9.47 91.66 ±16.32
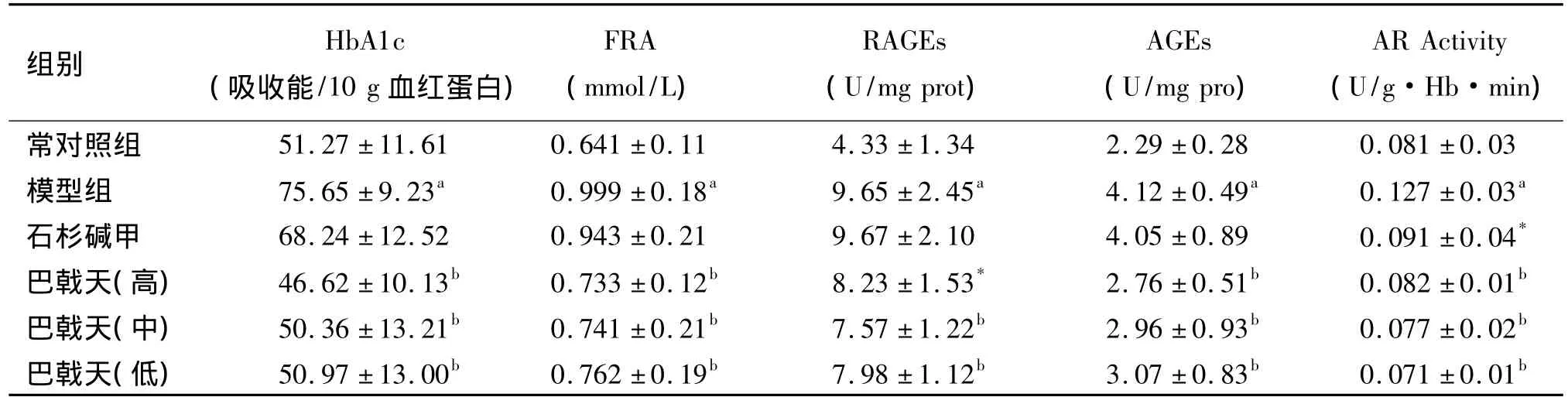
注:与正常对照组比较a P<0.01;与模型组比较b P<0.05
3 讨论
老年性痴呆(AD)是以近期记忆障碍为主要临床表现,以老年斑、神经原纤维缠结为主要病理改变的进行性神经衰退性疾病。老年性痴呆约占老年期痴呆的50%,记忆力减退和人格改变是本病最早出现的症状。记忆功能减退是认知障碍的标志症状,也是老年性痴呆的早期症状和主要特征。随着人口老龄化和痴呆患病率的逐年增加,寻找有效的延缓和改善痴呆的药物和方法显得尤为重要。D-半乳糖诱导动物模型是较公认的亚急性衰老模型,动物表现为学习记忆衰退、认知障碍和白内障以及骨质疏松和其他组织的衰老[10-11]。至于AD的脑内胆碱能改变已成定论,AD患病与神经元的退化、死亡、胆碱能功能衰竭密切相关。应用胆碱酯酶抑制剂而提升胆碱能功能可取得最为有效的对症治疗效果[12]。有研究显示5-羟色胺(5-HT)是维持正常智能的重要递质,与5-羟色胺能系统密切相关的是中逢核。以前认为5-HT及其代谢产物5-吲哚乙酸未见有与年龄相关的变化,中逢核细胞脱落不严重。后来日本学者发现5-HT虽对记忆过程本身无效,但在动物学习前1 h给与5-HT或在学习后海马区注射5-HT,均可引起记忆障碍。近年来研究发现AD患者5-HT系统也严重损害,表现为5-HT和5-HIAA浓度下降,其受体结合点减少。
老年性痴呆临床表现复杂,其主要临床表现学习记忆、智能减退是一个极其复杂的生理生化过程。有关学习记忆的神经生化机制众多,其中胆碱能突触假说为大多数学者所承认。而目前越来越多的学者认为研究老年记忆功能需考虑多种神经递质(如NE、DA、5-HT等系统)及神经活性物质(如脑内多肽类、血管加压素等)之间的相互协同和制约,各系统之间的交互影响。中医药在防治AD改善智能方面有其独特的优势和临床经验。
巴戟天醇提物能够下调 D-半乳糖致衰老大鼠的胸腺指数、脾脏指数,T、B淋巴细胞转化能力,IL-2水平,以及CD28阳性淋巴细胞数量,从而提高衰老机体的免疫力,可能具有一定的延缓衰老的作用[4]。巴戟天低聚糖(OMO)具有抑制大鼠脑组织中海马CA1区皮质和前脑基底核神经元细胞的减少,提示其机制可能是抑制神经元凋亡,从而达到抑制脑衰的发展;OMO显示可以明显提高Aβ25-35致拟痴呆大鼠学习记忆能力,其机制可能与提高单胺类神经递质水平和抑制大脑神经元凋亡有关[13]。
本研究采用多种行为药理学方法检测由D-半乳糖所致记忆障碍模型小鼠的学习记忆能力,结果证明巴戟天提取物对记忆获得、记忆巩固及记忆再现障碍有明确的改善功能,并证实了巴戟天提取物对小鼠白天自主行为的平均活动速度略有增加,但与模型组比较无显著差异,可明显缩短休息时间和增加快运动时间。而夜间自主行为,可增加平均速度,尤其是低剂量组作用更明显,而对休息时间和快、慢运动影响较小。各给药组与模型对照组相比单胺类递质含量无明显变化。巴戟天提取物均明显降低D-半乳糖处理后引起的AR活性增高;同时巴戟天提取物高、中、低剂量组明显降低HbA1c、FRA、AGEs和RAGEs以及AR活性。因而从药效学角度看来,巴戟天提取物具有改善D-半乳糖诱致小鼠学习记忆障碍的作用,其作用可能与其减少糖基化对脑神经细胞的损伤有关,但其确切的作用机理有待于研究。近年来,国内外学者在寻找防治AD的有效单味中药和复方方面进行了多方面的探索,并深入探讨其起效机理,取得了可喜的成绩。但对有效单味中药及复方进行规范化临床药理学研究尚少,有必要进一步加强,以早日开发出治疗AD的高效药物,造福于人类。
[1]刘明平,黄兆胜.中药对老年性痴呆中枢神经递质改变调节[J].时珍国医国药,1999,10(9):699-700.
[2]国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2005:56-57.
[3]王作明,孙立立,王 琦.有关巴戟天炮制的古文献分析[J].时珍国医国药,2001,12(12):1131-1132.
[4]王雪侠,张向前.巴戟天醇提物对D-半乳糖致衰老大鼠免疫功能的影响[J].中国医药导报,2013,10(4):17-19.
[5]麻 柔,谢仁敷,廖军鲜.成对和单味中药对造血细胞的作用[J].中西医结合杂志.1984,4(9):533-535.
[6]罗焕敏,姚志彬,陈以慈.当归芍药散改良方对老年性痴呆鼠空间学习记忆力的影响[J].中国老年学杂志,1995,25(5):283-285.
[7]吕俊华,郭 晶,杨文豪.绿茶多酚对D-半乳糖与Aβ25-35诱导的AD模型小鼠学习记忆障碍的改善作用[J].中
药材 2006,29(4):352-354.
[8]肖凤霞,邓少东,田青,等.库仑电化学法快速测定单胺类神经递质的方法学研究[J].广东药学院学报,2010,26(4):365-368.
[9]毛根祥,曹永葆,何志华,等.松花粉对D-半乳糖衰老模型小鼠学习记忆功能的影响及机制研究[J].心脑血管病防治,2012,12(4):290-291.
[10]张 熠,顾振纶,蒋小岗.夏天无总碱提取物对痴呆大鼠脑内5-HT和DA含量的影响[J].苏州大学学报(医学版),2004,24(2):136-138.
[11]潘竞锵,谭海荣,李博萍,等.中药对D-半乳糖诱导病理模型作用的研究进展[J].广东药学,2001,11(5):1-5.
[12]唐希灿.石杉碱甲(双益平):一种有望治疗早老性痴呆症的药物[J].中国药理学报(英文版),1996,17(6):481-484.
[13]陈地灵,张 鹏,林 励,等.巴戟天低聚糖对Aβ25-35致拟痴呆模型大鼠学习记忆障碍的影响[J].中国药理学通报,2013,29(2):271-276.
