华根霉蛋白质组双向电泳体系的建立及优化
2015-01-06郑礼月
郑礼月, 王 栋*, 徐 岩
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
华根霉蛋白质组双向电泳体系的建立及优化
郑礼月1,2, 王 栋*1,2, 徐 岩1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
华根霉(Rhizopus chinensis CCTCC M201021)是从我国传统微生物载体——大曲中分离筛选得到的一株丝状真菌,具有重要的工业应用前景。为建立一种适于华根霉胞内蛋白质的双向电泳体系以进行蛋白质组学研究,作者对华根霉胞内蛋白质的提取方法及双向电泳流程相关参数进行了考察和优化.确定采用液氮研磨与高速珠磨相结合的方法对华根霉进行细胞破碎,用TCA/丙酮对提取的蛋白质进行纯化,采用被动水化的上样方式上样,24 cm、pH 4~7的线性IPG胶条,上样量为1 200 μg蛋白质,考马斯亮蓝G-250胶体染色法,最终得到了背景清晰、分辨率高的双向电泳图谱。
华根霉;全蛋白;双向电泳
丝状真菌是一类重要的工业微生物,具有复杂的生理生化和代谢特性,多年以来其发酵产品已广泛应用于食品、医药、农业、能源、化工等众多领域.华根霉(CCTCC M201021)是从我国传统酿造微生物载体——白酒大曲中分离筛选得到的一株很有特点的丝状真菌,在分类学上属于毛霉目根霉属。华根霉可发酵产生多种酶和代谢产物[1],具有较为复杂的代谢调节机制,其产生的脂肪酶能在非水相中催化酯合成、酯交换、酸解、醇解和氨解反应,具有重要的工业应用价值[2]。华根霉作为一种丝状真菌,液态发酵中会形成不同的菌体形态,进而影响合成活性脂肪酶的发酵水平[3]。目前针对丝状真菌的发酵研究主要停留在发酵条件[4]、培养基成分优化[5]和蛋白质的异源表达[6]等方面,其生理代谢特点、菌体形态与其代谢产物间分子层面的生物学机制目前尚不清楚。
随着后基因组时代的来临,以基因组学、转录组学、蛋白质组学等为代表的系统生物学技术和方法为理解丝状真菌的形态问题提供了强有力的手段。近年来,随着曲霉、根霉等微生物全基因组的解析[7],对于丝状真菌的的认识除了基本的代谢和细胞功能外,诸如细胞壁分化、蛋白质分泌机制等生理现象和问题也得到了更深入的认识和理解。相比于基因组学,蛋白质组学能直接从蛋白质水平上反映细胞内蛋白质表达量的变化,因而蛋白质组学正被广泛的应用于微生物领域的研究。双向电泳技术是蛋白质组学中最常见一种实验技术,因其高灵敏度,高分辨率和高通量的优势[8]被广泛应用。然而,因双向电泳实验步骤繁杂及参数不确定性等原因,很难找到一种通用于所有生物的双向电泳条件。
目前,针对丝状真菌的蛋白质组学研究主要集中在曲霉上,根霉由于其细胞破碎困难等原因而鲜有报道。因而本研究的目的是创建和优化华根霉的胞内蛋白质双向电泳体系,为研究菌体形态与代谢产生的分子机制提供技术支持,同时也为其他霉菌的蛋白质组学研究提供参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种与培养条件
1)菌株:华根霉 (Rhizopus chinensis CCTCC M201021)由江南大学酿造微生物与应用酶学研究室筛选保藏。
2)斜面培养基:马铃薯—葡萄糖琼脂培养基;发酵培养基:麦芽糖10 g/L,蛋白胨40 g/L,ΜgSO4· 7H2O 0.5 g/L,K2HPO4·3H2O 2 g/L,橄榄油20 g/L;初始pH 5.5。
3)培养条件:种子培养,37℃静置培养72 h;发酵培养,30℃ 旋转式摇床200 r/min培养72 h,每升培养基接种5×107个孢子。
1.1.2 实验试剂IPG胶条 (pH 3~10/4~7,24 cm,线性)、两性电解质IPG buffer、非干扰性蛋白质浓度测定试剂盒2-D Quant Kit:美国GE公司产品;矿物油:Bio-Rad公司产品;二硫苏糖醇(DTT)、溴酚蓝、N,N,N’,N’-四甲基乙二胺(TEMED)、硫脲、碳酸氢铵 (NH4HCO、α-氰基-4-羟基肉桂酸(HCCA)、胰蛋白酶、乙腈(ACN):Sigma公司;低熔点琼脂糖、尿素、三氟乙酸(TFA)、三氯乙酸(TCA)、蛋白酶抑制剂、甲叉双丙烯酰胺、过硫酸铵(APS)、十二烷基硫酸钠(SDS)、丙烯酰胺、3-[(3-胆固醇氨丙基)二甲氨基]-1-丙磺酸 (CHAPS)、碘乙酰胺(IAA)、考马斯亮蓝 G-250:上海生工产品;其它试剂均购自国药。
1.1.3 实验仪器EttanTMIPGphor3等电聚焦仪:瑞典GE公司;EttanTMDALTSix垂直电泳系统:瑞典GE公司;ImageScanner扫描仪:瑞典GE公司;蛋白质电泳系统(Mini-Protein3 Cell):美国Bio-Rad公司;台式35K高速冷冻离心机:美国Sigma公司;Ultraflextreme飞行时间质谱仪:德国Bruker公司。
1.2胞内蛋白质提取
1.2.1 细胞破碎方法
1)液氮研磨法:收集发酵72 h的菌体,超纯水清洗菌体,5 000 r/min离心5 min,重复洗3次。称湿菌体质量,将湿菌体与玻璃珠以1∶3质量比混合后加入液氮,研磨至粉状。取裂解液1 mL,每毫升裂解液中加入10 μL蛋白酶抑制剂 (Protein Cocktail for fungi)、10 μL 20%IPG buffer和1.2 g玻璃珠与菌体混合物,于4℃下放置12 h,期间每2小时拿出涡旋2 min。
2)液氮研磨+Mini beads beater破碎法:取裂解液1 mL,每毫升裂解液中加入10 μL蛋白酶抑制剂(Protein Cocktail for fungi)、10 μL 20%IPG buffer和1.2 g玻璃珠与菌体混合物,涡旋混匀后置于mini beads beater破碎仪破碎。破碎后固液混合物于4℃放置12 h,期间每2小时拿出涡旋2 min。
3)Mini beads beater破碎法 (高速珠磨法):将(2)中1.2 g玻璃珠与菌体混合物替换为0.3 g湿菌体和0.9 g玻璃珠,其余全部与(2)相同。
将上述三种方法得到的固液混合物在4℃、12 000 r/min离心30 min,上清液即为胞内全部蛋白质溶液,蛋白质定量使用美国GE公司的2-D quant kit完成。
1.2.2 蛋白沉淀方法
1)丙酮沉淀法:将细胞破碎后上清液转移到50 mL离心管中,加入10倍体积丙酮溶液沉淀蛋白,于-20℃放置过夜,14 000 r/min离心30 min得蛋白质沉淀。
2)TCA-丙酮沉淀:蛋白溶液中加入10倍体积10%TCA/丙酮溶液,-20℃沉淀蛋白质 24 h,12 000 r/min、4℃离心30 min。去除上清液,加入与10%TCA/丙酮相同体积的丙酮(-20℃预冷)洗涤沉淀3次,以除去沉淀颗粒中残留的TCA。将得到的沉淀敞口置于室温下,使沉淀中残留的丙酮挥发干净。
向上述两种方法收集的沉淀中加入水化液涡旋至蛋白质完全溶解,溶解后在4℃、12 000 r/min离心30 min,收集上清液,使用GE 2-D quant kit对2.1中所得蛋白质浓度进行定量。
1.2.3 双向电泳双向电泳实验参照GE公司的《双向电泳操作手册》进行。向定量后的蛋白质溶液中加入体积分数0.2%的IPG缓冲液后开始上样,24 cm IPG胶条的蛋白质上样量与上样体积见表1。IPG胶条20℃水化12 h后进行第一向等电聚焦。

表1 不同IPG胶条的上样量Table 1 Sampling amount of different IPG strips
将等电聚焦后的胶条在平衡液Ⅰ平衡15 min,再在平衡液Ⅱ中平衡15 min,将平衡后的IPG胶条转移到SDS-PAGE凝胶上,用低熔点琼脂糖封胶液封胶后进行第二向SDS-PAGE。此过程采用恒功率进行,首先为2 W/胶,进行一段时间后改为14 W/胶。凝胶染色采用改进后的胶体考马斯亮蓝染色法[9],双向电泳图谱分析采用Pdquest8.0.1软件。
2 结果与讨论
2.1 不同细胞破碎方法对胞内蛋白质提取效果比较
华根霉因其坚实的细胞壁导致其胞内的微生物很难被释放出来,因而想要获得华根霉胞内全蛋白质,选取一种合适的方法对华根霉进行破壁是进行蛋白质组学研究的先决条件。本研究的目的是得到华根霉的胞内全蛋白质,以期探索出适合华根霉胞内蛋白质提取的最佳方法,为华根霉下一步蛋白质组学研究提供基础。
关于真菌胞内蛋白质提取的方法,国内外已有很多报道[10-11],但由于真菌种类、菌丝类型、细胞壁结构及次生代谢产物等特点各不相同,很难有通用的蛋白质提取方法。作者比较了液氮研磨法、高速珠磨法、液氮研磨与高速珠磨结合法等三种的细胞破碎方法,由图1可以看出,液氮研磨法和高速珠磨法法对华根霉细胞壁的破碎都有一定作用,能释放华根霉部分胞内蛋白质。从蛋白质总量来看,高速珠磨法的效果要好于液氮研磨法。但是将两种方法结合起来发现,相同质量的细胞菌体,提取到的蛋白质的总量远远大于单独使用两种破碎方法。说明这两种方法对华根霉有一定的破壁作用,但破碎并不完全,仍有一部分华根霉并没有被破碎,导致了其胞内蛋白质没有被完全释放,提取到的蛋白质仅为胞内部分蛋白质,为了从整体上对胞内全蛋白进行考察分析,避免胞内蛋白质提取不充分对后续的双向电泳图谱及蛋白质组的分析的影响,作者采取液氮研磨法与高速珠磨法相结合的破壁方法对华根霉进行细胞破碎。
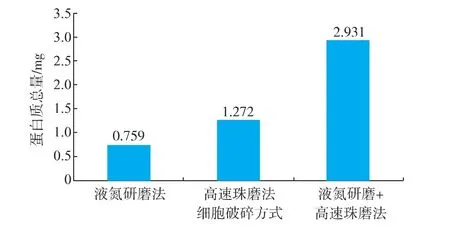
图1 不同破碎方法得到的蛋白质总量Fig.1 Protein amount obtained by different cell disruption methods
2.2 细胞破碎时间对胞内蛋白质提取效果的影响
早期研究发现菌体与石英砂的比例、菌悬液的浓度、破碎时间等都会影响细胞的破碎率[11]。作者采取固定菌体与石英砂的比例和菌悬液的浓度两个因素来优化破碎时间,提高破碎效果。另外,在细胞破碎过程中,细胞自有的蛋白酶也会被释放出来,水解样本中的蛋白质,极大地增加双向电泳结果分析的难度。因此,在细胞破碎和随后的制备过程中,应防止样本中的蛋白质被水解[12],因而需加入蛋白酶抑制剂以抑制蛋白酶活性。作者在优化破碎时间时,考察了两种浓度的蛋白酶抑制剂对最终蛋白质提取效果的影响。由图2可知,在最开始蛋白质质量浓度随破碎时间的增加而不断增大,当破碎时间到达4 min后,破碎时间的延长对蛋白质质量浓度的增加的影响变小,说明4 min时细胞的破碎率达到了最大。另外,从图2可以看出,蛋白酶抑制剂的量对胞内蛋白质质量浓度的影响较小,因此确定蛋白酶抑制剂的添加量为10 μL/mL,破碎时间为4 min。
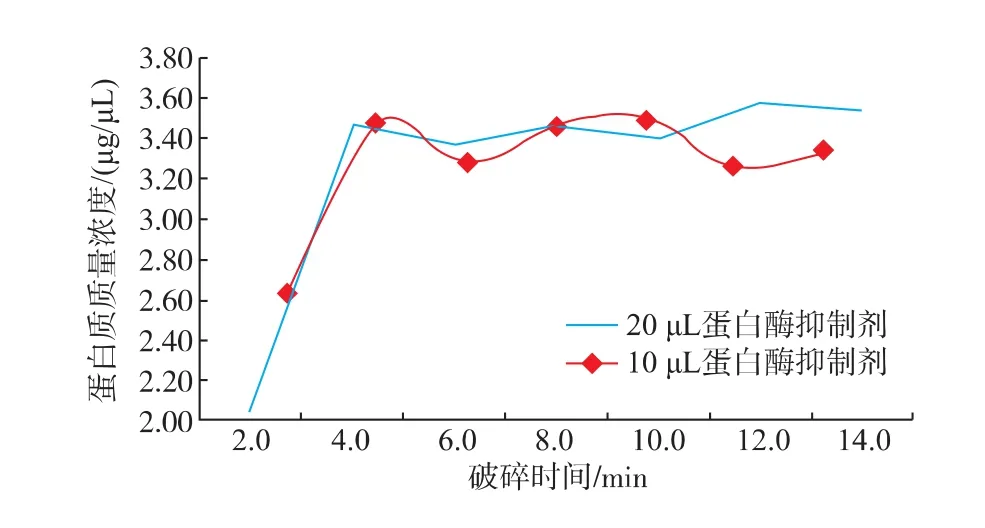
图2 蛋白质质量浓度与破碎时间的关系Fig.2 Protein concentration varies along with broken time
2.3 不同凝胶参数对双向电泳图谱的影响
预制IPG胶条pH范围的选择能显著影响双向电泳图谱,宽pH范围的胶条对蛋白质的覆盖率大,但是分辨率较低,窄pH范围的胶条则恰恰相反[13]。鉴于此,作者先用宽范围即24 cm、pH 3~10的IPG胶条做预实验,发现华根霉的胞内蛋白质多分布于酸性范围,碱性范围内的蛋白质点很少,见图3。采用pH 4~7的预制胶条进行实验后发现,蛋白质点多且分布均匀,见图4,为提高图谱的分辨率,后续实验换用pH 4~7的IPG胶条。
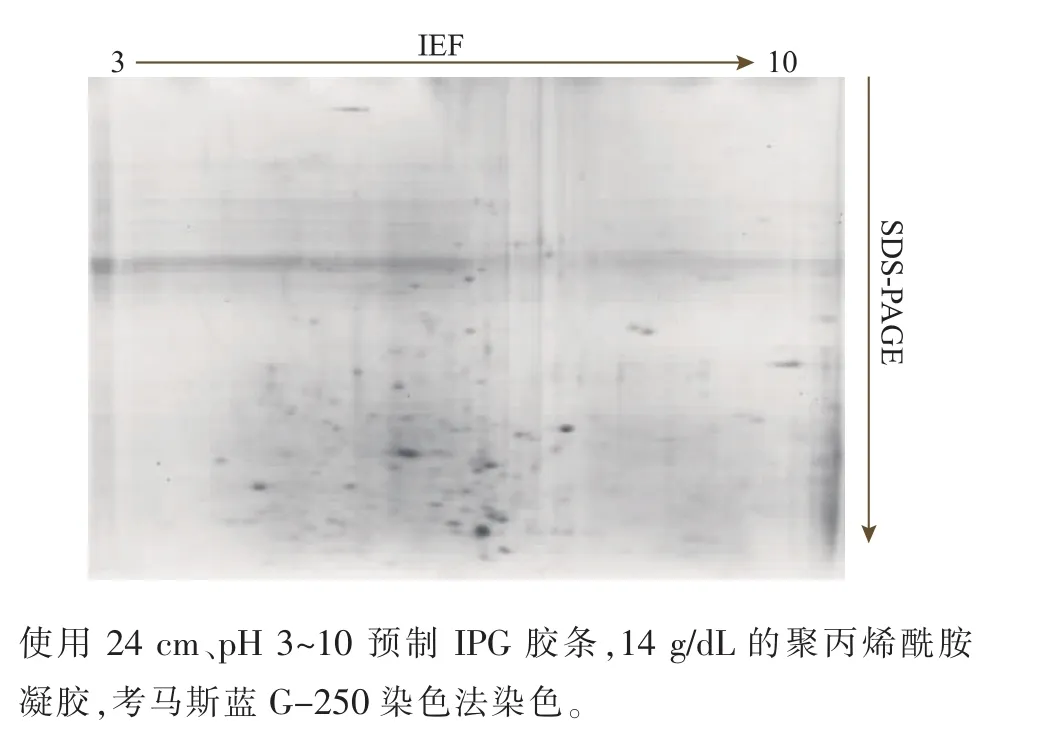
图3 华根霉双向电泳图谱Fig.3 2-DE map of R.chinensis
2.4 不同蛋白质纯化方法对双向电泳图谱的影响
在提取胞内蛋白质时,细胞内的脂类、核酸、多聚糖等也会一并被提取出来,这些污染物会使双向电泳图谱产生明显的横、纵条纹,影响结果的可靠性,因而对蛋白质的纯化、除杂就显得尤为重要[14]。在全细胞裂解液中,各种蛋白质的质量浓度范围差异较大,且呈动态变化,需要根据实验目的来决定是要高丰度蛋白质还是低丰度蛋白质,进而决定对收集到的蛋白质溶液的后续处理。蛋白质沉淀是一种常见的去除胞内干扰物质的方法,通过这种处理,可以有效除去污染物,使双向电泳图像清晰、分辨率高、无明显条纹,从而保证实验结果真实可信,揭示潜在的客观规律。
蛋白质组学中常见的蛋白质沉淀方法有丙酮沉淀法、TCA/丙酮沉淀法,还有Clean-up等试剂盒法,因Clean-up试剂盒的处理量小,处理成本高,而本研究中样品需求量大,故不采用此方法。作者对比了两种蛋白质纯化方法:丙酮沉淀法和TCA/丙酮沉淀法,见图4。从双向电泳图谱质量来看,利用丙酮对蛋白进行沉淀时,见图4a。图谱的酸性端会产生明显的横条纹,使得酸性端相当一部分蛋白质不能够被识别、分析;从蛋白质回收率来看,丙酮沉淀法的回收率为26.34%,而TCA/丙酮沉淀法的回收率为38.19%,丙酮沉淀法的回收效果差,蛋白质丢失率较高,因而本研究选取TCA/丙酮沉淀法作为蛋白质的纯化方法。
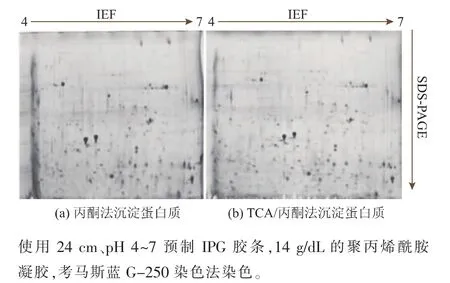
图4 不同蛋白质沉淀方法所得华根霉双向电泳图谱Fig.4 2-D mapsofR.chinensiswith different precipitation methods
2.5 不同蛋白质上样方式对双向电泳图谱的影响
除样品制备外,蛋白质上样方式对双向电泳图谱的清晰度、分辨率等有着直接的影响[13]。常见的上样方式有主动水化上样和被动水化上样等。作者比较了主动水化上样和被动水化上样两种方式,以期获得蛋白质点数较多、分辨率较高的双向电泳图谱。从图谱质量看,主动水化上样后进行等电聚焦时酸性端高相对分子质量区域会有横条纹出现,见图5a,而被动水化得到的双向电泳图谱酸性区域没有明显条纹出现,见图5b;从蛋白质点数目来看,主动水化的上样方式得到的蛋白质点数明显少于被动水化。可能是由于主动水化槽较被动水化槽宽(底面面积较大),过多的蛋白质样品吸附于水化槽中,使得进入IPG预制胶条的蛋白质量减少,从而导致图谱上蛋白质点数目过少,确定华根霉胞内蛋白质的上样方式为被动水化上样。
2.6 不同蛋白质上样量对双向电泳图谱的影响
分离到尽可能多而且清晰的蛋白质点是进行蛋白质组学的首要条件[15],单就上样环节而言,在不降低蛋白质分离质量的前提下,大的蛋白质上样量可以得到数目较多的蛋白质点。一般而言,对于窄pH范围的IPG胶条,需要比宽pH范围的IPG胶条上更多的样品,这是因为pI值不在此范围内的蛋白质在等电聚焦的过程中会走出胶条。单pH范围IPG胶条的上样量往往较大,这样就可以很好的检测低丰度的蛋白质。作者采用了400 μg和1 200 μg两种上样量来考察上样量对华根霉双向电泳图谱的影响,见图6。本研究推荐采用大上样量,其目的在于,如果在大的上样量的基础上能够提高双向电泳图谱的质量,可以大大提高蛋白质点的数目并为下游蛋白质点的鉴定奠定基础。使用pH 4~7范围的IPG胶条对华根霉胞内蛋白质进行双向电泳,见图6。增大了上样量后,胶图上没有明显条纹及拖丢等现象,可见的蛋白质点数明显增加,高丰度蛋白质点更加清晰、明显,低丰度的蛋白点开始被识别,因而在后续的实验中均采用1 200 μg的蛋白质上样量。

图5 不同上样方式所得华根霉双向电泳图谱Fig.5 2-D maps of R.chinensis with different protein loading methods

图6 不同上样量所得华根霉双向电泳图谱Fig.6 2-DE map of protein sample by different loading quantity
2.7重复性实验
重复性是分离蛋白质组所有蛋白质的关键参数之一,双向电泳步骤繁琐,实验周期长,实验结果往往具有不稳定性。为确保从蛋白质双向电泳图谱中获得可靠的生物学信息,良好的重复性是十分必要的[16]。作者利用已创建条件,对样品进行了生物学重复,以验证样品提取及双向电泳技术的重复性。由图7可知,两个重复样品的电泳图谱无明显横纵条纹,分辨率较高,蛋白质点的分离效果较好。利用PDQuest8.0.1软件对双向电泳图谱进行分析后发现,图谱中蛋白质点的匹配率可以达到85.7%(每张胶图上约800个蛋白质点),证明利用上述已确立的双向电泳条件不仅可以得到较高分辨率的双向电泳图谱,同时具有较好的重复性,所得数据具有统计学意义,能够真实反映华根霉胞内蛋白质表达水平。
3 结语

图7 华根霉胞内蛋白双向电泳图谱的重复性Fig.7 Repeatability of 2-DE maps with intracellular proteins separated from Rhizopus.chinensis
为了获得高分辨率、高重复度、高稳定性、无明显横纵条纹的双向电泳图谱,作者探究了不同的细胞破碎方法、蛋白质提取纯化方法、不同凝胶参数、不同上样量及上样方式等对华根霉双向电泳图谱的影响,创建并优化了适用华根霉的双向电泳体系。经过对各个条件进行实验比较,确定华根霉的双向电泳条件如下:液氮研磨和高速珠磨相结合的方法对华根霉进行细胞破碎,破碎过程中添加真菌专用蛋白酶抑制剂,然后用TCA/丙酮沉淀法对蛋白质样品进行纯化,选择24 cm、pH 4~7的IPG预制胶条,采取被动上样方式进行上样,上样量为1 200 μg,使用质量浓度为14 g/dL的丙烯酰胺凝胶进行双向电泳实验,然后选取改进后的胶体考马斯蓝G-250染色法对凝胶进行染色。所得图谱经PDQuest软件分析,每张胶约能分离到800个蛋白质点,该图谱的创建为后续华根霉蛋白质组学的研究打下了基础,可为其他霉菌的细胞破碎、蛋白质提取纯化方法研究提供参考。
[1]徐岩,赵光鳌,高克亮,等.华根霉产脂肪酶发酵培养基的研究[J].工业微生物,2000,30(3):8-10.
XU Yan,ZHAO Guangao,GAO Keliang,et al.Research of Rhizopus chinensis of lipase production fermentation medium[J]. Industrial Microbiology,2000,30(3):8-10.(in Chinese)
[2]王栋.华根霉(Rhizopus chinensis)非水相合成活性脂肪酶及其酶学特性的研究[D].无锡,江南大学,2008.
[3]Teng Yun,Xu Yan,Wang Dong.Changes in morphology of Rhizopus chinensis in submerged fermentation and their effect on production of mycelium-bound lipase[J].Bioprocess and Biosystems Engineering,2009,32(3):397-405.
[4]朱增亮,王栋,徐岩.发酵罐装置改进提高华根霉膜结合脂肪酶液态发酵水平[J].工业微生物,2013,43(2):1001-6678.
ZHU Zhengliang,WANG Dong,XU Yan.Fermentation level of membrane-bound lipase produced by Rhizopus chinensis[J]. Industrial Microbiology,2013,43(2):1001-6678.(in chinese)
[5]孙舒扬,王栋,徐岩.固液态发酵中橄榄油对Rhizopus chinensis全细胞脂肪酶的影响[J].微生物学通报,2006,33(4):10-14.
SUN Suyang,WANG Dong,XU Yan.Effects of olive oil on whole-cell lipase production of solid-state and submerged fermentation by Rhizopus chinensis[J].Microbiology China,2006,33(4):10-14.(in chinese)
[6]王睿,喻晓蔚,沙冲,等.定向进化-易错PCR方法提高华根霉Rhizopus chinensis CCTCC M201021脂肪酶的活力[J].生物工程学报,2009,25(12):1892-1899.
WANG Rui,YU Xiaowei,SHA Chong.Increasing activity of Rhizopus chinensis CCTCC M201021 lipase by directed evolution-error prone PCR[J].Chinese Journal of Biotechnology,2009,25(12):1892-1899.(in Chinese)
[7]Ma,Li-Jun,et al.Genomic analysis of the basal lineage fungus Rhizopus oryzae reveals a whole-genome duplication[J].PLoS Genetics,2009,5(7):e1000549.
[8]廖翔,应天翼,黄留玉,等.蛋白质组学研究中的双向电泳技术[J].生物技术通讯,2003,14(6):522-524.
LIAO Xiang,YING Tianyi,HUANG Liuyu.Two-dimensional electrophoresis technology in proteomics[J].Letters in Biotechnology,2003,14(6):522-524.(in Chinese)
[9]Candiano,Giovanni.Blue silver:a very sensitive colloidal Coomassie G-250 staining for proteome analysis[J].Electrophoresis,2004,25(9):1327-1333.
[10]Nandakumar.Mark R.Marten Comparison of lysis methods and preparation protocols for one-and two-dimensional electrophoresis of Aspergillus oryzae intracellular[J].Electrophoresis,2002(23):2216-2222.
[11]胡彬彬,林连兵,魏云林,等.一种高效的真菌总蛋白质提取方法[J].中国生物工程杂志,2013,33(9):53-58.
HU Binin,LIN Lianbin,WEI Yunlin.An efficient method of fungus protein extraction[J].China Biotechnology,2013,33(9):53-58.(in Chinese)
[12]Urquhart,Brooke L,et al.'Proteomic contigs'of Mycobacterium tuberculosis and Mycobacterium bovis(BCG)using novel immobilised pH gradients[J].Electrophoresis,1997,18(8):1384-1392.
[13]张丽,应天翼,黄留玉,等.桃果实总蛋白质双向电泳优化体系的建立[J].食品与生物技术学报,2013,32(3):250-257.
ZHANG Li,YING Tianyi,HUANG Liuyu.Optimization of two-dimensional electrophoresis conditions for proteome analysis of peach fruit[J].Journal of Food Science and Biotechnology,2013,32(3):250-257.(in Chinese)
[14]张国庆,廖杰,于力方.双向电泳技术在蛋白质组研究中的应用[J].标记免疫分析与临床,2003,10(3):171-173.
ZHANG Guoqing,LIAO Jie,YU Lifang.Application of two-dimensional electrophoresis in proteomics research[J].Labeled Immunoassay and Clinical,2003,10(3):171-173.(in Chinese)
[15]严广斌.蛋白质组学[J].中华关节外科杂志,2011,5(4):27-27.
YAN Guangbin.Proteomics[J].Chinese Journal Joint Surgeon,2011,5(4):27-27.(in Chinese)
[16]张卫东,郗园林.蛋白质双向电泳技术分析志贺菌诱导耐多药相关蛋白[J].河南医学研究,2010,19(1):1-3.
ZHANG Weidong,XI Yuanlin.Analysis of proteins related to induced multi drug resistance of shigella flexneri by two -mensional electrophoresis[J].Henan Medical Research,2010,19(1):1-3.(in Chinese)
Construction and Optimization of Two-Dimensional Electrophoresis for Proteome Analysis of Rhizopus chinensis
ZHENG Liyue1,2, WANG Dong*1,2, XU Yan1,2
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China; 2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Rhizopus chinensis CCTCCM201021 is an important filamentous fungus,which was isolated from Daqu,a traditional leaven in the production of Chinese liquor.In order to understand this fungal deeply,the conditions of two-dimensional electrophoresis(2-DE)for proteome analysis of R.chinensis were investigated and optimized.Intracellular proteins of Rhizopus chinensis was extracted and separated for 2-DE.Different sample preparation methods,parameters of the gel,sample loading quantity and methods were investigated to optimize 2-DE maps of R.chinensis. Ultimately disrupt cell in liquid nitrogen and mechanical agitation,precipitate proteins with TCA/acetone,passively rehydrate proteins with 24 cm pH 4~7 linear strips were selected.Thesample loading quantity for each strip was 1 200 μg,and modified colloidal coomassie brilliant blue G-250 was applied to stain gels.Finally,2D-gel map with no obvious vertical and horizontal stripes,low background,high resolution and good reproducibility was obtained.Approximately 800 protein spots were isolated from the 2-DE protein map after analyzed by PD-Quest software.
Rhizopus.chinensis,intracellular proteins,two-dimensional electrophoresis
Q 93
A
1673—1689(2015)05—0487—07
2014-01-25
国家973计划项目(2011CB710800);国家自然科学基金项目(31271920);国家863计划项目(2012AA022207,2013AA102108);江苏省高校优势学科建设工程资助项目。
*通信作者:王 栋(1971—),男,浙江绍兴人,工学博士,副教授,硕士研究生导师,主要从事酿酒科学与发酵工程方面的研究。
E-mail:dwang@jiangnan.edu.cn
