不同生长年限园参根的双向电泳分析
2017-02-05麻锐冯凯姜锐陈伟靳雯棋
麻锐++冯凯++姜锐++陈伟++靳雯棋++徐晓浩++毕英飞++孙立伟


doi:10.15889/j.issn.1002-1302.2016.10.019
摘要:为了解园参根在生长过程中的蛋白质组学变化,利用双向电泳技术分离1~5年园参根蛋白,重点分析园参根生长(3年)、成熟(5年)之间的蛋白质组学差异,并利用MALDI-TOF/TOF鉴定差异显著的81个蛋白点。结果表明:有19个差异蛋白点在成熟期表达量下调,62个蛋白点表达量上调,针对其与园参根生长发育的潜在关系进行分类与讨论;园参根在逐渐成熟的过程中与抗胁迫相关的过氧化氢酶、单脱氢抗坏血酸还原酶等,以及与能量代谢相关的ATP酶、甘油醛-3-磷酸脱氢酶等表达量增加,而与生长相关的果胶酯酶表达量减少,这些蛋白质的变化对于探讨人参根的生长发育规律有重要意义。
关键词:园参;生长年限;双向电泳;蛋白质组学
中图分类号:S567.5+10.1文献标志码:A文章编号:1002-1302(2016)10-0084-04
收稿日期:2015-09-02
基金项目:国家自然科学基金(编号:81373932);吉林省教育厅科学技术研究项目[编号:吉教科合字(2014)第193号];吉林省科技计划(编号:20150520138JH、20130522045JH、20140519016JH、YYZX201268)。
作者简介:麻锐(1982—),女,吉林吉林人,博士,讲师,主要从事人参蛋白质组学研究。E-mail:maruijilin@163.com。
通信作者:冯凯,硕士,讲师,主要从事植物生物科学研究。E-mail:fengk544@163.com。人参(Panax ginseng C A May,Araliaceae)为五加科多年生草本植物,其根部作为补气圣品,有悠久的药用历史。人参的品质多受其生长年限的影响,需要生长5年以上才可收获药用。研究表明,人参根中含有多种皂苷、挥发油、多糖、蛋白质等物质,具有调节中枢神经系统、促进大脑对能量物质的利用、改善心脏功能、降低血糖、增强人体免疫力、抗肿瘤等作用[1],并且这些物质含量会随着参龄的增长而递增,进入成熟期(5年)后趋于稳定[2-3]。也就是说,进入成熟期的人参质量好,药效价值显著,并且在这过程中的生理生化转变皆可由基因调控的蛋白质差异表达而得以反映。因此,研究人参根生长期与成熟期的蛋白质组学变化对于揭示人参生长发育特性有重要意义。
近年来,随着蛋白质组学的快速发展,高通量、高灵敏度的双向电泳和质谱等蛋白质组学技术已经可以快速鉴定上千种蛋白质,为监测植物生长代谢过程中蛋白质的动态变化提供了可能。本研究应用比较蛋白质组学技术,建立不同生长年限园参的蛋白质表达图谱,分析其差异表达蛋白的功能,探讨园参参根的生长发育规律,对认识园参药效形成有一定意义。
1材料与方法
1.1试验材料
75株试验样品采自吉林省抚松县露水河镇,分别为1、2、3、4、5年生园参各15株。新鲜园参用超纯水洗净后,切成碎块,用液氮研磨成精细粉末后存于-80 ℃备用。
1.2蛋白提取
园参根蛋白质的提取方法采用改进后的酚提法[4]。取0.2 g液氮研磨的园参根粉末,加入7倍体积、含0.07% β-巯基乙醇的丙酮溶液(-20 ℃预冷),-20 ℃静置1 h后,于4 ℃、15 000 r/min离心15 min,弃上清,重复3次;将沉淀置于 4 ℃ ,待丙酮完全挥发后,加入4倍体积样品裂解液{含 7 mol/L 尿素、2 mol/L硫脲、2% 3-[(3-单酰胺丙基)-二乙胺]-1-丙磺酸(CHAPS)、1%植物蛋白抑制剂},旋涡混匀,100 W超声40 min后,于15 000 r/min、4 ℃离心 15 min,收集蛋白上清液;加入等体积Tris-饱和酚(pH值=7.8)振荡30 min,于4 ℃、10 000 r/min离心10 min,取中层、下层,加7倍体积含0.1 mol/L乙酸铵的甲醇溶液沉淀过夜,于4 ℃、15 000 r/min离心15 min,弃上清;沉淀用含 0.1 mol/L 乙酸铵的甲醇溶液洗涤2遍,再用预冷的丙酮洗涤3遍,将沉淀物干燥,于-80 ℃贮存。参照Bradford的方法进行蛋白质定量[5]。
1.3双向电泳(2-DE)
取1 000 μg蛋白,加入再水化液[含5 mol/L 尿素、2 mol/L 硫脲、2% CHAPS、2%磺基三甲基胺乙内酯3-10(SB3-10)、0.65% pH值3~10固相pH值梯度缓冲液(IPG buffer)、0.35% pH值4~7固相pH值梯度缓冲液(IPG buffer)][6]至终体积450 μL。等电聚焦采用24 cm、pH值3~10预制干胶条(GE Healthcare),Ettan IPGPhorII等电聚焦仪(Amersham Biosciences)聚焦。聚焦程序:(1) 30 V 10 h;(2)200 V 2 h;(3)500 V 2 h;(4)1 000 V 2 h;(5)8 000 V 3 h;(6)8 000 V 72 000 V·h。等电聚焦完成后,将IPG胶条放入含有1%二硫苏糖醇(DTT)平衡缓冲液[75 mmol/L Tris-HCl,pH值=8.8,6 mol/L尿素,2 mol/L硫脲,30%甘油,2%十二烷基硫酸钠(SDS),0.002%溴酚蓝]中平衡15 min后,再将胶条置于含有2.5%碘乙酰胺的平衡缓冲液中平衡 15 min。最后采用12.5%聚丙烯酰胺凝胶电泳(SDS-PAGE)胶进行双向电泳。
1.4图像扫描及分析
凝胶经考马斯亮蓝染色后,使用扫描仪(Amersham Biosciences)进行图像扫描,最后利用Image Master 2D Platinum Software Version 6.0(Amersham Biosciences)进行处理、分析(包括蛋白点的检测、匹配等),找出各样品凝胶的差异点。在3次重复试验中确保差异点间体积变化均在1.5倍以上。
1.5蛋白质的鉴定
挖取差异蛋白点,分别转入0.5 mL Eppendorf离心管中,通过复旦大学蛋白质组学实验室的4 700串联飞行时间质谱仪[4700 Proteomies Analyzer (TOF/TOFTM) (Applied Biosystems,USA)]进行MALDI-TOF-MS/MS鉴定,所得结果用GPS(Applied Biosystems,USA)-MASCOT(Matrix Science,UK)进行数据库检索。数据库为NCBI绿色植物库;检索的方式为combined,即指纹图谱和串级联合检索;最大允许漏切位点为1;酶为胰蛋白酶;质量误差范围设置:PMF,0.3 u;MS/MS,0.4 u。匹配肽段数目大于2的蛋白将被接受。最后利用NCBI和SWISS-PROT数据库进行蛋白质功能的查询。
2结果与分析
2.1不同年份园参根的蛋白质表达图谱
本研究利用双向电泳技术,重点分析成熟期(5年)、生长期(3年)园参的根蛋白质表达情况(图1),每例样品重复3张胶。本研究得到差异表达的81个蛋白点,它们在不同胶中的相对体积相差1.5倍以上。在5年园参根中有33个蛋白点(5T1~5T33)特异表达,29个蛋白点(5C1~5C29)表达量上调。3年园参根中有5个蛋白点(3T1~3T5)特异表达,14个蛋白点(3C1~3C14)表达量上调。
2.2差异表达蛋白的鉴定
研究表明,不同生长年限园参根的图谱中蛋白质丰度发生改变。其中低丰度蛋白表达不同,而中、高丰度蛋白点分布很相似。有趣的是,在不同年限园参根图谱中,20~30 ku区域内均有8个不同pI值的高丰度蛋白点,经MALDI-TOF/TOF MS分析,为类核糖核酸酶储存蛋白(表1)。据报道,此高丰度蛋白的含量也会随着季节的变化而变化[7],是一类人参生长储存蛋白,为人参在自然环境中生存提供能量。
通过搜索NCBI绿色植物蛋白质数据库,从81个差异蛋白点中成功鉴定52个蛋白(鉴定率64.2%),鉴定结果见表1。
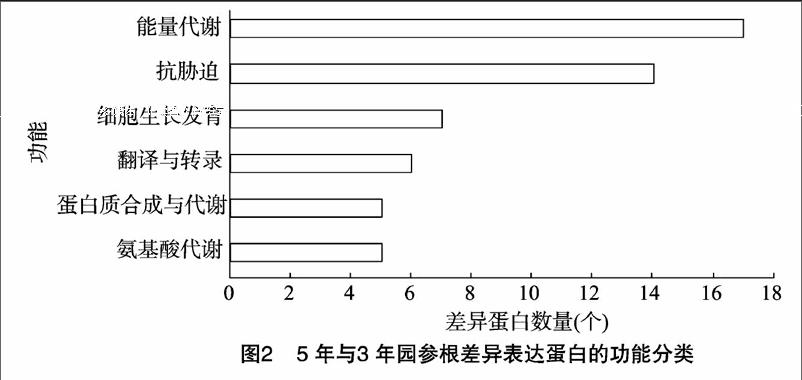
依据GO数据库的描述,将成熟与生长期园参差异表达蛋白按其生物功能分为6类(图2),其中与抗逆、能量代谢相关的蛋白在园参生长发育过程中表达差异明显。
3结论与讨论
蛋白质组学研究方法和技术的发展提供了一种从表达蛋白整体水平揭示生命活动规律的新策略和新思路,为认识园参生长过程中蛋白质组学的改变提供了强有力的研究手段。本研究通过比较不同生长年限园参根的差异表达蛋白,发现其中大多数蛋白质是与抗氧化、抗胁迫及能量代谢相关的酶,这提示园参根由生长到成熟的转变过程中导致抗胁迫、能量代谢相关途径发生改变。
3.1抗胁迫相关蛋白
园参根长年埋于地下,是发生抗逆反应的主要部位。为了对胁迫信号作出相应的应答,随着参龄的增长,园参根内发生一系列抗逆相关蛋白表达上调,以适应不利的环境条件。差异表达中的过氧化氢酶(5T20~ST22) 在5年园参中特异表达。过氧化氢酶是生物体内主要的抗氧化酶类,催化细胞内过氧化氢的分解,从而使细胞免受过氧化氢的毒害[8],保护人参免受氧化胁迫。此外还有一些抗逆相关蛋白表达上调,单脱氢抗坏血酸还原酶(5T15、5C22)在5年园参中也特异表达,它对于维生素C的再生具有重要作用[9]。内质网结合蛋白(5C35~5C37)属于热休克蛋白Hsp70亚家族,对于维持细胞稳态和防止细胞凋亡具有重要作用。在植物体内,内质网结合蛋白可能通过调控内质网上的未折叠蛋白应答、Ca2+信号反应等调节植物的抗旱涝胁迫能力[10-11]。在本研究中还发现一些参与次生代谢相关的酶,它们的表达也会受到胁迫反应的影响,如紫檀碱还原酶(5C17)、异黄酮还原酶(5C18)等在5年园参中表达量高于3年园参,提高了成熟园参的抗胁迫能力。更重要的是此类抗胁迫相关蛋白往往也具有药效作用,如在肿瘤细胞中,内质网结合蛋白的产生与防止凋亡、免疫系统攻击、抗肿瘤药物耐药性产生有关[12]。对此类蛋白的深入研究将为研究园参药效形成机制提供理论依据。
3.2能量代谢相关蛋白
在成熟的园参根中不仅抗胁迫相关蛋白表达量上调,也伴随着与能量代谢相关蛋白的表达差异。植物在抗胁迫过程中体内的代谢途径会发生改变,与能量代谢相关的酶活性的提高可为有利于提高抗逆能力的物质合成提供能量(NADPH2、ATP)。能量代谢与抗胁迫过程的关系密不可分。ATP酶(5C11、5C16)是一种功能性蛋白,在5年园参中表达量上调,它与各种膜体系和细胞器有着广泛联系,同时在能量代谢、物质的吸收与运输等生理功能上具有重要作用。研究表明,低温胁迫会引起质膜ATP酶含量和活性的提高,从而释放出更多能量(以热能形式为主)来抵御低温的侵袭[13]。甘油醛-3-磷酸脱氢酶(5T25、5C21)是糖酵解过程中的重要酶,参与糖酵解过程中第1个ATP的形成。近年来已发现,植物甘油醛-3-磷酸脱氢酶也可被盐、旱、冷、热、缺氧胁迫、缺铁胁迫、植物激素、病菌侵染等多种环境胁迫所诱导表达,参与植物的抗胁迫反应[14]。同时,在本研究中还有一些与能量代谢相关的酶如苹果酸脱氢酶(5T15、5C22)、磷酸甘油酸变位酶(5T7)、稀醇酶(5C13、5C15)等在5年成熟园参中表达量较高。
3.3生长发育相关蛋白
在差异表达蛋白中果胶酯酶(3C8)在3年园参中表达量上调,它作为催化果胶的甲氧酯水解产生果胶酸和甲醇反应的酶,普遍存在于高等植物的不同组织器官中,在细胞壁组成和降解、细胞游离、花粉发育、种子萌发、根尖延伸、种子开裂、果实软化成熟、抗病等方面具有重要作用[15]。在根中,该酶与根边缘细胞的启动有密切的相关性,Wen等关于豌豆的试验表明:果胶酯酶基因表达与根边缘细胞发育有密切的正相关性[16]。本研究发现,果胶酯酶在园参生长阶段的表达量要高于成熟园参,说明该酶在根的伸长过程中发挥着重要的生物学活性。
丝氨酸羟甲基转移酶(5T18)存在于成熟园参根中,而在快速生长期其含量极低或检测不到。丝氨酸羟甲基转移酶在植物的一碳代谢和光呼吸中起着非常重要的作用。已有研究表明,在苹果叶片中丝氨酸羟甲基转移酶参与光合作用,促进叶片的生长,并且只存在于营养生长期的叶片中,而在幼年期的叶片和生殖生长期的叶片中含量极低或检测不到[17]。成熟园参代谢能力增强,需要大量的一碳单位化合物用来合成多种产物,如DNA、RNA、辅酶、甲硫氨酸等,因此丝氨酸羟甲基转移酶表达量增高。由于丝氨酸羟甲基转移酶在植物中有多种重要而又普遍的生理功能,目前围绕它的研究越来越多。
在园参生长发育的过程中,许多酶差异表达。在未来的研究中,以这些差异表达蛋白为研究对象,对认识园参根的生长发育规律、有效利用人参资源有重要意义。
参考文献:
[1]Baeg I H,So S H. The world ginseng market and the ginseng(Korea)[J]. Journal of Ginseng Research,2013,37(1):1-7.
[2]Lin W N,Lu H Y,Lee M S,et al. Evaluation of the cultivation age of dried ginseng radix and its commercial products by using 1H-NMR fingerprint analysis [J]. American Journal of Chinese Medicine,2010,38(1):205-218.
[3]Yun T K,Lee Y S,Lee Y H,et al. Anticarcinogenic effect of Panax ginseng C.A. Meyer and identification of active compounds [J]. Journal of Korean Medical Science,2001,16:6-18.
[4]Wang X Q,Yang P F,Liu Z,et al. Exploring the mechanism of Physcomitrella patens desiccation tolerance through a proteomic strategy [J]. Plant Physiology,2009,149(4):1739-1750.
[5]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[6]Chinnasamy G,Rampitsch C. Efficient solubilization buffers for twodimensional gel electrophoresis of acidic and basic proteins extracted from wheat seeds [J]. Biochimica et Biophysica Acta,2006,1764(4):641-644.
[7]Kim S I,Kweon S M,Kim E A,et al. Characterization of RNase-like major storage protein from the ginseng root by proteomic approach[J]. Journal of Plant Physiology,2004,161(7):837-845.
[8]Mur L A J,Kenton P,Atzorn R,et al. The outcomes of concentration-specific interactions between salicylate and jasmonate signaling include synergy,antagonism,and oxidative stress leading to cell death [J]. Plant Physiology,2006,140(1):249-262.
[9]Liu Y J,Yuan Y,Liu Y Y,et al. Gene families of maize glutathione-ascorbate redox cycle respond differently to abiotic stresses [J]. Journal of Plant Physiology,2012,169(169):183-192.
[10] Gething M J,Sambrook J. Protein folding in the cell [J]. Nature,1992,355(6355):33-45.
[11]Cho E K,Hong C B. Over-expression of tobacco NtHSP70-1 contributes to drought-stress tolerance in plants[J]. Plant Cell Reports,2006,25(4):349-358.
[12]Wang M,Wey S,Zhang Y,et al. Role of the unfolded protein response regulator GRP78/BiP in development,cancer,and neurological disorders[J]. Antioxidants & Redox Signaling,2009,11(9):2307-2316.
[13]Zhang X X,Liu S K,Takano T. Overexpression of a mitochondrial ATP synthase small subunit gene (AtMtATP6) confers tolerance to several abiotic stresses in Saccharomyces cerevisiae and Arabidopsis thaliana[J]. Biotechnology Letters,2008,30(7):1289-1294.
[14]Yang F,Wang Y,Miao L F. Comparative physiological and proteomic responses to drought stress in two poplar species originating from different altitudes[J]. Physiologia Plantarum,2010,139(4):388-400.
[15]Brummell D A,Dal C V,Crisosto C H,et al. Cell wall metabolism during maturation,ripening and senescence of peach fruit [J]. Journal of Experimental Botany,2004,55(405):2029-2039.
[16]Wen F S,Zhu Y M,Hawes M C. Effect of pectin methylesterase gene expression on pea root development[J]. Plant Cell,1999,11(6):1129-1140.
[17]Zeng G J,Li C M,Zhang X Z,et al. Differential proteomic analysis during the vegetative phase change and the floral transition in Malus domestica[J]. Development Growth & Differentiation,2010,52(7):635-644.薛鹏飞,柳鹏福,史吉平,等. 盐单胞菌Fosmid文库构建及群体感应淬灭酶的筛选[J]. 江苏农业科学,2016,44(10):88-91.
