响应面法优化重组大肠杆菌产ADI酶发酵培养基
2015-01-06司海明
张 龙, 司海明, 倪 晔
(江南大学 生物工程学院,江苏 无锡 214122)
响应面法优化重组大肠杆菌产ADI酶发酵培养基
张 龙, 司海明, 倪 晔*
(江南大学 生物工程学院,江苏 无锡 214122)
在单因素优化的基础上,采用响应面分析方法对重组大肠杆菌生产精氨酸脱亚胺酶(ADI)的发酵培养基进行了优化。借助于SAS软件,结合Plackett-Burman和Box-Behnken实验设计对5种培养基组分进行优化。结果表明,最佳培养基组分为胰蛋白胨11.16 g/L,酵母提取物20 g/L,甘油6.3 g/L,磷酸氢二钾16.38 g/L,磷酸二氢钾2.31 g/L。采用优化后的培养基进行摇瓶发酵,ADI酶活达到5.7 U/mL发酵液,比初始培养基(3.72 U/mL发酵液)提高了1.53倍,比LB培养基(2.83 U/mL发酵液)提高了2.01倍。采用优化后的培养基在3 L发酵罐中进行发酵,ADI酶活达到15.17 U/mL发酵液,较LB培养基(4.32 U/mL发酵液)提高了3.51倍。
大肠杆菌;培养基优化;ADI酶活;响应面
肝细胞癌(Hepatocellular carcinoma,HCC)是世界第五大常见恶性肿瘤,死亡率极高,肝癌晚期病人平均存活率仅为1~4个月[1-2]。由于化疗效果较差,目前迫切的需要另一种有效的治疗方法。肝癌细胞是精氨酸营养缺陷型细胞,由于缺少精氨琥珀酸合成酶(Arginine succinate synthetase,ASS)必须从环境中获取精氨酸以供生长[3-4]。精氨酸脱亚胺酶(Arginine deiminase,ADI,EC3.5.3.6)能将L-精氨酸不可逆地水解为L-瓜氨酸和氨,从而切断肿瘤细胞的精氨酸供给,来达到消灭或抑制肿瘤细胞生长的作用,而正常细胞可以自身合成精氨酸不受影响[3,5,8]。这种“精氨酸剥夺疗法”治疗精氨酸营养缺陷型癌症具有广泛的研究前景。近年来,PEG化修饰重组ADI以其良好的疗效和较低的副作用已得到了广泛关注,美国凤凰公司研发的ADI-PEG-20针对治疗肝癌临床试验已经进行至第Ⅲ期[6-7]。除了肝细胞癌外,ADI还可以用于治疗黑素瘤、白血病、乳腺癌和胃癌等疾病[9-12]。
ADI广泛存在于细菌、古细菌和真核细胞中,自从 1933年 F.Horn首次报道了绿脓假单胞菌(Bacillus pyocyaneus)中含有ADI后[13],之后很多来源于不同微生物的ADI相继被报道,其中包括假单胞菌[8,14-16]、支原体[5,17]、盐杆菌[18]和乳球菌[19]等。 不同微生物来源的ADI在酶活及性质方面也有所不同,比酶活范围从5.4~140.3 U/mg,最适反应pH 5.6~7.6。
作者所在研究室前期从自然界筛选得到一株产 ADI的 变 形 假 单 胞 菌 (Pseudomonas plecoglossicida)[8],通过对其进行蛋白质工程改造,获得了一株在生理中性pH下具有高比酶活和改良酶学性质的ADI优势突变株M13-3[20-21]。大肠杆菌通常采用LB培养基进行发酵,但是LB培养基往往发酵效率低,成本高,不适合大规模培养。作者对实验室前期构建的重组表达ADI突变株M13-3的大肠杆菌的发酵培养基进行优化,以LB培养基为对照培养基,在单因素优化实验的基础上,对确定的5种培养基组分使用响应面方法 (Response Surface Methodology,RSM)进行优化,采用多元二次回归方程拟合实验因子(培养基组分的浓度)与响应值(每毫升发酵液中ADI酶活)的关系,分析各组分的最优浓度,进一步提高发酵液中ADI酶活[22-25]。
1 材料与方法
1.1 菌种
基因工程菌E.coli BL21(DE3)/pET24a-adi菌株:作者所在实验室保藏。
1.2 培养基
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。经过单因素优化实验,确定初始发酵培养基组分为:胰蛋白胨16 g/L,酵母提取物20 g/ L,甘油10 g/L,磷酸氢二钾12.54 g/L,磷酸二氢钾2.31 g/L。
1.3 培养方法
1.3.1 菌种活化将菌种甘油管接种于30 mL LB培养基中,37℃活化10 h。
1.3.2 摇瓶培养方法将经过活化的菌液按4%的转接体积分数加入到发酵培养基中,于37℃下培养,当菌浓OD600达到0.6~0.8时,加入终浓度0.2 mmol/L的IPTG进行诱导,转速为200 r/min,30℃培养6 h。
1.3.3 3 L发酵罐发酵将活化种龄为6 h的菌液按2%的体积分数接入3 L发酵罐中,搅拌转速300 r/min,通气量为4 vvm,37℃下培养至菌株生长对数初期,加入终浓度为0.2 mmol/L的IPTG并在30℃下发酵。
1.4 ADI酶活测定
ADI酶活测定:采用作者所在研究室建立的改良的二乙酰一肟-硫胺脲法[20]。酶活力单位定义:37℃条件下,每分钟转化1 μmol精氨酸盐酸盐生成瓜氨酸所需的酶量定义为1 U。
1.5 Plackett-Burman试验设计
Plackett-Burman(PB)设计法是一种基于各因子两水平的试验设计方法,通过比较因子间两水平的差异和整体的差异来确定因子的显著性。根据文献及实验的实际情况,采用SAS软件设计实验次数N=12的实验方案,对初始发酵培养基的5种因子进行考察,每个因子取两水平,低水平为初始值,高水平为低水平的1.5倍,响应值为每毫升发酵液中ADI的酶活(三组平行实验均值)。
1.6 最陡爬坡试验
根据PB试验得出的结果,可以确定显著因子的爬坡方向,设计N=6的爬坡实验,确定响应面实验的中心点,即0水平值。
1.7Box-Behnken试验
以胰蛋白胨、甘油、磷酸氢二钾3个因子为自变量,以实验中心点确定三因子的三个水平,即-1,0,1水平值。以ADI酶活为响应值,采用Box-Behnken(BBD)设计并与响应面分析相结合,来探索培养基中关键因素的最优质量浓度。共有15个实验点,其中析因点12个,中心点3个,每组实验重复3次。
1.8 模型拟合与验证
对BBD试验所获得的实验数据与响应面模型进行拟合分析,确定回归方程的极值点及相应的自变量取值,并进行摇瓶验证实验,重复3次。根据摇瓶验证结果进行3 L发酵罐放大验证实验,验证模型的可靠性,最终确定优化结果。
2 结果与分析
2.1 Plackett-Burman试验设计筛选重要实验因子
在单因素优化实验结果的基础上,对培养基的5种组分进行PB重要性筛选,使用SAS软件设计12组实验,每组同时做3个平行实验,取ADI酶活的平均值作为响应值,实验设计与响应值结果见表1。显著性分析、因素水平取值及方差分析见表2。
根据表2的结果,根据统计学原理分析响应值及其回归方程系数,分析显著性结果,显示胰蛋白胨(X1)、甘油(X3)和磷酸氢二钾(X5)这三种成分是影响ADI酶活的主要因素(Prob>F值<0.05),同时模型方差分析的可信度R2=0.974 3,证明该模型显著性极高。

表1 Plackett-Burman试验因素设计及响应值Table 1 Experimental design and response values of Plackett-Burman(N=12)
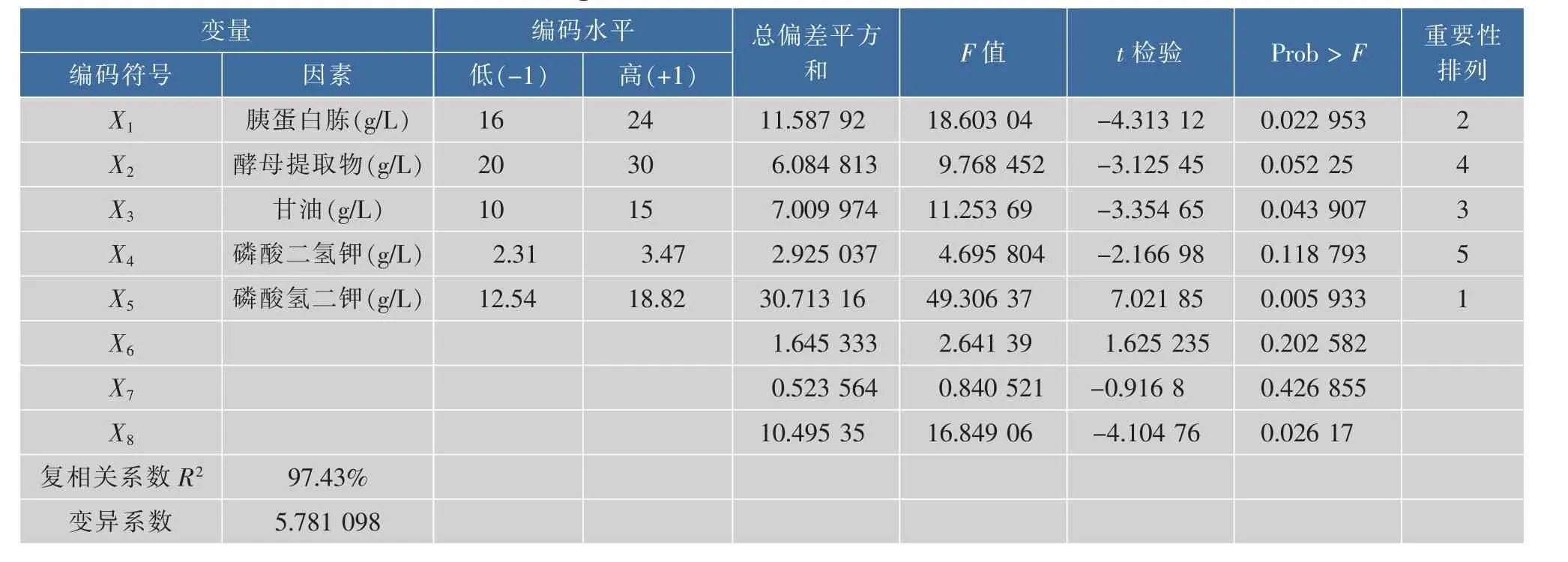
表2 Plackett-Burman实验因素水平及方差分析Table 2 Range of values of Plackett-Burman and ANOVA
由表2中t检验值的大小得出,胰蛋白胨和甘油对ADI酶活具有负效应,而磷酸氢二钾具有正效应,并对胰蛋白胨、甘油、磷酸氢二钾三个因素进行下一步实验。
2.2 最陡爬坡试验
对PB试验结果确定的三种显著性实验因素进行爬坡实验,使其浓度尽量靠近最佳水平值区域,从而增加响应面试验的准确性与显著性。最陡爬坡试验以各试验因子低水平值为起点,以效应水平作为爬坡方向,由于胰蛋白胨和甘油负效应明显,质量浓度应相应降低;磷酸氢二钾响应值为正,质量浓度应该增加。根据这三个因素效应的大小决定其变化步长及方向,以其低水平为各自起点,其他变量也同时取相应低水平,实验设计及结果见表3。
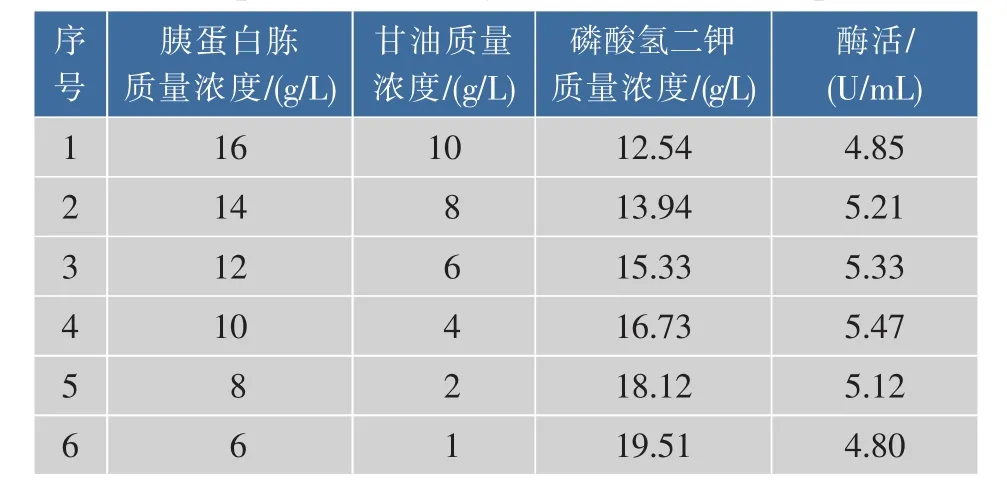
表3 最陡爬坡试验设计及结果Table 3 Experimental design and results of steepest ascent
由结果可见,酶活最高值在第3组与第4组实验之间,并且第4组的产量较之更高,所以作者以第4组的条件作为最佳因素质量浓度的组合并作为下一步中响应面试验的中心点,即胰蛋白胨10 g/L、甘油4 g/L、磷酸氢二钾16.73 g/L。
根据上述结果,确定三种实验因素的三水平值,实验标号及水平值见表4。
2.3 Box-Behnken试验设计及结果分析
Box-Behnken是基于三水平的二阶试验设计,是较为优化的中心组合设计方法,与其他方法相比,实验次数较少,效率较高。根据BBD的中心组合设计并与响应面分析相结合,以发酵液中ADI酶活为响应值,设计15组实验来进一步优化胰蛋白胨、甘油、磷酸氢二钾这三个显著因素的质量浓度,培养基其他组分质量浓度与初始培养基相同。15组实验中,12组为析因点实验,3组为中心点实验,每组均做3个平行实验,结果取平均值,实验设计及结果见表5。
表4 Box-Behnken实验因素及水平
Table 4 Experimental variables and levels for Box-Behnken design
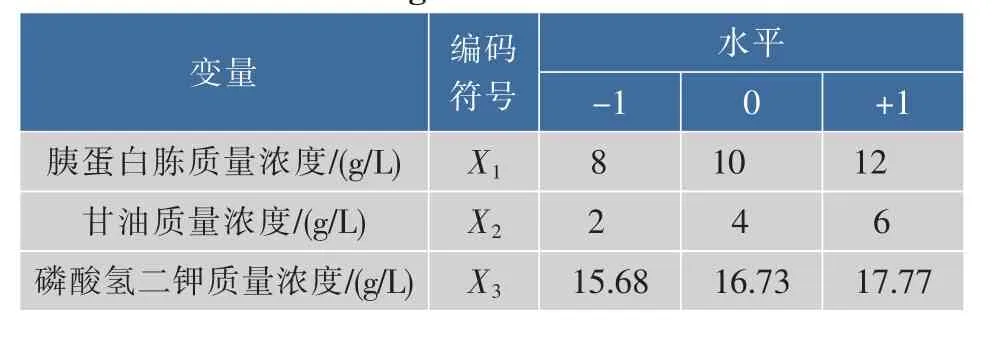
变量 编码符号水平-1 0胰蛋白胨质量浓度/(g/L) 8 X1 10 12甘油质量浓度/(g/L) X2 2 4 +1 X3磷酸氢二钾质量浓度/(g/L) 15.68 16.73 6 17.77
使用SAS软件对BBD设计的实验结果进行方差分析及多元二阶模型拟合,方差分析结果见表6。结果表明,F值(5.05)反应了总模型方程具有较显著的效应,复相关系数R2值是0.901,说明实验数据对于实验模型拥有很高的拟合程度,变异系数CV值为7.49,证明该方程真实反应了实验数据。对实验模型进行二阶回归拟合,得到回归方程为:


表5 Box-Behnken实验设计及结果Table 5 Design and results of Box-Behnken

表6 回归方程分析Table 6 Analysis of variance(ANOVA)for the quadratic model
根据上述回归分析结果绘制相应三维曲面图,见图1~图3。作为确定各因素最优浓度的依据也可以直观地看出两种试验因子的相互作用关系。在试验质量浓度范围内,三种试验因子之间并没有明显的相互关系,从表6的交互项显著性值(prob>F值>0.1)也可得知。但是模型存在最优的极值条件,即在相应曲面的最高点处。
对回归方程求解,分别求出极值点为X1=0.578 6,X2=1.153 1,X3=-0.330 5,对应的实验组分质量浓度为胰蛋白胨11.157 2 g/L,甘油6.306 2 g/L,磷酸氢二钾16.379 6 g/L,预测最大酶活可以达到6.14 U/mL发酵液。
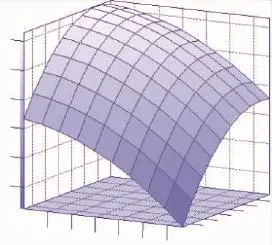
图1 ADI酶活与胰蛋白胨(X1)和甘油(X2)的关系(X3=0)Fig.1 Response surface plot of the combined effect of tryptone(X1)and glycerol(X2)on ADI activity(Y)
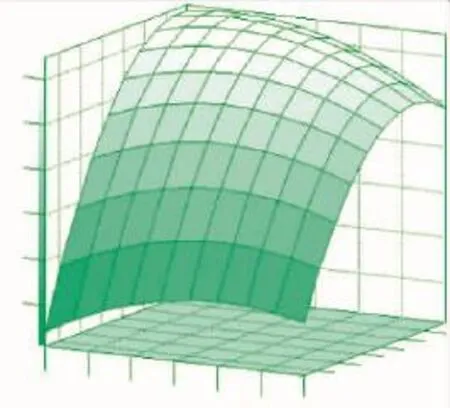
图2 ADI酶活与胰蛋白胨(X1)和磷酸氢二钾(X3)的关系(X2=0)Fig.2 Response surface plot of the combined effect of tryptone(X1)and K2HPO4(X3)on ADI activity(Y)
2.4 验证实验
以实验因子的最优质量浓度对模型进行验证实验,最优培养基组分为胰蛋白胨11.16 g/L,酵母提取物20 g/L,甘油6.3 g/L,磷酸氢二钾16.38 g/L,磷酸二氢钾2.31 g/L。结果表明,优化后培养基经摇瓶发酵,ADI酶活达到5.7 U/mL发酵液,比初始培养基(3.72 U/mL发酵液)提高了1.53倍,比LB培养基(2.83 U/mL发酵液)提高了2.01倍。对比模型预测最大响应值即ADI酶活为6.14 U/mL发酵液,故预测值与实际值的误差是-5.7%。该结果表明,经过响应面设计优化后的产ADI的最优培养基是有效可行的。

图3 ADI酶活与甘油(X2)和磷酸氢二钾(X3)的关系(X1=0)Fig.3 Response surface plot of the combined effect of glycerol(X2)and K2HPO4(X3)on ADI activity(Y)
根据摇瓶验证实验的结果进行3 L发酵罐验证实验,进一步验证模型的可靠性。发酵10 h后,LB培养基中ADI酶活达到最大值,为4.32 U/mL发酵液;而采用优化后培养基发酵10 h后,ADI酶活最大值为15.17 U/mL发酵液,提高了3.51倍,见图4。

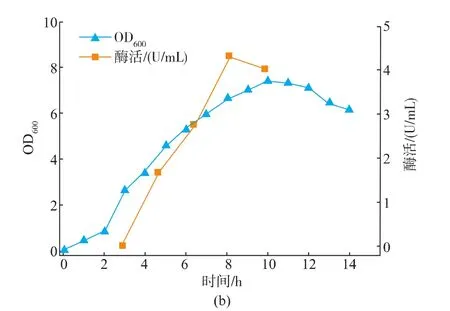
图4 3 L发酵罐中采用RSM优化后培养基(a)和LB培养基(b)发酵产重组ADI的时间进程曲线Fig.4 Comparison of recombinant ADI fermentation using RSM optimized medium (a)and LB medium(b)
3 结语
通过PB试验筛选显著影响因子,并结合响应面试验分析,确定了重组大肠杆菌发酵产ADI酶的最佳培养基配方为胰蛋白胨11.16 g/L,酵母提取物20 g/L,甘油6.3 g/L,磷酸氢二钾16.38 g/L,磷酸二氢钾2.31 g/L。采用优化后的培养基,摇瓶发酵产ADI的酶活达到5.7 U/mL发酵液,比初始培养基和LB培养基摇瓶发酵分别提高了1.53倍和2.01倍;而在3 L发酵罐中的ADI酶活进一步提高到15.17 U/mL发酵液。本研究结果证明:采用响应面方法对培养基进行优化以提高重组大肠杆菌产ADI酶是有效可行的。
[1]Izzo F,Marra P,Beneduce G,et al.Pegylated arginine deiminase treatment of patients with unresectable hepatocellular carcinoma:results from phase I/II studies[J].Journal of Clinical Oncology,2004,22(10):1815-1822.
[2]Whang-Peng J,Cheng A L,Hsu C,et al.Clinical development and future direction for the treatment of hepatocellular carcinoma [J].Journal of Experimental&Clinical Medicine,2010,2(3):93-103.
[3]Ni Y,Schwaneberg U,Sun Z.Arginine deiminase,a potential anti-tumor drug[J].Cancer Letters,2008,261(1):1-11.
[4]Ensor C M,Holtsberg F W,Bomalaski J S,et al.Pegylated arginine deiminase(ADI-SS-PEG20,000 mw)inhibits human melanomas and hepatocellular carcinomas in vitro and in vivo[J].Cancer Research,2002,62(19):5443-5450.
[5]Takaku H,Matsumoto M,Misawa S,et al.Anti-tumor activity of arginine deiminase from Mycoplasma arginini and its growth-inhibitory mechanism[J].Jpn J Cancer Res,1995,86(9):840-846.
[6]Glazer E S,Piccirillo M,Albino V,et al.Phase II study of pegylated arginine deiminase for nonresectable and metastatic hepatocellular carcinoma[J].Journal of Clinical Oncology,2010,28(13):2220-2226.
[7]Shen L J,Shen W C.Drug evaluation:ADI-PEG-20--a PEGylated arginine deiminase for arginine-auxotrophic cancers[J]. Current Opinion in Molecular Therapeutics,2006,8(3):240-248.
[8]Liu Y,Sun Z,Ni Y,et al.Isolation and identification of an arginine deiminase producing strain Pseudomonas plecoglossicida CGMCC2039[J].World Journal of Microbiology and Biotechnology,2008,24(10):2213-2219.
[9]Ascierto P A,Scala S,Castello G,et al.Pegylated arginine deiminase treatment of patients with metastatic melanoma:results from phase I and II studies[J].Journal of Clinical Oncology,2005,23(30):7660-7668.
[10]Gong H,Zolzer F,Von Recklinghausen G,et al.Arginine deiminase inhibits proliferation of human leukemia cells more potently than asparaginase by inducing cell cycle arrest and apoptosis[J].Leukemia,2000,14(5):826-829.
[11]Park H,Lee J,Shim Y,et al.Arginine deiminase enhances MCF-7 cell radiosensitivity by inducing changes in the expression of cell cycle-related proteins[J].Molecules and Cells,2008,25(2):305-311
[12]Kim J E,Kim S Y,Lee K W,et al.Arginine deiminase originating from Lactococcus lactis ssp.lactis american type culture collection (ATCC)7962 induces G1-phase cell-cycle arrest and apoptosis in SNU-1 stomach adenocarcinoma cells[J].British Journal of Nutrition,2009,102(10):1469-1476.
[13]Horn F.The breakdown of arginine to citrulline by Bacillus pyocyaneus[J].Hoppe-Seyler’s Z Physiol Chem,1933,216:244-247.
[14]Shibatani T,Kakimoto T,Chibata I.Enzymatic production of L-citrulline by Pseudomonas putida[J].Appl Microl,1972,22(6):992-999.
[15]Shibatani T,Kakimoto T,Chibata I.Crystatllization and properties of L-arginine deiminase of Pseudomonas putida[J].J Biol Chem,1975,250(12):4580-4583.
[16]Galkin A,Kulakova L,Sarikaya E,et al.Structural insight into arginine degradation by arginine deiminase,an antibacterial and parasite drug target[J].J Biol Chem,2004,279(14):14001-14008
[17]Takaku H,Takase M,Abe S,et al.In vivo anti-tumor activity of arginine deiminase purified from Mycoplasma arginine[J].Int J Cancer,1992,51(2):244-249.
[18]Monstadt G M,Holldorf A W.Arginine deiminase from halobacterium salinarium.purification and properties[J].Biochem J,1991,273(Pt 3):739-745.
[19]Kim J E,Jeong D W,Lee H J.Expression,purification,and characterization of arginine deiminase from Lactococcus lactis ssp. lactis ATCC 7962 in Escherichia coli BL21[J].Protein Expr Purif,2007,53(1):9-15.
[20]Ni Y,Li Z,Sun Z,et al.Expression of arginine deiminase from Pseudomonas plecoglossicida CGMCC2039 in Escherichia coli and its anti-tumor activity[J].Current Microbiology,2009,58(6):593-598.
[21]Ni Y,Liu Y,Schwaneberg U,et al.Rapid evolution of arginine deiminase for improved anti-tumor activity[J].Applied Microbiology and Biotechnology,2011,90(1):193-201.
[22]郝学财,余晓斌,刘志钰,等.响应面方法在优化微生物培养基中的应用[J].食品研究与开发,2006,27(1):38-41.
HAO Xuecai,YU Xiaobin,LIU Zhiyu,et al.The application of response surface methodology in optimization of microbial media [J].Food Research and Development,2006,27(1):38-41.(in Chinese)
[23]段学辉,颜淑芳,彭云召,等.响应面法优化灰绿青霉Penicillium glaucum NS16产酶条件[J].食品与生物技术学报,2010,29(3):464-470.
DUAN Xuehui,YAN Shufang,PENG Yunzhao,et al.Optimization of fermentation condition for cellulose-producin Penicillium glaucum NS 16 by response surface methodology[J].Journal of Food Science and Biotechnology,2010,29(3):464-470.(in Chinese)
[24]黄雪莲,于新.响应面优化绿色木霉菌培养基[J].食品与生物技术学报,2011,30(5):740-744.
HUANG Xuelian,YU Xin.Optimization of medium of Trichoderma viride using response surface methodology[J].Journal of Food Science and Biotechnology,2011,30(5):740-744.(in Chinese)
[25]Chen X,Tang L,Li S,et al.Optimization of medium for enhancement of ε-Poly-L-Lysine production by Streptomyces sp.M-Z18 with glycerol as carbon source[J].Bioresource Technology,2011,102(2):1727-1732.
Fermentation Medium Optimization for Arginine Deiminase Production from Recombinant Escherichia coli by Response Surface Methodology
ZHANG Long, SI Haiming, NI Ye*
(School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Response surface methodology was used to optimize the fermentation medium of recombinant E.coli for arginine deiminase production on the basis of single factor optimization. Five medium factors were optimized by SAS software combined with Plackett-Burman and Box-Behnken design.The optimized fermentation medium contains 11.16 g/L tryptone,20 g/L yeast extract,6.3 g/L glycerol,16.38 g/L K2HPO4,and 2.31 g/L KH2PO4.Using the optimized medium,the activity of ADI reached 5.7 U/mL broth,which was 1.53-fold higher than that of in the initial medium (3.72 U/mL)and 2.01-fold of that in LB medium (2.83 U/mL).In a 3-L bioreactor,ADI activity of 15.17 U/mL broth was attained using optimized medium,which was remarkably enhanced compared with that of LB medium(4.32 U/mL).
Escherichia coli,medium optimization,arginine deiminase,response surface
TQ 920.1
A
1673—1689(2015)05—0475—07
2014-02-27
国家自然科学基金项目(30900030;21276112);国家973计划项目 (2011CB710800);教育部新世纪优秀人才支持计划项目(NCET-11-0658)。
*通信作者:倪 晔(1975—),女,江苏无锡人,工学博士,教授,硕士研究生导师,主要从事生物催化和酶工程等方面的研究。
E-mail:yni@jiangnan.edu.cn
