枯草芽孢杆菌产过氧化氢酶的优化与工业化
2015-01-06曹汶龙郭娅琼堵国成
曹汶龙, 郭娅琼, 康 振, 堵国成*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
枯草芽孢杆菌产过氧化氢酶的优化与工业化
曹汶龙1,2, 郭娅琼1,2, 康 振1,2, 堵国成1,2*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
为了实现过氧化氢酶的工业化生产,作者对实验室前期构造成功的B.subtilis WSHDZ-01(pSTOP1622-katA)进行了3 L发酵罐的发酵验证,并且通过数据分析优化了碳氮源浓度,使得过氧化氢酶酶活达到35 398 U/mL,比优化前提高53.41%。在此基础上,分别进行了24 L发酵罐和500 L发酵罐的放大实验,最高酶活分别达到28 940、23 190 U/mL。结果表明,该过氧化氢酶在产酶水平上已经达到工业化生产需求,为更大规模的工业化生产奠定坚实的基础。
枯草芽孢杆菌;过氧化氢酶;优化;放大实验
过氧化氢酶(Hydrogen peroxide oxidoreductase,编号EC 1.11.1.6.)又称触媒(Catalase),简称CAT,是广泛存在于动植物以及微生物体内的一类末端氧化酶。生物在演化过程中逐步建立起的防御系统中,CAT就是关键酶之一[1]。CAT的生物学功能是促使过氧化氢(H2O2)分解为分子氧和水,从而防止机体的过氧化,使细胞免于H2O2的毒害[2]。
过氧化氢酶是一种催化效率非常高的生化酶,在临床、医药、纺织等行业具有广泛的用途。在临床分析中,CAT对研究肿瘤发病机理、自由基代谢失衡和抗衰老以及鉴别诊断某些疾病具有重要意义[3]。在医药行业,由于H2O2具有杀菌、清洁、漂白及消毒的功效,常被用于器械消毒,如在隐形眼镜消毒过程中添加CAT可分解消毒液中残留的H2O2;在纺织工业中,传统的工艺消耗大、污染大[4-5],利用CAT能快速除去H2O2,可以省去清洗步骤或只需一次冷水洗涤即可。这样既节约能源、保护环境,又保证了纺织物的质量。
尽管过氧化氢酶具有高效、环保、处理效果显著等优点,但是其高昂的价格、在工业应用中容易失活等问题依旧阻碍着其在纺织工业中的大规模应用。为了更好地在工业中应用,一方面需要提高发酵水平以降低成本,另一方面考虑到纺织加工处理的工艺条件,需要开发出更加适应高温和碱性条件的过氧化氢酶用于过氧化氢漂白的后处理[6]。
为了克服上述的困难,在之前的研究中,江南大学生物系统与生物加工工程实验室筛选出一株耐热、耐碱CAT的高产菌株B.subtilis WSHDZ-01[7],利用基因重组技术成功克隆了B.subtilis WSHDZ-01菌株的 CAT基因序列,并将其在 B.subtilis WSHDZ-01中过量表达,最终获得了一株高产CAT的枯草芽孢杆菌工程菌。
在本研究中,为了提高CAT的产量,并且将其进行工业化生产,我们在实验室摇瓶发酵研究的基础上,考察影响CAT产量的关键因素,对发酵过程以及培养基碳氮源浓度进行进一步优化,逐级进行放大生产实验,利用实验室3 L发酵罐 (型号BioFlo/CelliGen 115,美国NBS公司生产)进行发酵,摸索最优化条件,并在宜兴协联化学有限公司进行24 L和500 L发酵放大实验,使CAT产量最终达到工业化生产的要求。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒枯草芽孢杆菌WSHDZ-01:产过氧化氢酶菌株,由作者所在实验室筛选得到,作为代谢工程改造菌及发酵宿主。穿梭质粒pstop1622[8]:由德国布伦瑞克大学构建并馈赠,用于重组质粒的构建以及过氧化氢酶基因的表达。
1.1.2 培养基
1)斜面培养基:6°P麦芽汁,琼脂1.5~2.0 g/dL,pH 7.5。
2)种子培养基:6°P麦芽汁,pH 7.5。
3)基本发酵培养基(g/L):葡萄糖 10,NaNO35,MgSO4·7H2O 0.5,Na2HPO49.52,KH2PO40.6,FeSO4· 7H2O 0.002 5;pH自然。
根据需要在培养基中添加四环素至终质量浓度为10 μg/mL。
1.2 方法
1.2.1 培养方法B.subtilisWSHDZ-01(pSTOP1622-katA)经摇瓶种子培养基 (25 mL/250 mL)于37℃、200 r/min活化,12 h后以5%的接种体积分数转接到摇瓶基本发酵培养基中 (25 mL/250 mL),37℃、200 r/min培养56 h(OD600nm=1.0时加入0.5 g/dL木糖进行诱导),测定CAT活性。
3 L发酵罐培养:重组菌按照上述方法培养,菌液转入(5%接种体积分数)发酵罐(3 L罐装液1.8 L)。通气量为1.0 vvm,搅拌转速400 r/min,37℃培养(OD600nm=1.0时加入0.5 g/dL木糖进行诱导),pH不作控制。
24 L发酵罐(宜兴协联生物化学有限公司自行设计)培养:重组菌按照上述方法培养,菌液转入(1%接种体积分数)24 L发酵罐中发酵 (装液量60%)。空气通入量为1.0 vvm,搅拌转速400 r/min,37℃培养 (溶氧反弹时加入0.5 g/dL木糖进行诱导),pH不作控制。
500 L发酵罐 (宜兴协联生物化学有限公司自行设计)培养:重组菌按照上述方法培养,菌液转入(1%接种体积分数)24 L发酵罐中(60%装液量),37℃发酵培养12 h,空气通入量为1.0 vvm,搅拌转速150 r/min,12 h后将全部种子液转入500 L发酵罐中,空气通入量为1.0 vvm,搅拌转速150 r/min,37℃培养 (溶氧反弹时加入0.5 g/dL木糖进行诱导),pH不作控制。
1.2.2 CAT检测方法取一定量发酵液,4℃下12 000 r/min离心10 min,获得的上清液作为胞外CAT的测定用样品。
37℃条件下采用分光光度法测定CAT活性,反应体系为3 mL。将0.1 mL待测酶液样品快速加入到 2.9 mL含 10 mmol/L H2O2的 50 mmol/L KH2PO4-K2HPO4缓冲液(pH 7.0)中,用UV-2450型紫外-可见光分光光度计于240 nm处测定H2O2的分解速率。酶活定义为:37℃下每分钟分解1 μmol H2O2所需酶量为一个酶活单位。
1.2.3 理化参数检测方法适当加水稀释发酵液,通过比浊法[9]测定其吸光度值OD600nm,从而确定菌体浓度。
还原糖含量测定采用3,5-二硝基水杨酸法[10]。
硝酸盐含量测定采用紫外分光光度法[11]。首先将样品在25 mL具塞比色皿中适当稀释,然后加入0.5 mL浓度为0.1 mol/L盐酸,分别测定275 nm和220 nm处的吸光度值。A=A220nm-A275nm,求得吸光度的校准值后,从校准曲线中查得相应的硝酸盐浓度,响应数值乘以稀释倍数即得所测样品的硝酸盐含量。
2 结果与分析
2.1 B.subtilisWSHDZ-01(pSTOP1622-katA1672)3 L发酵罐发酵验证
为了实现直接将工程菌放大至工业化生产,研究 采 用 B.subtilis WSHDZ-01 (pSTOP1622-katA1672)作为出发菌株,进行发酵罐培养条件其产酶情况进行验证。采用基本发酵培养基组分,装液量60%,通气量1.0 vvm,转速400 r/min,37℃下发酵56 h(溶氧反弹时加入0.5 g/dL木糖进行诱导),间隔4 h取样测定CAT活性。胞外CAT最高活性出现在48 h,可达23 074 U/mL。通过分析发酵过程中菌体浓度、CAT活力、残糖等参数之间的关系见图1。发酵进行12 h后培养基中葡萄糖基本耗完,菌浓无法上升,从而限制了CAT活性的进一步提高。提高菌体浓度可能会对提高酶活有一定的影响,因此设想提高初始碳氮源质量浓度可提高CAT的产量。
2.2 B.subtilisWSHDZ-01(pSTOP1622-katA1672)3 L发酵罐碳源质量浓度控制
3 L发酵罐发酵验证得到的数据变化见图2。菌体在生长过程中快速消耗了大量的葡萄糖,发酵进行12 h后,培养基中葡萄糖基本耗完,葡萄糖质量浓度过低限制了菌体的生长以及氮源的利用。
因此,可以通过增加初始培养基中碳氮源的质量浓度,让菌体在初始阶段大量增殖,而菌体在后期葡萄糖贫乏的条件下更好地利用氮源产生CAT。因此我们采取的策略是维持其他组分及含量不变,使培养基中碳氮源加倍,3 L发酵罐相同发酵条件下培养56 h,测定CAT的产生情况。结果显示,培养基中碳氮源加倍后胞外CAT的活性大幅上升,48 h时达35,398 U/mL,与单倍碳氮源发酵相比提高53.41%。

图1 B.subtilis WSHDZ-01(pSTOP1622-katA1672)3 L罐发酵参数分析Fig.1 Analysis of B.subtilis WSHDZ-01 (pSTOP1622-katA1672)in a 3 L stirred tank reactor

图2 3 L罐碳氮源加倍发酵参数分析Fig.2 Extracellular CAT activity of B.subtilis WSHDZ-01(pSTOP1622-katA1672)in a 3 L stirred tank reactor with doubled carbon-nitrogen source
2.3 B.subtilisWSHDZ-01(pSTOP1622-katA1672)24 L发酵罐发酵验证
在实验室水平下,B.subtilis WSHDZ-01(pSTOP1622-katA1672)在3 L发酵罐的酶活高达35 398 U/mL,已经具备了工业化生产的潜力。因此,我们在宜兴协联化学有限公司进行了逐级放大实验。首先在24 L发酵罐中对B.subtilis WSHDZ-01(pSTOP1622-katA1672)进行发酵。发酵结果见图3。在双倍碳氮源条件下,24 L发酵罐中酶活达到28 940 U/mL,而且通过OD600的数值可以发现,在24 L发酵罐中菌体生长状况不是很好,最高菌浓仅为3 L发酵罐的62.7%,原因可能是在24 L发酵罐中所使用的化学试剂均为工业级,相比实验室分析纯的试剂在纯度上有一定的差距,才导致菌体生长状况不是很好。虽然菌浓不高,但是菌体产酶效率很高,最高酶活为3 L发酵罐的81.7%。已基本满足工业化的生产需求。
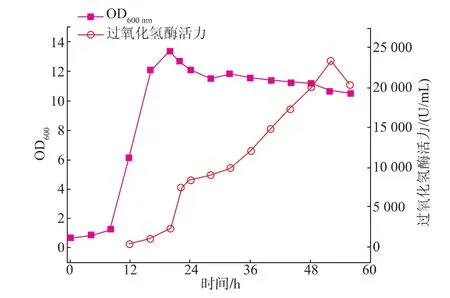
图3 B.subtilis WSHDZ-01(pSTOP1622-katA1672)24 L罐发酵参数分析Fig.3 Analysis of B.subtilis WSHDZ-01(pSTOP1622-katA1672)in 24 L stirred tank reactor
2.4 B.subtilisWSHDZ-01(pSTOP1622-katA1672)500 L发酵罐发酵验证
在24 L发酵罐实验取得成功后,我们继续尝试在500 L发酵罐中进行发酵验证实验,结果见图4。可以看出,在500 L发酵罐中,菌体的延迟期增长,对数生长期缩短,最后导致菌体生长到最高菌浓所需时间有了一定的延后,从而致使酶活最高点出现在52 h处,达到23 190 U/mL,是24 L发酵罐最高酶活的80.1%。从上述规律可以看出,随着罐体体积的增加,酶活产量有一定的下降趋势,发酵周期有所延长,但酶活产量水平已经达到了工业化的生产要求。
3 结语
近年来,随着过氧化氢酶在纺织、造纸、制浆等行业的普遍应用,市场对过氧化氢酶的需求也呈大幅增长趋势。尤其是在棉织物的前处理工艺中,过氧化氢酶起着重要的作用,纺织热漂步骤中使用过氧化氢酶是实现纺织工业节能减排和可持续发展的有效方法。目前商品化过氧化氢酶的价格较高,温度和pH耐受范围较低,这些都制约着过氧化氢酶在纺织工业的大规模应用。
作者验证了B.subtilis WSHDZ-01(pSTOP1622-katA1672)在3 L发酵罐中有着优良的产酶能力,并且通过优化碳氮源浓度使得酶活有了大幅度的提升。作者还在24 L发酵罐和500 L发酵罐中进行了放大实验,发现该菌株在工业化条件下产酶性能依然优良,为工业化大规模生产奠定了坚实的基础。虽然本研究在产量方面达到了工业化的生产要求,但是仍有一些不足,比如从3 L发酵罐扩大到500 L发酵罐,酶活呈下降的趋势,其工业化生产的发酵工艺仍有待进一步的研究优化,除此之外,今后的研究还可以围绕提高过氧化氢酶的耐热性以及耐碱性展开,以提高其在工业中的应用性能。
[1]Sendur OF,Turan Y,Tastaban E,et al.Antioxidant status in patients with osteoporosis:a controlled study[J].Joint Bone Spine,2009,76(5):514-518.
[2]Cabiscol E,Tamarit J,Ros J.Oxidative stress in bacteria and protein damage by reactive oxygen species[J].International Microbiology,2010,3(1):3-8.
[3]Usui S,Komeima K,Lee S Y,et al.Increased expression of catalase and superoxide dismutase 2 reduces cone cell death in retinitis pigmentosa[J].Molecular Therapy,2009,17(5):778-786.
[4]Gudelj M,Fruhwirth G,Paar A,et al.A catalase-peroxidase from a newly isolated thermoalkaliphilic Bacillus sp.with potential for the treatment of textile bleaching effluents[J].Extremophiles,2001,5(6):423-429.
[5]冷晒祥,钱国坻,华兆哲,等.过氧化氢酶的棉针织物漂染工艺研究[J].印染,2006,32(19):1-3.
LENG Shaixiang,QIAN Guodi,GUA Zhaozhe,et al.Catalase for H2O2removal after cotton knits bleaching[J].Dyeing& Finishing,2006,32(19):1-3.(in Chinese)
[6]张东旭,堵国成,陈坚.微生物过氧化氢酶的发酵生产及其在纺织工业的应用[J].生物工程学报,2010,26(11):1473-1481.
ZHANG Dongxu,DU Guocheng,CHEN Jian.Fermentation production of microbial catalase and its application in textile industry [J].Chinese Journal of Biotechnology,2010,26(11):1473-1481.(in Chinese)
[7]姚丹丹,刘立明,李江华,等.活性氧胁迫促进枯草芽孢杆菌WSHDZ-01过量合成过氧化氢酶[J].生物工程学报,2009,25(5):786-792.
YAO Dandan,LIU Liming,LI Jianghua,et al.Overproduction of catalove by oxidative stress on Bacillus subtilis WSHDZ-01[J]. Chinese Journal of Biotechnology,2009,25(5):786-792.(in Chinese)
[8]Biedendieck R,Yang Y,Deckwer WD,et al.Plasmid system for the intracellular production and purification of affinity-tagged proteins in Bacillus megaterium[J].Biotechnology and Bioengineering,2007,96(3):525-537.
[9]Dwivedi P,Wu P,Klopsch S J,et al.Metabolic profiling by ion mobility mass spectrometry(IMMS)[J].Metabolomics,2008,4(1):63-80.
[10]Zhu S,Wu Y,Yu Z,et al.Production of ethanol from microwave-assisted alkali pretreated wheat straw[J].Process Biochemistry,2006,41(4):869-873.
[11]Rai U,Sinha S,Tripathi R,et al.Wastewater treatability potential of some aquatic macrophytes:removal of heavy metals[J]. Ecological Engineering,1995,5(1):5-12.
Optimization and Industrial Production of Catalase in Bacillus subtilis
CAO Wenlong1,2, GUO Yaqiong1,2, KANG Zhen1,2, DU Guocheng1,2*
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Microorganism catalase,which is an important industrial enzyme,plays an important role in textile industry.To realize the industrial production of catalase,the fermentation on B.subtilis WSHDZ-01(pSTOP1622-katA),which was constructed before,was conducted in 3 L fermentor. Furthermore,the enzyme activity reached 35 398 U/mL after optimization of carbon and nitrogen concentration,which was increased by 53.41%compared with that before optimization.Based on this result,the fermentations in 24 L and 500 L fermentor were carried out,respectively and the maximum enzyme activity was 28 940 U/mL and 23 190 U/mL respectively.The result showed the yield of catalase has met the requirement of industrial production,which lay a solid foundation for larger-scale industrial production.
Bacillus subtilis,catalase,fermentation,optimization,larger-scale production
S 665.2
A
1673—1689(2015)05—0482—05
2014-02-28
国家863计划项目(2012AA022202);国家博士后基金面上项目(2013 M540414);江苏省博士后基金项目(1301010B)。
*通信作者:堵国成(1965—),男,江苏常州人,工学博士,教授,博士研究生导师,主要从事发酵过程优化与控制、酶工程与技术、代谢工程技术方面的研究。E-mail:gcdu@jiangnan.edu.cn
