Sphingomonas sp.生产威兰胶分批发酵动力学
2015-01-06许晓鹏郑志永詹晓北
许晓鹏, 郑志永, 朱 莉, 詹晓北*
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 粮食发酵工艺及技术国家工程实验室,江苏 无锡214122)
Sphingomonas sp.生产威兰胶分批发酵动力学
许晓鹏1,2, 郑志永1, 朱 莉1, 詹晓北*1,2
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 粮食发酵工艺及技术国家工程实验室,江苏 无锡214122)
为了优化革兰氏阴性棒状杆菌(Sphingomonas sp.)生产的发酵过程,对该菌发酵生产威兰胶分批发酵动力学进行了研究,利用数学建模方法得到了描述该菌株在7 L发酵罐中菌体生长、威兰胶合成和氮源消耗动力学数学模型。实验和模型数据的比较结果证明,该模型计算值与实际结果拟合良好,为其应用在威兰胶的放大工业化生产提供了依据。
威兰胶;革兰氏阴性棒状杆菌;发酵动力学;数学模拟
威兰胶 (welan gum)是革兰氏阴性棒状杆菌(Sphingomonas sp.)发酵生产的一种微生物胞外多糖,威兰胶的结构骨架由D-葡萄糖、D-葡萄糖醛酸、D-葡萄糖和L-鼠李糖单元组成。在葡萄糖及鼠李糖相连的葡萄糖残基的C3位上连接有α-L-鼠李糖或α-L-甘露糖支链[1],连接鼠李糖的几率占2/3;此外,约有半数的四糖片段上带有乙酰基及甘油基团[2-3]。威兰胶中含有2.8%~7.5%乙酰基,11.6%~14.9%的葡萄糖醛酸,甘露糖、葡萄糖和鼠李糖的摩尔比例为1∶2∶2[4],结构式见图1。
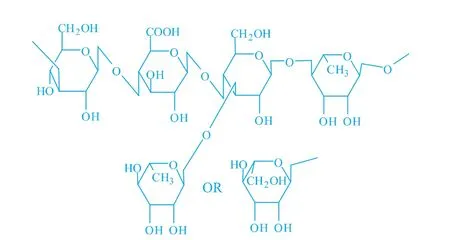
图1 威兰胶的结构式Fig.1 Structure of welan gum
威兰胶具有优良的触变性、悬浮性、水溶性等流变性能,且具有卓越的稳定性,市场前景广阔。它主要作为增稠剂、悬浮剂、乳化剂、稳定剂、润滑剂、成膜剂和粘合剂应用于工农业的各个方面,尤其在混凝土、石油、石墨等工业中有广泛的应用前景。
威兰胶是美国的CP Kelco公司20世纪80年代继黄原胶、结冷胶之后开发的最具市场前景的微生物代谢多糖之一。目前CP Kelco公司已成为威兰胶全球惟一的生产和供应商,国内在这方面研究较少[5-8]。作者对Sphingomonas sp.ZJ01进行发酵实验,采用matlab编程软件对实验数据进行拟合,得出数学模拟公式,以便对以后的实验和生产提供帮助。
研究发酵动力学是实现发酵过程最优控制的前提条件,也是研究发酵过程放大及从分批发酵过渡到流加发酵、连续发酵的理论基础。动力学模型的建立,离不开模型参数的估算。目前常见数学模型的参数拟合方法有线性转化法、非线性拟合法和遗传算法。线性转化法比较简单,不需要高深的数学知识,但由于违背了某些统计学规律,往往拟合误差较大。非线性拟合法能直接拟合,但当动力学方程存在多个局部极值的情况下容易陷入局部最优,拟合值让人不放心。而遗传算法具有多点寻优、并行处理等特点,搜索过程是从初始解群开始,以适应函数作为寻优判据,适者生存,劣者淘汰,直接对解群进行操作,不依赖模型的具体表达式,因此,它搜索面广,寻优效率高,能以较大概率逼近全局最优解。代志凯[9]比较了线性转化拟合、非线性拟合和遗传算法拟合法三种方法的拟合效果,结果表明:线性转化法拟合误差较大,非线性和遗传算法拟合效果较好,但遗传算法能以较大概率逼近全局最优,而非线性拟合法则容易陷入局部最优。因此作者采用遗传算法对菌体生长动力学进行拟合。
发酵动力学是对微生物生长和产物形成过程的定量描述,它研究微生物生长、发酵产物合成、底物消耗之间的动态定量关系,确定微生物生长速率、发酵产物合成速率、底物消耗速率及其转化率等发酵动力学参数特征,以及各种理化因子对这些动力学参数的影响,并建立相应的发酵动力学过程的数学模型,从而达到认识发酵过程规律及优化发酵工艺,提高发胶产量和效率的目的。
在微生物发酵过程中,发酵动力学是发酵过程优化和控制的重要基础,通过发酵动力学的研究,有助于深入了解微生物代谢的规律,从而有利于建立合理的发酵工艺或对已有的发酵过程进行优化[10]。Moser等按建模方式将其分为3类:机制模型、数学模型和正规模型。由于微生物反应过程非常复杂,在发酵过程中建立机制模型几乎不可能,所以目前国内外学者所建模型大多为第2类和第3类,其中又以数学建模较为简便,使用得最为广泛[11]。
微生物分批发酵动力学主要研究微生物在分批发酵过程中生长动力学、基质消耗动力学和代谢产物生成动力学。
威兰胶发酵碳源为过量的底物,因此其对菌体的生长有底物限制作用,而随着威兰胶浓度的增加其对菌体生长亦有限制的作用,因此作者在Monod方程[10]μ=的基础上,增加了底物抑制和产物抑制对菌体生长的影响,使方程更能反映菌体实际的生长过程。
1 材料与方法
1.1 实验材料、试剂与仪器
Sphingomonas sp.ZJ01:江南大学 生化工程与生物反应器实验室自行保藏;蔗糖、葡萄糖、酵母粉、大豆蛋白胨、麦芽提取物、鱼粉蛋白胨、NaNO3、KH2PO4、NaOH、MgSO4·7H2O:购自中国医药(集团)上海化学试剂公司。
1.2 方法
1.2.1 培养基种子培养基(g/L):葡萄糖10,酵母粉3,麦芽提取物3,鱼粉蛋白胨5;pH 7.0,115℃灭菌20 min,固体培养基添加质量分数为2%的琼脂。
发酵培养基(g/L):蔗糖 40,大豆蛋白胨0.7,NaNO34,KH2PO40.6,MgSO4·7H2O 0.2;121℃灭菌20 min。
1.2.2发酵工艺取两环经活化的菌种,接种到500 mL的种子瓶中,装液量为100 mL,30℃恒温摇床200 r/min培养24 h得到种子液,以接种体积分数6%接种至7 L发酵罐 (Bio flo115发酵罐,美国New Brunswick公司),通气量1 vvm,转速与溶氧相关联,控制溶氧不低于30%,发酵周期70 h,取样间隔4 h,装液量4 L,pH值控制在7.0。
1.2.3 发酵液中NaNO3浓度的测定采用酚二磺酸法测定[12-13]。取1 g发酵液加入4 g去离子水。混匀后于10 000 r/min离心20 min,取0.20 mL上清液,加入0.80 mL酚二磺酸溶液混匀后静置30 min,加2 mol/L NaOH溶液定容至20 mL,410 nm波长测定吸光度。
1.2.4 发酵液中生物量的测定分别称取发酵液3 g放入100 mL锥形瓶中,加浓盐酸3.0 mL,室温下(25℃左右)浸泡24 h,稀释至HCl浓度为8.5 mol/mL,沸水浴 45 min进一步消化,冷却后用 1 mol/L NaOH溶液中和至pH 7,移入100 mL容量瓶,定容,过滤。准确量取滤清液1.00 mL,加入1.00 mL蒸馏水,置10 mL具塞比色管中,加1.00 mL乙酰丙酮试剂,摇匀,沸水浴25 min,取出冷水至室温,再加无水乙醇2.00 mL摇匀,加入对二甲氨基苯甲醛试剂1.00 mL,再以无水乙醇定容至10 mL,摇匀,于80℃水浴2 h,水冷至室温,以空白溶液(不加试样,其余步骤相同)为参比,测定525 nm波长处的吸光度。每个试样平行测定3次,取3次平行测定的平均值[14]。
1.2.5 产胶率的测定定量称取发酵液,三倍发酵体积的95%酒精沉淀,离心、用少量75%酒精清洗沉淀两次,80℃烘至恒重,称干胶质量,干胶质量与发酵液质量的比即为产胶率。
1.2.6 发酵动力学模型本实验采用的动力学公式为:
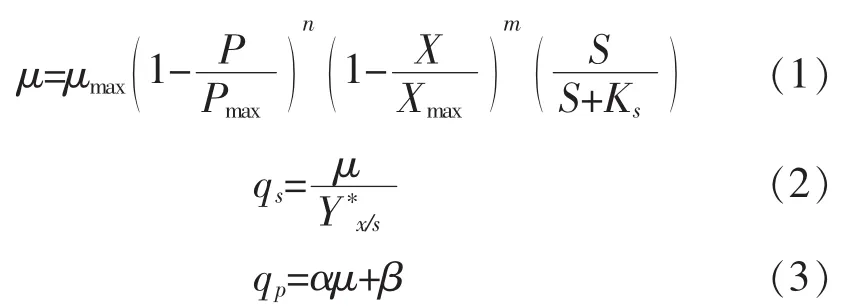
式中:μ为微生物细胞生长速率;μm为微生物细胞最大生长速率;Ks是底物亲和常数;S为底物浓度;X为微生物细胞浓度;Xm为最大微生物细胞浓度;P为代谢产物浓度;Pm为最大产物浓度;qs为限制性底物消耗速率;Y*x/s为底物转化为微生物细胞的转化率;qp为产物生成速率;α、β为常数。
根据产物形成与菌体生长的关系,将产物的形成分为三类:1)产物生产与菌体生长无关;2)产物生产与菌体生长部分偶联;3)产物生产与菌体生长没有关系。当α=0,β≠0时产物行成与细胞生长无关;当α≠0,β≠0时产物形成与细胞生长部分偶联;当α≠0,β=0是产物形成于菌体生长相偶联。
采用Matlab遗传算法的程序进行拟合,根据实验值拟合公式中的各参数的值,为之后的实验和工业化生产提供帮助。
遗传算法(Genetic algorithms,GA)是一种基于生物自然选择与遗传机理的随机搜索算法,以其高效、自适应及益于全局搜索的优势在很多领域中得到应用。它的搜索面广,寻优速度快,得到的结果能以较大概率接近全局最优解。对于解决分批发酵动力学参数,遗传算法较传统的方法具有不可比拟的优势[15-16]。
2 结果与讨论
发酵实验数据见表1。
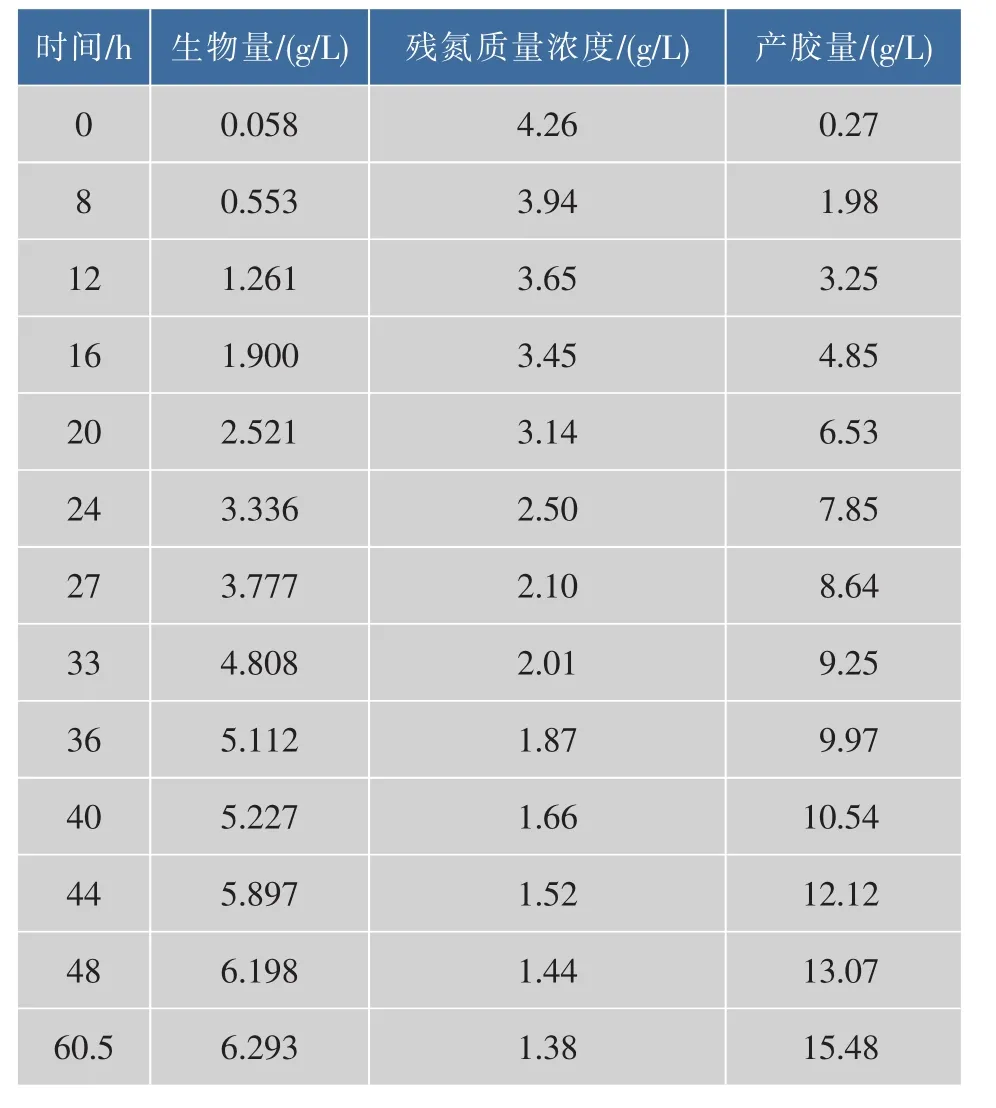
表1 发酵过程的参数值Table 1 Value of Sphingomonas sp.ZJ01 fermentation
发酵35 h后菌体浓度缓慢升高,主要是菌体到达稳定期,另外随着粘度的升高,系统的传质也受到了影响,因此也限制了菌体的生长。由图2可以看出,在菌体浓度增长明显趋缓时,产胶速率并没有明显的改变,主要是因为产胶是以一定菌体浓度为基础的,葡萄糖在细胞内部合成威兰胶并排出细胞外,随着粘度的增加,传质和传氧都受到影响,产胶率也会达到稳定值。图2发酵液中残氮下降速度也逐渐变慢,这和菌浓增长速度的变化相吻合,由图2(实线为Matlab拟合的曲线,圆圈为实测的值)看出,Matlab拟合的公式很好的反映了威兰胶发酵的菌浓变化,限制性底物氮源的变化和威兰胶产物的变化过程。
通过反复拟合得出方程(1)、(2)、(3)三个方程的参数值分别为Ks、Xm、Pm、α、β。
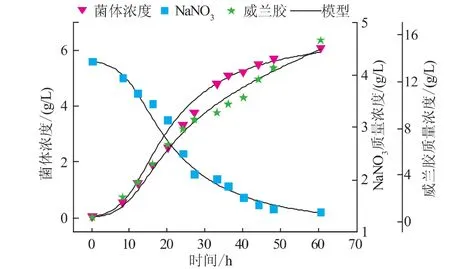
图2 Sphingomonas sp.ZJ01发酵动力学模型与实验数据的拟合Fig.2 Simulation of experimental data by kinetic model of Sphingomonas sp.ZJ01
由表2可以看出,Pm,Xm明显比实际值大的多,说明随着发酵的进行,体系粘度越来越大,产胶速率和菌体增长速率会受到很大影响,从而在发酵后期产物的反馈抑制占据主导地位,因此菌体浓度和产胶率会比模拟值小很多。
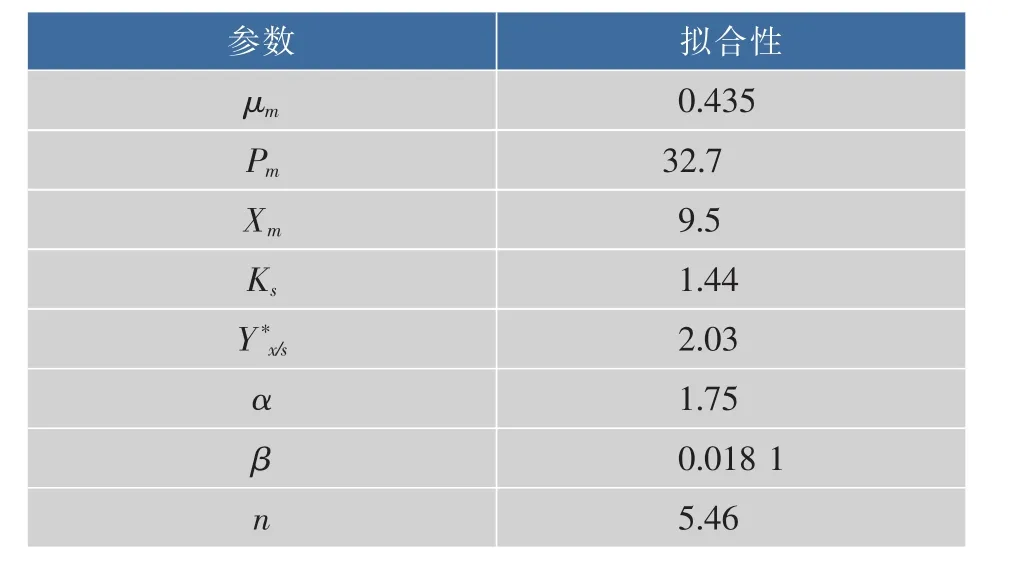
表2 动力模型参数值估算值Table 2 Estimated value of kinetic model parameter
以上得到分批培养的模拟方程的方程组为:
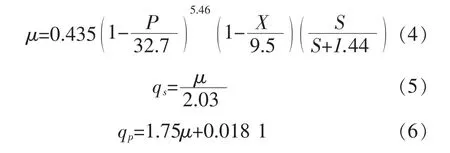
3 结语
作者根据威兰胶产生菌Sphingomonas sp.ZJ01的发酵特点,分别考虑到底物抑制、产物抑制、生物量抑制等方面对生物比生长速度的抑制,采用遗传算法模拟出与实际发酵过程曲线拟合度较高的模拟曲线,说明最初选取的拟合公式体现了影响威兰胶产生菌Sphingomonas sp.ZJ01发酵的主要因素,对后续策略性优化调控威兰胶的发酵具有一定的指导作用。
[1]Jansson P E,Widmalm G.Welan gum (S-130)contains repeating units with randomly distributed L-mannosyl and L-rhamnosyl terminal groups as determined by FABMS[J].Carbohydrate Research,1994,256(2):327-330.
[2]Kang K S,Veeder G T.Heteropolysaccharide S-130[P].US Patent:4342866,1981-09-28.
[3]Stankowski J D,Zeller S G.Location of the O-acetyl group in welan by the reductive cleavage method[J].Carbohydrate Research,1992,224:337-341.
[4]Attwool P T,Atkins E D T.X-Ray fibre diffraction results from Alcaligenes(ATCC 31555)microbial polysaccharide S-130 and a comparison with gellen gum[J].Carbohydrate Research,1986,148(1):C1-C4.
[5]贾薇,郑志永,刘汝冰,等.一种新型微生物多糖流变学初探[J].食品科学,2009,30(1):135-138.
JIA Wei,ZHENG Zhiyong,LIU Rubing,et al.Preliminary study of rheological properties of a novel kind of microbial polysaccharides[J].Food Science,2009,30(1):135-138(in Chinese)
[6]JIA Wei,ZHANG Jinsong,JIANG Yun,et al.Structure of oligosaccharide F21 derived from exopolysaccharide WL-26 produced by Sphingomonas sp.ATCC 31555[J].Carbohydr Polym,2012,90(1):60-66.
[7]LI Hui,XU Hong,XU Hao,et al.Enhanced welan gum production using a two-stage agitation speed control strategy inAlcaligenes sp.CGMCC2428[J].Bioprocess Biosyst,2011,34:95-102.
[8]代志凯,印遇龙,阮征.微生物发酵动力学模型及其参数拟合的软件实现[J].计算机与应用化学,2011,28(4):437-441.
DAI Zhikai,YIN Yulong,RUAN Zheng.Microbial fermentation kinetic model and its parameters estimation by software[J]. Computers and Applied Chemistry,2011,28(4):437-441(in Chinese)
[9]Monod J.The growth of bacterial cultures[J].Annu Rev Microbiol,1949,3:371-394.
[10]Leudeking-Piret E L.A kinetic studyofthe lactic acid fermentation batch processatcontrolled pH[J].Biochemical Microbiological Tech Eng,1959,1:393-412.
[11]彭崇慧,冯建章,张锡渝,等.定量化学分析简明教程[M].北京:北京大学出版社,1985:267.
[12]地矿部水文地质工程研究所编.天然水分析方法[M].北京:地质出版社,1971:49-54.
[13]吴金水,林启美,黄巧云,等.土壤中微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[14]王东阳,王健,陈宁.基于遗传算法的谷氨酸发酵动力学参数估计[J].生物技术通讯,2005,16(4):407-408.
WANG Dongyang,WANG Jian,CHEN Ning.Application of genetic algorithms to estimating parameters from kinetic model of glutamic acid batch fermentation[J].Letters in Biotechnology,2005,16(4):407-408.(in Chinese)
[15]雷英杰,张善文,李续武,等.MATLAB遗传算法工具箱及应用[M].西安:西安电子科技大学出版社,2005.
Study on Welan Gum Fermentation Dynamics of Sphingomonas sp.
XU Xiaopeng1,2, ZHENG Zhiyong1, ZHU Li1, ZHAN Xiaobei*1,2
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China)
The EPS welan gum batch fermentation dynamics of Sphingomonas sp.were demonstrated.The mathematics models of the dynamic parameters of Sphingomonas sp.growth in 7 L fermentation reactor,synthesis of welan gum,and consumption of nitrogenous source were depicted. The estimated model parameters were confirmed bythe batchfermentation experiment data.These models offered the evidences for large scale production of welan gum.
welan gum,Sphingomonas sp.,fermentation dynamics,math model
TQ 920.1
A
1673—1689(2015)05—0507—05
2014-02-20
国家“十二五”科技支撑计划项目(2011BAD23B04);国家863计划项目((2012AA021505);无锡市科技支撑计划项目(CLE01N1208)。
许晓鹏(1978—),男,吉林白山人,发酵工程专业博士研究生,工程师,主要从事发酵工程及产物分离提取方面的研究。
E-mail:xuxiaopeng@jiangnan.edu.cn
*通信作者:詹晓北(1962—),男,北京人,工学博士,教授,博士研究生导师,主要从事工业发酵与生物化工、糖生物技术方面的研究。
E-mail:xbzhan@yahoo.com
