穿心莲内酯自微乳化释药系统的处方优化与评价
2015-01-06刘丹霞张焕滨廖华卫崔升淼
刘丹霞,张焕滨,廖华卫,崔升淼
(广东药学院中药学院,广东广州510006)
LIU Danxia,ZHANG Huanbin,LIAO Huawei,CUI Shengmiao(School of Traditional Chinese Medicine,Guangdong Pharmaceutical University,Guangzhou 510006,China)
药剂学
穿心莲内酯自微乳化释药系统的处方优化与评价
刘丹霞,张焕滨,廖华卫,崔升淼
(广东药学院中药学院,广东广州510006)
目的研究穿心莲内酯自微乳化释药系统(AP-SMEDDS)的处方工艺。方法通过溶解度试验、相容性试验、三元相图的绘制及星点设计-效应面法的优化,以粒径、Zeta电位和自微乳化时间为指标,筛选各组分的最佳组合和处方配比。并对优化的AP-SMEDDS的理化性质和体外溶出度进行测定。结果穿心莲内酯的自微乳处方是:Maisine35-1∶吐温20∶Transcutol P=14.3∶39.7∶46.0(质量比)。AP-SMEDDS的平均粒径为19.96 nm,自微乳化时间<20 s,Zeta电位-9.76 mV,1 h累积溶出度为94.6%,为市售滴丸的2.14倍。结论所制备的穿心莲内酯自微乳可显著提高穿心莲内酯的体外溶出度,有望提高穿心莲内酯的口服生物利用度。
穿心莲内酯;自微乳化释药系统;处方研究
穿心莲内酯(andrographolide,AP)是从穿心莲中提取得到的二萜内酯类化合物,是中药穿心莲的主要有效成分之一。研究表明,穿心莲内酯具有解热、抗感染、抗菌、抗病毒、免疫调节、保肝利胆、改善心血管机能、降低血糖等广泛的生物学效应,且毒性低、不良反应小,具有广泛的开发前景[1]。但由于穿心莲内酯在水中的溶解度极小,导致其常规制剂的口服吸收效果差、生物利用度低,临床应用受到很大的限制。
自微乳化给药系统(self-microemulsifying drug delivery system,SMEDDS)作为一种新型的口服载药体系,可增加水难溶性药物的溶解度,改善药物的口服吸收效果,提高药物的生物利用度,还可以减少药物在高浓度水溶液下使用的细胞毒性和避免水不稳定性药物的水解及药物对胃肠的不良刺激[2-3]。本文进行了穿心莲内酯的自微乳给药系统的处方设计,并进行体外相关性质的评价。
1 仪器与试药
ME204E电子天平(METTLER TOLEDO);Zetasiter Nano ZS90粒径分析仪(英国马尔文公司);ZRS-8G智能溶出试验仪(天津天大天发科技有限公司);KH-250DB超声波清洗仪(上海生析超声仪器有限公司)。
穿心莲内酯对照品(中国药品生物制品检定所提供,批号:0797-9302);穿心莲内酯原料药(陕西锦泰生物工程有限公司,批号:JT20091205,质量分数: 98%);Labrafil M 1944、Labrafac CC、Capryol 90、Transcutol P、Labrasol、Masin35-1(法国Gattefosse公司);PEG-400(广东光华化学有限公司);油酸乙酯(上海鸿海化工有限公司);吐温20、吐温80(天津富宇精细化工有限公司)。
2 方法与结果
2.1 穿心莲内酯HPLC检测方法的建立[4]
色谱条件:色谱柱为迪马 C18柱(250 mm× 4.6 mm,5 μm);流动相为甲醇-水(体积比65∶35);流速为1.0 mL/min;检测波长为225 nm;柱温为35℃;进样量为10 μL。在上述色谱条件下,穿心莲内酯色谱峰理论塔板数大于3 000,自微乳化辅料不干扰穿心莲内酯的测定,穿心莲内酯质量浓度在3.06~40.8 μg/L的范围内与峰面积呈良好的线性关系(y=82 490x+5 419.7,R2=0.999 9),高、中、低质量浓度的平均回收率为 100.88%、98.58%和99.81%,RSD为1.69%、1.31%和1.57%,日内和日间精密度(RSD)均小于2.0%,符合测定要求。
2.2 AP-SMEDDS的处方设计
2.2.1 穿心莲内酯在油相、乳化剂和助乳化剂中的溶解度考察 通过预试验,选取吐温20、Labrasol为乳化剂,Transcutol P、1-2丙二醇为助乳化剂,Maisine35-1、油酸乙酯为油相。分别取上述油相、乳化剂和助乳化剂5 mL,加入过量的穿心莲内酯,涡旋分散均匀,37℃水浴平衡48 h,10 000 r/min离心10 min,上清液用甲醇稀释适宜倍数后,采用HPLC法测定穿心莲内酯的质量分数。结果表明,穿心莲内酯在油相中的溶解不理想,Maisine35-1和油酸乙酯的溶解度分别仅为1.17、0.66 mg/mL;而穿心莲内酯在乳化剂和助乳化剂中的溶解度相对较好,吐温20和Labrasol的溶解度分别为5.88、11.16 mg/mL,Transcutol P和1-2丙二醇的溶解度分别为9.96、14.39 mg/mL。
2.2.2 油相和乳化剂的相容性 选择对穿心莲内酯溶解度较高的油相和乳化剂进行相容性和乳化能力考察。以油酸乙酯和 Maisine35-1为油相,Labrasol和吐温-20为乳化剂,将油相和乳化剂按质量比1∶9、2∶8、3∶7、4∶6混合均匀,目测是否有明显浑浊或分层现象,如目测现象不明显时,将混合物置于3 000 r/min离心10 min,观察是否出现相分离现象。取无相分离的混合物样品适量,于100 r/min搅拌下滴入100倍量预热至37℃的水中,以目测等级[5]为指标观测乳化情况,目测标准分为5个等级: A级,迅速乳化(≤1 min),澄清或微泛蓝光;B级,迅速乳化(≤1 min),溶液呈半透明,呈蓝白光;C级,乳化稍慢(≤2 min),呈亮白色不透明液体;D级,乳化较慢(>2 min),色泽暗,呈灰色,略带油状;E级,难乳化,一直有油滴存在;“-”为浑浊或分层。结果见表1。
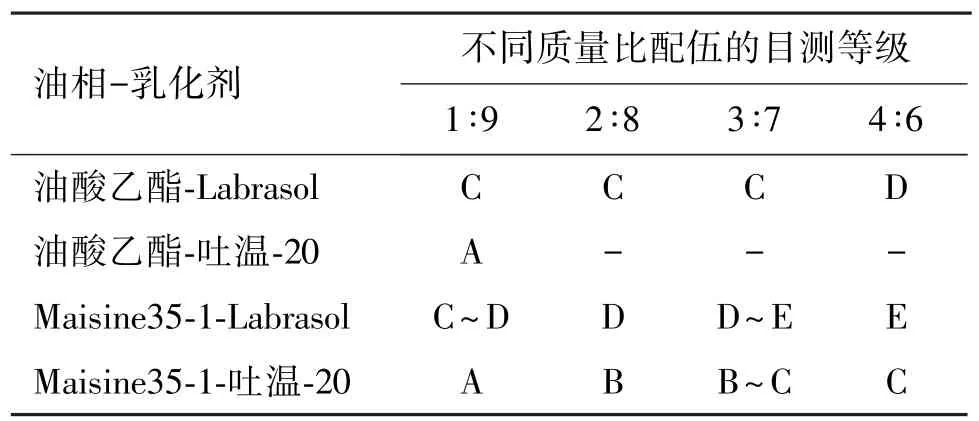
表1 油相和乳化剂的相容性Table 1 Results of compatibility tests
可见,除了Maisine35-1和吐温-20的配伍乳化效果和相容性较好之外,其余配伍的乳化效果或相容性较低,因此选择Maisine35-1为油相,吐温-20为乳化剂进行下一步考察。
2.2.3 助乳化剂的选择 将乳化剂与助乳化剂按质量比1∶1混合均匀,再与Maisine35-1按质量比9∶1、8∶2、7∶3、6∶4混匀,于100 r/min搅拌下滴入100倍量预热至37℃的水中,观察体系的乳化情况。结果显示,1-2丙二醇和Transcutol P的乳化区域大小相似。但是,当采用比例6∶4的1-2丙二醇作为穿心莲内酯自微乳化处方的助乳化剂时,稀释过程中药物会在短时间内大量析出,而采用Transcutol P则没有出现该现象,且对穿心莲内酯的溶解度也较高。综合考虑,选择Transutol P为自微乳化处方的助乳化剂。
2.3 AP-SMEDDS的处方优化
2.3.1 伪三元相图的绘制 根据处方组分的筛选结果,分别以吐温-20、Transcutol P和Maisine35-1为自微乳化处方的乳化剂、助乳化剂和油相,将吐温-20和Transcutol P按质量比9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9混合均匀,再与油相按质量比9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9混合均匀,取100 mg药物加入到空白处方中,充分溶解后,于100 r/min搅拌下滴入100倍量预热至37℃的水中,按照“2.2.2”项下的目测方法,记录能形成自微乳的点,采用Origin软件绘制处方的自微乳化区域,确定自微乳化区域中各因素的取值范围,结果见图1。
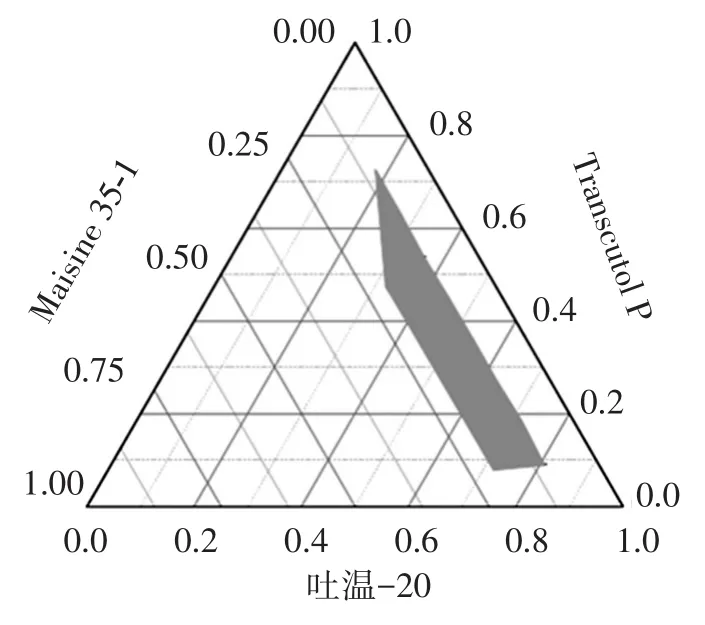
图1 自微乳化给药系统的伪三元相图Figure 1 Pseudo-ternary phase diagram of SMEDDS
2.3.2 星点设计法优化处方
2.3.2.1 平均粒径与电位的测定 取1 mL自微乳于50 mL烧杯中,加入蒸馏水20 mL,涡旋使分散均匀,采用马尔文激光粒度仪分别测定平均粒径和Zeta电位。
2.3.2.2 自微乳化时间的测定 取自微乳1 mL加入100 mL蒸馏水中,磁力搅拌,转速100 r/min,从自微乳液接触溶液时开始计时,测定完全形成均匀乳液的时间。
2.3.2.3 星点设计法 以自微乳化区域中吐温-20、Transcutol P和Maisine35-1的质量比为自变量;以自微乳化时间、分散后的平均粒径及Zeta电位为因变量,采用 Design expert 8.0.6进行 Box-Behnken design设计。自微乳化区域中各因素的取值范围见表2,设计及响应值见表3。

表2 Box-Behnken design设计的各因素取值范围Table 2 The range of factors in Box-Behnken design w/%
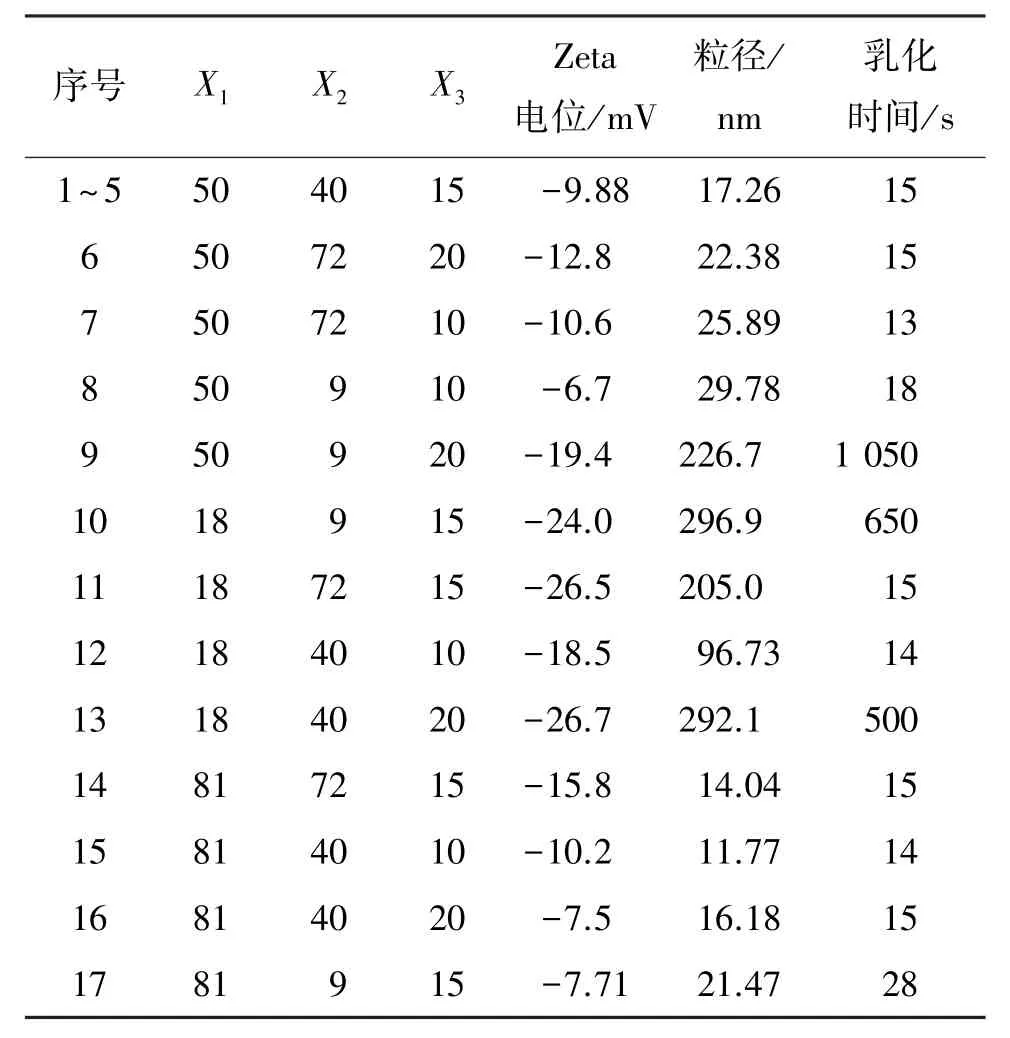
表3 Box-Behnken design设计表及响应值Table 3 Box-Behnken design table and response values
2.3.3 数据模型拟合 运用Design Expert 8.0.6,以方程回归系数最大且F检验合格为原则,对试验数据进行拟合,得到方程如下:
Zeta电位=-9.88+6.81X1-0.99X2-2.55X3-1.40X1X2+2.73X1X3+2.62X2X3-5.99 X12-2.64 X22+0.14 X32(R2=0.953 8,P=0.000 7);

乳化时间=15.00-138.38 X1-211.00 X2+190.13 X3+155.50 X1X2-121.25 X1X3-257.50 X2X3+11.87 X12+150.12 X22+108.88 X32(R2=0.908 9,P=0.000 5)。结果显示,Zeta电位、平均粒径和乳化时间和各自变量之间的非线性拟合效果较好,相关系数均大于0.90,差异具有统计学意义。
2.3.4 处方的预测和验证 运用Design Expert软件的预测功能,以平均粒径<30 nm,自微乳化时间<20 s,Zeta电位<-12 mV为限制条件[6],进行最优处方的预测。结果得到10个符合条件的处方。出于安全考虑,以油相用量多,乳化剂用量少为原则,综合评价后,确定优化处方的质量比为Maisine35-1∶吐温20∶Transcutol P=14.3∶39.7∶46.0。对预测处方的验证结果表明,各指标偏差绝对值均<6%,见表4。可见,所建立的数学模型具有良好的预测效果。
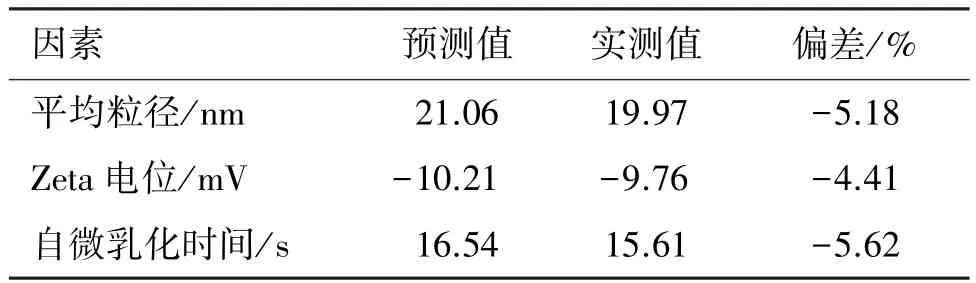
表4 优化处方的验证试验结果(n=3)Table 4 Verification test results of optimized formulation
2.4 微乳的质量评价
2.4.1 微乳形态和粒径分布 取AP-SMEDDS适量,用蒸馏水稀释20倍,搅拌均匀后,取适量滴加于铜网上,用质量浓度3%的磷钨酸溶液染色,用滤纸吸取过多的染色液,室温晾干,置于透射电镜下观察(见图2),并用马尔文激光粒度仪测定微乳的粒径和电位(见图3~图4)。结果显示,电镜下稀释后形成的乳滴呈圆球形,乳滴间无粘连,形态良好;微乳的平均粒径为19.96 nm(PDI=0.215),Zeta电位-9.76 mV。


图3 AP-SMEDDS的粒径分布Figure 3 Particle size profile of AP-SMEDDS
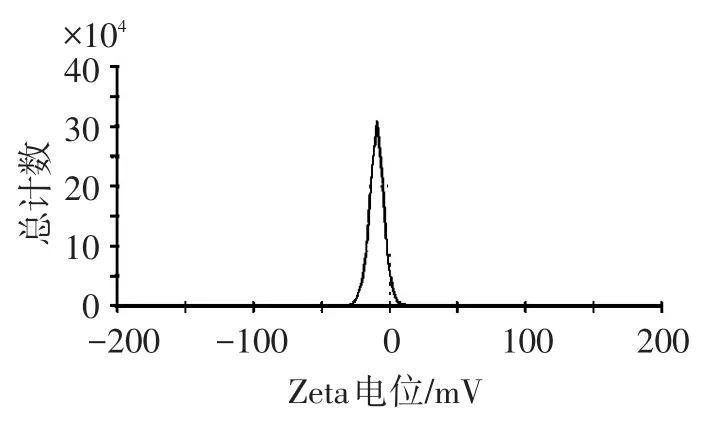
图4 AP-SMEDDS的电位Figure 4 Zeta potential of AP-SMEDDS
2.4.2 微乳的溶出度试验 取含等物质量的穿心莲内酯自微乳制剂(20 mg/粒)、穿心莲原料药和穿心莲内酯滴丸(150 mg/袋),按照2010年版《中国药典》附录溶出度测定法(转篮法)测定,以500 mL蒸馏水为溶出介质,温度为(37±0.5)℃,转速100 r/min。依法操作,分别于5、10、15、30、45、60 min取样5 mL,用0.45 μm微孔滤膜滤过,同时补液5 mL。取续滤液,加甲醇稀释后按照“2.1”项法测定测定穿心莲内酯含量,绘制溶出曲线,结果见图5。可见,穿心莲内酯SMEDDS在10 min内溶出达90%左右,而穿心莲内酯原料药和穿心莲内酯滴丸60 min的溶出分别仅为17.9%和44.3%,表明该穿心莲内酯自微乳化制剂可大大提高药物的体外溶出。
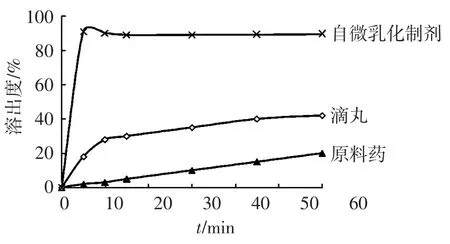
图5 穿心莲内酯溶出度比较Figure 5 Cumulative dissolution profiles of AP(n=3)
3 讨论
由于穿心莲内酯具有酯类结构,而酯类结构易受酸碱条件和温度变化的影响而开环水解,进而影响制剂的质量稳定性;所以,试验前期对穿心莲内酯的pH值和温度稳定性进行了考察。结果显示,穿心莲内酯在碱性条件下不稳定,在pH>8.0的条件下室温放置10 d后,残余的药物浓度只有起始药物浓度的80%左右;相比之下,穿心莲内酯在中性和酸性条件下则较稳定,特别是pH值为3~4范围内,放置10 d后药物的浓度基本无变化。这提示将制剂的pH值控制在中性或酸性条件下有利于药物的保存。
本文采用动态光散射技术测定自微乳粒径的大小和分布状况,为了保证样品粒径检测的准确性,样品的浓度应控制在一定范围内。如果样品浓度太低,可能会没有足够的散射光进行测量;如果样品浓度太高,就会发生多重散射。经测定,稀释倍数为20倍左右所测得的粒径和电位结果最为稳定、重复性好。
Pouton[7]根据处方是否含助乳化剂将自微乳化制剂归纳为两类,一类是油相比例较高且不含助乳化剂,另一类是油相比例较低并含有助乳化剂。由于穿心莲内酯在油相中的溶解度不理想,而在Transcutol P、1-2丙二醇等助乳化剂中的溶解度较好,为了提高体系的载药量和促使微乳的形成,本研究选择含助乳化剂的自乳化体系。
本文结果显示,当自微乳化处方采用较大比例的1-2丙二醇作为助乳化剂时,稀释过程中穿心莲内酯会在短时间内大量析出。原因可能是稀释过程中亲水性的1-2丙二醇快速迁移至水相中,导致微乳的结构稳定性降低,致使疏水性的药物暴露于周围水环境而析出的缘故。
[1]吕巧莉,涂国刚,王嘉琦,等.穿心莲内酯的研究进展及临床应用[J].南昌大学学报,2013,53(1):83-86.
[2]SELJAK KB1,BERGINC K,TRONTELJ J,et al.A selfmicroemulsifying drug delivery system to overcome intestinal resveratrol toxicity and presystemic metabolism [J].J Pharm Sci,2014,103(11):3491-3500.
[3]何琳,廖巍,卢秀霞,等.吲哚美辛自微乳肠溶胶囊的处方设计及体外溶出度评价[J].广东药学院学报,2013,29(4):351-356.
[4]刘意,龙晓英,何琳,等.穿心莲内酯微乳的制备及含量测定[J].中成药,2010,32(8):1424-1426.
[5]崔升淼,张慧文,张建,等.山楂叶总黄酮自微乳化释药系统的体内外评价[J].中成药,2012,34(7):1250-1254. [6]熊颖,刘启德,赖乐,等.银杏酮酯口服自微乳化给药系统的制备[J].药学学报,2009,44(7):803-808.
[7]POUTON C W.Lipid formulation for oral administration of drugs: nonemulsifying,self-emulsifying and self-microemulsifying drug delivery systems[J].Eur J Pharm Sci,2000,11 (Suppl):93-98.
(责任编辑:陈翔)
Optimization and evaluation of prescription for andrographolide self-microemulsifying drug delivery system
ObjectiveTo develop the formulation of andrographolide self-microemulsifying system(APSMEDDS).MethodsThe optimum formulations of AP-SMEDDS were screened by solubility,compatibility,ternary phase diagram and Box-Behnken design-response surface methodology,with the particle size,Zeta electric potential and self-microemulsifying time as parameters.The physic-chemical property and dissolution characters of AP-SMEDDS were also determined.ResultsThe optimum AP-SMEDDS was maisine35-1∶Tween20∶Tronssutol P=14.3∶39.7∶46.0.The mean particle diameter was 19.96 nm,the Zeta potential was-9.76 mV,and the self-microemulsifying time was less than 20 s.The accumulative dissolution of AP-SMEDDS was 94.6%,which was about 2.14 times as much as that of the marketed pills.ConclusionAP-SMEDDS can increase the accumulative dissolution of andrographolide significantly,which is advantageous to improve oral bioavailability of andrographolide.
andrographolide;self-microemulsifying drug delivery system;formulation design
R944.9
:A
10.3969/j.issn.1006-8783.2015.05.001
1006-8783(2015)05-0561-05>
LIU Danxia,ZHANG Huanbin,LIAO Huawei,CUI Shengmiao
(School of Traditional Chinese Medicine,Guangdong Pharmaceutical University,Guangzhou 510006,China)
2015-07-08
国家级大学生创新创业训练计划项目(201410573008);广东省科技计划项目(2013B031800019)
刘丹霞(1993—),2012级中药制药本科生;通信作者:崔升淼(1974—),女,博士,教授,硕士生导师,从事中药新剂型与新技术研究,电话:020-39352169,E.mail:cuishengmiao@qq.com。
时间:2015-09-28 15:20
http://www.cnki.net/kcms/detail/44.1413.R.20150928.1520.004.html
