玉竹多糖的硫酸酯化及其对HepG-2细胞体外抑制活性研究
2015-01-06王强李钟张维维陈菊英刘塔斯
王强,李钟,张维维,陈菊英,刘塔斯
(1.广东药学院中药学院,广东广州510006;2.湖南中医药大学药学院,湖南长沙410208)
玉竹多糖的硫酸酯化及其对HepG-2细胞体外抑制活性研究
王强1,李钟1,张维维1,陈菊英1,刘塔斯2
(1.广东药学院中药学院,广东广州510006;2.湖南中医药大学药学院,湖南长沙410208)
目的对玉竹精制多糖进行硫酸酯化,并分析其体外抗肿瘤活性的变化。方法采用三氧化硫-吡啶法对水溶性玉竹多糖进行硫酸酯化修饰,红外光谱分析光谱性质的变化。采用HepG-2细胞对水溶性玉竹多糖及其硫酸酯的体外抗肿瘤活性进行评价。结果玉竹中性多糖(POPZ80)取代度可达1.23,酸性多糖(POPS80)取代度可达0.26;水溶性玉竹多糖硫酸酯化后的体外抑制HepG-2活性明显增强,且在一定质量浓度范围内,抑制率与用药剂量呈正相关。结论玉竹精制多糖经硫酸酯化后体外抗肿瘤活性增强。
玉竹精制多糖;多糖硫酸酯化;硫酸基取代度;HepG-2;体外抗肿瘤活性
玉竹为百合科植物玉竹Polygonatum odoratum (Mill.)Druce的干燥根茎,味甘、微寒,具有养阴润燥、生津止渴的功能[1]。玉竹多糖为玉竹的主要成分。研究表明,玉竹多糖对血压、心率、血糖有调节作用[2],对肿瘤细胞有明显的抑制作用[3]。研究发现,对多糖进行适当的分子修饰能够提高原有的活性或者促使新的活性产生[4]。例如,香菇多糖硫酸酯化后,其抗氧化、抗肿瘤、抗病毒能力明显增强[5-8]。目前,国内外对玉竹的研究主要集中在玉竹粗多糖的药理活性及一级结构解析,在玉竹精制多糖乃至玉竹多糖硫酸酯化衍生物活性方面的研究报道不多,而多糖的衍生化研究是近期多糖研究的热点。本研究期望通过硫酸酯化的方法获得具有更高生物活性的水溶性玉竹多糖,为多糖的改性研究提供一定的理论依据。
1 材料与仪器
玉竹由湖南新邵玉竹GAP基地提供,经湖南中医药大学药学院刘塔斯教授鉴定为百合科植物玉竹Polygonatum odoratum(Mill.)Druce;DEAE-52纤维素(上海恒信公司);SephadexG-100(上海江莱生物科技有限公司);大孔吸附树脂AB-8(南开大学化工厂);RPMI 1640细胞培养基(Gibco公司);小牛血清(杭州四季青生物公司);MTT、透析袋(Sigma);三氧化硫吡啶复合物(阿拉丁)。其余试剂均为国产分析纯。HepG-2细胞(广东药学院生物活性重点实验室提供)。
NICOLET 5700型红外光谱仪(美国尼高力公司);UV-2450型紫外-可见分光光度计(日本岛津公司);ALpha1-2型真空冷冻干燥机(Chirst公司);N-1100型旋转蒸发仪(东京理化);BS-100A型自动部分收集器(上海沪西分析仪器厂有限公司);DK-8D型电热恒温水槽(上海精宏公司)。
2 方法
2.1 水溶性玉竹多糖的提取
将干燥的玉竹切片、粉碎,过60目筛,准确称取玉竹粉末,加入石油醚回流提取2次,每次2 h,除去玉竹中的脂溶性成分。滤过,将滤渣干燥。以水为溶媒,在料液比为1∶15(g∶mL)、温度80℃、时间2 h的条件下回流提取2次,合并2次提取液,减压浓缩[9]。
2.2 精制水溶性玉竹多糖的制备及理化性质测定
水溶性玉竹多糖液经AB-8树脂静态除色后减压浓缩,采用酶法+Sevage除蛋白。用体积分数95%乙醇分别醇沉到60%和80%,冷冻干燥,分别得到60%醇沉粗多糖(POP60)和80%醇沉粗多糖(POP80)。本文主要以POP80为原料,将 POP80分别过DEAE-52、SephadexG-100柱得玉竹精制多糖,冷冻干燥备用[10]。硫酸苯酚、I-KI[11]、考马斯亮蓝[12]、FeCl3[13]反应测定精制多糖纯度。
2.3 水溶性玉竹多糖的硫酸酯化
取精制多糖500 mg,加入到适量甲酰胺(已除水)中,搅拌溶解后加入适量的三氧化硫吡啶复合物,反应过程中不断充入N2。充分反应后将反应液移至冰水中,调节溶液pH至7~8之间。加入4倍体积的无水乙醇醇沉,密封放入4℃冰箱沉淀12 h,离心收集沉淀,加甲醇洗涤直至无吡啶气味[14]。加少量去离子水溶解于透析袋中,先用自来水透析1~2 d,再用去离子水透析2 d,每天换3~4次水。将透析液浓缩后冷冻干燥,得硫酸酯化多糖。
2.4 硫酸基的质量分数测定及取代度计算
采用BaSO4浊度法测定硫酸基的质量分数,以Na2SO4为标准物绘制硫酸基质量分数标准曲线[15]。精确称取经105℃干燥至恒重的Na2SO4固体,溶于去离子水中,配置成质量浓度为1.0 mg/L的标准溶液。精确吸取0~1.0 mL标准溶液(按0.2 mL递升,即分别取0、0.2、0.4、0.6、0.8、1.0 mL)置于比色管中,各管用去离子水补加至总体积8.0 mL,另加质量分数为8%的三氯乙酸1 mL和BaCl2-明胶试液1 mL,混合后在室温下静置15~20 min,以确保硫酸根离子和BaCl2中的钡离子充分反应,而且生成的BaSO4沉淀能够均匀分散在石英比色皿中。于波长360 nm下测定吸光度,得吸光度A1;另以同样标准溶液系列,唯以明胶试液代替BaCl2-明胶试液做对照,于波长360 nm下测定吸光度,得吸光度A2,以A1-A2的值对硫酸根浓度做标准曲线。按取代公式:DS=1.62×S%/(32-1.02×S%)计算硫酸基质量分数,式中DS表示取代度,S%表示硫酸根质量分数。
2.5 红外光谱分析
取玉竹多糖及多糖硫酸酯样品2 mg,以KBr压片,在4 000~400 cm-1区间扫描红外吸收光谱。2.6 体外抗肿瘤试验
利用MTT法评价水溶性玉竹多糖硫酸酯化前后抑制人肝癌细胞HepG-2的活性。取对数生长期的人肝癌细胞HepG-2培养于RPMI 1640完全培养液中,放入37℃的CO2培养箱中培养。接种时细胞浓度调整为4×105个/mL,将细胞加入96孔培养板中,每孔200 μL,置于37℃、5%(φ)CO2培养箱培养12 h,再加入用磷酸缓冲液稀释成不同浓度的多糖液10 μL。空白对照组加入等体积的PBS液,每组设4个复孔,将细胞培养板移入CO2培养箱中,培养48 h后用MTT法于490 nm波长下测定吸光度(A),按公式:抑制率=(A对照组-A给药组)/A对照组× 100%,计算肿瘤细胞增殖抑制率。
3 结果与分析
3.1 水溶性玉竹多糖纯化结果
POP80经DEAE-52、SephadexG-100柱得到2种精制多糖,分别为中性多糖(POPZ80,neutral polysaccharide) 和 酸 性 多 糖 (POPS80,acid polysaccharide),经紫外分析、I-KI反应、考马斯亮蓝反应、FeCl3反应,结果显示多糖不含蛋白质、淀粉、多酚类物质。硫酸苯酚法测得多糖质量分数为98.6%。3.2 水溶性玉竹多糖硫酸酯化结果
硫酸基质量在20~100 μg之间线线性关系良好,回归方程为:y=0.012 5x-0.121 2,R2=0.999 1。多糖能获得最高的取代度(1.23)。
3.3 玉竹精制多糖及其硫酸酯的红外光谱图
玉竹酸性糖 POPS80与玉竹酸性糖硫酸酯POPSS80,玉竹中性多糖POPZ80与玉竹中性多糖硫酸酯POPZS80的红外图谱见图1~图2。
由图 1~图 2可知,POPZS80、POPSS80与POPZ80、POPS80红外光谱有较明显的差异,除了玉竹精制多糖特征吸收峰外,还增加了2个吸收峰: 1 260 cm-1左右处出现—OSO3—的S=O拉伸振动特征吸收峰,812 cm-1左右处出现C—O—S的拉伸振动特征吸收峰,以上2组吸收峰表明分子内存在硫酸基(—O—SO3)。由以上分析可以初步鉴定水溶性玉竹多糖成功硫酸酯化[16]。

图1 玉竹酸性糖POPS80与玉竹酸性糖硫酸酯POPSS80的红外光谱Figure 1 The IR spectrum of POPS80 and POPSS80

图2 玉竹中性糖POPZ80与玉竹中性糖硫酸酯POPZS80的红外光谱Figure 2 The IR spectrum of POPZ80 and POPZS80
3.4 体外抗肿瘤试验
不同浓度水溶性玉竹多糖及其硫酸酯(其中POPZ80、POPS80取代度分别为1.23,0.26)对HepG-2肿瘤细胞体外增殖抑制作用见图3~图4。
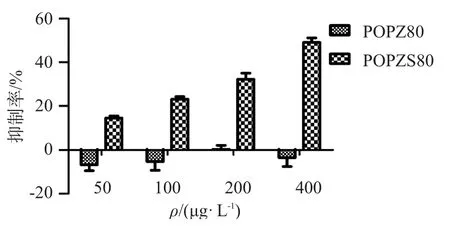
图3 POPZ80与POPZS80对HepG-2肿瘤细胞的体外生长抑制率Figure 3 The Inhibition rate of POPZ80 and POPZS80 on the growth of HepG-2 cells in vitro
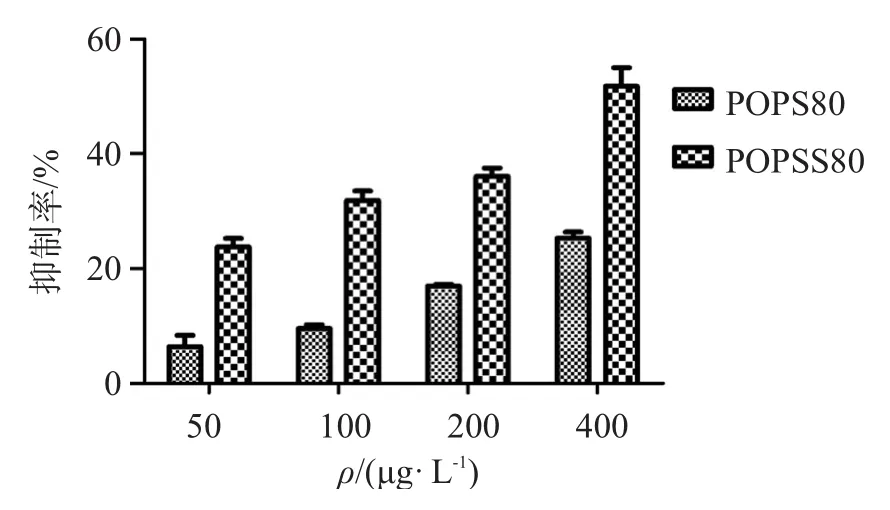
由图3可知,POPZ80对HepG-2肿瘤细胞无抑制作用,POPZS80对HepG-2肿瘤细胞的抑制率可达44.3%;由图 4可知,POPS80未硫酸酯化前已对HepG-2肿瘤细胞有一定的抑制作用,在用药剂量增加到400 μg/L时,抑制率可达55%,且在一定质量浓度范围内,抑制率与质量浓度呈正相关,表明经过硫酸酯化后,玉竹多糖的体外抗肿瘤活性明显提高。
4 讨论
本文采用三氧化硫-吡啶法对水溶性玉竹多糖进行硫酸酯化,此方法操作安全、简便。试验过程中发现,虽然提高反应温度、延长反应时间能够增加多糖硫酸取代度,但同时多糖降解也很严重,且多糖硫酸酯得率并不高。通过试验还发现,POPS80对HepG-2有体外抑制活性,而POPZ80对HepG-2肿瘤细胞无明显抑制作用,这可能与多糖分子质量、结构组成有关。二者硫酸酯化后对HepG-2细胞有明显的抑制作用,且有明显的浓度依赖关系,这可能是由于玉竹多糖糖单位的羟基被硫酸基基团取代后,糖环构象发生扭曲或转变,容易形成非共价键,而且这些阴离子基团间的排斥作用使糖链链段伸长,部分硫酸基有可能和糖环上的羟基形成氢键,因而在糖链局部形成螺旋结构,呈有活性的高级构象,且有序性增大,从而增强多糖的活性[16]。
对多糖进行结构修饰是为了获得活性更大的多糖及多糖衍生物,目前本研究只做了一种硫酸取代度下不同玉竹多糖硫酸酯体外抗肿瘤活性,而玉竹多糖硫酸酯活性与硫酸基团取代度之间关系,硫酸基团引入后玉竹多糖的空间结构变化如何导致生物活性改变还有待进一步的研究。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[M].北京:中国医药科技出版社,2010:78.
[2]季峰,魏贤勇,刘广龙,等.水溶性玉竹多糖降血糖作用的实验研究[J].江苏中医药,2006,27(9):70-71.
[3]许金波,陈正波.水溶性玉竹多糖抗肿瘤作用及其对免疫功能影响的实验研究[J].深圳中西医结合杂志,1996,6 (1):13-15.
[4]谢明勇,王之珺,谢建华.多糖的硫酸化修饰及其结构与生物活性关系研究进展[J].中国食品学报,2015,15(2): 1-8.
[5]郭振环.硫酸化香菇多糖的抗病毒和增强免疫活性及其与其他几种硫酸化多糖的比较[D].南京:南京农业大学,2010.
[6]燕航,钟耀广,王淑琴,等.硫酸酯化香菇多糖衍生物制备的研究[J].化学与生物工程,2006,23(3):44-45
[7]李珺.香菇多糖的制备及衍生化的研究[D].上海:上海海洋大学,2010.
[8]王亚辉.香菇多糖硫酸酯的制备纯化、鉴定及生物学活性的研究[D].南京:南京师范大学,2005.
[9]李钟,刘敏,何镇星,等.玉竹中酸性多糖的分离纯化及单糖组成分析[J].中国实验方剂学杂志,2013,19(9):69-72.
[10]刘敏,李钟,李雪银,等.水煎煮法提取玉竹多糖的动力学模型研究[J].广东药学院学报,2015,31(2):168-172
[11]高艳艳.黄芪多糖增强疫苗免疫效力及机理研究[D].兰州:中国农业科学院,2006.
[12]王蕊霞,刘晓宇.不同提取工艺下葛根多糖的比较研究[J].食品工业科技,2008,29(4):191-194.
[13]王展.菟丝子多糖的分离纯化、结构分析和生物活性研究及一些多糖方法学的研究[D].上海:中国科学院上海药物研究所,2000.
[14]MIHAI D,MOCANU G,CARPOV A.Chemical reactions on polysaccharides I.Pullulan sulfation[J].Eur Polymer J,2001,37(3):541-543
[15]孙汉文,许城燕,赵燕燕,等.枸杞多糖硫酸酯化修饰及其对Hela细胞的体外抑制作用[J].河北大学学报:自然科学版,2009,29(6):591-595.
[16]邹明畅,何立巍,蔡宝昌,等.昆布多糖硫酸酯化及其结构研究[J].河南中医学院学报,2009,24(2):26-30.
(责任编辑:陈翔)
Sulfated modification of water-soluble Polygonatum odoratum polysaccharides and its inhibiting effect on growth of HepG-2 cells in vitro
WANG Qiang1,LI Zhong1,ZHANG Weiwei1,CHEN Juyin1,LIU Tasi2
(1.School of Traditional Chinese Medicine,Guangdong Pharmaceutical University,Guangzhuo 510006,China;2.School of Pharmacy,Hunan University of Traditional Chinese Medicine,Changsha 410208,China)
ObjectiveTo sulfate refined polysaccharide extracted from Polygonatum odoratum and analysis the change in its anti-tumor activity in vitro.MethodsWater-soluble polysaccharide isolated from Polygonatum odoratum were chemically modified by using sulfur trioxide-pyridine.The changes in spectral properties of sulfated polysaccharide were analyzed by FT-IR spectroscopy.The HepG-2 cells were used to evaluate the in vitro anti-tumor activity of polygonatum polysaccharide and sulfated polysaccharide.ResultsThe degree of sulfation of POPZ80(neutral polysaccharide)and POPS80(acid polysaccharide)could reach 1.23 and 0.26.The sulfated derivatives could significantly inhibit the growth of HepG-2 cells.The inhibition rate was positively correlated with the concentration in the certain concentration range.ConclusionThe in vitro antitumor activity of refined Polygonatum odoratum polysaccharide was enhanced after sulfated modification.
Refined Polygonatum odoratum polysaccharide;sulfation of polysaccharide;degrees of sulfation;HepG-2;in vitro antitumor activity
R284.1
:A
10.3969/j.issn.1006-8783.2015.05.006
1006-8783(2015)05-0585-04
2015-07-27
国家科技部支撑计划项目(SQ2010BAJY1411-09)
王强(1990—),男,2013级硕士研究生;通信作者:李钟(1973—),女,副教授,硕士研究生导师,从事中药质量与资源的研究,Email:lizhongi@126.com。
时间:2015-10-09 15:34
http://www.cnki.net/kcms/detail/44.1413.R.20151009.1534.002.html
