广藿香内生真菌Bipolaris sorokiniana的次级代谢产物及其抗肿瘤活性研究
2015-01-06王沫陈玉婵李浩华孙章华谭国慧严寒静章卫民郭晓玲
王沫,陈玉婵,李浩华,孙章华,谭国慧,严寒静,章卫民,郭晓玲
(1.广东药学院中心实验室,广东广州510006;2.广东省微生物研究所/省部共建华南应用微生物国家重点实验室/广东省菌种保藏与应用重点实验室/广东省微生物应用新技术公共实验室,广东广州510070)
天然药物化学
广藿香内生真菌Bipolaris sorokiniana的次级代谢产物及其抗肿瘤活性研究
王沫1,2,陈玉婵2,李浩华2,孙章华2,谭国慧2,严寒静1,章卫民2,郭晓玲1
(1.广东药学院中心实验室,广东广州510006;2.广东省微生物研究所/省部共建华南应用微生物国家重点实验室/广东省菌种保藏与应用重点实验室/广东省微生物应用新技术公共实验室,广东广州510070)
目的研究分离自广藿香中的内生真菌索氏平脐蠕孢(Bipolaris sorokiniana,A606)的活性次级代谢产物,并初步考察其抗肿瘤活性。方法采用正相硅胶柱层析、C18反相硅胶柱层析、Sephadex LH-20凝胶柱层析、高效液相色谱法以及薄层层析等色谱技术对菌株A606发酵液的乙酸乙酯萃取物进行分离纯化,并通过各种波谱分析进行结构鉴定;采用SRB染色法对化合物进行细胞毒活性研究。结果从发酵液的乙酸乙酯萃取物中分离鉴定出8个化合物,分别为麦角甾-4,6,8(14),22-四烯-3-酮(1)、2-[4-(2-aminoethoxy)phenyl]ethanol(2)、邻苯二甲酸-二(2-乙基-己基)酯(3)、5-羟甲基糠醛(4)、3,5-二羟基甲苯(5)、对羟基苯乙醇(6)、5-甲基-2-呋喃甲醇(7)、3,4,6-trimethylcyclohex-3-en-1-ol(8);化合物1对4种肿瘤细胞株SF-268、MCF-7、NCI-H460和HepG-2的IC50值分别为20.84、15.31、13.62、25.45 μmol/L。结论化合物1~4、7~8均为首次从该属真菌中分离得到,其中化合物1对4种肿瘤细胞具有显著的抑制作用。
索氏平脐蠕孢;内生真菌;广藿香;细胞毒活性
植物内生真菌(endophytic fungi)是指生活史的一定阶段或全部阶段生活在健康植物组织内,但不对植物组织引起明显病害症状的真菌[1]。内生真菌物种丰富多样,它们处于植物内部的特殊环境中,能够产生各种结构的次生代谢产物,容易从中发现结构新颖并具有多种生物活性的化合物[2]。因此,内生真菌已成为发现新天然活性物质的重要资源,在农业和医药工业中具有重要的应用潜力。
广藿香[Pogostemon cablin(Blanco)Benth.]为唇形科草本药用植物,本课题组前期对广藿香内生真菌索氏平脐蠕孢(Bipolaris sorokiniana,A606)发酵液的乙酸乙酯萃取物进行了抗肿瘤活性筛选,发现其对肝癌细胞(HepG-2)、神经癌细胞(SF-268)、乳腺癌细胞(MCF-7)和肺癌细胞(NCI-H460)有明显的抑制作用(100 μg/mL的浓度下,对4种肿瘤细胞的抑制率全部超过80%)。为了进一步发掘该菌株A606的活性次级代谢产物,本文对该菌株进行了大量液体发酵培养,对获得的菌株发酵液乙酸乙酯萃取物进行分离纯化,从中分离得到8个单体化合物,分别鉴定为麦角甾-4,6,8(14),22-四烯-3-酮(1)、2-[4-(2-aminoethoxy)phenyl]ethanol(2)、邻苯二甲酸-二(2-乙基-己基)酯(3)、5-羟甲基糠醛(4)、3,5-二羟基甲苯(5)、对羟基苯乙醇(6)、5-甲基-2-呋喃甲醇(7)、3,4,6-trimethylcyclohex-3-en-1-ol(8),并对以上化合物进行了细胞毒活性测试。
1 材料、试剂与仪器
1.1 生物材料及菌株鉴定
肝癌细胞(HepG-2)、神经癌细胞(SF-268)、乳腺癌细胞(MCF-7)和肺癌细胞(NCI-H460)均由江苏省药用植物生物技术重点实验室蒋继宏教授提供。索氏平脐蠕孢A606从广东省高要市采集的广藿香中分离获得,广藿香由广东药学院中药学院严寒静副教授鉴定为 Pogostemon cablin(Blanco) Benth.。将分离得到的菌株经总DNA制备,采用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′,正向)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′,反向)扩增分离菌株rDNA ITS区,测序获得的序列(GenBank登录号为 KF494823)通过BLAST程序在GenBank上进行相似性序列检索分析,结果与 Bipolaris sorokiniana B41(GenBank登录号为KF725816)的相似度为99.6%,因此鉴定菌株A606为索氏平脐蠕孢Bipolaris sorokiniana。菌种保存于广东省微生物研究所。
1.2 试剂
柱色谱硅胶(100~200目,200~300目,青岛海洋化工厂);GF254高效薄层硅胶板(Merck公司);C18反相硅胶(40~75 μm,Fuji Silysia Chemical Ltd.);凝胶Sephadex LH-20(18~110 μm,Amersham Biosciences Ltd.);其余试剂均为分析纯,购自广州化学试剂厂。1.3 仪器
AVANCE III型 500 MHz核磁共振波谱仪(Bruker公司);API 2000 LC/MS/MS质谱仪(MDS Sciex公司);LC-20AT型高效液相色谱仪(日本岛津公司);ZF-6型三用紫外线分析仪(上海嘉鹏科技有限公司);Hangping FA2004电子天平(上海精密科学仪器有限公司);PZ1000B旋转式大容量普通摇床(武汉瑞华仪器设备有限公司);RE-2000型旋转蒸发仪(上海亚荣生化仪器厂);超净工作台(上海恒益科技有限公司)。
2 方法
2.1 菌株的发酵培养
菌株的发酵培养基为马铃薯葡萄糖(PD)液体培养基:马铃薯 200 g/L,葡萄糖 20 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,维生素B1 0.01 g/L,pH自然。在无菌条件下,用接种铲挑取适量菌体接种到装有250 mL培养液的500 mL锥形瓶中,在28℃、120 r/min的条件下摇床培养5 d,获得种子液,然后取适量种子液转接到装有250 mL培养液的500 mL锥形瓶中,培养条件与种子液相同,培养7 d,共接种120 L。
2.2 提取与分离
取发酵产物120 L用4层纱布滤过,得发酵液和菌丝体,发酵液用乙酸乙酯萃取5次(发酵液-乙酸乙酯体积比为1∶1),40℃下减压浓缩,得到发酵液粗提物18.8 g。发酵液粗提物经硅胶柱(石油醚-乙酸乙酯体积比50∶1~1∶2和二氯甲烷-甲醇体积比为5∶1)梯度洗脱,用薄层色谱检测(显色剂为茴香醛-浓硫酸试剂),合并相似组分,得到32个组分(Fr.1~Fr.32)。Fr.13经Sephadex LH-20以二氯甲烷-甲醇(体积比1∶1)洗脱得到亚组分Fr.13-3和Fr.13-4,将Fr.13-3经正相硅胶柱层析(石油醚-乙酸乙酯体积比30∶1)和PTLC制备得化合物3(8.6 mg),将Fr. 13-4过反相硅胶柱层析(甲醇-水体积比30∶70)得到化合物1(4.6 mg)。将Fr.30-5-7过反相硅胶柱层析(甲醇-水体积比30∶70~60∶40)得到化合物8(2.1 mg),将Fr.30-6过反相硅胶柱层析(甲醇-水体积比30∶70)得到化合物2(3.0 mg)。Fr.18经Sephadex LH-20以二氯甲烷-甲醇(体积比1∶1)洗脱、反相硅胶柱层析(甲醇-水体积比20∶80)得化合物4(5.6 mg)。Fr.20经Sephadex LH-20以二氯甲烷-甲醇(体积比1∶1)洗脱得Fr.20-6~Fr.20-6。将Fr.20-5经反相硅胶柱层析(甲醇-水体积比20∶80~50∶50)得到Fr.20-5-2,通过制备YMC-Pack SIL正相柱(正己烷-乙酸乙酯体积比1∶1]纯化得到化合物5(4.6 mg)。将Fr.20-6过反相硅胶柱层析(甲醇-水体积比30∶70)、制备薄层色谱、制备YMC-Pack SIL正相柱(正己烷-乙酸乙酯体积比1∶1)得到化合物6(14.5 mg)。Fr.30 经Sephadex LH-20以二氯甲烷-甲醇(体积比1∶1)洗脱得Fr.30-5~Fr.30-6。将Fr.30-5经反相硅胶柱层析(甲醇-水体积比20∶80~50∶50)得到 Fr.30-5-4~Fr.30-5-7,将Fr.30-5-4过反相硅胶柱层析(甲醇-水体积比60∶40)纯化得到化合物7(1.4 mg)。
3 结构鉴定
化合物1:淡黄色结晶(三氯甲烷)。ESI-MS m/z: 393.1[M+H]+,分子式为 C28H40O。1H-NMR(500 MHz,CDCl3)δ:6.58(1H,d,J=9.5 Hz,H-7),6.00 (1H,d,J=9.6 Hz,H-6),5.71(1H,s,H-4),5.20 (2H,qd,J=15.3,7.7 Hz,H-22,H-23),2.51(1H,m,Ha-2),2.43(2H,m,Hb-2,H-17),2.35(1H,m,H-24),2.12(2H,dd,J=15.9,8.0 Hz,H-15),2.06(1H,m,H-9),1.99(1H,ddd,J=13.1,5.2,2.3 Hz,H-20),1.84(1H,m,Ha-1),1.77(2H,m,Ha-11,Ha-12),1.68(1H,ddd,J=13.5,6.6,3.4 Hz,Hb-12),1.59 (1H,ddd,J=14.8,11.5,3.3 Hz,Hb-11),1.46(1H,m,Ha-16),1.27(1H,m,Hb-1),1.22(1H,m,Hb-16),1.03(3H,d,J=6.7 Hz,Me-27),0.97(3H,s,Me-19),0.93(3H,s,Me-18),0.90(3H,d,J=6.8 Hz,Me-21),0.82(3H,d,J=6.7 Hz,Me-28),0.80(3H,d,J=6.8 Hz,Me-26)。13C-NMR(125 MHz,CDCl3)δ:199.8 (C-3),164.7(C-5),156.4(C-14),135.2(C-7),134.3(C-23),132.7(C-22),124.6(C-6),124.6(C-8),123.2(C-4),55.9(C-17),44.5(C-10),44.2(C-9),43.1(C-13),39.5(C-24),37.0(C-20),35.8(C-2),34.3(C-15),33.3(C-25),27.9(C-16),25.6(C-11),21.4(C-12),20.2(C-1),19.9(C-27,C-28),19.2(C-19,C-26),17.8(C-21),16.8(C-18)。以上数据与文献[3]报道基本一致,鉴定该化合物为Ergosta-4,6,8(14),22-tetraen-3-one。
化合物2:淡黄色油状液体(甲醇)。ESI-MS m/z: 163.0[M-H2O]-,分子式为 C10H15NO2。1H-NMR (500 MHz,CD3OD)δ:7.01(2H,m,H-3,H-5),6.68 (2H,m,H-2,H-6),4.04(1H,m,Ha-1′),3.86(1H,m,Hb-1′),3.67(2H,d,J=1.9 Hz,H-4′),2.68(2H,d,J=6.9 Hz,H-2′),1.84(2H,m,H-3′)。13C-NMR (125 MHz,CD3OD)δ:156.9(C-1),131.6(C-3,C-5),131.1(C-4),116.2(C-2,C-6),71.6(C-1′),60.5 (C-4′),44.7(C-2′),40.1(C-3′)。以上数据与文献[4]报道基本一致,鉴定为2-[4-(2-aminoethoxy) phenyl]ethanol。
化合物3:淡黄色油状液体(三氯甲烷)。ESIMS m/z:391.3[M+H]+,分子式为 C24H38O4。1HNMR(500 MHz,CD3OD)δ:7.73(2H,dd,J=5.7,3.3Hz,H-3,H-6),7.63(2H,dd,J=5.7,3.3Hz,H-4,H-5),4.23(4H,m,H-1′,H-1″),1.71(2H,m,H-2′,H-2″),1.46-1.30(16H,m,H-3′,H-3″,H-4′,H-4″,H-5′,H-5″),0.97-0.93(12H,m,Me-6′,Me-6″,Me-8′,Me-8″)。13C-NMR(125 MHz,CD3OD)δ:168.8(—COO—),133.1(C-1,C-2),131.89(C-3,C-6),129.4(C-4,C-5),68.6(C-1′,C-1″),39.7(C-2′,C-2″),31.1(C-3′,C-3″),29.6(C-4′,C-4″),24.4(C-7′,C-7″),23.5(C-5′,C-5″),13.9(C-6′,C-6″),10.9(C-8′,C-8″)。以上数据与文献[5]报道基本一致,鉴定为邻苯二甲酸-二(2-乙基-己基)酯。
化合物4:无色油状液体(三氯甲烷)。ESI-MS m/z:127.0[M+H]+,分子式为 C6H6O3。1H-NMR (500 MHz,CDCl3)δ:9.57(1H,s,CHO),7.19(1H,d,J=3.5 Hz,H-6),6.50(1H,d,J=3.48 Hz,H-4),4.70(2H,s,CH2OH)。13C-NMR(125 MHz,CDCl3) δ:177.9(CHO),160.7(C-5),152.6(C-2),123.0(C-3),110.2(C-4),57.9(C-6)。以上数据与文献[6]报道基本一致,鉴定该化合物为5-羟甲基糠醛。
化合物5:无色油状液体(甲醇)。ESI-MS m/z: 107.0[M+H-H2O]+,分子式为 C7H8O2。1H-NMR (500 MHz,CD3OD)δ:6.10(2H,m,H-2,H-6),6.04 (1H,td,J=2.2,0.5 Hz,H-4),2.16(3H,d,J=0.5 Hz,Me-7)。13C-NMR(125 MHz,CD3OD)δ:159.5(C-1,C-3),141.3(C-5),108.7(C-2,C-6),100.8(C-4),21.7(C-7)。以上数据与文献[7]报道基本一致,鉴定该化合物为3,5-Dihydroxytoluene。
化合物6:淡黄色结晶(甲醇)。ESI-MS m/z: 137.2[M+H]+,分子式为 C8H10O2。1H-NMR(500 MHz,CD3OD)δ:7.1(1H,m,H-2),6.99(1H,m,H-6),6.68(1H,m,H-3),6.67(1H,m,H-5),3.65(2H,J=7.2 Hz,t,H-8),2.69(2H,J=7.2 Hz,t,H-7)。13CNMR(125 MHz,CD3OD)δ:156.9(C-1),131.2(C-3,C-5),131.0(C-4),116.3(C-2,C-6),64.7(C-8),39.5 (C-7)。以上数据与文献[8]报道基本一致,鉴定该化合物为对羟基苯乙醇。
化合物 7:白色固体(甲醇)。ESI-MS m/z: 111.0[M+H]+,分子式为 C6H8O2。1H-NMR(500 MHz,CD3OD)δ:6.32(1H,d,J=8.0 Hz,H-3),6.28 (1H,d,J=2.1 Hz,H-4),4.61(2H,s,-CH2OH),2.24 (3H,s,Me-6)。13C-NMR(125 MHz,CD3OD)δ:155.0 (C-2),141.4(C-5),105.0(C-3),103.0(C-4),57.3 (-CH2OH),18.7(C-6)。以上数据与文献[9]报道基本一致,鉴定该化合物为5-甲基-2-呋喃甲醇。
化合物8:白色固体(三氯甲烷)。ESI-MS m/z: 174.9[M+Cl]-,分子式为 C9H16O。1H-NMR(500 MHz,CDCl3)δ:4.10(1H,d,J=6.7 Hz,H-1),2.08 (1H,m,Ha-2),2.02(1H,m,Ha-5),1.47(1H,d,J=7.2 Hz,Hb-2),1.44(1H,d,J=6.3 Hz,Hb-5),1.37 (1H,m,H-6),1.26(3H,s,Me-7),1.21(3H,s,Me-8),1.00(3H,d,J=6.7 Hz,Me-9)。13C-NMR(125 MHz,CDCl3)δ:131.7(C-3),129.8(C-4),72.7(C-1),54.8(C-2),31.0(C-6),30.4(C-5),24.6(C-7),19.7(C-8),16.4(C-9)。以上数据与文献[10]报道基本一致,鉴定该化合物为3,4,6-trimethylcyclohex-3-en-1-ol。
4 细胞毒活性测试
采用SRB法[11]测定粗提物细胞毒活性。取对数生长期的HepG-2、NCI-H460、SF-268、MCF-7细胞,用胰酶消化,台盼蓝染色计数,台盼蓝排斥实验检测细胞活力大于95%后,用新鲜培养基调整细胞浓度为3 ×104个/mL,细胞接种于96孔板,每孔加入细胞悬液180 μL,并设3个空白孔调零,于37℃、体积分数5% CO2培养箱培养24 h。待细胞贴壁后,每孔加入20 μL待测样品,阴性对照加20 μL培养基,以顺铂作阳性对照。置CO2培养箱中培养72 h后,加入质量分数50%冷三氯醋酸50 μL固定细胞,4℃放置1 h后用蒸馏水洗涤5次,空气中自然干燥。然后加入由1%(质量分数,下同)冰醋酸配制的4 mg/mL SRB溶液(100 μL/孔),室温中染色30 min,去上清,用1%冰醋酸洗涤5次,空气干燥。最后加入10 mmol/mL的Tris溶液(200 μL/孔),用酶标仪测定570 nm处的吸光值(A),用公式:细胞生长抑制率=[A空白对照组-A样品组]/A空白对照组×100%,计算粗提物对细胞生长的抑制率。结果显示其他化合物在100 μmol/L浓度下,对4种肿瘤细胞的抑制率均低于20%,几乎没有活性,而化合物1对4种肿瘤细胞均有显著的抑制作用,见表1。
表1 化合物1对4种肿瘤细胞株的IC50值Table 1 IC50values of compound 1 against four tumor cells lines (±s,n=3)
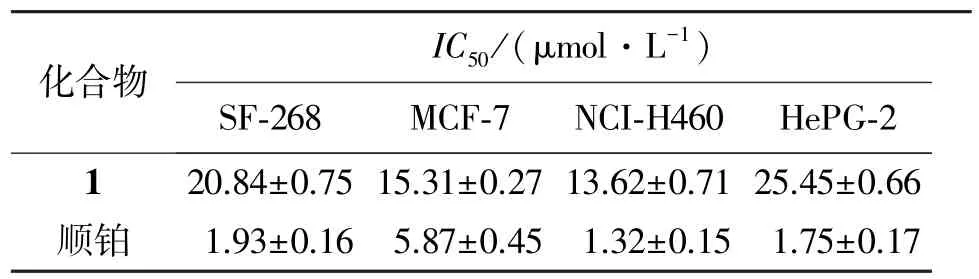
表1 化合物1对4种肿瘤细胞株的IC50值Table 1 IC50values of compound 1 against four tumor cells lines (±s,n=3)
化合物IC50/(μmol·L-1) SF-268 MCF-7 NCI-H460 HePG-2120.84±0.75 15.31±0.27 13.62±0.71 25.45±0.66顺铂 1.93±0.16 5.87±0.45 1.32±0.15 1.75±0.17
5 讨论
平脐蠕胞属(Bipolaris)真菌是一类寄生多种植物或生于多种植物基质,分布广泛,具有重要经济意义的真菌类群[12]。本文从分离自广藿香内生真菌索氏平脐蠕孢Bipolaris sorokiniana A606的发酵液中分离并鉴定了8个化合物,其中化合物1~4、7~8均为
首次从该属真菌中分离得到。化合物1具有抗肿瘤[13]、利尿[14]、免疫调节等活性[15],对慢性肾衰竭具有保护作用[16],本文结果也表明该化合物对4种肿瘤细胞株具有显著的抑制作用。化合物6为橄榄油中酚类化合物的主要成分,具有多种生物活性[17]。
[1]TAN R X,ZOU W X.Endophytes:A rich source of functional metabolites[J].Nat Prod Rep,2001,18(4):448-459.
[2]施琦渊,陈晓梅,郭顺星.植物内生真菌来源的抗菌活性物质研究进展[J].中国药学杂志,2007,42(11):804-807.
[3]GAN K H,FANN Y F,HSU S H,et al.Mediation of the cytotoxicity of lanostanoids and steroids of ganoderma tsugae through apoptosis and cell cycle[J].J Nat Prod,1998,61 (4):485-487.
[4]MITANI K,SAKURAI S,SUZUKI T,et al.Novel phenoxyalkylamine derivatives.V.synthesis,α-blocking activity and quantitative structure-activity analysis of α-[(phenoxyethylamino)propyl]-α-phenylacetonitrile derivatives[J]. Chem Pharm Bull,1988,36(10):4121-4135.
[5]杜国顺,蔡祥海,尚建华,等.灯台叶中的非碱性成分[J].中国天然药物,2007,5(4):259-262.
[6]丁霞,王明艳,余宗亮,等.山茱萸中5-羟甲基糠醛的分离鉴定及生物活性研究[J].中国中药杂志,2008,31 (1):4125-4128.
[7]MONDE K,SATOH H,NAKAMURA M,et al.Organochlorine compounds from a terrestrial higher plant:structures and origin of chlorinated orcinol derivatives from diseased bulbs of Lilium maximowiczii[J].J Nat Prod,1998,61(7):913-921.
[8]李军,张淑霞,郭华强,等.紫丁香树皮中羟基苯乙醇类化合物的提取方法及含量研究[J].化学与粘合,2008,31(1):37-39.
[9]KIM B Y,AHN J B,LEE H W,et al.Synthesis and biological activity of novel substituted pyridines and purines containing 2,4-thiazolidinedione[J].Eur J Med Chem,2004,39(5):433-447.
[10]SINGLETON D A,KIM K,MARTINEZ J P.Diels-Alder reactions of 2-alkenylboranes and cis-1-alkenylboranes. Anomalous selectivity that allows a choice of regiochemistry [J].Tetrahedron Lett,1993,34(19):3071-3074.
[11]SKEHAN P,STORENG R,SCUDIERO D,et al.New colorimetric cytotoxicity assay for anticancer-drug screening [J].J Nat Cancer Inst,1990,82(12):1107-1112.
[12]邓晖,张天宇.中国平脐蠕孢属的分类研究[J].菌物系统,2002,21(3):327-333.
[13]LEE W Y,PARK Y K,AHN J K,et al.Cytotoxic activity of ergosta-4,6,8(14),22-tetraen-3-one from the sclerotia of Polyporus umbellatus[J].B Kor Chem Soc,2005,26 (9):1464-1466.
[14]YUAN D M J,KOMATSU KI,MAKINO T,et al.An antialdosteronicdiuretic component(drain dampness) in Polyporus sclerotium[J].Biol Pharm Bull,2004,27(6): 867-870.
[15]FUJIMOTO H,NAKAMURA E,OKUYAMA E,et al.Six immunosuppressive features from an ascomycete,Zopfiella longicaudata,found in a screening study monitored by immunomodulatory activity[J].Chem Pharm Bull,2004,52(8):1005-1008.
[16]ZHAO Y Y,SHEN X,CHENG X L,et al.Urinary metabonomics study on the protective effects of ergosta-4,6,8(14),22-tetraen-3-one on chronic renal failure in rats using UPLC Q-TOF/MS and a novel MSE data collection technique[J].Process Biochem,2012,47(12):1980-1987.
[17]王红亮,史慧贤,姜申德.羟基酪醇的研究进展[J].化工进展,2010,29(6):1133-1137.
(责任编辑:陈翔)
Study on secondary metabolites of endophytic fungus Bipolaris sorokiniana from Pogostemon cablin and their antitumor activities
WANG Mo1,2,CHEN Yuchan2,LI Haohua2,SUN Zhanghua2,TAN Guohui2,YAN Hanjing1,ZHANG Weimin2,GUO Xiaoling1
(1.Central Laboratory,Guangdong Pharmaceutical University,Guangzhou 510006,China;2.State Key Laboratory of Applied Microbiology Southern China,Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application,Guangdong Open Laboratory of Applied Micrbiology,Guangdong Institute of Microbiology,Guangzhou 510070,China)
ObjectiveTo study the active secondary metabolites of the endophytic fungus Bipolaris sorokiniana,A606 isolated from Pogostemon cablin and their antitumor activities.MethodsThe compounds were isolated and purified from the ethyl acetate extract of the strain A606 fermentation broth by silica gel,reverse phase silica gel,Sephadex-LH20,high performance liquid chromatography and preparative TLC.Their structures were identified by extensive analysis of their spectroscopic data.All isolated compounds were evaluated for their cytotoxic activities against human tumor cell lines by the SRB assay.ResultsEight compounds were isolated and identified as Ergosta-4,6,8(14),22-tetraen-3-one(1),2-[4-(2-aminoethoxy)phenyl]ethanol(2),Di-(2-ethylhexyl)phthalate(3),5-(hydroxymethyl)furan-2-carbaldehyde(4),3,5-Dihydroxytoluene(5),2-(4-Hydroxyphenyl)ethanol(6),(5-methylfuran-2-yl) methanol(7),3,4,6-trimethylcyclohex-3-en-1-ol(8).Compound 1 showed cytotoxic activity against four tumor cell lines SF-268,MCF-7,NCI-H460 and HepG-2 with IC50values of 20.84,15.31,13.62 and 25.45 μmol/L,respectively.Conclusion Compounds 1~4、7~8 were isolated from the genus Bipolaris for the first time.Compound 1 displayed the significant cytotoxic activity.
Bipolaris sorokiniana;endophytic fungus;Pogostemon cablin;cytotoxic activity
R284.1
:A
10.3969/j.issn.1006-8783.2015.05.004
1006-8783(2015)05-0576-05
2015-09-02
国家 973前期专项项目(2014CB460613);国家自然科学基金项目(81203006);广东省自然科学基金项目(2015A030313710,S2012010009773)
王沫(1989—),女,2013级硕士研究生,从事微生物天然产物研究,Email:wangmo1989111@126.com;通信作者:章卫民(1965—),男,博士,研究员,从事药用微生物资源及其活性物质,电话:020-87688309,Email:wmzhang58@qq.com;郭晓玲(1961—),女,副教授,从事药物分析、中药新剂型及质量控制研究,电话:020-39352523,Email:13922409242 @163.com。
时间:2015-09-28 15:28
http://www.cnki.net/kcms/detail/44.1413.R.20150928.1528.008.html
