线栓法制备大鼠大脑中动脉闭塞/再灌注模型的改进及评价
2015-01-06田芳张昊莫灿龙胡辉谭文
田芳,张昊,莫灿龙,胡辉,谭文
(华南理工大学生物科学与工程学院/生物医药前孵化器研究中心/广东省发酵与酶工程重点实验室,广东广州510006)
线栓法制备大鼠大脑中动脉闭塞/再灌注模型的改进及评价
田芳,张昊,莫灿龙,胡辉,谭文
(华南理工大学生物科学与工程学院/生物医药前孵化器研究中心/广东省发酵与酶工程重点实验室,广东广州510006)
目的建立稳定可靠、成功率高的大鼠大脑中动脉闭塞/再灌注(MCAO/R)模型。方法25只SD大鼠随机分为MCAO/R组(n=15)和假手术组(n=10),采用改进的Longa线栓法制作大鼠MCAO/R模型;术后1、3、7 d评估大鼠神经功能;术后7 d TTC染色计算脑梗死体积;HE染色检查组织形态变化,NeuN免疫组织化学染色检测神经元存活状况。结果模型成功率为86.7%;成功的模型动物均出现了明显的神经功能缺损;脑梗死体积为35.5%±1.2%(梗死体积/对侧半球体积);损伤侧脑组织出现明显病理改变,神经元大量死亡。结论改进法制备的大鼠MCAO/R模型成功率高、重复性及稳定性好,可更好地应用于脑缺血/再灌注损伤的相关研究。
大脑中动脉闭塞/再灌注;大鼠;动物模型;线栓
脑梗死是危害人类健康的主要疾病之一,该病大多发生于大脑中动脉(MCA)[1]。大鼠MCAO/R模型是研究脑梗死最常用的动物模型之一,通常通过线栓的插入和拔出造成MCA的栓塞及再灌注。线栓头部大小和形状对模型的成功至关重要。然而,常用的灼烧法制成的线栓造模成功率较低,且阻塞效果在不同体质量大小的动物间差别较大,导致模型稳定性较差,从而对脑缺血疾病的研究和药物作用的评价造成了一定影响。本研究针对这一问题,采用硅胶包被技术对线栓头端进行处理,并使动物体质量与线栓头端直径相匹配,从而更成功、有效的阻断流向MCA的血流,同时通过脑血流的实时监测及建模后组织学等的评价验证模型的成功及稳定性,为相应研究提供重要基础。
1 材料与方法
1.1 主要试剂与仪器
2,3,5-氯化三苯基四氮唑(TTC,美国Sigma,批号:101315079);鼠Anti-NeuN(美国Milipore,批号: MAB377);二抗(丹麦DAKO,批号:K4001);市售鱼线(0.28 mm);XT-X-4A手术显微镜(镇江新天医疗器械有限公司);PA15139动物脉搏血氧仪(美国MouseOx Plus Starr Life Sciences);PF5001激光多普勒血流仪(瑞典Perimed AB);RM2255旋转式切片机(德国Leica);DM4000光学显微镜(德国Leica)。
1.2 实验动物与分组
成年雄性SD大鼠,体质量250~300 g,购自中山大学实验动物中心,生产许可证号:SCXK(粤) 2011-0029。25只动物随机分为2组:MCAO/R组(n=15)和假手术组(n=10)。
1.3 线栓制备
将直径0.28 mm的鱼线剪成3 cm长的线段,在其前段(5~6 mm)均匀包裹一薄层硅胶,凉干后在手术显微镜下选取硅胶包被均匀光滑、头端圆钝的线栓,游标卡尺测量其头端直径,挑出直径0.36 mm及0.38 mm左右的线栓,在距离其前端2 cm处作标记。1.4 建立MCAO/R大鼠模型
1.4.1 术前准备 实验前大鼠饲养在25℃室温,12 h昼夜交替,自由摄食和饮水的环境里。术前禁食12 h,不禁水。
1.4.2 模型制作 5%(φ)异氟烷麻醉大鼠,用恒温电热毯使其体温维持在(37.0±0.5)℃,改进Longa 法[2]制作MCAO/R模型。颈部正中切口,钝性分离颈部肌肉,手术显微镜下暴露右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。沿ICA继续向颅底方向分离出翼腭动脉(PPA)并将其结扎。在CCA分叉下方剪一个小口,然后将硅胶包被的线栓通过这个小口插入(体质量250~280 g大鼠使用头端直径0.36 mm线栓;体质量280~300 g大鼠使用头端直径0.38 mm线栓),继续前进使线栓进入ICA直到其头部到达MCA根部,这时可以感觉到轻微的阻力,从CCA分叉处算起,进入颈内动脉的线栓长度约为18~22 mm,这样便阻断了流向MCA的血流。MCA闭塞2 h后再次麻醉大鼠,轻轻将线栓拔出使血流重新流入MCA。假手术组的手术操作步骤基本同MCAO/R组,但无线栓插入。
术中使用激光多普勒血流仪监测脑血流以判断模型是否成功,在囟门后侧2 mm,右侧5 mm处[2]用多普勒探头分别于MCA闭塞前、闭塞后及再灌注后测脑血流。闭塞后该处血流下降到闭塞前的30%以下则标志着缺血成功,这是造成神经元损伤的前提[4],再灌注后血流上升到闭塞前的70%以上则表明未发生颅底出血,再灌注成功[5]。术中同时使用动物脉搏血氧仪监测大鼠心率、动脉血氧饱和度及呼吸频率。术后给予动物充足食物和水。
1.5 神经功能评估
单盲法分别于术后1、3、7 d对大鼠神经功能缺损程度进行评估,方法参照Bederson等[6]的评分法并稍加改进:0分,无缺损,提尾悬空时两前肢均可伸直。1分,轻度缺损,提尾悬空时左侧前肢屈曲、肩内收。2分,中度缺损,提尾悬空时左侧前肢屈曲、肩内收;置动物于软塑料板上,施加侧向推力,左侧的侧向推动阻力明显降低,不向左侧转圈。3分,中度到重度缺损,同2分评分中现象,并向左侧转圈。4分:重度缺损,不能自发行走及意识水平下降。
1.6 梗死体积测定
术后7 d对大鼠实施安乐死(MCAO/R组n=8,假手术组n=6),取脑组织将其冠状切为6片,每片厚2 mm,然后将脑片置于2%TTC中,37℃ 孵育约10 min,最终正常脑组织呈红色,梗死脑组织呈白色。染色后的脑片用10%(φ)甲醛溶液缓冲液固定,扫描仪进行正反两面扫描。ImageJ 1.48 u软件测定损伤侧非梗死区面积和对侧半球面积,两者之差即为梗死面积,利用面积乘以切片厚度可分别求得梗死体积与对侧半球体积,最终结果用同侧脑梗死体积占对侧脑半球体积的百分比表示[7]。
1.7 组织切片制作
术后7 d将大鼠深度麻醉(MCAO/R组n=5,假手术组n=4),4%(φ)多聚甲醛溶液经心脏灌流后取脑,然后将脑组织置于10%甲醛溶液中固定至少48 h,选取前囟点前、后各1 mm之间的脑组织块,脱水并包埋到蜡块中。用旋转式切片机将组织块冠状切为5 μm厚的切片,并展平到载玻片上用于后续染色。
1.8 组织学检查
将“1.7”中制好的组织切片进行常规HE染色,并在显微镜下观察两组切片的组织形态学。
1.9 神经元存活状况检测
以anti-NeuN作为一抗,将“1.7”中制好的组织切片进行免疫组织化学染色,检测两组动物脑组织中的神经元存活状况。步骤如下:柠檬酸盐缓冲液煮沸10 min,3%H2O2处理10 min,5%BSA室温封闭30 min,anti-NeuN(1∶2 000)4℃孵育过夜,二抗37℃孵育40 min,DAB显色5 min,苏木素复染5 s,封片后显微镜下观察两组切片的NeuN免疫阳性细胞。
1.10 统计学分析
2 结果
2.1 脑血流变化
MCAO/R组采用头端直径0.36 mm及0.38 mm的线栓闭塞MCA后均使脑血流下降到了闭塞前的30%以下,再灌注后又上升到了闭塞前的70%以上,表明模型构建成功。此外,两种不同规格的线栓与大鼠体质量匹配后造成的脑血流变化一致(表1)。

表1MAO/R组不同直径线栓造成的脑血流变化Table 1Changes of cerebral blood flow caused by different suture diameters in MCAO/R group
2.2 生理参数
如表2所示,所有动物的生理参数均正常、一致,MCAO/R组与假手术组间差异无统计学意义。
2.3 模型成功率及死亡率
本实验 MCAO/R组15只大鼠中,成功构建MCAO/R模型13只,模型成功率为86.7%。其中2只于术后1 d死亡,开颅取脑未发现颅底出血现象,但脑组织出现较严重水肿,死亡率为13.3%。
表2两组实验动物的生理参数Table 2Physiological parameters in two groups(±s)
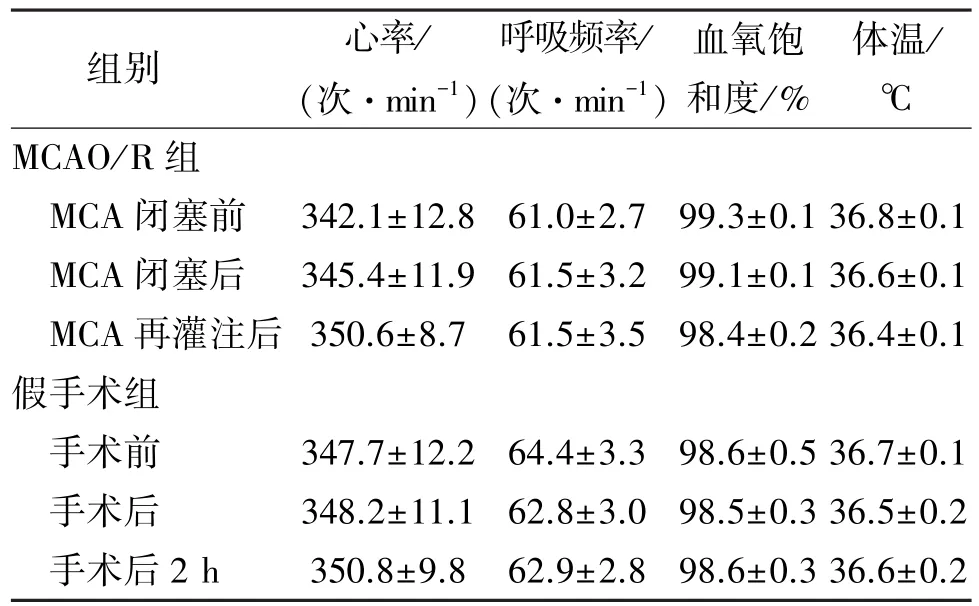
表2两组实验动物的生理参数Table 2Physiological parameters in two groups(±s)
组别 心率/(次·min-1)呼吸频率/(次·min-1)血氧饱和度/%体温/ ℃MCAO/R组MCA闭塞前 342.1±12.8 61.0±2.7 99.3±0.1 36.8±0.1 MCA闭塞后 345.4±11.9 61.5±3.2 99.1±0.1 36.6±0.1 MCA再灌注后 350.6±8.7 61.5±3.5 98.4±0.2 36.4±0.1假手术组手术前 347.7±12.2 64.4±3.3 98.6±0.5 36.7±0.1手术后 348.2±11.1 62.8±3.0 98.5±0.3 36.5±0.2手术后2 h 350.8±9.8 62.9±2.8 98.6±0.3 36.6±0.2
2.4 神经功能缺损评分
术后1、3、7 d,假手术组动物未出现神经功能缺损,各时间点Bederson评分均为0分。而MCAO/R组动物出现了明显神经功能缺损,各时间点Bederson评分依次为3.2±0.1、2.9±0.2、2.5±0.2。MCAO/R组与假手术组相比在每个时间点差异均有统计学意义(P<0.01,图1)。
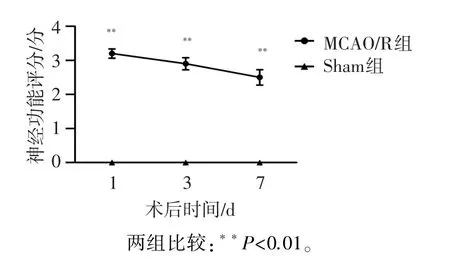
图1 术后1,3,7 d神经功能缺损评分Figure 1 Neurological scores at 1,3 and 7 days after surgery
2.5 梗死体积
TTC染色结果显示(图2),术后7 d假手术组脑组织无损伤表现,MCAO/R组脑组织梗死体积为(35.5%±1.2)%(梗死体积/对侧半球体积)。
2.6 组织学变化
HE染色结果显示,假手术组和MCAO/R组正常侧脑组织细胞间质均匀无异常(图3-A1),高倍镜下可见细胞形态清晰,神经元胞体丰满,未见异常病理变化(图3-B1)。MCAO/R组损伤侧皮层及基底节出现细胞间质疏松现象(图3-A2),高倍镜下可见脑组织损伤区(方框内区域)出现细胞皱缩、核固缩、胞核深染或消失、炎细胞浸润现象(图3-B2)。
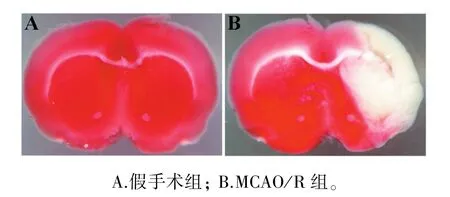
图2 术后7 d各组脑组织TTC染色Figure 2 TTC staining of brain tissues in different groups at 7 days after surgery

图3 术后7 d各组脑组织HE染色Figure 3 HE staining of brain tissues in different groups at 7 days after surgery
2.7 神经元存活状况
NeuN免疫组织化学染色结果显示,假手术组脑组织中可见大量NeuN免疫阳性细胞,而MCAO/R组脑组织损伤区NeuN免疫阳性明显减弱,神经元大量死亡(图4,位置选取同HE染色)。

图4 术后7 d各组脑组织NeuN免疫组织化学染色Figure 4 NeuN immunohistochemical staining of brain tissues in different groups at 7 days after surgery
3 讨论
近年来人们为研究人类脑梗死构建了多种动物模型,其中线栓法制作的大鼠MCAO/R模型具有不开颅、手术操作简便、创伤小、可以控制缺血及再灌注时间等优点,能够最大程度模拟人类脑梗死后的病理生理状态[8],为该病的发病机理研究及药物疗效评估提供了重要基础。
线栓是MCAO/R模型成功的关键因素之一,线栓制作的关键是对其头端的处理。线栓法的倡导者Longa采用的线栓制作方法比较简单,就在其前端加热灼烧形成一光滑而膨大的球形。Laing等[9]认为,Longa的线栓不易推进,且不易堵塞后交通动脉和穿支血管的血供,使得模型成功率和稳定性难以保证。本实验采用头端前段包被硅胶的线栓,这种栓线较头端教烧成光滑圆球的线栓柔软度好,表面光滑,在线栓插入过程中对血管壁损伤小。更因前段5~6 mm范围内有硅胶包被,因此更易阻断MCA血供,栓塞成功率高,重复性好,使得本实验的模型成功率大大提高。
此外,本课题组也曾使用了灼烧法制作的头端膨大的线栓,发现这种线栓在不同体质量大小的动物间对脑血流的阻塞效果不同,导致脑梗死体积变异性较大,因此,除线栓头端包被硅胶外,还应考虑动物体质量与线栓头端直径的匹配。Neil等[10]认为,在成年SD大鼠中,头端直径0.38 mm的线栓能够造成恒定大小的脑梗死体积,但在预实验中发现,大鼠体质量较小时,0.38 mm的线栓会出现难以入颅或入颅后造成颅底出血的现象,因此本实验就Neil的方法作了进一步改进:250~280 g大鼠使用头端直径0.36 mm的线栓,280~300 g大鼠使用头端直径0.38 mm的线栓。结果显示,动物体质量与线栓头端直径相匹配后,两种不同规格的线栓均可顺利入颅并造成恒定的脑血流下降,且未发生颅底出血现象,最终MCAO/R组出现明显且恒定的脑梗死。这一改进方法更加有效地阻断了MCA的血供,进一步降低了动物死亡率,提高了模型成功率及稳定性。
在模型制作过程方面,与Longa法不同的是,本实验的线栓是从颈总动脉插入,手术难度比从颈外动脉插入要小,更易操作,且不刺激气管,对生理结构的损伤小。更重要的是,在手术过程中使用激光多普勒血流仪实时、无创的监测局部脑血流变化,保证了模型的稳定可靠性。同时在手术显微镜下实施操作,较国内流行的目视法,大大提高模型制作效率与成功率,成功制作1只动物模型仅需10~15 min。手术过程中,实时检测和调控动物各项生理参数,保证了动物体温、心率、呼吸频率、血氧饱和度等生理指标的一致性,从而最大限度的排除了除手术之外其他因素对动物造成的影响。
本实验选择为期7 d的观察,旨在进一步确定模型的稳定性,结果发现第7天时大鼠仍表现出明显的神经功能缺损,梗死灶及病理学变化也很明显,因此这一模型也有助于观察药物长期疗效。
通过对动物神经功能缺损程度、脑梗死体积、组织形态变化、神经元存活状况等指标的综合评价,本实验采用改进法制作的MCAO/R模型成功率高、重复性及稳定性好,较好地模拟了人类大脑中动脉缺血溶栓后的病理生理状态,在此模型基础上可从组织、细胞、分子等水平进行多种指标的检测,从而展开对脑梗死病理生理机制的深入研究及药物疗效的评价。
[1]WARDLAW J M,WARLOW C P,COUNSELL C. Systematic review of evidence on thrombolytic therapy for acute ischaemic stroke[J].Lancet,1997,350(9078): 607-614.
[2]LONGA E Z,WEINSTEIN P R,CARLSON S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[3]CONNOLLY E J,WINFREE C J,SPRINGER T A,et al. Cerebral protection in homozygous null ICAM-1 mice after middle cerebralartery occlusion.Role ofneutrophil adhesion in the pathogenesis of stroke[J].J Clin Invest,1996,97(1):209-216.
[4]BENDEL O,PRUNELL G,STENQVIST A,et al. Experimental subarachnoid hemorrhage induces changes in the levels of hippocampal NMDA receptor subunit mRNA [J].Brain Res Mol Brain Res,2005,137(1/2):119-125. [5]NAGEL S,PAPADAKIS M,CHEN R,et al.Neuroprotection by dimethyloxalylglycine following permanent and transient focal cerebral ischemia in rats[J].J Cereb Blood Flow Metab,2011,31(1):132-143.
[6]BEDERSON J B,PITTS L H,TSUJI M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[7]SCHWARTING S,LITWAK S,HAO W,et al.Hematopoietic stem cells reduce postischemic inflammation and ameliorate ischemic brain injury[J].Stroke,2008,39(10):2867-2875.
[8]HOFFMAN G E,MERCHENTHALER I,ZUP S L. Neuropro-tection by ovarian hormones in animal models of neurological disease[J].Endocrine,2006,29(2):217-231.
[9]LAING R J,JAKUBOWSKI J,LAING R W.Middle cerebral artery occlusion without craniectomy in rats. Which method works best?[J].Stroke,1993,24(2): 294-298.
[10]SPRATT N J,FERNANDEZ J,CHEN M,et al.Modification of the method of thread manufacture improves stroke induction rate and reduces mortality after thread-occlusion of the middle cerebral artery in young or aged rats[J].J Neuro Sci Methods,2006,155(2):285-290.
(责任编辑:王昌栋)
An improved method for inducing middle cerebral artery occlusion/reperfusion in rats
TIAN Fang,ZHANG Hao,MO Canlong,HU Hui,TAN Wen
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China;Pre-incubator for Innovative Drugs and Medicine Center,South China University of Technology,Guangzhou 510006,China;Guangdong Provincial Key Laboratory of Fermentation and Enzyme Engineering,Guangzhou 510006,China)
ObjectiveTo establish a stable and reliable model of middle cerebral artery occlusion/ reperfusion(MCAO/R)in rats.MethodsTwenty-five male SD rats were randomly divided into the MCAO/R group(n=15)and the sham-operated group(n=10).The MCAO/R model was established by the modified suture-occluded method of Longa.The neurological deficits were evaluated at 1,3 and 7 days after the surgery.Then the brains were harvested to evaluate the infarct volume by TTC staining,the histomorphological changes by HE staining and the surviving neurons by NeuN immunohistochemical staining.ResultsThe success rate of MCAO/R model was 86.7%.All the model animals showed obvious neurological dysfunction after surgery.The volume of infarction/contralateral hemisphere was(35.5± 1.2)%.Histopathological changes and neuronal deaths occurred obviously in the ipsilateral hemisphere.ConclusionThe MCAO/R model established by the modified method is repeatable and stable with higher success rate,and suitable for study of cerebral ischemia/reperfusion injury.
MCAO/R;rats;animal model;suture
R-331
:A
10.3969/j.issn.1006-8783.2015.05.024
1006-8783(2015)05-0665-05
2015-05-21
广东省科技计划项目(2012B011000050);广州市重大专项科技项目(201300000051)
田芳(1989—),女,2012级硕士研究生,Email:tf623731605@163.com;通信作者:谭文,男,教授,主要从事医药生物学研究,Email:went@scut.edu.cn。
时间:2015-09-12 14:47
http://www.cnki.net/kcms/detail/44.1413.R.20150912.1447.004.html
