紫薯中绿原酸类化合物标准品的制备
2015-01-05李联洪王明奎
李 甫,陈 斌,李联洪,王明奎
(1.中国科学院成都生物研究所,四川 成都 610041;2.成都曼思特生物科技有限公司,四川 成都 610000)
紫薯中绿原酸类化合物标准品的制备
李 甫1,陈 斌1,李联洪2,王明奎1
(1.中国科学院成都生物研究所,四川 成都 610041;2.成都曼思特生物科技有限公司,四川 成都 610000)
从紫薯中提取制备高纯度、市场价值较高的绿原酸类化合物标准品。紫薯切片,采用沸水提取、大孔树脂吸附和凝胶柱色谱分段,然后以反相制备液相色谱获得高纯标准品,最后以核磁共振技术确定化学结构。从紫薯中制备得到异绿原酸A、异绿原酸B、异绿原酸C和3,4,5-O-三咖啡酰基奎宁酸,高效液相色谱检测表明这些化合物的纯度均在98%以上。本研究建立的制备工艺可高效地将紫薯中绿原酸类化合物富集,并快速获得高纯样品,有效地避免了紫薯花色苷类化合物对产品色泽和纯度的影响。
紫薯;绿原酸类化合物;标准品;分离;制备
紫薯(Ipomoea batatas L.)为旋花科甘薯属草本植物,一般认为其原产于热带美洲或中美洲,世界上许多热带或亚热带地区都有广泛种植。在一些发展中国家,紫薯已经成为一种主要的粮食作物。就世界范围而言,紫薯已成为小麦、水稻、玉米、马铃薯、大麦和木薯之后排名第七的主食[1]。研究表明,紫薯含有多种功能性成分,如花青素[2-7]、咖啡酸类化合物[8-10]、黄酮[11]、多糖[12]、游离氨基酸[13]、有机硒[14]和蛋白质等[15],因此,紫薯具有多种生理保健功能,如抗癌[16-17]、降血糖[18-19]、降血压[20]、抗氧化[21-22]等。
紫薯中的绿原酸类化合物主要为咖啡酰基奎宁酸类化合物,这类化合物生物活性好,是许多中药材(如金银花)和相关药品的主要活性成分,常被用来评价相关药材和药品质量的标准物质。然而,部分该类成分,如异绿原酸B、异绿原酸C和3,4,5-三咖啡酰基奎宁酸在传统药材中的含量较低,且结构不稳定,关于这些化合物标准品制备工艺鲜有报道。已有研究和笔者高效液相色谱分析结果表明,紫薯中这些化合物的含量较高,是大量获得其高纯样品的优质资源[8]。但是,研究发现紫薯中的花青素类化合物在多数分离材料上拖尾现象非常严重,直接影响绿原酸类化合物最终产品的色泽和纯度。有文献报道采用高速逆流色谱技术从紫薯中分离得到绿原酸和异绿原酸A,但是这两个化合物在山银花等药材中含量同样较高,市场价值不大,且异绿原酸A的纯度尚未达到标准品的要求,其对最终产品的色泽也没有明确说明[23]。为此,本实验研究从紫薯中获取色泽较好、纯度大于98%的一系列绿原酸类成分的生产工艺。
1 材料与方法
1.1材料与试剂
紫薯KX-3 四川紫金都市农业发展有限公司。
乙腈(色谱纯) 美国Sigma公司;异绿原酸A、异绿原酸B、异绿原酸C、3,4,5-三咖啡酰基奎宁酸标准品 成都曼思特生物科技公司;D72大孔树脂天津波鸿树脂科技有限公司;Sephadex LH-20凝胶北京绿百草科技发展有限公司;其他试剂均为分析纯。
1.2仪器与设备
LC-20AT液相色谱分析仪(配有自动进样器和DAD检测器) 日本岛津公司;LC-6000型制备高效液相色谱仪 北京创新通恒科技有限公司;Ascend 400M核磁共振仪 瑞士Bruker公司。
1.3方法
1.3.1 色谱条件
分析色谱条件:分析型色谱柱:依利特Sinachrom ODS BP(4.6 mm×250 mm,5 μm);柱温:30 ℃;检测波长:280 nm;流速:0.8 mL/min;流动相:乙腈-水-醋酸(22∶73∶5,V/V);进样量:20 μL。
制备色谱条件:制备色谱柱:Daiso-ODS-BP(50 mm×250 mm,10 μm);柱温:室温;检测波长:280 nm;流速:80 mL/min;一次制备流动相:乙腈-水-醋酸(20∶75∶5,V/V);二次制备流动相:乙腈-水-醋酸(18∶77∶5,V/V)。
1.3.2 制备色谱条件的建立
实验考察了不同流动相组成对紫薯中绿原酸类化合物分离效果的影响,发现甲醇-酸水体系对该类化合物的分离度较差,重叠较为严重,而乙腈-酸水体系分离度较好,所以选择乙腈-酸水体系作为制备溶液。
二极管阵列检测器表明绿原酸类化合物的最大吸收波长为326 nm,花色苷类化合物的最大吸收波长为280 nm和530 nm,考虑到该组分主要为绿原酸类成分、花色苷类成分含量较低、制备液相检测器灵敏度不高等因素,将制备液相波长设定为280 nm,以有效地检测到微量的花色苷化合物,获得高纯度的绿原酸类化合物单体。
流速的确定取决于分离度、填料性能和泵的工作能力,综合考虑这3方面因素,本实验分别考察60、80、100 mL/min流速条件下的分离情况,确定流速80 mL/min最为合适。
1.3.3 紫薯绿原酸类化合物的提取与纯化
紫薯(5 kg)切薄片,以沸水提取3 次(20 L/次),每次提取时间10 min,提取液过滤,滤液加浓盐酸至pH 3,该溶液通过D72大孔树脂,纯水洗脱至洗脱液无色,换用甲醇洗脱至树脂无色,甲醇洗脱液浓缩至干,得红色洗脱物43 g。取20.0 g该洗脱物溶于50 mL 0.5%醋酸水溶液进行Sephadex LH-20柱层析,先用40%甲醇(含0.5%醋酸)溶液洗脱,色谱柱中呈现出3 条色带,均为紫薯花色苷类化合物,依次接收得组分1~3,再以80%甲醇(含0.5%醋酸)溶液洗脱得紫薯绿原酸类化合物(组分4)。
1.3.4 紫薯绿原酸类化合物的制备
取2.0 g组分4溶于10 mL制备液中,过滤,采用1.3.1节制备液相条件的方法进行制备,根据峰形收集13~30 min流出液,60 ℃减压浓缩干燥,得化合物1、化合物2、化合物3和化合物4。
1.3.5 纯度检测
以1.3.1节中的分析色谱方法进行纯度测定,采用面积归一化法进行计算。
1.3.6 结构鉴定
采用1H-NMR和13C-NMR技术对4 个化合物进行结构鉴定,化合物1、2和3用CD3OD溶解,化合物4用二甲基亚砜-d6溶解,核磁共振频率400 MHz。
2 结果与分析
2.1 紫薯中绿原酸类化合物与花色苷类化合物的初级分离
紫薯的主要化学成分为花色苷和绿原酸类化合物,花色苷类化合物为红色,绿原酸类成分为白色,因此,首先要实现两者的有效分离,避免花色苷类化合物影响绿原酸类化合物的色泽和纯度。通过实验发现,花色苷类化合物在正相硅胶和反相硅胶上拖尾都非常严重,而且在这两种分离材料上花色苷和绿原酸类似物分离度不好,重叠较为严重,这两种分离材料并不适合两者的初级分离。进一步实验发现Sephadex LH-20凝胶柱对紫薯花色苷和绿原酸类化合物具有很好的分离度,而且花色苷类化合物在凝胶上几乎没有拖尾现象,色带非常集中,因此选用Sephadex LH-20凝胶有效地实现两者的分离。
在1.3.3节条件下,获得3 个主要含有紫薯花色苷的组分1(1.4 g)、组分2(1.9 g)和组分3(8.2 g),同时获得主要含有紫薯绿原酸类化合物的组分4(7.9 g)。
2.2 色谱峰的收集和样品的高效液相色谱分析
一次制备时采用中心切割法对4 个色谱峰分别进行收集(图1)。峰3和峰4的分离度较好,仅一次制备就可以获得98%以上的纯品;峰1和峰2有部分重叠,一次制备获得产品纯度不够,需二次制备,二次制备时将流动相中的乙腈比例适当降低,延长峰1和峰2的保留时间,使两者基本达到基线分离,获得纯度合格的标准样品。
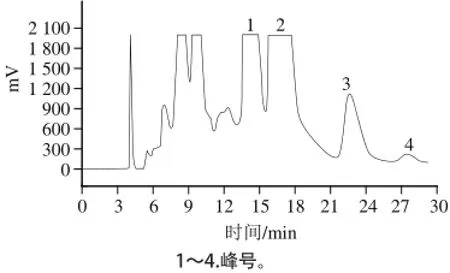
图1 紫薯组分4制备液相色谱图Fig.1 Preparative high performance liquid chromatography of fraction 4 from sweet purple potato
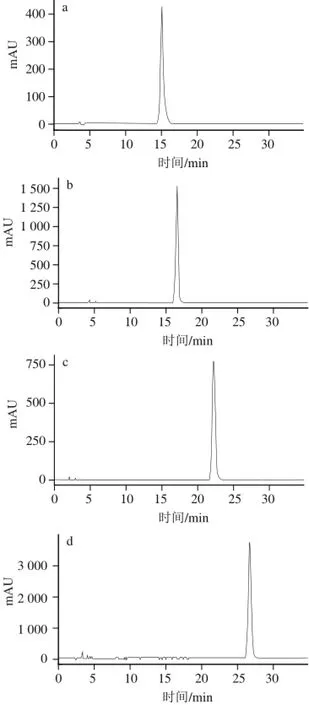
图2 化合物1(a)、2(b)、3(c)、4(d)的高效液相色谱图Fig.2 High performance liquid chromatography of compounds 1 (a), 2 (b), 3 (c) and 4 (d)
在1.3.4节的分离制备条件下,从2.0 g组分4中分离得到化合物1(峰1)115.3 mg、化合物2(峰2)148.8 mg、化合物3(峰3)45.1 mg、化合物4(峰4)7.3 mg。采用面积归一法计算这些化合物的纯度依次为99.9%、 99.7%、99.9%和98.2%,均高于98.0%,符合标准品的要求(图2)。
2.3结构鉴定
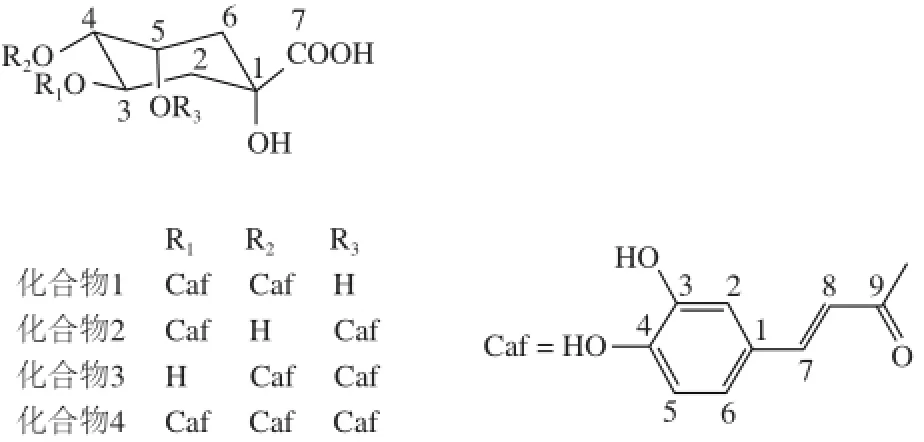
图3 化合物1~4的化学结构Fig.3 Chemical structures of compounds 1 through 4
化合物1,白色粉末。1H-N M R(C D3O D,400 MHz)δ:5.62(1H,m,H-3)、5.12(1H,m,H-4)、4.39(1H,m,H-5)、2.31(1H,m,H-6)、2.21(2H,m,H-2)、2.12(1H,m,H-6)、7.58(1H,d,J=15.9 Hz,H-7’)、7.52(1H,d,J=15.9 Hz,H-7’)、7.02(H,d,J=1.8 Hz,H-2’,)、7.00(H,d,J=1.8 Hz,H-2’)、6.91(1H,d,J=8.0 Hz,H-6’)、6.89(1H,d,J=8.0 Hz,H-6’)、6.75(1H,d,J=8.0 Hz,H-5’)、6.73(1H,d,J=8.0 Hz,H-5’)、6.29(1H,d,J=15.9 Hz,H-8’)、6.18(1H,d,J=15.9 Hz,H-8’’)。13C-NMR(CD3OD,100 MHz)δ:76.2(C-1)、39.4(C-2)、69.2(C-3)、75.8(C-4)、69.3(C-5)、38.7(C-6)、176.9(C-7)、127.9(C-1’)、127.6(C-1’)、115.4(C-2’)、115.3(C-2’)、146.9(C-3’)、146.8(C-3’)、149.6(C-4’,4’)、116.6(C-5’)、116.5(C-5’)、123.2(C-6’)、1 2 3.1(C-6’’)、1 4 7.9(C-7’)、147.8(C-7’)、114.8(C-8’,8’)、168.8(C-9’)、168.3(C-9’)。以上数据与文献[24]报道的3,4-O-双咖啡酰基-奎宁酸的核磁数据基本一致,故鉴定化合物1为3,4-O-双咖啡酰基-奎宁酸,即异绿原酸B(结构见图3)。
化合物2,白色粉末。1H-N M R(C D3O D,400 MHz)δ:5.42(1H,m,H-5)、5.39(1H,m,H-3)、3.96(1H,m,H-4)、2.30(1H,m,H-6)、2.17(2H,m,H-2)、2.15(1H,m,H-6)、7.60(1H,d,J=15.9 Hz,H-7’)、7.56(1H,d,J=15.9 Hz,H-7’)、7.06(2H,brs,H-2’,2’’)、6.94(1H,d,J=8.0 Hz,H-6’)、6.96(1H,d,J=8.2 Hz,H-6’)、6.77(1H,d,J=8.0 Hz,H-5’)、6.79(1H,d,J=8.2 Hz,H-5’)、6.35(1H,d,J=15.9 Hz,H-8’)、6.26(1H,d,J=15.9 Hz,H-8’)。13C-NMR(CD3OD,100 MHz)δ:74.9(C-1)、37.7(C-2)、72.2(C-3)、7 0.8(C-4)、7 2.7(C-5)、3 6.2(C-6)、177.5(C-7)、128.1(C-1’)、127.9(C-1’’)、115.5(C-2’)、115.3(C-2’)、147.4(C-3’)、147.0(C-3’)、149.7(C-4’)、149.6(C-4’)、116.6(C-5’)、116.6(C-5’)、123.2(C-6’)、123.0(C-6’)、147.2(C-7’)、147.0(C-7’)、115.7(C-8’)、115.1(C-8’)、169.1(C-9’)、168.5(C-9’)。以上数据与文献[24]报道的3,5-O-双咖啡酰基-奎宁酸的核磁数据基本一致,故鉴定化合物1为3,5-O-双咖啡酰基-奎宁酸,即异绿原酸A(结构见图3)。
化合物3,白色粉末。1H-NMR(CD3OD,400 MHz)δ:5.42(1H,dd,J=8.2,3.2 Hz,H-5)、5.32(1H,m,H-4)、3.97(1H,m,H-3)、2.36(1H,m,H-6)、2.21(2H,m,H-2)、2.14(1H,m,H-6)、7.62(1H,d,J=15.9 Hz,H-7’)、7.56(1H,d,J=16.0 Hz,H-7’)、7.06(2H,d,J=2.0 Hz,H-2’,H-2’)、6.97(2H,dd,J=8.0,2.0 Hz,H-6’,6’)、6.79(1H,d,J=8.0 Hz,H-5’)、6.77(1H,d,J=8.0 Hz,H-5’)、6.35(1H,d,J=15.9 Hz,H-8’)、6.21(1H,d,J=16.0 Hz,H-8’’)。13C-NMR(CD3OD,100 MHz)δ:74.1(C-1)、37.3(C-2)、69.5(C-3)、73.6(C-4)、72.1(C-5)、36.9(C-6)、176.8(C-7)、127.9(C-1’)、127.8(C-1’)、115.6(C-2’)、115.2(C-2’)、146.7(C-3’)、146.8(C-3’)、149.5(C-4’,4’)、116.6(C-5’)、116.5(C-5’)、123.1(C-6’)、123.0(C-6’)、147.0(C-7’)、146.9(C-7’)、115.0(C-8’)、114.8(C-8’)、169.3(C-9’)、168.5(C-9’)。以上数据与文献[25]报道的4,5-O-双咖啡酰基-奎宁酸的核磁数据基本一致,故鉴定化合物1为4,5-O-双咖啡酰基-奎宁酸,即异绿原酸C(结构见图3)。
化合物4,白色粉末。1H-NMR(DMSO-d6,400 MHz)δ:5.38(2H,m,H-3,5)、5.28(1H,m,H-4)、2.17(1H,m,H-6)、2.06(2H,m,H-2)、1.93(1H,m,H-6)、7.50(2H,d,J = 16.0 Hz,H-7’,7’’)、7.33(1H,d,J = 15.9 Hz,H-7’)、7.19(1H,d,J = 1.8 Hz,H-2’)、7.13(2H,d,J = 1.8 Hz,H-2’,2’’)、6.94(3H,m,H-6’,6’,6’’)、6.88(1H,d,J = 8.0 Hz,H-5’)、6.75(2H,d,J = 8.0 Hz,H-5’,5’’)、6.38(2H,d,J = 16.0 Hz,H-8’,8’’)、6.26(1H,d,J = 15.9 Hz,H-8’)。13C-NMR(DMSO-d6,100 MHz)δ:72.9(C-1)、35.7(C-2)、67.4(C-3)、70.5(C-4)、68.0(C-5)、36.6(C-6)、174.2(C-7)、125.4(C-1’,1’’)、125.3(C-1’)、114.8(C-2’)、114.5(C-2’,2’’)、145.0(C-3’)、144.8(C-3’)、144.6(C-3’’)、145.8(C-4’)、145.6(C-4’)、145.5(C-4’’)、115.3(C-5’,5’,5’’)、122.2(C-6’)、121.0(C-6’,6’’)、148.5(C-7’)、148.4(C-7’,7’)、113.9(C-8’)、113.8(C-8’,8’’)、165.8(C-9’)、165.7(C-9’)、165.4(C-9’’)。以上数据与文献[26]报道的3,4,5-O-三咖啡酰基奎宁酸的核磁数据基本一致,故鉴定化合物1为3,4,5-O-三咖啡酰基奎宁酸(结构见图3)。
3 结 论
本实验得出Sephadex LH-20凝胶可有效地实现紫薯中花色苷和绿原酸类化合物的分离,消除紫薯花色苷对绿原酸类成分色泽和纯度的影响,进一步采用反相制备色谱快速、高效地获得纯度高于98.0%的异绿原酸A、异绿原酸B、异绿原酸C和3,4,5-O-三咖啡酰基奎宁酸。这些化学成分均具有广泛的的生理活性,科研、工业需求高,然而除了异绿原酸A外,其他几种物质在传统中药材中虽有分布但普遍含量较低,因此市场价值较高。从本实验的结果可以看出,异绿原酸B和异绿原酸C在紫薯中含量较高,是大量获取这两种成分的理想原料。本研究建立的制备工艺具有产品色泽好、纯度高、操作简单、成本低、可用于规模化生产等优点。
[1] MONTILLA E C, HILLEBRAND S, BUTSCHBACH D, et al. Preparative isolation of anthocyanins from Japanese purple sweet potato (Ipomoea batatasL.) varieties by high-speed countercurrent chromatography[J]. Journal of Agricultural and Food Chemistry, 2010, 58(18): 9899-9904.
[2] TERAHARA N, SHIMIZU T, KATO Y, et al. Six diacylated anthocyanins from the storage roots of purple sweet potato, ipomoea batatas[J]. Bioscience, Biotechnology and Biochemistry, 1999, 63(8): 1420-1424.
[3] GODA Y, SHIMIZU T, KATO Y, et al. Two acylated anthocyanins from purple sweet potato[J]. Phytochemistry, 1997, 44(1): 183-186.
[4] 余燕影, 王杉, 曹树稳, 等. 川山紫薯色素提取分离及主要组成成分分析[J]. 食品科学, 2004, 25(11): 167-170.
[5] 刘超, 王征, 李鑫, 等. 高效液相色谱法分析不同品种紫甘薯中花青素组分及其含量[J]. 中国食物与营养, 2008, 14(8): 19-21.
[6] 杨颖, 夏其乐, 陈剑兵, 等. 紫薯花色苷的理化性质研究[J]. 食品添加剂, 2009, 30(11): 251-253.
[7] 吕昱, 严敏. 紫薯花色苷的生理功能及分离纯化研究进展[J]. 食品与机械, 2013, 29(4): 250-253.
[8] ISLAM M S, YOSHIMOTO M, YAHARA S, et al. Identifi cation and characterization of foliar polyphenolic composition in sweetpotato (Ipomoea batatas L.) genotypes[J]. Journal of Agricultural and Food Chemistry, 2002, 50(13): 3718-3722.
[9] HE Kai, YE Xiaoli, LI Xuegang, et al. Separation of two constituents from purple sweet potato by combination of silica gel column and high-speed counter-current chromatography[J]. Journal of Chromatography B, 2012, 881/882: 49-54.
[10] 丁利庆, 杜琪珍. 紫薯中两种功能性成分的分离鉴定[J]. 食品科学, 2011, 32(1): 74-77.
[11] 陆国权, 任韵, 唐忠厚, 等. 甘薯黄酮类物质的提取及其基因型差异研究[J]. 浙江大学学报: 农业与生命科学版, 2005, 31(5): 541-544.
[12] 林娟, 邱宏端, 林宵, 等. 甘薯多糖的提取纯化及成分分析[J]. 中国粮油学报, 2003, 18(2): 64-66.
[13] 眀兴加, 李坤培, 张明, 等. 紫色甘薯的开发前景[J]. 重庆中草药研究, 2006(1): 55-60.
[14] 刘宜贵, 吴松青. 美国超短蔓黑红薯新品种[J]. 北京农业, 2002(12): 38.
[15] 刘鲁林, 木泰华, 孙艳丽. 甘薯块根中胰蛋白酶抑制剂研究进展[J].粮食与油质, 2006(12): 64-66.
[16] 刘宁, 王红兵, 王春波. 青紫薯色素抗肿瘤作用及毒理学实验研究[J].卫生研究, 2008, 37(4): 489-491.
[17] HAQIWARA A, YOSHINO H, ICHIHARA T, et al. Prevention by natural food anthocyanins, purple sweet potato color and red cabbage color of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP)-associated colorectal carcinogenesis in rats initiated with 1, 2-dimethylhydrazine[J]. Journal of Toxicology Science, 2002, 27(1): 57-68.
[18] MATSUI Y, EBUCHI S, FUKUI K, et al. Anti-hyperglycemic effect of diacylated anthocyanin derived from Ipomoea batatas cultivar Ayamurasaki can be achieved through the α-glucosidase inhibitory action[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7244-7248.
[19] 刘主, 彭凌, 朱必凤, 等. 甘薯糖蛋白SPG-1的分离纯化及其降血糖作用研究[J]. 食品研究与开发, 2006, 27(11): 68-72.
[20] YAMAKAWA O, SUDA I, YOSHIMOTO M, et al. Development and utilization of sweet potato cultivars with high anthocyanin content[J]. Journal of Food and Food Ingredients, 1998, 178(1): 69-77.
[21] 孟祥军, 初晓, 王风华, 等. 青紫薯色素对自然衰老大鼠体内抗氧化能力的影响[J]. 齐鲁医学杂志, 2005, 20(5): 394-399.
[22] 王杉, 邓泽元, 曹树稳, 等. 紫薯色素对老龄小鼠抗氧化功能的改善作用[J]. 营养学报, 2005, 27(3): 245-248.
[23] 石伯阳, 李佳银, 周桥, 等. 紫甘薯中绿原酸及异绿原酸的高速逆流色谱分离[J]. 食品科学, 2013, 34(13): 87-90. doi: 10.7506/spkx1002-6630-201313019.
[24] 滕荣伟, 周志宏, 王祖德, 等. 白花刺参中的咖啡酰基奎宁酸成分[J].波谱学杂志, 2002, 19(2): 167-174.
[25] 周渊, 周思祥, 姜勇, 等. 毛冬青叶的化学成分研究[J]. 中草药, 2012, 43(8): 1479-1483.
[26] 卢张伟, 郑军, 汪豪, 等. 山牡荆树干心材的化学成分[J]. 药学与临床研究, 2009, 17(4): 287-289.
Preparation of High-Purity Chlorogenic Acid Derivatives from Purple Sweet Potato
LI Fu1, CHEN Bin1, LI Lianhong2, WANG Mingkui1
(1. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China; 2. Chengdu MUST Bio-technology Company Limited, Chengdu 610000, China)
The purpose of the present study was to prepare high-purity and high-value chlorogenic acid derivatives from purple sweet potato. Purple sweet potato slices were extracted with hot water. The extracted compounds were separated with D72 macroporous resin, sephadex LH-20 column chromatography and preparative high performance liquid chromatography (HPLC) to obtain high-purity chlorogenic acid analogues which were identifi ed as isochlorogenic acid A, isochlorogenic acid B, isochlorogenic acid C and 3,4,5-O-tricaffeoyl quinic acid, respectively, by nuclear magnetic resonance technique. HPLC analysis suggested that the purities of these analogues were all over 98%. The developed method can be used to rapidly obtain standard samples of chlorogenic acid derivatives from purple sweet potato, while avoiding effectively the negative effects of the anthocyanins on product color and purity.
purple sweet potato; chlorogenic acid derivative; standard sample; isolation; preparation
R284.2
A
1002-6630(2015)12-0133-05
10.7506/spkx1002-6630-201512025
2014-11-20
四川省科技支撑计划项目(2012SZ0054);“十二五”国家科技支撑计划项目(2011BAC09B04)
李甫(1979—),男,副研究员,博士,研究方向为天然产物化学。E-mail:lifu@cib.ac.cn
