响应面试验优化超声波辅助提取圆叶葡萄鞣花酸 和总酚工艺
2015-01-05赵雅娇张雅丽
魏 征,赵雅娇,黄 羽,张雅丽,卢 江,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.广西农业科学院葡萄与葡萄酒研究所,广西 南宁 530000)
响应面试验优化超声波辅助提取圆叶葡萄鞣花酸 和总酚工艺
魏 征1,赵雅娇1,黄 羽2,张雅丽1,卢 江1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.广西农业科学院葡萄与葡萄酒研究所,广西 南宁 530000)
以圆叶葡萄Noble皮和籽为原料,使用丙酮提取溶剂(丙酮-水-盐酸体积比70∶29∶1),采用超声波辅助提取圆叶葡萄中以鞣花酸为主的多酚类化合物。在单因素试验的基础上,利用响应面试验优化圆叶葡萄皮中鞣花酸和总酚提取工艺,建立数学回归模型,并分析双因素间的交互作用。结果表明,影响圆叶葡萄皮中鞣花酸和总酚含量的显著因素为料液比、提取时间和超声功率,得到的最佳提取工艺条件为料液比1∶30(g/mL)、提取时间28 min、超声功率616 W,此条件下鞣花酸和总酚含量分别为616.21μg/g和15.06 mg/g(以没食子酸当量计,鲜质量)。用响应面试验对圆叶葡萄中鞣花酸和总酚提取进行优化,可得到最佳工艺条件,验证结果与理论预测拟合度高,可为实际生产提供理论依据。
圆叶葡萄;鞣花酸;超声波辅助提取;响应面
圆叶葡萄(Vi t i s ro t u n d i f o l i a),葡萄科(Vitaceae),圆叶葡萄亚属(MuscadiniaPlanch),起源于美国东南 部地区。本实验室陆续从美国引进多个圆叶葡萄品种,分别定植于广西和云南等地,已经正常挂果[1],可实现一年两熟。研究表明,圆 叶葡萄 具有抗癌[2]、抗菌[3-5]、抗炎[6]、抗糖尿病[7]、抑制肥胖相关代谢并发症[8]和抑制细胞凋亡[9-10]等特性,均与其含有特有的多酚类化合物有关。鞣花酸是一种多酚二内酯,具有抗肿瘤、抗病毒、抗氧化、抗菌、增强免疫、抗增殖和DNA损伤等活性,还有凝血功能[11-14],在蔷薇科家族的浆果(如黄莓、覆盆子、玫瑰果和草莓等)和许多草本植物(石榴、橡树和桦树叶等)中普遍存在[2-4]。葡萄种属中,目前只在圆叶葡萄中检测到鞣花酸类化合物,包括鞣花酸及鞣花单宁,以单体、多聚体及糖苷等形式存在,含量丰富,为圆叶葡萄中多酚的主要成分[15-17]。目前,对于鞣花酸的提取鉴定较多采用溶剂浸提法,而超声波或微波辅助溶剂浸提操作简便、能耗低,可在一定程 度上提高提取效率[18-20],但针对圆叶葡萄 不同部位鞣花酸的提取工艺鲜有系统研究。本研究选用圆叶葡萄Noble皮和籽为原料,针对圆叶葡萄中以鞣花酸为主的多酚化合物提取工艺进行优化,旨在完善提取方法,提高提取效率,也为后期圆叶葡萄种质资源评价以及相关产品开发提供理论依据。
1 材料与方法
1.1材料与试剂
成熟的N oble夏果于2012年8月采自广西南宁。
甲醇、丙酮、乙醇、乙酸乙酯、正丁醇、三氯甲烷和盐酸等(均为分析纯) 北京化工试剂公司;鞣花酸(色谱纯) 美国Sigma公司;乙腈、甲酸(均为色谱纯)美国Honeywell公司。
1.2仪器与设备
LC-20AT高效液相色谱(high performance liquid chromatography,HPLC)仪(SPD-M20A二极管阵列检测器、SIL-20A自动进样器、CTO-10AS柱温箱)日本岛津公司;Primo R多用途台式高速离心机 美国Thermo公司;LGJ-18冷冻干燥机 北京四环科技仪器有限公司;RE-52旋转蒸发仪 上海亚荣生化仪器厂;FW-135中草药粉碎机(30~200目) 天津泰斯特有限公司。
1.3方法
1.3.1样品前处理
手工分离鲜果的皮和籽,经预冷处理后,真空冷冻干燥48 h,粉碎机粉碎。对葡萄籽粉按料液比1∶20(g/mL)加入石油醚,25℃条件下避光浸提脱脂24 h,澄清去上清液,残渣避光风干,-20℃保存备用。
1.3.2超声波辅助溶剂法提取圆叶葡萄中总酚和鞣花酸
参考Xu Changmou等[21]的方法,有改动。精确称取0.500 0 g葡萄皮或籽粉(已脱脂)干样于50 mL离心管中,按料液比1∶30(g/mL)加入丙酮(丙酮-水-盐酸体积比70∶29∶1),漩涡30 s,置于超声波清洗机中,25℃、600 W条件下超声提取30 min,7 600 r/min离心20 min,残渣重复提取2次,合并上清液。取出2 mL用于总酚测定(24 h内完成),其余在35℃条件下真空旋蒸除去溶剂,甲醇(含1%甲酸)定容至5 mL,-80℃保存。样品先经0.45μm纤维素膜过滤,再上HPLC检测。所有提取及检测均平行3次。
1.3.3圆叶葡萄中总酚和鞣花酸提取单因素试验
对提取溶剂种类、溶剂体积分数、料液比、提取时间及超声功率进行单因素试验,以确定各因素影响程度和适宜范围。单因素试验各因素设定值参照1.3.2节,只变更单因素项,其余不变。提取溶剂选用甲醇、丙酮、乙醇、乙酸乙酯、正丁醇和三氯甲烷(体积分数70%,含1%盐酸),溶剂选用体积分数50%、60%、70%、80%的丙酮(含1%盐酸),料液比选用1∶10、1∶20、1∶30、1∶40,提取时间选用10、20、30、40、50 min,超声功率选用200、400、600、800 W。
1.3.4响应面试验优化圆叶葡萄皮中酚类化合物提取工艺
根据单因素试验结果,以鞣花酸和总酚含量为响应值,应用Box-Behnken试验设计,对料液比、提取时间和超声功率3个因素进行响应面分析。各因素及水平编码见表1。
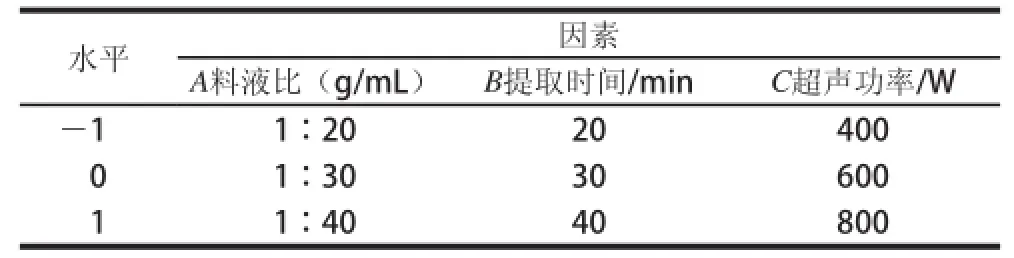
表1 圆叶葡萄皮中酚类化合物提取因素水平表Table 1 Code and corresponding actual values of the optimization parameters of muscadine phenolic compounds extraction
1.3.5 指标测定
1.3.5.1总酚含量测定
参考Singleton等[22]的方法,有改动。取100 ☒L样液或各梯度的标准液至10 mL具塞试管,依次加入3 mL蒸馏水、250 ☒L福林酚试剂、750 ☒L质量分数20%的Na2CO3溶液和900 ☒L蒸馏水,至总体积5 mL。漩涡混匀,40℃水浴30 min,在760 nm波长处测定吸光度,空白以100 ☒L蒸馏水代替样液,其余不变。以没食子酸为标样,结果以没食子酸当量表示(mg/g,鲜质量),总酚标准曲线为y=0.002 1x-0.047(R2=0.996 2),线性范围为50~1 000 ☒g/mL。
1.3.5.2鞣花酸含量测定
HPLC检测条件:检测波长254 nm;扫描范围:200~600 nm;流动相A:1%甲酸水溶液,流动相B:乙腈;洗脱梯度:0 min,0%B;35 min,40%B;38 min,100%B;53 min,100%B,55 min,0%B;60 min,0%B;流速:1 mL/min;进样量:10μL。鞣花酸标准曲线为y=105 850x-347 410(R2= 0.994 7),线性范围为20~400μg/mL。
1.4数据处理
采用Office 2010统计所有数据,Ori gin 8.0作图,结果以表示。采用SPSS 20.0进行ANOVA和Duncan’s差异显著性分析(P=0.05),并采用Design-Expert 8.0.5进行响应面分析。
2 结果与分析
2.1 单因素试验结果
2.1.1提取溶剂种类对圆叶葡萄总酚和鞣花酸含量的影响
在料液比1∶30、提取溶剂体积分数70%(含1%盐酸)、超声功率600 W、提取时间30 min、25℃条件下进行不同提取溶剂单因素试验。
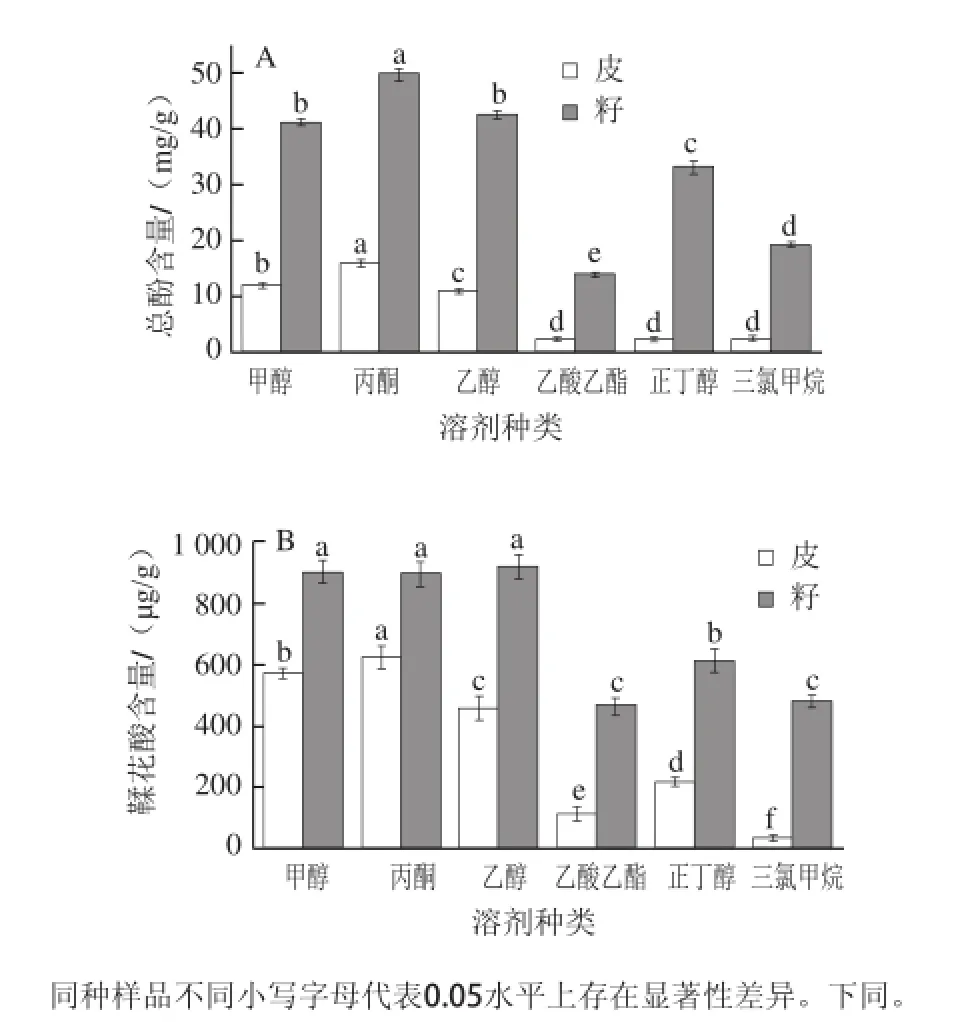
图1 提取溶剂种类对圆叶葡萄总酚(A)和鞣花酸(B)含量的影响Fig.1 Effects of different solvents on the yield of total phenols and ellagic acid from muscadine
图1表明,不同提取溶剂对圆叶葡萄总酚和鞣花酸含量有较大影响。甲醇、丙酮和乙醇的提取量显著高于乙酸乙酯、正丁醇和三氯甲烷。其中,丙酮提取皮和籽中总酚含量分别为16.03 mg/g和49.77 mg/g,皮中鞣花酸含量为635.53μg/g,显著高于甲醇和乙醇提取时的含量,而籽中鞣花酸含量三者差异不显著,与已有研究[22-23]结果一致。单因素试验结果表明,选用丙酮作为提取溶剂效果更好。
2.1.2溶剂体积分数对圆叶葡萄总酚和鞣花酸含量的影响
在料液比1∶30、丙酮为提取溶剂(含1%盐酸)、超声功率600 W、提取时间30 min、25℃条件下进行不同丙酮体积分数单因素试验。

图2 丙酮体积分数对圆叶葡萄总酚(A)和鞣花酸(B)含量的影响Fig.2 Effects of acetone concentration on the yield of total phenols and ellagic acid from muscadine
由图2可知,皮和籽中总酚及鞣花酸含量在丙酮体积分数为60%~80%之间差异不显著,但皮中鞣花酸含量显著高于丙酮体积分数为50%时的含量,籽中鞣花酸含量在不同体积分数条件下均差异不显著。丙酮体积分数过高时,会使某些脂溶性物质和醇溶性的杂质溶出增多,这些成分往往同丙酮-水分子竞争结合,干扰因素随之增大,不仅导致多酚含量的下降,还可能给后续工作带来不便[24]。综合考虑以上因素,后期试验选择体积分数为70%的丙酮水溶液。
2.1.3料液比对圆叶葡萄总酚和鞣花酸含量的影响
在70%丙酮(含1%盐酸)为提取溶剂、超声功率600 W、提取时间30 min、25℃条件下进行不同料液比单因素试验。
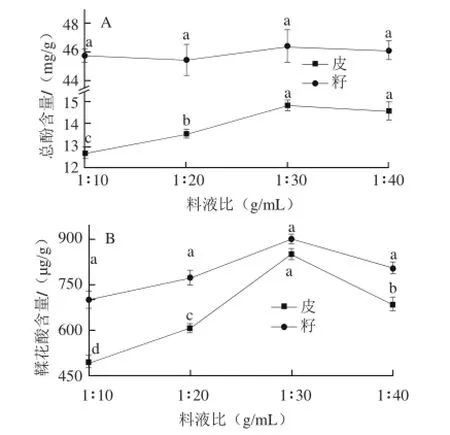
图3 料液比对圆叶葡萄总酚(A)和鞣花酸(B)含量的影响Fig.3 Effects of different ratios of solid to liquid on the yield of total phenols and ellagic acid from muscadine
图3表明,在料液比1∶10~1∶30范围内,籽中总酚含量在不同条件下差异不显著,而皮中总酚含量及皮与籽中鞣花酸含量均随提取溶剂用量增加而增大;但料液比在1∶30之后,各指标含量均趋于下降。综合认为,选择1∶30的料液比效果最好。
2.1.4提取时间对圆叶葡萄总酚和鞣花酸含量的影响
在料液比1∶30、70%丙酮(含1%盐酸)为提取溶剂、超声功率600 W、25℃条件下进行不同提取时间单因素试验。

图4 提取时间对圆叶葡萄总酚(A)和鞣花酸(B)含量的影响Fig.4 Effects of extraction time on the yield of total phenols and ellagic acid from muscadine
提取时间对总酚和鞣花酸含量影响较大(图4)。皮与籽中总酚和鞣花酸含量均在20~30 min内随提取时间的延长显著增大,随后均随时间的延长而显著降低。一般提取时间越长,含量越高,但提取时间大于30 min后其含量反而降低,这可能是由于时间过长有较多的其他脂溶性成分随之溶出,因此后续选择30 min继续研究。
2.1.5超声功率对圆叶葡萄总酚和鞣花酸含量的影响
在料液比1∶30、70%丙酮(含1%盐酸)为提取溶剂、提取时间30 min、25℃条件下进行不同超声功率单因素试验。
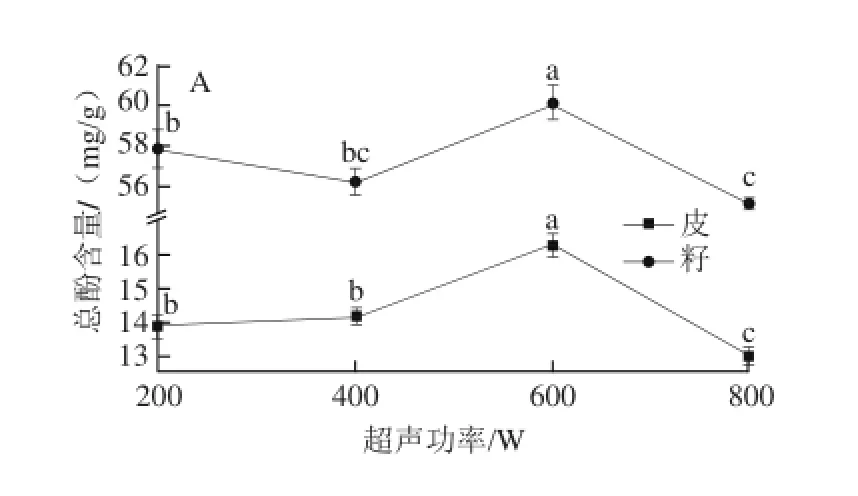
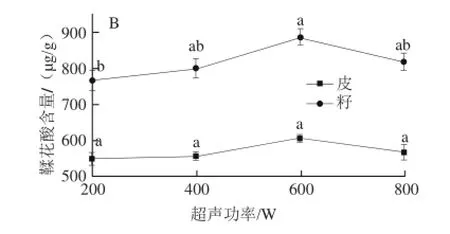
图5 超声功率对圆叶葡萄总酚(A)和鞣花酸(B)含量的影响Fig.5 Effects of ultrasonic power on the yield of total phenols and ellagic acid from muscadine
由图5可知,在200~600 W范围内,随着超声功率的提高,皮中总酚含量相应提高,籽中总酚含量虽在400 W时略低于200 W,但两者之间差异不显著,且皮和籽中总酚含量均在600 W时达到最大值,随后显著下降。而皮与籽中鞣花酸含量在不同条件下差异不显著,但趋势线反映出鞣花酸变化趋势与总酚相一致,从而选择600 W进行后续研究。
2.2响应面优化试验结果
2.2.1回归方程的建立与方差分析
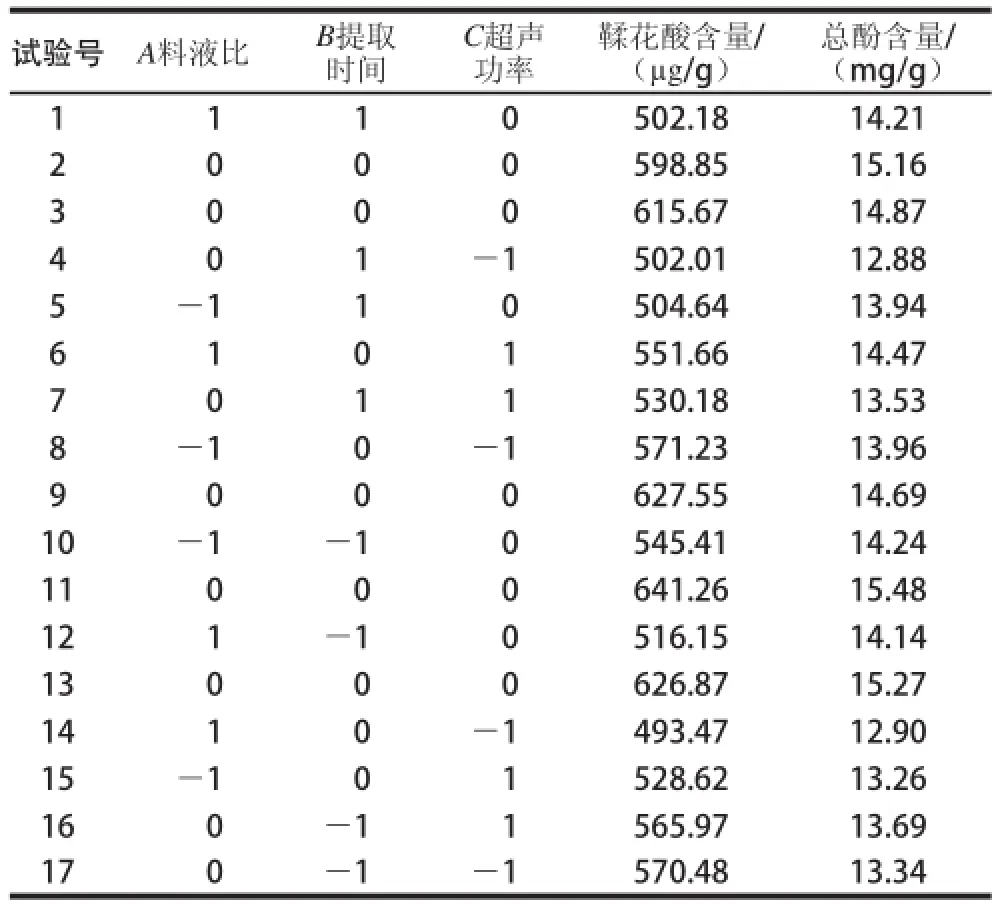
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
由单因素试验结果可知,不同单因素对圆叶葡萄皮和籽的影响规律大致相同,但皮中差异显著性总体高于籽,因此响应面分析只在皮中进行。综合单因素试验结果,选择料液比、提取时间和超声功率3个因素为变量,以总酚和鞣花酸含量作为响应值,对超声波辅助提取圆叶葡萄皮中总酚和鞣花酸的参数进行响应面优化分析。根据试验结果(表2),经Design-Expert 8.0.5软件对试验数据进行回归分析(表3、4),二次回归拟合后,得到超声辅助溶剂提取圆叶葡萄皮中鞣花酸及总酚的二次多项回归方程:Y鞣花酸=622.04-10.81A-19.88B+4.90C+6.70AB+25.20AC+8.17BC-55.43A2-49.51B2-30.36C2;Y总酚=15.09+0.040A-0.11B+0.23C+0.092AB+0.57AC+0.075BC-0.34A2-0.62B2-1.11C2。

表3 鞣花酸含量回归方程各项方差分析Table 3 Analysis of variance for the fitted quadratic polynomial regression model of ellagic acid content

表4 总酚含量回归方程各项方差分析Table 4 Analysis of variance for the fitted quadratic polynomial regression model of total phenol
从表3方差分析可知,以鞣花酸含量为响应值建立的回归模型极显著,模型相关系数校正决定系数表明模型实际值与预测值吻合度较好,失拟项P=0.698 2>0.05,失拟不显著,说明其他不可忽略的因素对试验结果的影响很小。一次项中提取时间对鞣花酸含量的线性效应极显著;二次项中料液比、提取时间和超声功率均对鞣花酸含量的曲面效应极显著;交互项中,料液比和超声功率相互作用极显著。该方程对试验拟合较好,因此可用该模型对鞣花酸提取试验进行分析和预测。由F检验得到因素影响大小顺序为:提取时间>料液比>超声功率。
同理,以总酚含量为响应值的回归模型极显著(表4),模型的相关系数校正决定系数,失拟项失拟不显著。一次项中超声功率对总酚含量的线性效应显著;二次项中料液比对总酚含量曲面效应显著,提取时间和超声功率极显著;交互项中,料液比和超声功率间极显著。同样证明了此模型与试验拟合较好,自变量与响应值之间线性关系显著,也可用于对总酚提取试验的理论推测。由F检验得到的因素影响大小顺序为:超声功率>提取时间>料液比。
2.2.2响应面分析
通过Box-Behnken试验得到的多元二次回归模型所作的响应面图及其等高线图,可用于评价试验因素对圆叶葡萄皮总酚及鞣花酸含量影响的两两交互作用以及确定各个因素的最佳水平范围。

图6 各因素交互作用对鞣花酸含量影响的响应面图Fig.6 Response surface plots showing the interactive effects of three extraction parameters on ellagic acid content

图7 各因素交互作用对总酚含量影响的响应面图Fig.7 Response surface plots showing the interactive effects of three extraction parameters on total phenol content
各因素交互作用的响应面立体分析见图6、7。由图6可较直观地看出各因素交互作用对圆叶葡萄皮中鞣花酸含量的影响,提取时间对鞣花酸影响最大,表现为曲线较陡;料液比和超声功率影响较小,表现为曲线较平滑,随其数值的变化,响应值变化较小。从图6b可以看出,响应面线较陡,说明料液比和超声功率交互作用对鞣花酸含量的影响较明显,这与方差分析的结果相一致。图7中交互作用表现更为明显,超声功率曲线陡峭度相比其他因素大很多,其次是提取时间,料液比曲线平滑度最高。图7b响应曲面线较陡,图7c次之,图7a最为平缓,说明超声功率和料液比间交互作用对 总酚含量影响最为明显,同样符合方差分析结果。
2.2.3 验证实验结果
采用Design-Expert软件,根据所建立的模型进行参数最优化分析,得到的最佳工艺条件为料液比1∶29.61、提取时间28.52 min、超声功率615.07 W,此条件下,鞣花酸含量为624.31μg/g,总酚含量为15.10 mg/g。为了便于实际操作,确定提取圆叶葡萄皮的条件为料液比1∶30、提取时间28 min、超声功率616 W,在此条件下进行3组平行验证实验,鞣花酸及总酚含量分别为(616.21±25.62)μg/g和(15.06±0.37)mg/g,实际结果与理论预测吻合度很高,因此响应面优化得到的最佳提取条件可靠且有应用价值。
3 讨 论
葡萄多酚受原料预处理、测定方法等多因素共同影响,且前处理远大于测定方法对结果造成的影响。葡萄多酚的常用提取溶剂包括丙酮、甲醇、乙醇、乙酸乙酯和水等。由于溶剂间的极性不同,其多酚的提取效果及提取后的抗氧化能力存在较大差异。Yilmaz等[23]将几种常用溶剂最佳提取体积分数时的提取效率进行了对比分析,指出以50%~75%的丙酮溶液提取圆叶葡萄多酚,其提取效果要优于60%乙醇及70%甲醇。Xu Baojun等[24]研究了6种常用溶剂系统对8种主要豆类食品中多酚物质的提取效率差异,表明酸化的70%的丙酮(含0.5%的乙酸)或80%的丙酮对多酚物质有最佳的提取效率,这均与本研究结果相一致。
在提取实验中,提取次数与料液比存在交互作用,通常溶剂用量越大,提取效果越好,提取等量酚类化合物所需次数也越少,但过大的溶剂用量一方面会造成能源浪费,另外也会对后续过滤、浓缩的进一步处理带来麻烦。本研究基于大量前人实验结果,即重复提取3次开展实验[21,25-26],最终结果也表明取得了较好效果。
超声功率对鞣花酸及总酚含量的影响趋势不同,可能由于当超声波功率较低时,超声强度不足以产生空化作用,随着超声功率的增加,超声波在液体介质中不断产生无数内部压强达到上千个大气压的微气穴,微气穴不断爆破产生强大冲击,此时空化作用明显,超声提取率增加[27]。但当超声强度过大,导致压强突增产生的空气气泡过多,没有充分的时间溃陷,超声空化作用降低,也达不到使葡萄皮与籽细胞破壁的强度,故有效成分的溶出也不充分。在空化作用与机械作用的最佳结合点上,有效成分溶出最完全,提取率最大。
本实验采用响应面法优化圆叶葡萄中鞣花酸类多酚化合物提取工艺,在响应面法优化所得的条件下进行试验,所测得的鞣花酸与总酚含量与预测值十分接近,参数准确可靠,可用于实际操作。
4 结 论
本研究采用超声辅助溶剂提取法针对圆叶葡萄皮和籽中鞣花酸进行提取工艺研究。根据单因素试验结果,选择料液比、提取时间和超声功率3 个因素对圆叶葡萄皮的提取工艺进行响应面优化分析,得到的最佳工艺条件为:料液比1∶29.61(g/mL)、提取时间28.52 min、超声功率615.07 W。在料液比1∶30、提取时间28min、超声功率616W条件下进行验证实验,鞣花酸及总酚含量分别为(616.21±25.62)μg/g和(15.06±0.37) mg/g,实际结果与理论预测拟合度高。
[1]黄羽,彭宏祥,林玲,等.美国圆叶葡萄引种表现及栽培技术要点[J].福建果树, 2010(2): 40-42.
[2] YI Weiguang, FISCHER J, AKOH C C. Study of anticancer activities of muscadine grape phenolicsin vitro[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22): 8804-8812.
[3] KIM T J, SILVA J L, JUNG Y S. Antibacterial activity of fresh and processed red muscadine juice and the role of their polar compounds onEscherichia coliO157: H7[J]. Journal of Applied Microbiology, 2009, 107(2): 533-539.
[4] PARK Y J, BISWAS R, PHILLIPS R D, et al. Antibacterial activities of blueberry and muscadine phenolic extracts[J]. Journal of Food Science, 2011, 76(2): M101-M105.
[5] BROWN J C, JIANG Xiuping. Activities of muscadine grape skin and polyphenolic constituents againstHelicobacter pylori[J]. Journal of Applied Microbiology, 2013, 114(4): 982-991.
[6] NORATTO G D, ANGEL M G, TALCOTT S T, et al. Polyphenolics from Ac☒aí (Euterpe oleraceaMart.) and red muscadine grape (Vitis rotundifolia) protect human umbilical vascular endothelial cells (HUVEC) from glucose- and lipopolysaccharide (LPS)-induced inflammation and target microRNA-126[J]. Journal of Agricultural and Food Chemistry, 2011, 59(14): 7999-8012.
[7] YOU Qi, CHEN Feng, WANG Xi, et al. Inhibitory effects of muscadine anthocyanins onα-glucosidase and pancreatic lipase activities[J]. Journal of Agricultural and Food Chemistry, 2011, 59(17): 9506-9511.
[8] GOURINENI V, SHAY N F, CHUNG S, et al. Muscadine grape (Vitis rotundifolia) and wine phytochemicals prevented obesity-associated metabolic complications in C57BL/6J mice[J]. Journal of Agricultural and Food Chemistry, 2012, 60(31): 7674-7681.
[9] MERTENS T S U, LEE J H, PERCIVAL S S, et al. Induction of cell death in Caco-2 human colon carcinoma cells by ellagic acid rich fractions from muscadine grapes (Vitis rotundifolia)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(15): 5336-5343.
[10] HUDSON T S, HARTLE D K, HURSTING S D, et al. Inhibition of prostate cancer growth by muscadine grape skin extract and resveratrol through distinct mechanisms[J]. C ancer Research, 2007, 67(17): 8396-8405.
[11] KIM S, NISHIMOTO S K, BUMGARDNER J D, et al. A chitosan/β-glycerophosphate thermo-sensitive gel for the delivery of ellagic acid f or the treatment of brain cancer[J]. Biomaterials, 2010, 31(14): 4157-4166.
[12]陆晶晶,丁轲,杨大进.保健品功能因子鞣花酸研究进展[J].食品科学, 2010, 31(21): 45 1-454.
[13] MAZZONE G, TOSCANO M, RUSSO N. Density functional predictions of antioxidant activity and UV spectral features of nasutin A, isonasutin, ellagic acid, and one of its possible derivatives[J]. Journal of Agricultural and Food Chemistry, 2013, 61 (40): 9650-9657.
[14] LARROSA M, GARCIA G T, ESPIN J C, et al. Ellagitannins, ellagic acid and vascular health[J]. Molecular Aspects of Medicine, 2010, 31(6): 513-539.
[15] BINDON K A, MADANI S H, PENDLETON P, et al. Factors affecting skin tannin extractability in ripening grapes[J]. Journal of Agricultural and Food Chemistry, 2014, 62(5): 1130-1141.
[16] LU Zhongwei, LIU Yajun, ZHAO Lei, et al. Effect of low-intensity white light mediated de-etiolation on the biosynthesis of polyphenols in tea seedlings[J]. Plant Physiology and Biochemistry, 2014, 80( 7): 328-336.
[17] XU Changmou, YAGIZ Y, BOREJSZA-WYSOCKI W, et al. Enzyme release of phenolics from muscadine grape (Vitis rotundifoliaMichx.) skins and seeds[J]. Food Chemistry, 2014, 157(8): 20-29.
[18] SAND HU A K, GU Liwei. Antioxidant capacity, phenolic content, and profiling of phenolic compounds in the seeds, skin, and pulp ofVitis rotundifolia(muscadine grapes) as determined by HPLC-DADESI-MSn[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8): 4681-4692.
[19] YOU Qi, CHEN Feng, WANG Xi, et al. Analysis of phenolic composition of Noble Muscadine (Vitis rotundifolia) by HPLC-MS and the relationship to its antioxidant capacity[J]. Journal of Food Science, 2012, 77(10): C1115-C1123.
[20] ARAPITSAS P. Hydrolyzable tannin analysis in food[J]. Food Chemistry, 2012, 135(3): 1708-1717.
[21] XU Changmou, ZHANG Yali, CAO Lei, et al. Phenolic compounds and antioxidant properties of different grape cultivars grown in China[J]. Food Chemistry, 2010, 119(4): 1557-1565.
[22] SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal Enology and Viticulture, 1965, 16(3): 144-158.
[23] YILMAZ Y, TOLEDO R T. Oxygen radical absorbance capacities of grape/wine industry byproducts and effect of solvent type on extraction of grape seed polyphenols[J]. Journal of Food Composition and Analysis, 2006, 19(1): 41-48.
[24] XU Baojun, CHANG S K C. A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents[J]. Journal of Food Science, 2007, 72(Suppl 2): 159-166.
[25]刘洋,刘婷婷,于鑫,等.蒙古栎叶片多酚的超声提取、优化及抗氧化能力[J].东北林业大学学报, 2010, 38(1): 70-73.
[26]孙玉霞,史红梅,蒋锡龙,等.响应面法优化葡萄枝条中多酚化合物提取条件的研究[J].中国农学通报, 2011, 27(7): 466-471.
[27]于明,朱文学,郭菡,等.响应面分析法优化超声提取槐豆胶工艺[J].食品科学, 2013, 34(2): 114-11 8.
Optimization of Ultrasound-Assisted Extraction of Ellagic Acid and Total Phenols from Muscadine (Vitis rotundifolia) by Response Surface Methodology
WEI Zheng1, ZHAO Yajiao1, HUANG Yu2, ZHANG Yali1, LU Jiang1,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. Grape and Wine Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530000, China)
The extraction conditions of ellagic acid and total phenols from the skin and seeds of the Noble muscadine using acetone/water/hydrochloric acid (70:29:1,V/V) by ultrasonic-assisted extraction (UAE) were optimized employing a combination of single-factor experiments and response surface methodology through mathematical modeling. The analysis of two-factor interactions was carried out. The results indicated the ratio of solid to liquid, extraction time and ultrasonic power to be the most significant factors affecting the extraction efficiencies of ellagic acid and total phenols. The optimum extraction conditions for ellagic acid an d total phenols from muscadine skin were determined as follows: ratio of solid to liquid, 1:30; extraction time, 28 min; and ultrasonic power, 616 W. The predicted contents of ellagic acid and total phenols under these conditions were 616.21μg/g and 15.06 mg/g (using gallic acid equivalent, fresh weight), respectively, agreeing with the experimental values. In conclusion, UAE can be applied to the extraction of ellagic acid.
muscadine; ellagic ac id; ultrasonic-assisted e xtraction; response surface methodology
S663.1;TS255.3
A
1002-6630(2015)12-0029-07
10.7506/spkx1002-6630-201512006
2014-11-25
国家高校科研基金项目(2012RC019);国家现代农业产业技术体系建设专项(CARS-30-yz-2)
魏征(1984—),男,博士研究生,研究方向为葡萄采后生理与分子生物学。E-mail:weizheng76096@sina.com
*通信作者:卢江(1962—),男,教授,博士,研究方向为葡萄功能基因组与分子营养、葡萄种质资源收集、评价及鉴定。E-mail:j.lu.cau@gmail.com
