响应面试验优化新疆野生准噶尔山楂残渣中多糖纯化工艺
2015-01-05
(新疆特殊环境物种保护与调控生物学实验室,新疆师范大学生命科学学院,新疆 乌鲁木齐 8 30054)
响应面试验优化新疆野生准噶尔山楂残渣中多糖纯化工艺
张 玉,李 进*,吕海英,张 侠,张花丽
(新疆特殊环境物种保护与调控生物学实验室,新疆师范大学生命科学学院,新疆 乌鲁木齐 8 30054)
为纯化准噶尔山楂残渣中的粗多糖,通过动态吸附和洗脱实验从7 种大孔吸附树脂中选出两种最优树脂NKA-9和D101,按一定比例进行混合实验。在单因素试验基础上,利用响应面法确定最佳纯化条件:NKA-9与D101树脂最佳混合质量比为2∶3;最佳吸附工艺条件为上样液流速3.75 mL/min、上样液质量浓度1.32 g/L、树脂径高比1∶13,此条件下多糖的吸附率为60.75%;最佳洗脱工艺条件为洗脱液浓度0.27 mol/L、洗脱液流速3.5 mL/min、洗脱液用量7 BV,此条件下多糖的洗脱率为84.22%。样品中 多糖含量由原来的5.06%上升至21.13%。
准噶尔山楂;多糖;响应面法;精制工艺
多糖又称多聚糖,是由多个单糖聚合而成的天然高分子化合物,在动植物体内广泛存在,分布极广[1-3],植物多糖由于其具有调节免疫、抗肿瘤、延缓衰老、降低糖脂等生物活性,在抗生素替代物及保健品领域已有很广泛的应用[4-7]。
准噶尔山楂( Crataegus songarica)是蔷薇科山楂属植物,是新疆特有落叶小乔木,现已被列为三级重点保护植物并被列入中国优先保护物种名录,生长于河谷或干旱碎石坡地,海拔700~20 000 m,在中国大陆仅分布 于新疆霍城县,在俄罗斯、阿富汗、伊朗等地也有分布,花期5~6 个月,果期7~8 个月[8]。研究表明,其果实中富含抗细胞氧化的黄酮类[9]、熊果酸[10]、天然花色苷[11]等,然而对于准噶尔山楂多糖的研究还未见报道。
大孔吸附树脂是一种具有良好的大孔网状结构和较大比表面积的高分子型吸附树脂,与传统吸附剂相比,它具有选择吸附性强、解吸条件温和、吸附量大、耐污染、使用寿命长、机械强度高、再生容易等优点,近年来我国将其作为中药分离纯化的常用方法[12-14]。
响应面法是采用多元二次回归方程拟合响应项与响应值之间的函数关系,得到最优工艺条件的有效方法之一,目前,该分析方法已广泛应用于食品工业[15-16]。
目前准噶尔山楂资源没有被充分利用,其果实提取过花色苷后产生的大量残渣通常被直接丢弃,前期实验发现这些残渣中含有大量多糖类物质。本实验以提取过花色苷的准噶尔山楂残渣为原料提取多糖,利用响应面法优化多糖精制工艺,为更高效地利用新疆特有准噶尔山楂资源提供一定的科学依据。
1 材料与方法
1.1材料与试剂
准噶尔山楂成熟果实采于新疆伊犁,已提取过花色苷,粉末60℃烘干、过筛备用。
D101、NKC-9、NKA-9、YPR-Ⅱ、S-8、CAD-40、HPD100树脂 天津南开合成科技有限公司。
1.2仪器与设备
RV10自动控制型立式旋转蒸发仪 德国IKA集团;VIS-7220紫外-可见分光光度计、DZF-6021型真空干燥箱上海恒平科学仪器有限公司;SHA-CA数显水浴恒温振荡器 天津赛得利斯实验分析仪器厂;AUY220电子天平 日本岛津公司。
1.3方法
1.3.1准噶尔山楂粗多糖的制备
采用水提醇沉法[17]。取5 g山楂粉末于200 mL蒸馏水中90℃热水浸提60 min,浸提液减压浓缩,双氧水氧化脱色,Sevag试剂除蛋白后4 000 r/min离心10 min,取上清液,加5倍体积的95%乙醇溶液,冰箱静置24 h后减压抽滤分离絮状沉淀,乙醇、丙酮淋洗3次后于60℃恒温箱烘干,得粗多糖。经苯酚-硫酸法测定,多糖含量为5.06%。
1.3.2大孔树脂的预处理[18]
使用95%乙醇溶液将树脂充分浸泡24 h后用无水乙醇洗涤至无白色混浊出现,用蒸馏水冲洗树脂无醇味,后分别用5%HCl溶液、5%NaOH溶液浸泡3 h,用蒸馏水洗至pH值为中性。
1.3.3大孔树脂的筛选
选用7种不同型号的树脂:D101、NKC-9、NKA-9、YPR-Ⅱ、S-8、CAD-40和HPD100树脂,准确称取5.0 g预处理过的树脂放入锥形瓶中,分别加入40μg/mL的上样液(准噶尔山楂多糖溶液)30 mL,恒温25℃,振荡吸附24 h后分离出树脂,加入洗脱液(NaCl溶液)振荡洗脱24 h,用紫外分光光度计测定溶液的吸光度,根据式(1)、(2)计算不同型号树脂的吸附率和洗脱率。

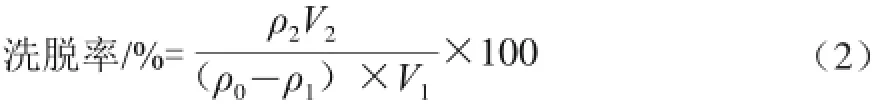
式(1)、(2)中:V1为吸附液体积/mL;V2为洗脱液用量/mL;ρ0为上样液起始质量浓度/(μg/mL);ρ1为吸附后上样液质量浓度/(μg/mL);ρ2为洗脱液质量浓度/(μg/mL)。
根据文献[19],将上述方法选出的吸附率和洗脱率最高的两种树脂按照不同比例混合,准确称取5.0 g预处理过的混合树脂放入锥形瓶中,量取40μg/mL的准噶尔山楂多糖溶液30 mL进行吸附和洗脱,计算吸附率和洗脱率,选出最优的混合比例。
1.3.4多糖含量测定
采用苯酚-硫酸法[20]。制作标准曲线:精确量取质量浓度为100μg/mL的葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0 mL至10 mL具塞比色管中,各用蒸馏水补至1.0 mL,使用苯酚-硫酸法显色,于490 nm波长处测吸光度,横坐标X为葡萄糖质量浓度(μg/mL),纵坐标Y为吸光度,得到回归方程:Y=0.069 45X+0.002 8(R2=0.999 14),线性关系良好。
样品多糖含量的测定:精确称量70 mg干燥准噶尔山楂粗多糖定容至100 mL,苯酚-硫酸法显色后测定吸光度,根据标准曲线方程计算得准噶尔山楂多糖质量浓度,按照式(3)计算多糖含量。
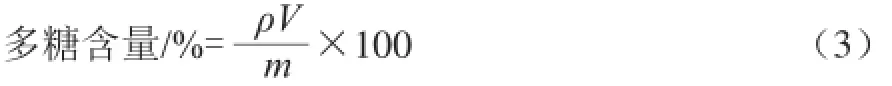
式中:ρ为液体中多糖质量浓度/(μg/mL);V为液体体积/mL;m为称取干燥样品的质量/mg。
1.3.5吸附多糖单因素试验
配制pH值分别为6、7、8、9、10,质量浓度为1 g/L的准噶尔山楂多糖溶液,控制流速3 mL/min,流经树脂径高比为1∶10的大孔树脂柱;配制质量浓度为0.5、1.0、1.5、2.0 g/L的准噶尔山楂多糖溶液,固定pH 8,控制流速3 mL/min,流经树脂径高比为1∶10的大孔树脂柱;配制质量浓度为0.5 g/L的准噶尔山楂多糖溶液,固定pH 8,控制流速分别为1.0、3.0、5.0、7.0 mL/min,流经树脂径高比为1∶10的大孔树脂柱;配制质量浓度为0.5 g/L的准噶尔山楂多糖溶液,固定pH 8,流速为1.0 mL/min,流经树脂径高比分别为1∶5、1∶8、1∶10、1∶13、1∶15的大孔树脂柱;收集流出液,计算吸附率。
1.3.6洗脱多糖单因素试验
配制pH值分别为6、7、8、9、10,浓度为0.2 mol/L NaCl溶液,固定洗脱液用量4 BV,控制流速3.0 mL/min进行洗脱;配制pH 8、洗脱液用量4 BV、浓度为0.2 mol/L的NaCl溶液,控制流速分别为1.0、3.0、5.0、7.0 mL/min进行洗脱;配制pH 8、洗脱液用量4 BV、浓度分别为0、0.1、0.15、0.2、0.25、0.3 mol/L的NaCl溶液,控制流速1.0 mL/min进行洗脱;配制pH 8、浓度0.25 mol/L的NaCl溶液,控制流速1.0 mL/min,洗脱液用量分别为2、4、6、8BV进行洗脱;收集洗脱液,计算洗脱率。
1.3.7 吸附和洗脱多糖的响应面试验
选取3 个对吸附率和洗脱率影响较大的单因素,设计Box-Behnken试验[21-23],响应面试验因素与水平见表1、2。

表1 吸附多糖响应面因素水平表Table 1 Factors and their coded levels of response surface design for the optimization of adsorption conditions

表2 洗脱多糖响应面因素水平表Table 2 Factors and their coded levels of response surface design for the optimization of desorption conditions
2 结果与分析
2.1 大孔树脂的筛选

图1 不同树脂对多糖的吸附和解吸附能力Fig.1 Comparison of polysaccharide adsorption and desorption capacities of different resins
由图1可以看出,不同型号树脂对多糖的吸附能力差异较大,利用吸附的可逆性分离多糖,吸附率与洗脱率的高低都将影响多糖纯化的程度,由于树脂极性不同,吸附洗脱准噶尔山楂多糖的程度也不同,其中以NKA-9的吸附能力最强,D101洗脱率最高,本实验将采用NKA-9树脂和D101树脂按一定比例混合纯化准噶尔山楂粗多糖,旨在提高吸附率与洗脱率。
由图2可以看出,经过混合后的树脂,吸附率与洗脱率都大幅上升,NKA-9与D101树脂质量比为2∶3时,吸附率为77%,洗脱率为97%;树脂质量比为3∶2时吸附率为78%,洗脱率为74%;树脂质量比为1∶1时, 吸附率为74%,洗脱率为85%。因此选择NKA-9与D101树脂比例为2∶3。

图2 不同混合比例树脂的吸附率与洗脱率对比Fig.2 Comparison of adsorption and desorption capacities of NKA-9:D101 mixtures in different proportions
2.2 动态吸附准噶尔山楂多糖单因素试验结果
2.2.1 上样液pH值对吸附率的影响
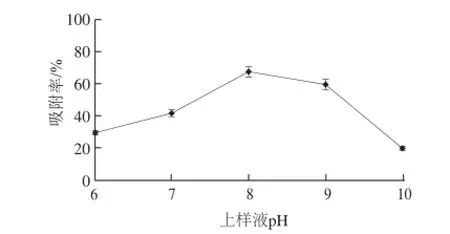
图3 上样液pH值对吸附率的影响Fig.3 Effect of sample pH on the adsorption rate of polysaccharides
由图3可以看出,混合树脂吸附率随着pH值的升高呈现先升高后下降的趋势,pH达到8时,吸附率最大。这是因为多糖类物质在强碱性条件下会发生异构化和分解反应,因此在弱碱性条件下有利于大孔树脂吸附多糖,pH值继续升高不利于吸附[24-25],因此选择pH 8为最佳上样液pH值。
2.2.2 上样液质量浓度对吸附率的影响

图4 上样液质量浓度对吸附率影响Fig.4 Effect of sample concentration on the adsorption rate of polysaccharides
由图4可以看出,随着上样液质量浓度从0.5 g/L逐渐增加,吸附率反而下降,这是因为树脂吸附目标产物时,存在着一个吸附平衡,该平衡和料液质量浓度有很大的关系。尤其是当树脂的吸附平衡是受液膜扩散控制时,料液质量浓度对树脂吸附平衡影响更大[26],当上样液质量浓度过大时,多糖含量高,过于密集,不能使其更充分地与树脂接触,影响吸附效果,且高质量浓度会增加悬浮杂质,堵塞树脂孔洞,所以选择0.5 g/L为上样液合适质量浓度。
2.2.3 上样液流速对吸附率的影响
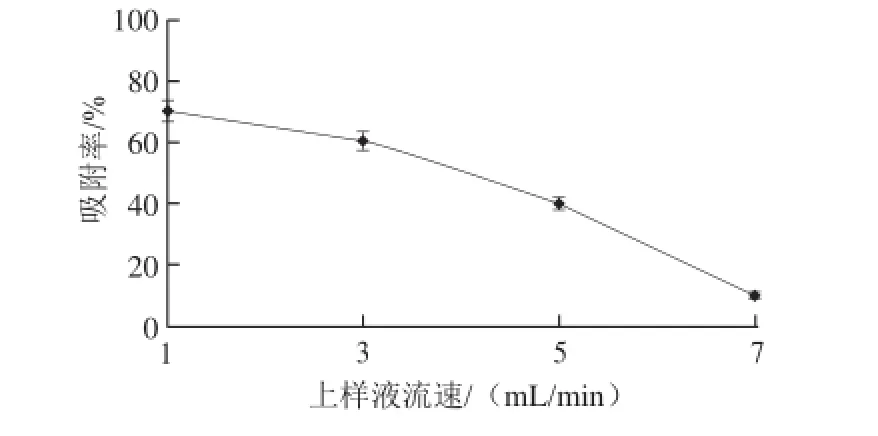
图5 上样液流速对吸附率的影响Fig.5 Effect of sampling flow rate on the adsorption rate of polysaccharides
由图5可知,随着上样液流速的增加,吸附率在不断降低,上样液流速为1.0 mL/min时,混合树脂的吸附率最大。这是由于流速的增加意味着多糖的单位时间流量增加,过快的流速会提 前泄漏,不能使树脂充分吸附多糖,降低内孔利用率,引起损失,流速低,有利于充分吸附,但会影响生产效率,使生产周期延长,所以确定1.0 mL/min为上样液最佳流速。
2.2.4 树脂径高比对吸附率的影响
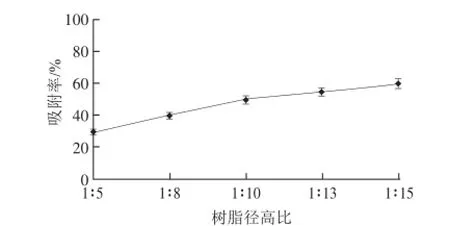
图6 树脂径高比对吸附率的影响Fig.6 Effect of column diameter-to-height ratio on the adsorption rate of polysaccharides
由图6可知,大孔树脂径高比和吸附率呈良好的线性关系,随着树脂径高比的减小,吸附率不断增大。因为树脂用量越大,吸附总表面就越大,越有利于吸附过程的进行,但树脂用量过多,又将导致成本增加。从节省材料和最适吸附率角度考虑,确定1∶13为合适大孔树脂径高比。
2.3 动态洗脱准噶尔山楂多糖单因素试验结果
2.3.1 洗脱液pH值对洗脱率的影响
由图7可以看出,随着洗脱液pH值的升高,洗脱率也随之增高,pH 8时洗脱率最高,pH 9时,洗脱率开始有所降低,pH值升高到10时,洗脱率急速下降,这是由于过碱性的条件会引起 多糖降解且不符合树脂本身性质要求,因此选择pH 8为洗脱液的最佳pH值。

图7 洗脱液pH值对洗脱率的影响Fig.7 Influence of eluent pH values on the elution efficiency
2.3.2 洗脱液流速对洗脱率的影响
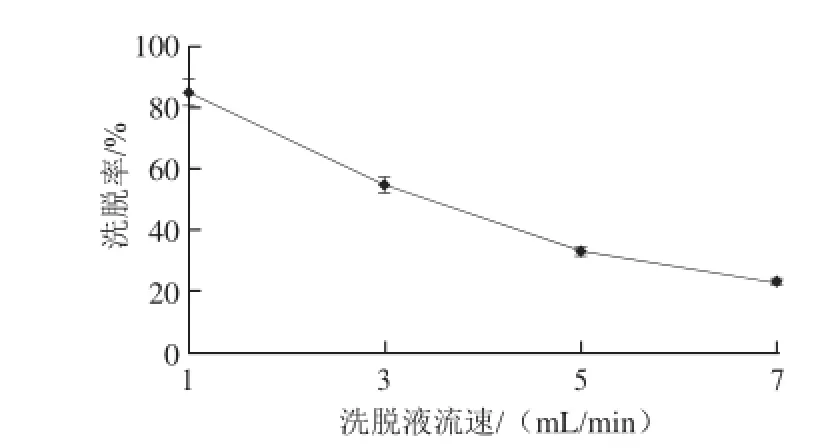
图8 洗脱液流速对洗脱率的影响Fig.8 Effect of eluent flow rate on the desorption rate of polysaccharides
由图8可以看出,洗脱液流速与洗脱率成反比例关系,随着流速的增大,洗脱率在不断降低,洗脱液流速为1.0 mL/min时,多糖的洗脱率最高,这是由于过快的流速使洗脱液与树脂柱接触不充分,导致多糖洗脱率降低,确定1.0 mL/min为洗脱液的最适流速。
2.3.3 洗脱液浓度对洗脱率的影响
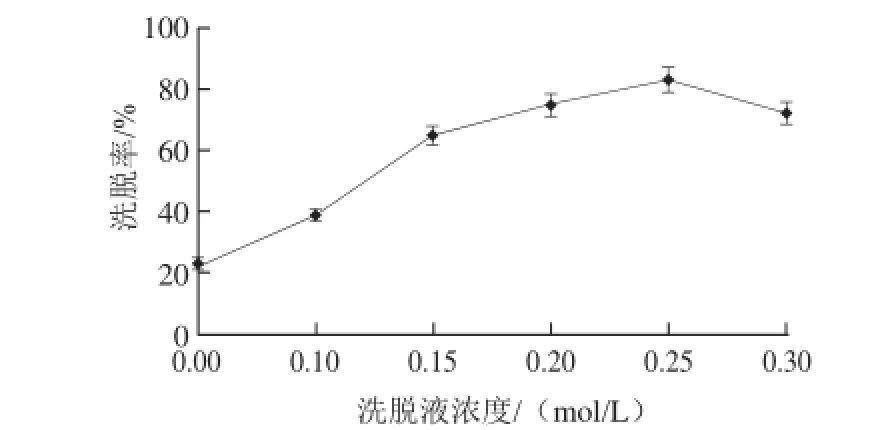
图9 洗脱液浓度对洗脱率的影响Fig.9 Effect of eluent concentration on the desorption rate of polysaccharides
由图9可以看出,随着NaCl溶液浓度的增高,洗脱率先升高后下降,出现这种情况是由于盐浓度过低会使多糖更易被吸附,吸附后不易被洗脱,盐浓度过高会使溶液的颗粒物含量增大,降低多糖洗脱率。所以确定0.25 mol/L为洗脱液的最适浓度。
2.3.4 洗脱液用量对洗脱率的影响

图10 洗脱液用量的选择Fig.10 Effect of eluent amount on the desorption rate of polysaccharides
由图10可以看出,洗脱剂用量与洗脱率呈正相关,随着NaCl溶液用量的增加,洗脱率在不断上升,用量越大,洗脱率越大,但增加幅度不断减小,在6~8 BV之间增加幅度最小。从节省洗脱剂的用量的角度考虑,选用6 BV的NaCl溶液洗脱。
2.4 响应面试验结果

表3 吸附多糖响应面试验设计与结果Table 3 Response surface design arrangement and corresponding experimental data for the optimization of adsorption conditions
使用Design-Expert软件,得到响应面试验设计与结果见表3、4。对结果进行分析拟合,得到二次多元回归方程:
吸附率(Y1)对上样液流速(A)、上样液质量浓度(B)、树脂径高比(C)的回归方程:

洗脱率(Y2)对洗脱液浓度(X1)、洗脱液流速(X2)、洗脱液用量(X3)的回归方程:



表4 洗脱多糖响应面试验设计与结果Table 4 Response surface design arrangement and corresponding experimental data for the optimization of desorption conditions
对得到的吸附与洗脱回归模型分别进行方差分析如表5、6所示。
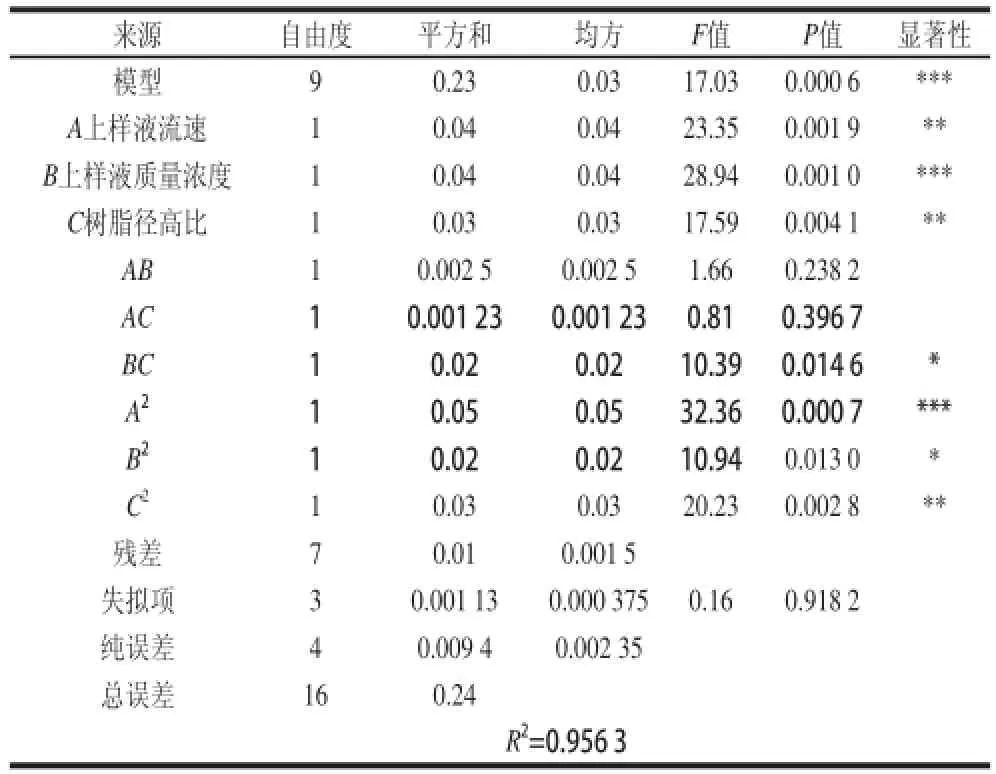
表5 吸附率回归模型的方差分析Table 5 Analysis of variance for the fitted regression equation for the adsorption rate of polysaccharides
吸附模型极显著(P<0.001),失拟项(P=0.918 2>0.05)不显著,说明模型与试验拟合程度较高,可用于上样液流速(A)、上样液质量浓度(B)、树脂径高比(C)对树脂吸附率的理论预测。回归方程各项显著性表明:一次项A(P=0.001 9<0.01)显著,B(P=0.001)极显著,C(P=0.004 1<0.01)显著,交互项只有BC项有差异,平方项A2为极显著项,C2为显著项,根据回归方程一次项系数绝对值大小可以得到,在试验范围内,3 个因素对多糖吸附率的影响由大到小排序为:上样液质量浓度(B)>上样液流速(A)>树脂径高比(C)。

表6 洗脱率回归模型的方差分析Table 6 Analysis of variance for the fitted regression equation for the desorption rate of polysaccharides
洗脱模型极显著(P<0.0 0 0 1),失拟项(P=0.385 2>0.05)不显著,说明模型与试验拟合程度较高,可用于洗脱液浓度(X1)、洗脱液流速(X2)、洗脱液用量(X3)对多糖洗脱率的理论预测。回归方程各项显著性表明:一次项X1(P<0.000 1)极显著,X2、X3都为显著项,平方项都为极显著项,为显著项,说明选取的三因素对NaCl溶液洗脱准噶尔山楂多糖的影响不是简单的线性关系,平方项对响应值也有很大影响。根据回归方程一次项系数绝对值大小可以得到,在试验范围内,3 个因素对多糖洗脱率的影响由大到小排序为:洗脱液浓度(X1)>洗脱液用量(X3)>洗脱液流速(X2)。
2.5 响应面分析
2.5.1 动态吸附多糖各因素间交互作用的响应面


图11 动态吸附多糖各因素间相互影响的响应面图Fig.11 Response surface plots illustrating the effect of adsorption parameters on the adsorption rate of polysaccharides
由图11a可见,等高线图呈椭圆形,说明上样液流速和质量浓度的交互作用对多糖吸附率影响显著,当流速相同时,随着上样液质量浓度的增大,吸附率变化不显著;当上样液质量浓度一定时,随着流速的增加,吸附率也增加,当流速超过一定范围时,反而不利于吸附。由图11b可见,等高线图呈圆形,响应面图的坡度较为平缓,说明树脂径高比和流速的交互作用对多糖吸附率影响不显著,当树脂径高比相同时,随着流速的增大,吸附率增大;当流速相同时,随着树脂径高比的 减小,吸附率增大。由图11c可见,等高线图呈椭圆形,说明树脂径高比和上样液质量浓度的交互作用对多糖吸附率影响显著;当树脂径高比相同时,随着上样液质量浓度的增加,吸附率变化不明显;当上样液质量浓度一定时,随着树脂径高比的减小,吸附率先升高后降低。
通过对方程求解得到最佳吸附条件为上样液流速3.75 mL/min、上样液质量浓度1.32 g/L、树脂径高比1∶13.2,吸附率为62.77%。考虑到实际操作的便利,将其修正为上样液流速3.75 mL/min、质量浓度1.32 g/L、树脂径高比1∶13,根据此条件进行吸附验证实验,吸附率为60.75%。
2.5.2 动态洗脱多糖各因素间交互作用响应面
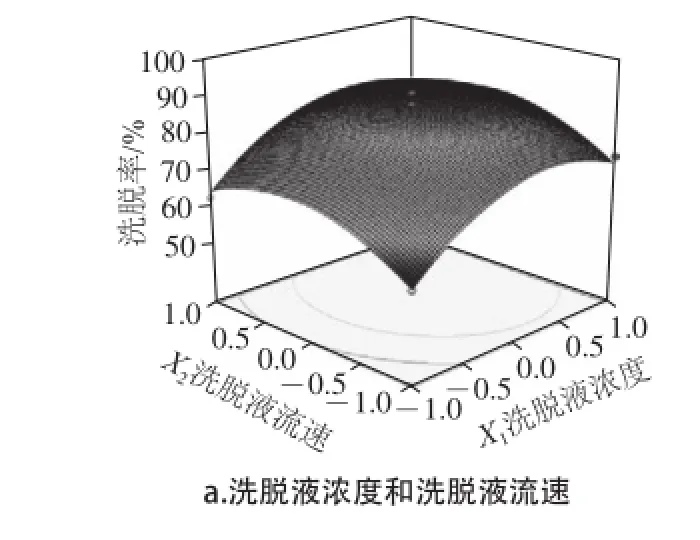

图12 动态洗脱多糖各因素间交互作用的等高线及响应面图Fig.12 Response surface and contour graphs illustrating the effect of desorption parameters on the desorption rate of polysaccharides
由图12a可见,等高线图呈圆形,响应面图的坡度较为平缓,说明洗脱液流速和浓度的交互作用对多糖洗脱率影响不显著,当流速相同时,随着浓度的增大,洗脱率升高;当浓度一定时,随着流速的增加,洗脱率变化不明显。由图12b可见,等高线图呈椭圆形,响应面图的坡度较陡,说明洗脱液浓度和用量的交互作用对多糖洗脱率影响显著,当浓度相同时,随着用量的增大,洗脱率变化不明显;当用量相同时,随着浓度的增大,洗脱率先增大后减小。由图12c可见,等高线图呈椭圆形,说明用量和流速的交互作用对多糖洗脱率影响显著;当用量相同时,随着流速的增加,洗脱率变化不明显;当流速一定时,随着用量的增大,洗脱率先升高后降低。
对方程求解,得到最佳洗脱条件为洗脱液浓度0.27 mol/L、洗脱液流速3.44 mL/min、洗脱液用量6.73 BV,洗脱率89.97%,考虑到实际操作的便利将其修正为洗脱液浓度0.27 mol/L、洗脱液流速3.5 mL/min、洗脱液用量7 BV,根据此条件进行洗脱验证实验,洗脱率为84.22%,与预测值相差不大,实验结果表明,经过纯化后,样品多糖含量由原来的5.06%上升至21.13%,可见采用响应面法可实现多条件同步优化准噶尔山楂精制工艺,具有实际应用价值。
3 结 论
在比较D101、NKC-9、NKA-9、YPR-Ⅱ、S-8、CAD-40和HPD100树脂对准噶尔山楂多糖溶液吸附和洗脱效果基础上选择NKA-9和D101为最优树脂。NKA-9与D101树脂质量比为2∶3对准噶尔山楂多糖的吸附洗脱效果最好。最佳吸附工艺条件为上样液流速3.75 mL/min、质量浓度1.32 g/L、树脂径高比1∶13,此条件下多糖的吸附率为60.75%。最佳洗脱工艺条件为洗脱液浓度0.27 mol/L、洗脱液流速3.5 mL/min、洗脱液用量7 BV,此条件下多糖的洗脱率为84.22%。
与常规方法相比,采用混合大孔树脂纯化多糖,多糖的损失率较小,能够较大地提高多糖的得率。经过纯化后,样品多糖含量由原来的5.06%上升至21.13%,提高近4 倍,本研究为准噶尔山楂残渣多糖的纯化提供新方法,具有较好的应用价值。
[1] 梁宁, 杨磊, 李靖. 多糖研究进展[J]. 吉林农业, 2011, 20(5): 321-329.
[2] 林龙, 常建波, 孙煜煊. 孔石莼多糖降血糖作用研究[J]. 食品科技, 2012, 37(6): 224-227.
[3] 刘德胜, 刘为忠, 颜玲. 樱桃叶多糖的抗氧化活性研究[J]. 中国生化药物杂志, 2012, 33(5): 571-573.
[4] 徐世忱, 李广全, 孙莹. 北五味子粗多糖的提取与成分分析[J]. 吉林医药工业, 1992(4): 15-18.
[5] 方一苇. 具有药理活性多糖的研究现况[J]. 分析化学, 1994, 22(9): 955-960.
[6] 刘洁, 李文香, 王文亮. 生物多糖研究进展[J]. 山东农业科学, 2011(5): 98-101.
[7] 王章姐, 郁万杨, 张梦如. 植物多糖研究进展[J]. 亚太传统医药, 2014, 10(6): 39.
[8] 安争夕, 韩英兰, 李学禹. 新疆植物志[M]. 2版. 乌鲁木齐: 新疆科技卫生出版社, 1995: 282.
[9] 任艳利, 张维, 刘影. 准噶尔山楂叶总黄酮的超声波提取及抗氧化研究[J]. 安徽农业科学, 2012, 40(15): 8710-8712.
[10] 任艳利, 张相锋, 赵玉. 超声波提取准噶尔山楂中的熊果酸与抗氧化研究[J]. 安徽农学通报, 2012, 8(1): 46-48.
[11] 吕海英, 周露露, 李进. 准噶尔山楂果实色素提取工艺研究[J]. 安徽农学通报, 2011, 17(9): 25-27.
[12] 赵静虹, 穆楠, 闫桂琴. 大孔树脂纯化翅果油树叶片多糖的研究[J].西南大学学报: 自然科学版, 2012, 34(4): 78-82.
[13] 雍晓静, 刘钢, 张境. 应用大孔树脂分离纯化枸杞叶总黄酮的研究[J].宁夏大学学报: 自然科学版, 2005, 26(2): 148-150.
[14] 蔡丹昭, 刘华钢. 大孔吸附树脂分离纯化番石榴叶总黄酮的研究[J].生命科学研究, 2008, 12(1): 57-60.
[15] 王明艳, 张小杰, 王涛. 响应面法优化香椿叶多糖的提取条件[J]. 食品科学, 2010, 31(4): 106-110.
[16] 崔凤杰, 许泓瑜. 响应曲面法优化灰树花水溶性多糖提取工艺的研究[J]. 食品科学, 2006, 27(4): 142-146.
[17] 马玉婷, 李进, 张志怡. 响应面法优化黑果枸杞酒渣多糖精制工艺[J].食品科学, 2012, 33(6): 37-43.
[18] 刘安军, 刘慧慧, 郭丹霄, 等. 大孔吸附树脂分离纯化枸杞叶总黄酮的研究[J]. 现代食品科技, 2012, 28(3): 292-296.
[19] 黄金龙, 殷之武, 何新华. 银杏叶总黄酮纯化工艺研究[J]. 中草药, 2012, 43(5): 922-925.
[20] 刘晓涵, 陈永刚, 林励. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技, 2009, 34(9): 270-272.
[21] GUO Lei, CHEN Yu. Optimization of ultrasonic-assisted extraction of polysaccharides fromEnteromorpha proliferaby response surface methodology[J]. Food Scie nce, 2010, 31(16): 117-121.
[22] NEDIM T, ESRA Y. Ultrasound-assisted extraction of d-pinitol from carob pods using response surface methodology[J]. Ultrasonics Sonochemistry, 2014, 21(2): 860-865.
[23] 王莉, 赵桦, 马英丽. 响应面法优化小丛红景天多糖超声提取工艺研究[J]. 食品工业科技, 2014, 35(14): 315-320.
[24] 黄永春, 杨锋, 马月飞. D941大孔树脂吸附茶多糖的热力学研究[J].食品科学, 2008, 29(11): 274-277.
[25] 黄建明, 郭济贤, 陈万生, 等. 大孔树脂对草乌生物碱的吸附性能及提纯工艺[J]. 复旦学报: 医学版, 2003, 30(3): 267-269.
[26] 杨乐, 王洪新, 秦晓娟. 大孔树脂纯化笋壳中的黄酮物质[J]. 食品与生物技术学报, 2011, 30(2): 218-223.
Optimization of Purification Process for Crude Polysaccharides from the Pomace of Wild Crataegus songorica in Xinjiang by Response Surface Methodology
ZHANG Yu, LI Jin*, L☒ Haiying, ZHANG Xia, ZHANG Huali
(Xinjiang Key Laboratory of Special Sp ecies Conservation and Regulatory Biology, College of L ife Sciences, Xinjiang Normal University, ☒rümqi 830054, China)
In order to improve the purity of polysaccharides from the pomace of wild Crataegus songorica, NKA-9 and D101 were selected from 7 kinds of macroporous resins by static adsorption-desorption experiments, and the two selected resins were mixed at an appropriate ratio. On the basis of single factor expe riments, response surface methodology was used to optimize process parameters. The optimal mixing ratio of NKA-9 to D101-1 was 2:3 (by mass). The optimum experimental parameters for adsorption were as follows: sample loading fl ow rate, 3.75 mL/min; sample concentration, 1.32 g/L; and resin diameter-to-height ratio, 1:13, yielding a rate of adsorption of 60.75%. Under the optimal desorption conditions: 7 BV of 0.27 mol/L NaCl as eluent at a fl ow rate of 3.5 mL/min, a rate of desorption of 84.22% could be achieved. The content of polysaccharides was increased from 5.06% to 21.13%.
Crataegus songorica; polys accharides; response surface methodology; purifi cation
Q946.8
A
1002-6630(2015)12-0022-07
10.7506/spkx1002-6630-201512005
2014-11-22
国家自然科学基金青年科学基金项目(31200300);新疆维吾尔自治区教育厅重点实验室项目(XJSD2013-0104)
张玉(1990—),女,硕士研究生,主要从事植物资源研究。E-mail:1107662720@qq.com
*通信作者:李进(1969—),男,教授,博士,主要从事植物生理生态和资源利用研究。E-mail:xjcjlj4@xjnu.edu.cn
