干热条件下壳聚糖-木糖的美拉德反应
2015-01-05
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
干热条件下壳聚糖-木糖的美拉德反应
李艳龙,黄国清,肖军霞*
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
以木糖为模式还原糖,研究干热条件下壳聚糖与木糖发生美拉德反应的可能性,探讨反应温度、相对湿度、反应时间和壳聚糖/木糖配比4个因素对美拉德反应的影响,并对在最适条件下获得的美拉德反应产物的热性能和流变学性质进行表征。结果表明,在干热条件下壳聚糖与木糖易于发生美拉德反应,且发生反应的最适条件为将两者按1∶1质量比例混合,在90℃及61.2%的相对湿度条件下反应4 h。在此条件下获得的壳聚糖-木糖美拉德反应产物的热分解温度与壳聚糖相比有所降低,流变学研究表明美拉德反应产物在溶液中的弹性明显增强。
壳聚糖;木糖;美拉德反应;干热法
壳聚糖是由几丁质通过脱乙酰基而制得,几丁质广泛存在于虾、蟹、昆虫外壳以及真菌和一些藻类的细胞壁中,其在自然界的含量仅次于纤维素[1]。壳聚糖具有无毒、生物相容、可降解、可控释等优点,因此在敏感成分微囊化、食品添加剂、澄清剂等都有极大的应用潜力[2-10]。但是壳聚糖只溶于酸性溶液,这在很大程度上限制了其应用,壳聚糖的改性已成为近年来研究的热点。壳聚糖的改性方法总体可分为物理改性和化学改性,物理改性包括聚电解质复合和小分子无机物填充等,而化学改性主要包括酰化、羧基化等[11]。改性后的壳聚糖,其水溶性有很大的改善,而且具有更好的抗氧化和抗菌性等功能性质[12-15]。
美拉德反应又称羰氨反应,是食品中的氨基化合物(氨基酸、肽、蛋白质和胺)和羰基化合物(糖类)在食品加工和贮存过程中发生的反应,是引起食品非酶褐变的主要因素之一[16]。美拉德反应可使蛋白质糖基化,因此该反应在蛋白质改性中的应用已经吸引了众多学者的关注[17-21]。壳聚糖含有大量的游离氨基,因此也可与还原糖发生美拉德反应进而引起其性质的改变。目前,已报道的利用美拉德反应对壳聚糖进行改性的方法主要有两种,分别是湿热法和半干热法。在湿热法中,将壳聚糖与还原糖溶解在酸性溶液中,然后加热使两者在溶液状态下发生美拉德反应;半干热法是在湿热法的基础上,将壳聚糖与还原糖的混合溶液干燥后在一定湿度条件下保温使两者在粉末状态下发生反应。现有的研究表明,美拉德反应可以显著提高壳聚糖的溶解性和抗菌活性[22-25],因此在壳聚糖的改性中具有很大的应用潜力。
但是,上述两种美拉德反应改性方法操作过程繁琐,能源消耗较大,而且反应产物中可能有酸性溶剂残留,因此不太适合工业化应用。本实验以木糖为还原糖,使其与壳聚糖在干热条件下,即将两者的固体粉末直接混合均匀后使之在一定温度和相对湿度条件下发生美拉德反应,研究环境因素对两者美拉德反应的影响,以探讨在干热条件下两者发生美拉德反应的可能性,并对美拉德反应产物的部分特性进行表征。本研究对于推动美拉德反应在壳聚糖改性中的实际应用具有积极意义。
1 材料与方法
1.1 材料与试剂
壳聚糖(脱乙酰度大于90.0%) 上海蓝季科技发展有限公司;D-木糖(分析纯) 天津市化学试剂公司;乙酸、盐酸、氯化镁、溴化钠、碘化钾(均为分析纯) 天津市巴斯夫化工有限公司。
1.2 仪器与设备
302型电热鼓风干燥器 龙口市先科仪器公司;UV-2000紫外-可见分光光度计 上海尤尼科仪器有限公司;色彩色差计 柯尼卡美能达投资有限公司;DSC822差示扫描量热仪 梅特勒-托利多公司;MCR302界面流变仪 奥地利Anton Paar股份有限公司。
1.3 方法
1.3.1 壳聚糖-木糖美拉德反产物的制备
准确称取一定量壳聚糖与木糖,在研钵中充分研磨混匀后放入康威氏皿内室,在外室中加入饱和盐溶液,然后将康威氏皿放入恒温箱中,使壳聚糖与木糖在一定温度和一定湿度条件下反应一定时间。反应结束后,将反应物冷却至室温,检测美拉德反应发生的程度。
1.3.2 壳聚糖-木糖美拉德反应的检测
1.3.2.1 比色法
美拉德反应中间阶段和最终阶段产生的物质分别在290 nm和420 nm波长处有吸收[26],因此可用290 nm和420 nm波长处的吸光度表示美拉德反应的程度。准确称取反应产物0.25 g溶于50 mL 1%乙酸溶液中,待溶液澄清后,取上清液分别于290 nm和420 nm波长处测定吸光度。
1.3.2.2 色度值法
研究过程中发现,当美拉德反应的程度过高时会导致形成不溶性产物,此时用比色法就不能准确反映美拉德反应的进程。由于美拉德反应会使壳聚糖的颜色加深,因此本研究同时测定了美拉德反应产物的L值。L值越小,表明样品的颜色越深,美拉德反应程度越高。称取适量(大于3 g)样品,将其盛入4 cm的小型透明真空袋内,试样要保证表面平整光滑,然后用色彩色差计测定反应物的L值,每个样品平行测定3次。
1.3.3 壳聚糖-木糖美拉德反应条件的优化
1.3.3.1 反应温度对壳聚糖-木糖美拉德反应的影响
称取研磨均匀的壳聚糖和木糖各3.0 g,选取60、70、80、90、100℃温度条件下,在由饱和碘化钾溶液(61.2%)提供相对湿度的情况下反应6 h后,冷却至25℃,测定美拉德反应发生的程度。
1.3.3.2 相对湿度对壳聚糖-木糖美拉德反应的影响
称取研磨均匀的壳聚糖和木糖各3.0 g,分别在饱和氯化镁溶液(26.1%)、饱和溴化钠溶液(51.4%)、饱和碘化钾溶液(61.2%)、饱和氯化钠溶液(73.9%)控制相对湿度的条件下,于90℃反应6 h后,冷却至25℃,测定美拉德反应发生的程度。
1.3.3.3 反应时间对壳聚糖-木糖美拉德反应的影响
称取研磨均匀的壳聚糖和木糖各3.0 g,于90℃和相对湿度61.2%条件下,分别反应2、3、4、5 h和6 h。反应结束后,冷却至25℃,测定美拉德反应发生的程度。
1.3.3.4 混合比例对壳聚糖-木糖美拉德反应的影响
称取研磨均匀的壳聚糖3 g,然后按照2∶1、1.5∶1、1∶1、1∶1.5、1∶2的质量比称取木糖,将两者混合均匀,于相对湿度61.2%,90℃反应4 h后,冷却至25℃,测定美拉德反应发生的程度。
1.3.4 美拉德反应产物的表征
1.3.4.1 热性能
称取5 mg壳聚糖-木糖美拉德反应物于铝盘中密封,以空铝盘为参照,置于DSC822差示扫描量热仪中,以氮气对吹扫气,升温速率设为5℃/min,测定反应产物的热性能。
1.3.4.2 流变学性质
称取0.25 mg壳聚糖-木糖美拉德反应物或对照溶于50 mL 1%乙酸溶液中,测定其流变学性质。所选夹具为夹角2°、直径6 cm的锥板,测试间距离为0.047 mm,测试温度为25℃。
1.4 数据分析
每种样品每次均测定3个平行,结果以表示,采用SPSS 17.0进行统计分析。组间差异显著性分析采用方差分析中的Tukey HSD测试,显著水平小于0.05时认为差异显著。
2 结果与分析
2.1 壳聚糖-木糖美拉德反应条件的优化
2.1.1 反应温度对壳聚糖-木糖美拉德反应的影响
由图1可知,在60~90℃范围内,随着反应温度的升高,美拉德反应产物在290 nm和420 nm波长条件下的吸光度均随之显著增加,但是当温度进一步升至100℃时,其在这两个波长处吸光度均显著降低。从图1还可以看出,在60℃和70℃时,在420 nm波长处的吸光度低于290 nm波长处的吸光度,表明此时美拉德反应主要发生在中间阶段;但是当温度进一步升高到80℃和90℃时,420 nm波长处的吸光度开始大于290 nm波长处的吸光度,表明此时美拉德反应到了最终阶段。

图1 反应温度对壳聚糖-木糖美拉德反应产物吸光度的影响Fig.1 Effect of reaction temperatures on the absorbance of chitosan-xylose Maillard reaction products

图2 反应温度对壳聚糖-木糖美拉德反应产物色度值的影响Fig.2 Effect of temperature on the L value of chitosan-xylose Maillard reaction products
由图2可知,随着反应温度的升高,美拉德反应产物的L值显著降低,ΔL逐渐变小,表明美拉德反应产物颜色随之加深。这说明,壳聚糖-木糖美拉德反应的程度随温度的升高而逐渐增加,且在100℃时美拉德反应最为强烈,这与100℃时吸光度的测定结果不一致。这是由于在100℃时反应过于强烈,美拉德反应进入了最终阶段,产生了大量的不溶性高分子聚合物,使得美拉德反应产物在溶液中的溶解度和吸光度降低。由于溶解性的降低不利于壳聚糖的实际应用,因此在随后的研究中选择90℃为最适反应温度。
2.1.2 相对湿度对壳聚糖-木糖美拉德反应的影响
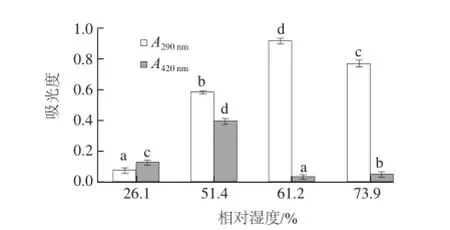
图3 相对湿度对壳聚糖-木糖美拉德反应产物吸光度的影响Fig.3 Effect of relative humidity on the absorbance of chitosan-xylose Maillard reaction products
由图3可知,相对湿度对壳聚糖-木糖美拉德反应的进程有显著影响。当相对湿度为26.1%时,在2个波长条件下的吸光度均最小,表明低湿度不利于壳聚糖-木糖美拉德反应的发生,或者反应进行的较快,美拉德反应进入了后期,形成了不溶性高分子聚合物,导致吸光度减小。当相对湿度为61.2%时,美拉德反应产物在290 nm波长处的吸光度最大,当相对湿度进一步增加时,该波长处的吸光度开始降低;另外,在相对湿度为51.4%时,420 nm波长处的吸光度最大,表明在此相对湿度条件下有利于美拉德反应进入到最终阶段。

图4 相对湿度对壳聚糖-木糖美拉德反应产物色度值的影响Fig.4 Effect of relative humidity on the L value of chitosan-xylose Maillard reaction products
由图4可知,不同相对湿度条件下壳聚糖-木糖美拉德反应产物色度值有差异,在相对湿度为26.1%时的L值最小,表明此条件下产物的颜色最深,结合图3可以说明,在低湿度条件下,壳聚糖-木糖美拉德反应进行较快,达到反应末期形成了高聚合物,溶解性降低,导致吸光度减小。相对湿度为61.2%时L值较相对湿度为51.4%和73.9%时小,说明反应程度较高,结合吸光度变化,在随后的研究中均选择相对湿度为61.2%。
2.1.3 反应时间对壳聚糖-木糖美拉德反应的影响
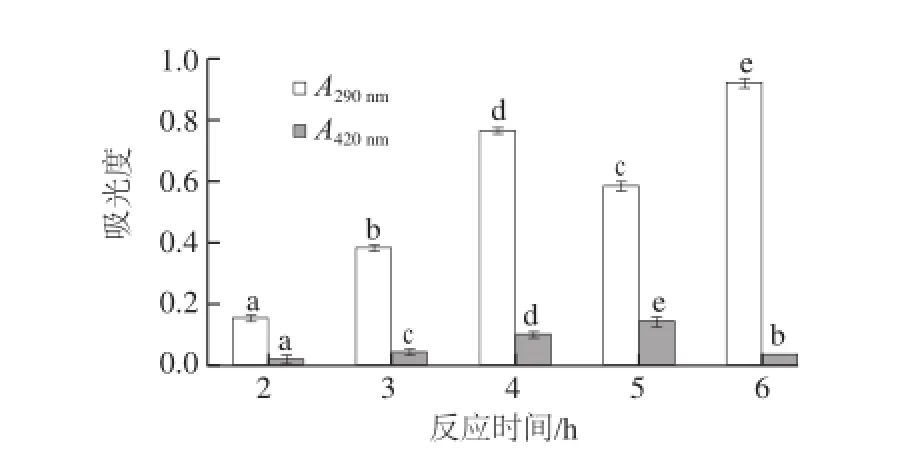
图5 反应时间对壳聚糖-木糖美拉德反应产物吸光度的影响Fig.5 Effect of reaction duration on the absorbance of chitosan-xylose Maillard reaction products
由图5可知,在反应时间为2~4 h时,随着反应时间的延长,在290 nm和420 nm波长处的吸光度随之显著增加,表明美拉德反应程度随之加大;当反应时间延长至5 h时,420 nm波长处的吸光度显著增加,而290 nm波长处的吸光度显著降低,说明美拉德反应的中间阶段产物进一步反应生成了最终阶段产物,导致在290 nm波长处的吸光度减小;当反应时间延长至6 h时,290 nm波长处的吸光度又显著增加,但是420 nm波长处的吸光度开始降低。这可能是由于随着时间的延长,美拉德反应逐渐进入到最终阶段,导致产物的溶解性降低,因此使得420 nm波长处的吸光度降低,而290 nm波长处的吸光度反而有所增加,这表明当反应时间进一步延长时,由于壳聚糖晶体结构被破坏,更多的壳聚糖分子参与了美拉德反应,因此使其在290 nm波长处的吸光度又开始显著增加。
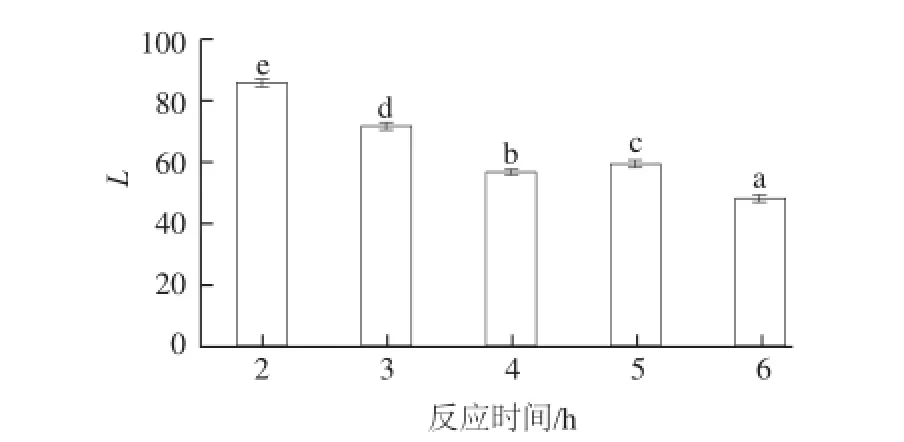
图6 反应时间对壳聚糖-木糖美拉德反应产物色度值的影响Fig.6 Effect of reaction duration on the L value of chitosan-xylose Maillard reaction products
由图6可知,壳聚糖-木糖美拉德反应产物的色度值变化规律与图5的变化规律基本一致,即反应时间为2~4 h时,色度值随着反应时间的延长逐渐降低,表明美拉德反应程度随时间的延长而增加;而当反应进行到5 h时,其色度值有所上升,这可能是由于壳聚糖晶体结构被破坏,更多的活性基团暴露出来,因此在一定程度上降低了产物整体的色度值;当反应时间进一步延长时,色度值继续显著降低,表明美拉德反应程度进一步增加。在研究过程中发现,反应4 h时产物的溶解性较好,当反应时间过长时,产物的溶解性显著下降,这与图5中美拉德反应进入最终阶段的分析一致。因此,在随后的研究中,选择4 h为最适反应时间。
2.1.4 壳聚糖与木糖的混合比例对美拉德反应的影响

图7 壳聚糖与木糖质量比对美拉德反应产物吸光度的影响Fig.7 Effect of chitosan to xylose ratio on the absorbance of chitosan-xylose Maillard reaction product
由图7可知,随着壳聚糖与木糖反应配比的减小,在290 nm波长处的吸光度逐渐增加,当壳聚糖-木糖质量比为1∶2时,美拉德反应产物在290 nm波长处的吸光度最大;当配比为1∶1时,壳聚糖-木糖美拉德反应产物在420 nm波长处的吸光度最大,但是当配比减小时吸光度开始降低;这可能是由于随着壳聚糖-木糖质量比的减小,没有足够的壳聚糖参与美拉德反应的最终阶段造成的。
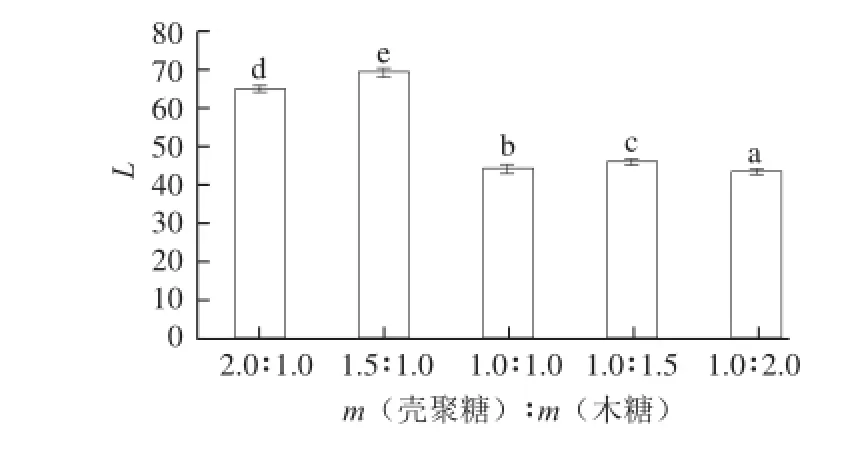
图8 壳聚糖与木糖配比对美拉德反应产物色度值的影响Fig.8 Effect of chitosan to xylose ratio on the L value of chitosan-xylose Maillard reaction product
由图8可知,壳聚糖-木糖美拉德反应产物的色度值变化规律与图7的变化规律基本一致。在研究过程中发现,壳聚糖-木糖质量比为1∶1时产物的溶解性较好,当二者配比增大或减小时,产物的溶解性开始显著下降。因此,在随后的研究中,选择壳聚糖-木糖质量比为1∶1作最适反应配比。
2.2 壳聚糖-木糖美拉德反应产物的表征
2.2.1 热性能
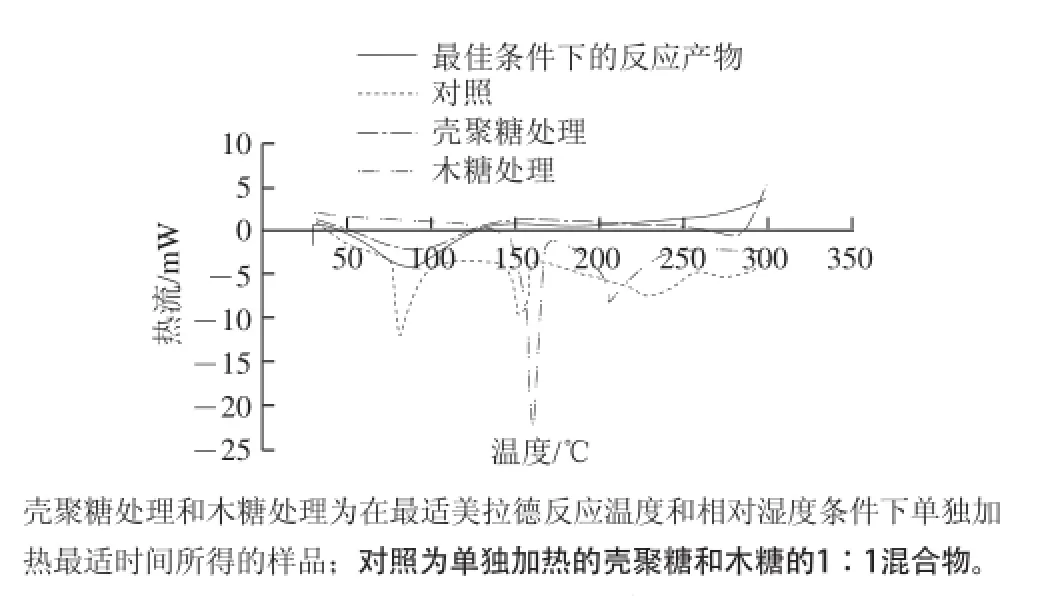
图9 壳聚糖-木糖美拉德反应物的热性质Fig.9 DSC pattern of chitosan-xylose Maillard reaction products
从图9可以看出,最适条件下所得的壳聚糖-木糖美拉德反应物、单独加热的壳聚糖和木糖及其两者的混合物(对照)在100℃附近出现了一个明显的吸热峰,该温度附近的吸热峰通常是由于水分蒸发引起的,表明这些样品中均含有一定的水分;另外,木糖及对照在150℃附近均出现了一个明显的吸热峰,这是由于木糖的晶体结构在此温度条件下被破坏而引起;另外,单独加热的壳聚糖在280℃附近开始出现明显的放热峰,表明在此温度下壳聚糖开始分解,而美拉德反应物在250℃左右处即开始出现放热峰,这可能是由于美拉德反应产生了一些更易于分解的产物,因此使得该放热峰得以提前。
2.2.2 壳聚糖-木糖美拉德反应物的流变学性质
2.2.2.1 壳聚糖-木糖美拉德反产物的黏弹性
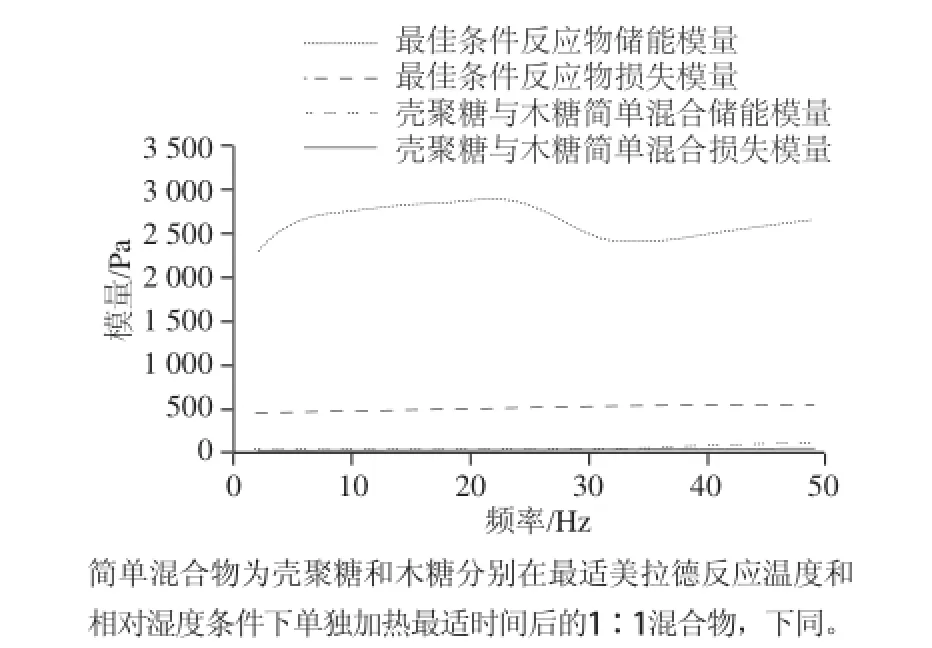
图10 壳聚糖-木糖美拉德反应产物的频率扫描曲线Fig.10 Frequency sweeping patterns of chitosan-xylose Maillard reaction products
由图10可知,壳聚糖-木糖的美拉德反应产物的储能模量和损失模量均明显高于壳聚糖与木糖简单混合物的模量值,表明美拉德反应增加了壳聚糖分子间或分子内的相互作用,使得分子之间的缠绕力增加,从而使得模量值增加;另外,美拉德反应产物的储能模量在整个频率范围内均高于损失模量,表明美拉德反应产物在溶液中主要表现胶体的弹性性质。因此,壳聚糖与木糖的美拉德反应可显著改变壳聚糖的黏弹性性质。
2.2.2.2 最适条件下壳聚糖-木糖美拉德反应物的黏度
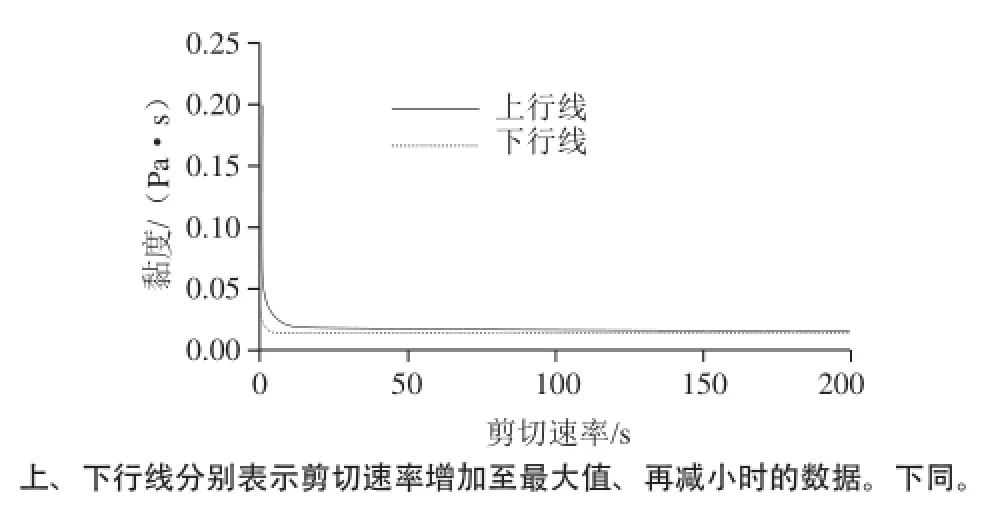
图11 壳聚糖和木糖的简单混合物的流变学特性Fig.11 Dynamic viscosity curve of chitosan-xylose mixture
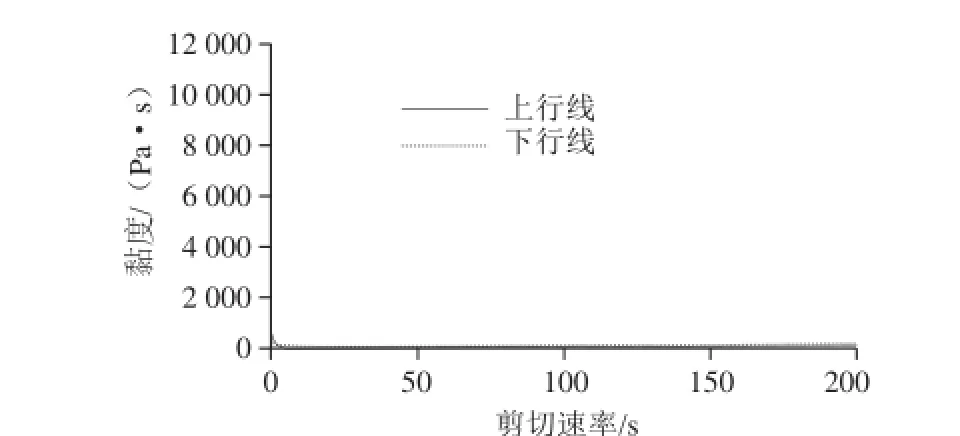
图12 壳聚糖-木糖美拉德反应产物的流变学特性Fig.12 Dynamic viscosity curve of chitosan-xylose Maillard reaction products
壳聚糖和木糖的简单混合物溶解后的动态黏度曲线如图11所示,在最适条件下得到的美拉德反应产物的动态流变学曲线如图12所示。2个样品的黏度均随着剪切速率的增加而急剧降低,然后保持恒定,表明这两种混合物溶液均在低转速下均表现出了明显的假塑性流体的特性,但是在高剪切速率下其黏度随剪切速率的变化不明显,表现为明显的牛顿液体特性;当剪切力逐渐消除时,其黏度均能恢复,表明两者均具有良好的触变性。同时还可以看出,壳聚糖-木糖美拉德反应产物的初始黏度远远高于两者的简单混合物,表明美拉德反应引发了大分子物质的形成,从而使得所得产物在溶液中的分子间或分子内的相互作用急剧增加,这与频率扫描的结果一致。
3 结 论
壳聚糖与木糖在干热条件下可发生美拉德反应,反应的最适条件为反应温度90℃、相对湿度61.2%、反应时间4 h和壳聚糖与木糖混合质量比例1∶1,热能性和流变学研究表明壳聚糖与木糖通过美拉德反应形成了易热分解的中间产物,并且产生了高分子物质,使得产物在溶液中的弹性增强。与湿热法和半干热法相比,本实验提出的干热法工艺步骤更加简单,无需溶解和干燥等步骤,因此能耗更低。尚需进一步对改性壳聚糖的性质进行研究,并与湿热法和干热法进行系统的比较,以推动美拉德反应在壳聚糖改性中的实际应用。
[1]王惠英, 孙涛, 周冬香, 等. 壳聚糖的美拉德反应及其产物的抗氧化性能研究[J]. 食品工业科技, 2007, 28(10): 91-93.
[2]HU WW, CHEN Y J, RUAAN R H, et al. The regulation of DNA adsorption and release through chitosan multilayers[J]. Carbohydrate Polymers, 2014, 99(2): 394-402.
[3]BUTSTRAEN C, SALA☒N F. Preparation of microcapsules by complex coacervation of gum Arabic and chitosan[J]. Carbohydrate P olymers, 2014, 99(2): 608-616.
[4]ROLLER S, COVILL N. The antimicrobial properties of chitosan in mayonnaise and mayonnaise based shrimp salads[J]. Food Protection, 2000, 63(2): 202-209.
[5]ZHANG D L, QUANTICK P C. Effects of chitosan coating on enzymatic browning and decay during postharvest storage of Litchi (Litchi chinensisSonn) fruit[J]. Postharvest Biology and Technology, 1997, 12(2): 195-202.
[6]JIANG Y M, LI Y B. Effects of chitosan coating on postharvest life and quality of longan fruit[J]. Food Chemistry, 2001, 73(2): 139-143.
[7]SAGOO S, BOARD R, ROLLER S. Chitosan inhibits growth of spoilage micro-organisms in chilled pork products[J]. Food Microbiology, 2002, 19(2/3): 175-182.
[8] RODRIGUEZ M S, VAMOS V, AGULLÓ V. Antimicrobial action of chitosan against spoilage organisms in precooked pizza[J]. Journal of Food Science, 2003, 68(1): 271-274.
[9]PRASERTSUNGA I, DAMRONGSAKKULB S, TERASHIMAD C, et al. Preparation of low molecular weight chitosan using solution plasma system[J]. Carbohydrate Polymers, 2012, 87(4): 2745-2749.
[10] SONG Qingping, WANG Chongxia, ZHANG Ze, et al. Adsorption of lead using a novel xanthated carboxymethyl chitosan[J]. Water Science & Technology, 2014, 69(2): 298-302.
[11]魏婉楚.壳聚糖的改性及其应用[J].中山大学研究生学刊:自然科学与医学版, 2013, 34(1): 1-12.
[12] CHUNG Y C, KUO C L, CHEN C C. Preparation and important functional properties of water-soluble chitosan produced through Maillard reaction[J]. Bioresource Technology, 2005, 96(13): 1473-1482.
[13] HUANG Jinru, HUANG Chungyi, HUANG Yaowen, et al. Shelflife of fresh noodles as affected by chitosan and its Maillard reaction products[J]. Food Science and Technology, 2007, 40(7): 1287-1291.
[14] UMEMURA K, KAWAI S. Preparation and characterization of Maillard reacted chitosan films with hemicellulose model compounds[J]. Journal of Applied Polymer Science, 2008, 108(4): 2481-2487.
[15] UMEMURA K, KAWAI S. Modifi cation of chitosan by the Maillard reaction using cellulose model compounds[J]. Carbohydrate Polymers, 2007, 68(2): 242-248.
[16]龚平,阚建全.美拉德反应产物性质的研究进展[J].食品与发酵工业, 2009, 35(4): 141-146.
[17]MIRALLES B, ADOLFO M R, SANTIAGO A, et al. The occurrence of a Maillard-type protein-polysaccharide reaction betweenβ-lactoglobulin and chitosan[J]. Food Chemistry, 2007, 100(3): 1071-1075.
[18]JUMNONGPON R, CHAISERI S, HONGSPRABHAS P, et al. Cocoa protein crosslinking using Maillard chemistry[J]. Food Chemistry, 2012, 134(1): 375-380.
[19]牛丽亚, 姜绍通, 潘丽军, 等. 小麦胚芽蛋白糖基化反应改性的研究[J].食品工业科技, 2013, 34(8): 257-261.
[20]李琦, 张曦, 任发政, 等. 蛋清蛋白-木糖美拉德反应产物的成膜性及其膜特性的研究[J]. 食品科技, 2012, 37(2): 34-41.
[21]刘丽波, 孙迪, 李春, 等. 糖基化修饰牛乳清蛋白过敏原性研究进展[J].食品科学, 2012, 33(13): 334-338.
[22] CHANG H L, CHEN Y J, TAN F J. Antioxidative properties of a chitosan-glucose Maillard reaction product and its effect on pork qualities during refrigerated storage[J]. Food Chemistry, 2011, 124(2): 589-595.
[23]LI Xiaoxia, SHI Xiaowen, JIN Yong, et al. Controllable antioxidative xylan-chitosan Maillard reaction products used for lipid food storage[J]. Carbohydrate Polymers, 2013, 91(1): 428-433.
[24]ZHANG Jinbo, WU Nana, LAN Ting, et al. Improvement in emulsifying properties of soy protein isolate by conjugation with maltodextrin using high-temperature, short-time dry-heating Maillard reaction[J]. International Journal of Food Science & Technology, 2014, 49(2): 460-467.
[25]LIU Yan, ZHAO Guanli, ZHAO Mouming, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J]. Food Chemistry, 2012, 131(3): 901-906.
[26]孙涛, 陈春红, 谢晶. 基于与木糖进行美拉德反应的低聚壳聚糖衍生物的抗氧化性能研究[J]. 天然产物研究与开发, 2011, 23(2): 219-223.
Maillard Reaction between Chitosan and Xylose in Dry State
LI Yanlong, HUANG Guoqing, XIAO Junxia*
(College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China)
This experiment explored the possibility of the Maillard reaction between chitosan and xylose in the dry heat state and investigated the effects of reaction temperature, relative humidity, reaction duration, and mixing ratio on the reaction. Meanwhile, the thermal behavior and rheological properties of the resultant Maillard reaction products were characterized as well. The results indicated that the Maillard reaction between chitosan and xylose occurred readily in the dry state and the optimum conditions were determined as follows: chitosan-xylose mixing ratio, 1:1; reaction temperature, 90 ℃; relative humidity, 61.2%; and reaction duration, 4 h. The resultant Maillard reaction products displayed a reduced thermal degradation temperature compared with chitosan. Rheological measurement s revealed greatly enhanced elastic property in solution.
chitosan; xylose; Maillard reaction; dry heat method
TS202.3
A
1002-6630(2015)12-0001-06
10.7506/spkx1002-6630-201512001
2014-08-06
国家自然科学基金青年科学基金项目(31101391);青岛农业大学校高层次人才启动基金项目(631415)
李艳龙(1989—),男,硕士研究生,研究方向为生物大分子绿色改性技术。E-mail:lylfood@sina.com
*通信作者:肖军霞(1977—),女,教授,博士,研究方向为天然产物化学与微囊化。E-mail:xjxfood@qau.edu.cn
