丹参酮ⅡA磺酸钠注射液对脑出血大鼠灶周内源性神经干细胞的影响研究
2015-01-05方永军胡亚莉柯尊华周振国
张 毅,方永军,周 锋,胡亚莉,柯尊华,周振国,罗 卫,畅 涛
·论著·
丹参酮ⅡA磺酸钠注射液对脑出血大鼠灶周内源性神经干细胞的影响研究
张 毅,方永军,周 锋,胡亚莉,柯尊华,周振国,罗 卫,畅 涛
目的 观察丹参酮ⅡA磺酸钠注射液对脑出血大鼠灶周内源性神经干细胞的影响。方法 将78只Sprague Dawley大鼠随机分为正常组6只,假手术组24只,对照组24只及治疗组24只。治疗组、对照组、假手术组大鼠采用立体定向仪自体血注入法制备脑出血模型(假手术组大鼠只做刺入动作,不向脑内注血),治疗组大鼠造模后1 d开始腹腔注射丹参酮ⅡA磺酸钠注射液,对照组及假手术组大鼠造模后1 d开始腹腔注射0.9%氯化钠溶液,正常组大鼠常规饲养,采用免疫组化染色观察4组大鼠造模后第3天、7天、14天、28天灶周5-溴-2′-脱氧尿苷酸(BrdU)、神经元特异烯醇化酶(NSE)阳性细胞数。结果 造模后第3天、14天及28天治疗组大鼠灶周BrdU阳性细胞数多于假手术组和对照组(P<0.05);造模后第7天治疗组大鼠灶周BrdU阳性细胞数多于正常组、假手术组及对照组,假手术组和对照组大鼠灶周BrdU阳性细胞数多于正常组(P<0.05)。治疗组大鼠灶周BrdU阳性细胞数在造模后第3天开始增多,到第7天时达峰值,此后逐渐下降。造模后第3天治疗组大鼠灶周NSE阳性细胞数多于假手术组,造模后第14天及28天治疗组大鼠灶NSE阳性细胞数多于假手术组和对照组(P<0.05);造模后第7天治疗组大鼠灶周NSE阳性细胞数多于正常组、假手术组及对照组,假手术组和对照组大鼠灶周NSE阳性细胞数多于正常组(P<0.05)。假手术组、对照组和治疗组大鼠灶周NSE阳性细胞数在造模后呈进行性增多,并于造模后第28天达峰值。结论 丹参酮ⅡA磺酸钠注射液可促进脑出血大鼠灶周内源性神经干细胞的增殖并诱导其向神经元分化。
丹参酮;脑出血;大鼠;神经干细胞
张毅,方永军,周锋,等.丹参酮ⅡA磺酸钠注射液对脑出血大鼠灶周内源性神经干细胞的影响研究[J].实用心脑肺血管病杂志,2015,23(10):45-49.[www.syxnf.net]
Zhang Y,Fang YJ,Zhou F,et al.Impact of tanshinone ⅡA sulfonate sodium injection on peripheral endogenous neural stem cells of rats with cerebral hemorrhage[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(10):45-49.
脑出血(intracerebral hemorrhage)的致死、致残率较高,存活患者多遗留不同程度的功能残疾。临床研究显示,内源性神经干细胞(neural stem cells)的激活、增殖及分化为脑出血提供了治疗思路。丹参用于治疗脑出血的历史悠久,其主要成分丹参酮ⅡA具有良好的治疗效果,能明显促进脑出血患者神经功能的康复[1-2]。目前,有关丹参酮ⅡA的动物实验研究多集中在缺血性脑血管疾病方面,有研究结果显示,大鼠缺血前后应用丹参酮能促进双侧脑室管膜下区神经干细胞的增殖,并改善大鼠学习能力[3]。但有关丹参酮ⅡA磺酸钠注射液用于治疗脑出血的动物实验研究较少,为此,本研究建立了脑出血大鼠模型,旨在观察丹参酮ⅡA磺酸钠注射液对脑出血大鼠灶周内源性神经干细胞的影响。
1 材料与方法
1.1 实验动物 选取SPF级成年健康雄性Sprague Dawley(SD)大鼠78只,年龄3~4个月,体质量250~300 g,由西安交通大学基础医学院实验动物中心提供。
1.2 主要仪器和试剂 脑立体定位仪(日本NARISHIGE SN-3型),小型牙科钻(韩国世新STRONG 204型),光学显微镜(日本OLYMPUS公司),丹参酮ⅡA磺酸钠注射液(上海第一生化药业有限公司),小鼠抗大鼠5-溴-2′-脱氧尿苷酸(BrdU)单克隆抗体(武汉博士德生物工程有限公司),兔多克隆抗神经元特异烯醇化酶(NSE)(武汉博士德生物工程有限公司)。
1.3 动物分组及给药 将78只SD大鼠随机分为正常组(6只)、假手术组(24只)、对照组(24只)和治疗组(24只)。治疗组大鼠造模后1 d开始腹腔注射5 μg/ml的丹参酮ⅡA磺酸钠注射液2 ml,1次/d,直至处死;假手术组及对照组大鼠造模后1 d开始腹腔注射0.9%氯化钠溶液2 ml,1次/d,直至处死。治疗组、对照组及假手术组大鼠处死前1 d腹腔注射BrdU,50 mg·kg-1·次-1,1次/4 h,共3次。正常组大鼠常规饲养,并于第7天全部处死,其余3组大鼠分别在造模后第3天、7天、14天、28天各处死6只后取脑。
1.4 模型制备 采用立体定向仪自体血注入法[4]制备大鼠脑出血模型:治疗组、对照组、假手术组大鼠称重后用10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,俯卧位固定于立体定位仪上,调节门齿托高度,使大鼠前后囟处于同一水平;碘伏消毒后沿头皮正中切一长约10 mm的切口,无菌操作下暴露前囟,参照大鼠立体定位图谱定位前囟前0.2 mm,中线右旁开3 mm,垂直进针5.5 mm,进入大鼠右侧尾壳核区,用小型牙科钻钻透颅骨至硬脑膜处,停止钻孔;穿刺股动脉,抽取非肝素抗凝自体动脉血进针至尾状核,缓慢注入50 μl,2 min内匀速注入,缓慢将注射器完全退出,局部医用骨蜡封闭,皮肤缝合,尾部切口加压包扎。假手术组只做刺入动作,不向脑内注血,其余操作相同。术后将大鼠在 20 ℃~25 ℃恒温条件下饲养,每3 d换垫料1次,自由活动及进食水。
1.5 神经功能测定 造模后参照 Bederson 评分标准[5]对大鼠进行评分。以大鼠完全清醒后的行为学改变来判断模型制作是否成功。每组动物分别于造模后及处死之前进行神经功能评分,主要观察其运动、感觉功能、平衡能力及生理反射能力,总分为4分,正常为0分,分值越高其神经损害越严重。评分标准,0分:无神经功能缺损体征;1分:提尾时损伤对侧前肢屈曲;2分:前肢屈曲及损伤对侧抵抗推力下降;3分:向损伤对侧转圈;4分:向损伤对侧转圈及意识模糊,低的生存率。1~4分为造模成功,造模不成功时补充大鼠。
1.6 标本采集 10%水合氯醛腹腔注射麻醉大鼠后,开胸经左心室插管进行灌注,先用37 ℃ 0.9%氯化钠溶液100 ml冲净血液后,再用4%多聚甲醛灌注处死大鼠,待肝脏及肢体变硬后解剖取脑。
1.7 切片制作、免疫组化检测 鼠脑标本用4%多聚甲醛浸泡4~6 h,在30%蔗糖溶液中过夜(4 ℃)至沉底,脑组织石蜡包埋切片,将大鼠脑组织以进针处为中心,冠状位连续切片,厚约6 μm/片,每隔5张片取2张片,用防脱玻片直接贴附,室温下晾干,-20 ℃下保存备用。免疫组化检测严格按照试剂盒说明操作。BrdU阳性细胞表现为细胞核阳性,免疫组化染色呈红色,卵圆形或圆形,标记具有增殖活性的细胞主要集中在侧脑室外侧壁上部、上角和海马齿状回,可以在侧脑室外上角形成迁移流。NSE阳性细胞表现为细胞质阳性,免疫组化染色呈黄褐色,在侧脑室下区和海马齿状回区表现为梭形或卵圆形。BrdU/NSE双重免疫组化标记细胞,细胞核呈红色,细胞质呈黄褐色。光镜下采集图像,用南京捷达JD-801图像分析系统统计BrdU、NSE阳性细胞数。
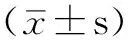
2 结果
2.1 4组大鼠不同时间点灶周BrdU阳性细胞数比较 各组大鼠造模后第3天、7天、14天及28天灶周BrdU阳性细胞数比较,差异有统计学意义(P<0.05);其中造模后第3天、14天及28天治疗组大鼠灶周BrdU阳性细胞数多于假手术组和对照组,差异有统计学意义(P<0.05);造模后第7天治疗组大鼠灶周BrdU阳性细胞数多于正常组、假手术组及对照组,假手术组和对照组大鼠灶周BrdU阳性细胞数多于正常组,差异有统计学意义(P<0.05,见表1)。治疗组大鼠灶周BrdU阳性细胞数在造模后第3天开始增多,到第7天时达峰值,此后逐渐下降,见图1~4。

Table 1 Comparison of peripheral BrdU-positive cell counts among the four groups at different time points
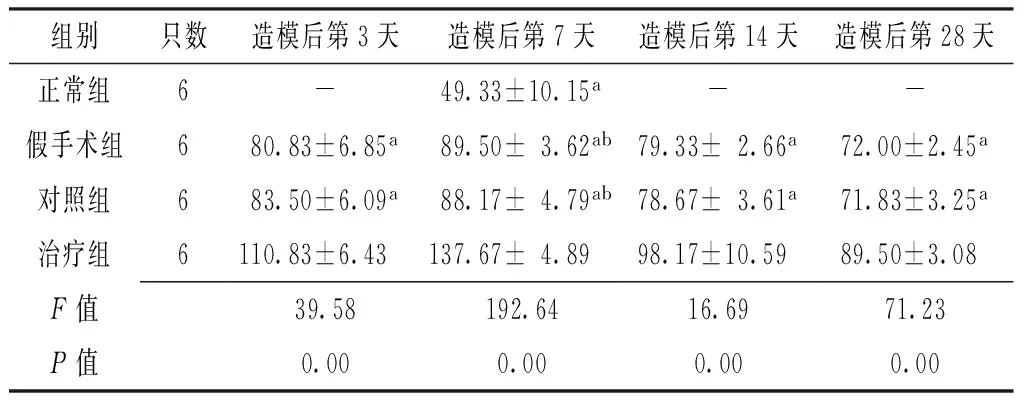
组别只数造模后第3天造模后第7天造模后第14天造模后第28天正常组6-49.33±10.15a--假手术组680.83±6.85a89.50±3.62ab79.33±2.66a72.00±2.45a对照组683.50±6.09a88.17±4.79ab78.67±3.61a71.83±3.25a治疗组6110.83±6.43137.67±4.8998.17±10.5989.50±3.08F值39.58192.6416.6971.23P值0.000.000.000.00
注:与治疗组比较,aP<0.05;与正常组比较,bP<0.05;-表示未测量
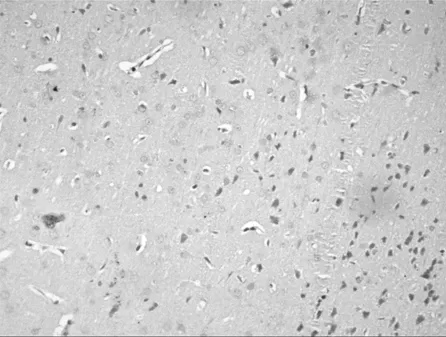
图1 正常组大鼠灶周BrdU阳性细胞表达情况
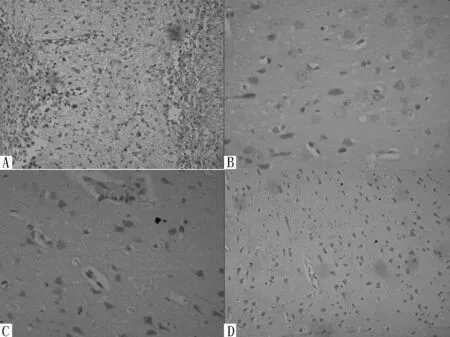
注:A为造模后第3天(免疫组化染色,×100),B为造模后第7天(免疫组化染色,×400),C为造模后第14天(免疫组化染色,×400),D为造模后第28天(免疫组化染色,×100)
图2 对照组大鼠灶周BrdU阳性细胞表达情况
Figure 2 Expression of BrdU-positive cells of B group

注:A为造模后第3天,B为造模后第7天,C为造模后第14天,D为造模后第28天
图3 假手术组大鼠灶周BrdU阳性细胞表达情况
(免疫组化染色,×100)
Figure 3 Expression of BrdU-positive cells of C group
2.2 4组大鼠不同时间点灶周NSE阳性细胞数比较 各组大鼠造模后第3天、7天、14天及28天灶周NSE阳性细胞数比较,差异有统计学意义(P<0.05);其中造模后第3天治疗组大鼠灶周NSE阳性细胞数多于假手术组,造模后第14天及28天治疗组大鼠灶周NSE阳性细胞数多于假手术组和对照组,差异有统计学意义(P<0.05);造模后第7天治疗组大鼠灶周NSE阳性细胞数多于正常组、假手术组及对照组,假手术组和对照组大鼠灶周NSE阳性细胞数多于正常组,差异有统计学意义(P<0.05,见表2)。假手术组、对照组和治疗组大鼠灶周NSE阳性细胞数在造模后呈进行性增多,并于造模后第28天达峰值,见图5~8。
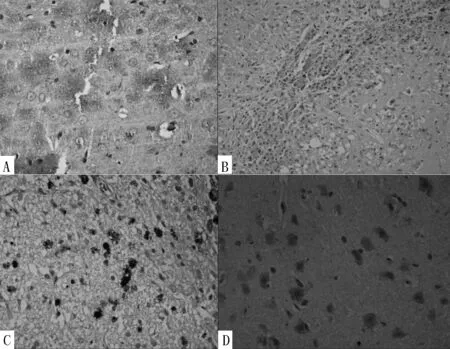
注:A为造模后第3天(免疫组化染色,×400),B为造模后第7天(免疫组化染色,×100),C为造模后第14天(免疫组化染色,×400),D为造模后第28天(免疫组化染色,×400)
图4 治疗组大鼠灶周BrdU阳性细胞表达情况
Figure 4 Expression of BrdU-positive cells of D group

Table 2 Comparison of peripheral NSE-positive cell counts among the four groups at different time points
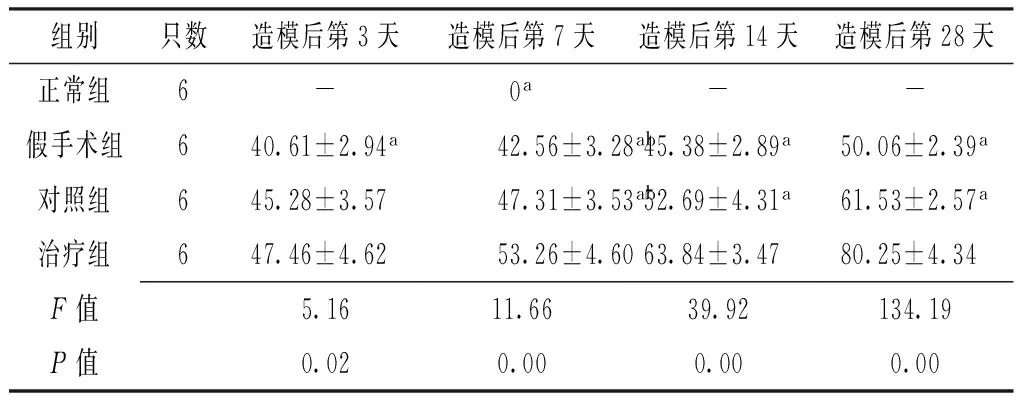
组别只数造模后第3天造模后第7天造模后第14天造模后第28天正常组6-0a--假手术组640.61±2.94a42.56±3.28ab45.38±2.89a50.06±2.39a对照组645.28±3.5747.31±3.53ab52.69±4.31a61.53±2.57a治疗组647.46±4.6253.26±4.6063.84±3.4780.25±4.34F值5.1611.6639.92134.19P值0.020.000.000.00
注:与治疗组比较,aP<0.05;与正常组比较,bP<0.05;-表示未测量
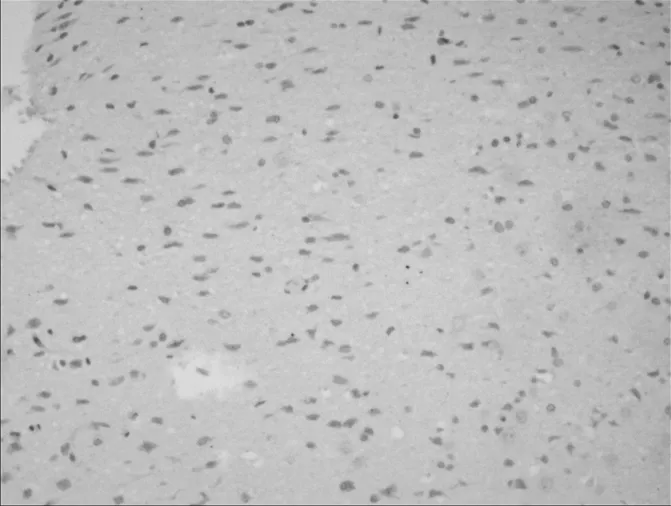
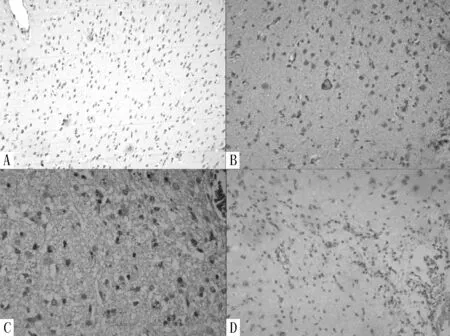
图5 正常组大鼠灶周NSE阳性细胞表达情况

注:A为造模后第3天(免疫组化染色,×100),B为造模后第7天(免疫组化染色,×100),C为造模后第14天(免疫组化染色,×400),D为造模后第28天(免疫组化染色,×400)
图6 对照组大鼠灶周NSE阳性细胞表达情况
Figure 6 Expression of NSE-positive cells of B group
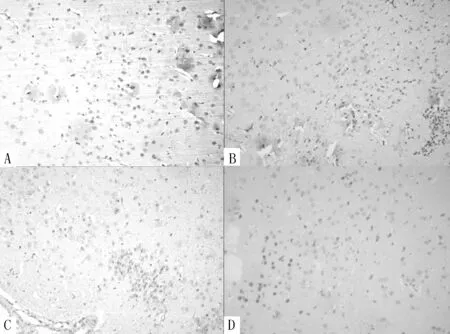
注:A为造模后第3天,B为造模后第7天,C为造模后第14天,D为造模后第28天
图7 假手术组大鼠灶周NSE阳性细胞表达情况
(免疫组化染色,×100)
Figure 7 Expression of NSE-positive cells of C group
3 讨论
神经干细胞是指具有分化为神经元细胞、星形胶质细胞、少突胶质细胞的能力,能自我更新并足以提供大量脑组织细胞的细胞。以往认为神经干细胞只存在于胚胎中,近年来大量研究发现,成年脑脑室下区、海马齿状回、室管膜区等区域存在具有自我更新和多种分化潜能的神经干细胞[6]。疾病和创伤可诱导内源性神经干细胞的增殖、分化,但在未经干预的情况下,其自身诱导的修复能力有限,不足以完全恢复受损的神经。动物实验研究表明,基底核脑出血大鼠病灶周围可出现神经干细胞增殖[7],但这种状态下内源性神经干细胞的增殖能力及对脑出血后神经功能缺损的修复作用均有限[8]。原位诱导内源性神经干细胞既能促进神经功能修复,又能克服外源性神经干细胞移植的缺点,是治疗脑出血理想的方法。有研究表明,中药及其有效成分对脑出血后内源性神经干细胞的增殖有诱导作用。施建生等[9]对中等量脑出血大鼠应用人参总皂甙治疗,在5个时间点与单纯脑出血组灶周神经干细胞增殖情况进行比较,结果发现治疗14、28、60 d治疗组大鼠神经干细胞均多于单纯脑出血组,提示脑出血后神经干细胞被激活增殖,人参总皂甙对脑出血后神经干细胞的增殖有促进作用,进而改善运动功能。
注:A为造模后第3天(免疫组化染色,×100),B为造模后第7天(免疫组化染色,×100),C为造模后第14天(免疫组化染色,×400),D为造模后第28天(免疫组化染色,×100)
图8 治疗组大鼠灶周NSE阳性细胞表达情况
Figure 8 Expression of NSE-positive cells of D group
丹参及其有效成分丹参酮是治疗脑卒中的常用药物,临床治疗效果较好。丹参药理作用广泛,能保护心肌、扩张血管、抗动脉粥样硬化、抗血栓、改善微循环、调节组织修复和再生、抗菌消炎[10]。丹参及其有效成分丹参酮在诱导干细胞增殖和分化方面也显示出了巨大的潜力[11-12]。丹参酮ⅡA是从丹参中提取的脂溶性有效成分,为丹参的主要有效成分,可诱导干细胞分化。丹参酮ⅡA对多种细胞有生物学效应,包括诱导成人骨髓间充质干细胞分化为神经元样细胞,抑制瘢痕成纤维细胞的增殖等,并作为生物反应的辅酶对某些生化反应具有促进或干扰作用[13]。陈岩等[3]采用丹参酮治疗脑缺血大鼠,结果显示,丹参酮预处理能显著增加去卵巢大鼠及脑缺血模型大鼠室管膜下区神经干细胞的数量,大鼠造脑缺血模型后应用丹参酮也能增加其室管膜下区神经干细胞的数量,并显著改善其学习能力。临床上,丹参酮ⅡA磺酸钠注射液也用于治疗脑出血,并有较好的临床疗效。
目前,鉴定神经干细胞主要有以下3个方面:特异性神经抗原的表达、自我更新能力及多向分化潜能,而鉴定神经干细胞的方法主要是细胞标志物。对神经干细胞进行BrdU掺入实验,可帮助证实细胞是否具有自我更新能力。BrdU是胸腺嘧啶的同源替代物,可以在细胞周期的S期掺入到细胞核DNA内,如果神经干细胞在丝裂原的刺激下能够进行增殖,就会将BrdU整合入细胞DNA。DNA链中只要有0.5%的胸腺嘧啶被其取代,就可以利用BrdU单抗标记技术检测出来,该方法简便、准确,无论是研究体内、体外神经干细胞的增殖和自我更新,还是进行移植前的标记,BrdU均被广泛应用。而NSE、神经元特异性核蛋白(NeuN)是神经元表达的特异性标志抗原[14]。
本研究将丹参酮ⅡA磺酸钠注射液用于治疗脑出血大鼠模型,结果显示,治疗组大鼠灶周BrdU阳性细胞数在造模后第3天开始增多,多于假手术组和对照组,到第7天时达峰值,此后逐渐下降,至第28天仍多于假手术组和对照组。假手术组、对照组和治疗组大鼠灶周NSE阳性细胞数在造模后呈进行性增多,并于造模后第28天达峰值,造模后第7天、14天及28天治疗组大鼠灶周NSE阳性细胞数多于假手术组和对照组。提示丹参酮ⅡA磺酸钠注射液可促进脑出血大鼠灶周内源性神经干细胞的增殖并诱导其向神经元分化。
[1]陈健,苏文理,黄坤茂,等.脑出血急性期应用丹参酮ⅡA磺酸钠的疗效机制与安全性研究[J].中西医结合心脑血管病杂志,2012,10(9):1059-1061.
[2]况小平,彭惠.丹参酮ⅡA磺酸钠治疗高血压脑出血的临床观察[J].江西医药,2013,48(10):885-886.
[3] 陈岩,李志伟,杨谦.丹参酮对大鼠脑缺血后神经干细胞增殖影响的研究[J].陕西医学杂志,2011,40(7):774-775.
[4]Rosenberg GA,Mun-Bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats[J].Stroke,1990,21(5):801-807.
[5]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination [J].Stroke,1986,17(3):472-476.
[6]Gound E,Reeves AJ,Grazano MS,et al.Neurogenesis in the neocortex of adult primates[J].Science,1999,286(27):548-552.
[7]施建生,高志伟,柯开富.脑出血后内源性神经干细胞的增殖[J].交通医学,2009,23(4):337-339.
[8]刘安民,蔡望青,麦荣康,等.大鼠脑出血后内源性神经干细胞激活和增殖的实验研究[J].中华神经医学杂志,2008,7(10):997-1000.
[9]施建生,高志伟,柯开富.人参总皂甙对脑出血后内源性神经干细胞增殖的影响[J].南通医学院学报,2009,29(4):253-255.
[10]浦锡娟,徐凯琳.丹参的药理作用研究进展[J].临床医学工程,2009,16(8):154-155.
[11]唐映,杨万章.丹参诱导干细胞分化的研究进展[J].中西医结合心脑血管病杂志,2007,5(8):721-722.
[12]曹炜,陈凯,王阶.丹参和三七单体成分对干细胞分化的影响[J].中国中医药信息杂志,2010,17( 8):106-108.
[13]杨丽华,刘延庆.丹参酮ⅡA影响干细胞移植的研究进展[J].上海中医药杂志,2014,48(4):105-107.
[14]顾恩妍,哈福,李林凤,等.神经干细胞的鉴定方法[J].中国组织工程研究与临床康复,2009,13(10):1947-1950.
(本文编辑:谢武英)
Impact of Tanshinone ⅡA Sulfonate Sodium Injection on Peripheral Endogenous Neural Stem Cells of Rats with Cerebral Hemorrhage
ZHANGYi,FANGYong-jun,ZHOUFeng,etal.DepartmentofCerebralSurgery,theAffiliatedHospitalofShaanxiTraditionalChineseMedicineUniversity,Xianyang712000,China
Objective To observe the impact of tanshinone ⅡA sulfonate sodium injection on peripheral endogenous neural stem cells of rats with cerebral hemorrhage.Methods A total of 78 Sprague Dawley rats were randomly divided into groups A(n=6),B(n=24),C(n=24)and D(n=24),stereotactic instrument and autologous blood injection method were used to prepare for cerebral hemorrhage model(rats of C group received puncture without intracerebral injection of autologous blood),rats of A group were conventionally feed,rats of B group and C group received intraperitoneal injection of 0.9% sodium chloride injection after 1 day of preparation,while rats of D group received intraperitoneal injection of tanshinone ⅡA sulfonate sodium injection after 1 day of preparation.Immumohistochemical staining method was used to observe the peripheral BrdU-positive cell counts and peripheral NSE-positive cell counts after 3 days,7 days,14 days and 28 days of preparation.Results After 3 days,14 days and 28 days of preparation,peripheral BrdU-positive cell counts of D group were statistically significantly more than those of B group and C group(P<0.05);after 7 days of preparation,peripheral BrdU-positive cell counts of D group were more than those of A group,B group and C group,and those of B group and C group were statistically significantly more than those of A group(P<0.05).Peripheral BrdU-positive cell counts of D group obviously increased at the third of preparation,and increased to the peak at the seventh day,and then gradually decreased.After 3 days of preparation,peripheral NSE-positive cell counts of D group were statistically significantly more than those of C group(P<0.05);after 14 and 28 days of preparation,peripheral NSE-positive cell counts of D group were more than those of B group and C group(P<0.05);after 7 days of preparation,peripheral NSE-positive cell counts of D group were more than those of A group,B group and C group,and those of B group and C group were statistically significantly more than those of A group(P<0.05).Peripheral NSE-positive cell counts of B group,C group and D group obviously increased after preparation,and increased to the peak at the 28th day.Conclusion Tanshinone ⅡA sulfonate sodium injection can promote the proliferation and induce the differentiation of peripheral endogenous neural stem cells of rats with cerebral hemorrhage.
Tanshinone;Cerebral hemorrhage;Rat;Neural stem cells
陕西省教育厅科学研究计划项目(自然科学专项)(11JK0697);陕西省科技厅科学技术研究发展计划项目(自然基金)(2012JM4004)
712000陕西省咸阳市,陕西中医药大学附属医院脑外科(张毅,方永军,周锋,柯尊华,周振国,罗卫,畅涛);陕西中医药大学(胡亚莉)
R 743.34
A
10.3969/j.issn.1008-5971.2015.10.011
2015-07-12;
2015-09-13)
