高迁移率族蛋白B1激活NF-κB/αvβ3而增加A549细胞迁移与侵袭能力
2015-01-04
华中科技大学同济医学院附属武汉市第一医院临床免疫学实验室,湖北 武汉 430022
高迁移率族蛋白B1激活NF-κB/αvβ3而增加A549细胞迁移与侵袭能力
朱建华,胡娜,赵岚,黄炎
华中科技大学同济医学院附属武汉市第一医院临床免疫学实验室,湖北 武汉 430022
背景与目的:高迁移率族蛋白B1(high mobility group box 1,HMGB1)在多种肿瘤中高表达,在肿瘤的侵袭转移中发挥重要作用。本研究旨在探讨HMGB1促进肺癌A549细胞侵袭的分子机制。方法:肺癌A549细胞经HMGB1,NF-κB抑制剂6-amino-4-quinazoline (QNZ) 或Bortezomib (Bort)处理后,划痕实验和Transwell小室体外侵袭实验检测肿瘤细胞的迁移及侵袭能力;NF-κB荧光素酶报告基因实验检测NF-κB活性;Real-time RT-PCR和Western blot检测A549细胞NF-κB和整合素αvβ3表达。结果:HMGB1能增强A549细胞迁移和侵袭能力,增加NF-κBp65蛋白的表达,同时增强A549细胞NF-κB活性,Real-time RT-PCR和Western blot检测结果发现HMGB1上调肿瘤细胞αvβ3表达。NF-κB抑制剂QNZ或Bort消除HMGB1促进A549细胞迁移及侵袭,增强NF-κB表达和活性以及αvβ3表达的效应。结论:HMGB1通过激活A549细胞NF-κB上调αvβ3表达促进A549细胞迁移与侵袭行为。
高迁移率族蛋白B1;A549;肿瘤转移;NF-κB;αvβ3
肺癌是近年来发病率和死亡率最高的恶性肿瘤之一,肿瘤转移是导致死亡的主要原因,肿瘤的侵袭转移与多种蛋白的表达有关。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是细胞内一种含量丰富的非组蛋白染色体结合蛋白,HMGB1在结直肠腺癌、肝癌、乳腺癌、肺癌、宫颈癌及白血病等多种肿瘤中表达升高[1]。人结肠癌细胞释放的HMGB1可抑制树突状细胞活性而抑制抗肿瘤免疫,促进结肠癌淋巴结转移[2]。研究表明,HMGB1介导金属基质蛋白酶9表达促进肿瘤细胞侵袭[3]。尽管越来越多的研究发现HMGB1与肿瘤侵袭转移密切相关,但其机制仍然不明。本研究主要探讨HMGB1促进肺癌细胞迁移与侵袭的分子机制,证明HMGB1激活A549细胞NF-κB,上调与侵袭相关蛋白的表达而促进肺癌侵袭,为临床治疗肺癌提供实验依据。
1 材料和方法
1.1 细胞与试剂
人非小细胞肺癌A549细胞株购自中国典型培养物保藏中心(武汉)。细胞培养所用试剂DMEM粉剂购自美国Gibco公司;特级胎牛血清购自杭州四季青公司;HMGB1购自美国Sigma-Aldrich公司;NF-κB抑制剂6氨基喹唑啉(6-amino-4-quinazoline,QNZ)购自德国Merck Biosciences公司;NF-κB抑制剂硼替佐咪(Bortezomib,Bort)购自美国Millennium Pharmaceuticals公司;Transwell小室购自美国BD公司;逆转录试剂盒购自美国Fermentas公司;羊抗人αv和β3一抗、兔抗人NF-κBp65抗体、驴抗羊二抗及羊抗兔二抗均购自美国Santa Cruz公司;NF-κB荧光素酶报告基因系统购自美国Invitrogen公司。
1.2 实验方法
1.2.1 细胞培养及细胞分组
将A549细胞接种在含10%胎牛血清的DMEM培养基,加入100 U/L青霉素和100 mg/L链霉素,置于37 ℃,CO2体积分数为5%的培养箱内培养。A549细胞经HMGB1(200 ng/mL)、NF-κB抑制剂QNZ(40 nmol/L)或Bort(20 nmol/L)处理24 h,根据加入的试剂,分为以下6组:①正常对照组;②HMGB1组;③QNZ组;④HMGB1+QNZ组;⑤Bort组;⑥HMGB1+ Bort组。
1.2.2 划痕实验
将对数生长期A549细胞接种于6孔板,细胞融合度达到70%以上时用Tip头在培养板划均匀直线。PBS洗去漂浮细胞,于37 ℃,CO2体积分数为5%条件下温育48 h,在显微镜下观察拍照,测量细胞迁移距离,并计算各组细胞的划痕修复率。划痕修复率(%)=[0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度]×100%。
1.2.3 肿瘤细胞侵袭迁移实验
预处理后的A549细胞,于37 ℃,CO2体积分数为5%的培养箱内培养24 h。Transwell小室用Matrigel包被(10 µg/µL)的8 µm孔径膜将其分隔为上、小室。下室加完全培养基600 µL,将各组细胞用PBS洗涤后用无血清培养基悬浮,调整浓度至1×106/mL,加100 µL至上室,于37 ℃,CO2体积分数为5%条件下温育8 h,取出小室,用PBS润湿,用棉签擦去微孔膜上层的细胞,PBS洗涤,将Transwell小室用4%甲醛溶液固定15 min,结晶紫染色,显微镜下观察,随机选取5个高倍视野(×200)进行细胞计数,并计算平均值,实验重复3次。
1.2.4 NF-κB荧光素酶报告实验
预处理后的A549细胞,将1×104个对数生长期细胞接种至24孔板,融合度达70%~80%时,依照LipofectamineTM2000转染试剂的操作指南,转染质粒(pNFkB-TA-Luc 0.4 µg,pCMVβgal 0.1 µg),细胞继续培养24 h。彻底吸弃培养基,PBS洗涤2次,每孔加入100 µL 1×Reporter Lysis缓冲液,冰上温育15 min,4 ℃,10 000×g离心5 min,取细胞裂解上清液50 µL加入96孔板,分别加入50 µL Steady Glo reagent,冰上温育5 min。在激发波长430 nm,发射波长550 nm设置下,用HTS7000BioAssay Reader检测荧光素酶活性。取细胞裂解上清液50 µL加入96孔板,加入50 µL的β-gal Assay 2×缓冲液并混匀,37 ℃温箱中温育,当溶液变为浅黄色时,加入150 µL 1 mol/L碳酸钠中止反应。在吸收波长为405 nm处,使用HTS7000 Bio Assay Reader检测β-gal值以标化转染效率。计算荧光素酶强度值/ β-gal值,得到相对荧光素酶活性,即相对发光值(relative light unit,RLU)。
1.2.5 Real-time RT-PCR检测αvβ3的 mRNA表达
预处理的A549细胞在6孔板中培养12 h后,提取各组细胞总RNA进行逆转录成cDNA,用SYBR Green Ⅰ法,在Mx3000P实时定量荧光PCR仪进行荧光定量PCR检测αvβ3的mRNA表达水平,每个样本做3个复孔,设定阈值,测定平均Ct值。
1.2.6 Western blot检测αvβ3和NF-κB蛋白质水平
预处理后的A549细胞,按照每1.0×106个细胞加入100 µL RIPA蛋白裂解液,混匀后置冰上20 min,4 ℃,14 000×g离心30 min,将上清液转入洁净EP管,采用BCA蛋白定量分析检测蛋白含量。取20 µg蛋白采用伯乐公司的8%~12%梯度聚丙烯酰胺凝胶电泳分离蛋白,电转移到0.45 µm PVDF膜。将转有蛋白的PVDF膜置于5%脱脂奶粉-TBST室温中振荡封闭1 h,然后置于适当稀释的一抗中4 ℃温育过夜;第2天室温用1×TBST洗涤PVDF膜,将膜置于适当稀释的含辣根过氧化物酶标记二抗的1×TBST中,室温温育1 h;用1×TBST洗涤后,进行化学发光操作,伯乐公司ChemicDoc XRS系统曝光,并用Quantity One imaging软件对曝光后条带进行分析。所用抗体为:羊抗人αvβ3抗体,兔抗人NF-κBp65抗体,β-actin (Santa Cruz Biotechnology;1∶1 000)。
1.3 统计学处理
2 结 果
2.1 HMGB1及NF-κB抑制剂对A549迁移能力的影响
划痕实验结果(图1),与对照组,HMGB1+QNZ组和HMGB1+Bort组划痕修复率比较,HMGB1组细胞划痕修复率显著增加,划痕区明显缩窄,差异有统计学意义[(43.42±0.53)%、(42.79±0.37)%、(43.12±0.44)%vs(76.53±0.71)%,P<0.05];单独NF-κB抑制剂QNZ组和Bort组划痕修复率分别为(41.89±0.25)%和(41.21±0.75)%,与对照组比较,划痕区无明显缩窄,差异无统计学意义。以上结果表明HMGB1能促进A549细胞迁移,NF-κB抑制剂逆转HMGB1促A549细胞迁移效应。
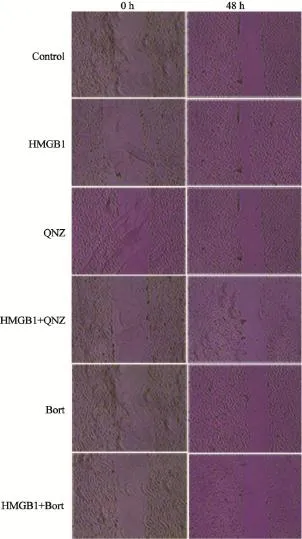
图1 HMGB1促进A549细胞迁移,NF-κB抑制剂逆转HMGB1促A549细胞迁移效应Fig. 1 HMGB1 promoted A549 cells migration and NF-κB inhibitors reverse this effect
2.2 HMGB1及NF-κB抑制剂对A549细胞体外侵袭能力的影响
体外侵袭实验结果(图2)显示,HMGB1组A549细胞穿过Matrigel人工基底膜的细胞数为(177±12),与对照组(91±7)、HMGB1+QNZ组(45±3)和HMGB1+Bort组(53±7)比较,明显升高,差异有统计学意义(P<0.05);NF-κB抑制剂QNZ组和Bort组细胞穿膜数分别为(39±6)和(42±5),与对照组比较,细胞穿膜数明显减少,差异有统计学意义(P<0.05)。此结果表明,HMGB1能增强A549细胞侵袭能力,抑制NF-κB活性则抑制A549细胞侵袭且消除HMGB1促进A549细胞侵袭效应。
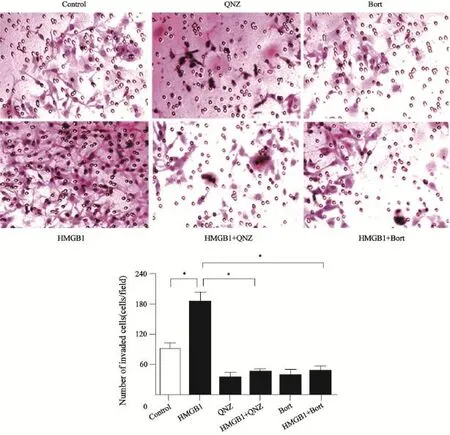
图2 HMGB1增强A549细胞侵袭,NF-κB抑制A549细胞侵袭且消除HMGB1促进A549细胞侵袭效应Fig. 2 HMGB1 promoted A549 cells invasion and NF-κB inhibitors reverse this effect
2.3 HMGB1及NF-κB抑制剂对A549细胞NF-κB表达及活性的影响
Western blot检测结果显示,与对照组比较,HMGB1组A549细胞NF-κB蛋白表达显著增加(图3A)。NF-κB荧光素酶报告基因试验结果显示,HMGB1组A549细胞NF-κB的活性与对照组比较增强3.12倍,与HMGB1+QNZ组和HMGB1+Bort组比较,NF-κB的活性分别增强了6.21倍和5.73倍,NF-κB抑制剂消除了HMGB1的激活效应而且强烈抑制A549细胞基础NF-κB活性(图3B)。这一结果说明HMGB1上调A549细胞NF-κB的表达,进一步提示增强NF-κB的表达和活性是HMGB1发挥效应的前提条件。
2.4 HMGB1及NF-κB抑制剂对A549细胞整合素αvβ3表达的影响
整合素αvβ3是一种重要细胞黏附分子,介导肿瘤细胞的侵袭迁移,我们进一步研究了HMGB1是否影响A549细胞整合素αvβ3的表达。结果显示,经HMGB1处理后A549细胞整合素αvβ3表达升高,QNZ或Bort处理组整合素αvβ3表达较对照组降低,HMGB1+QNZ组与HMGB1+Bort组细胞与HMGB1组比较,整合素αvβ3表达下降(图4)。这些结果表明HMGB1上调A549细胞整合素αvβ3表达,NF-κB抑制剂QNZ或Bort抑制HMGB1促进A549细胞整合素αvβ3表达的作用。
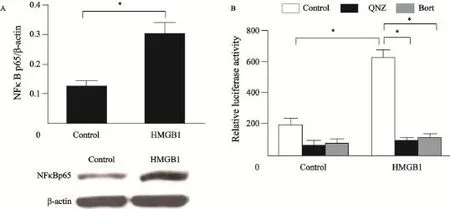
图3 HMGB1激活A549细胞NF-κBFig. 3 HMGB1 activated A549 cells NF-κB
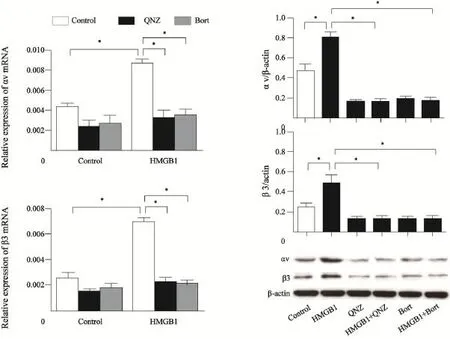
图4 HMGB1激活NF-κB上调A549细胞整合素αvβ3的表达Fig. 4 HMGB1 up-regulated integrin αvβ3 expression in A549 cells
3 讨 论
肿瘤转移是肺癌致死的重要因素,肿瘤侵袭转移是一个多步骤演进的复杂过程,需要多基因参与,关于肺癌侵袭转移的具体机制还不清楚,相关蛋白及其作用机制的发现对肿瘤转移的预防与治疗具有重要意义。本研究探讨了HMGB1对肺癌A549细胞迁移侵袭的影响及其相关分子机制,研究结果发现,HMGB1激活肺癌A549细胞NF-κB上调整合素αvβ3表达,从而促进肿瘤细胞迁移和侵袭。
HMGB1是一种广泛存在于细胞核内的DNA结合蛋白,在多种肿瘤细胞和组织中高表达,促进肿瘤的发展及其转移[4-5],HMGB1通过多种机制影响肿瘤侵袭转移,研究发现HMGB1与其受体结合激活PI3K/Akt信号通路促进血管内皮生长因子(VEGF)的分泌维持血管生成[6];肿瘤微环境中组织缺氧情况下释放的HMGB1激活TLR4/RAGE信号通路产生IL-1β和IL-18等炎性递质,诱导炎性反应促进肝癌细胞侵袭和转移[5]。划痕实验和侵袭试验的结果显示,HMGB1增强A549细胞侵袭迁移能力,我们进一步探讨HMGB1促进A549细胞侵袭迁移的分子机制,荧光素酶报告基因试验结果发现HMGB1激活A549细胞NF-κB。有研究[7]发现NF-κB信号途径在肿瘤的发生、发展过程中起重要作用,调控肿瘤血管生成和侵袭迁移。有研究[8]表明NF-κB通过诱导趋化因子受体CXCR4的表达促进肿瘤细胞迁移和转移。
为了确定HMGB1是否通过激活NF-κB而促进A549细胞侵袭转移,我们选用了2种不同的NF-κB抑制剂。QNZ是常用的NF-κB抑制剂,Bort是一种有效的选择性抑制20S蛋白酶体抑制剂,但它主要的生物学效应是抑制NF-κB的激活,组成性下调NF-κB依赖性基因的表达。研究结果显示HMGB1促进A549细胞表达NF-κB,NF-κB抑制剂基本消除了HMGB1促进肿瘤细胞侵袭转移效应,单独用NF-κB抑制剂QNZ或Bort处理A549细胞后其侵袭转移能力也明显下降,说明NF-κB抑制剂可以抑制A549细胞基线侵袭能力。值得注意的是,单独QNZ或Bort对A549细胞的迁移能力几乎没有影响,可能NF-κB调控影响肿瘤细胞侵袭能力蛋白的表达,而不影响肿瘤细胞迁移能力的蛋白表达。NF-κB荧光素酶报告基因实验和Western blot结果证明HMGB1通过上调并激活A549细胞NF-κB而发挥作用。整合素是一类重要的细胞黏附分子,研究报道αvβ3整合素参与肿瘤细胞的侵袭和转移[9-10]。αvβ3通过与细胞外基质fibrinogen、fibronectin和laminin介导肿瘤细胞的黏附侵袭,本研究结果显示在HMGB1刺激A594细胞表达αvβ3,而NF-κB抑制剂消除HMGB1的促表达作用。
综上所述,研究结果显示,在HMGB1促进肺癌A549细胞侵袭迁移的基础上,证明HMGB1通过激活549细胞NF-κB上调αvβ3表达而促进肿瘤细胞侵袭转移,但是HMGB1通过哪条信号途径激活A549细胞NF-κB而促进αvβ3表达有待进一步研究。
[1] TAND D, KANG R, ZE H J, et al. High-mobility group box1 and cancer [J]. Biochim Biophys Acta, 2010, 1799(1-2): 131-140.
[2] KUSUME A, SASAHIRA T, LUO Y, et al. Suppression of dendritic cells by HMGB1 is associated with lymph node metastasis of human colon cancer[J]. Pathobiology, 2009, 76(4):155-162.
[3] LIU P L, TSAI J R, HWANG J J, et al. High-mobility group box 1-mediated matrix metalloproteinase-9 expression in non-small cell lung cancer contributes to tumor cell invasiveness[J]. Am J Respir Cell Mol Biol, 2010, 43(5): 530-538.
[4] TANG C H, KENG Y T, LIU J F, et al. HMGB-1 induces cell motility and αvβ3 integrin expression in human chondrosarcoma cells [J].Cancer Lett, 2012, 322(1): 98-106.
[5] YAN W, CHANG Y, LIANG X, et al. High mobility group box1 activates caspase-1 and promotes hepatocellular carcinoma invasiveness and metastases [J]. Hepatology, 2012, 55(6): 1863-1875.
[6] SCHLUETER C, WEBER H, MEYER B, et al. Angiogenetic signaling through hypoxia HMGB1: an angiogenetic switch molecule [J]. Am J Pathol, 2005, 166 (4): 1259-1263.
[7] KARIN M. Nuclear factor-κB in cancer development and progression [J]. Nature, 2006, 441 (7092): 431-436.
[8] HELBIG G, CHRISTOPHERSON Ⅱ K W, BHATNAKSHATRI P, et al. NF-κB promotes breast cancer cell migration and metastasis by inducing the expression of the chemokine receptor CXCR4 [J]. J Biol Chem, 2003, 278 (24): 21631-21638.
[9] ZHAO F, LI L, GUAN L, et al. Roles for GP Ⅱb/Ⅲa and αvβ3 integrins in MDA-MB-231 cell invasion and shear flow-induced cancer cell mechanotransduction [J]. Cancer Lett, 2014, 344(1): 62-73.
[10] KNOWLES L M, GURSKI L A, ENGEL C, et al. Integrin αvβ3 and fibronectin upregulate slug in cancer cells to promote clot invasion and metastasis [J]. Cancer Res, 2013, 73(20): 6175-6184.
HMGB1 activates NF-κB/αvβ3 to promote A549 cells migration and invasion
ZHU Jianhua, HU Na,ZHAO Lan, HUANG Yan (Laboratory of Clinical Immunology, Wuhan No.1 Hospital, Tongji Medical College, Huazhong University of Science and Technology (HUST), Wuhan Hubei 430022, China)
ZHU Jianhua E-mail: zhujh621@163.com
Background and purpose:High mobility group 1 (HMGB1), frequently found to be overexpressed in many human tumors, plays an important role in tumor progress and metastasis. This study aimed to investigate the mechanism of HMGB1 promoting A549 cell metastasis.Methods:A549 cells were untreated or treated with HMGB1 (200 ng/mL) in absence or presence of NF-κB inhibitors 6-amino-4-quinazoline (QNZ, 40 nmol/L) or Bortezomib (Bort, 20 nmol/L). Scratch assay and Transwell assay were performed to evaluate A549 cells migration and invasion ability. The activity of NF-κB was examined by luciferase reporter assay. NF-κBp65 and αvβ3 expressions were detected by Real-time RT-PCR or Western blot.Results:HMGB1 increased A549 cells migration and invasion ability. HMGB1 enhanced NF-κB protein level and NF-κB activity in A549 cells. Real-time RT-PCR and Western blot showed that HMGB1 up-regulated αvβ3 expression in A549 cells. NF-κB inhibitors QNZ or Bort reserved the promoting effects of HMGB1 on A549 cells migration and invasion, NF-κB expression and activity as well as αvβ3 expression.Conclusion:HMGB1 promotes A549 cell migration and invasion through activating NF-κB and up-regulating αvβ3.
High mobility group box 1; A549; Invation; NF-κB; αvβ3
10.3969/j.issn.1007-3969.2015.02.005
R73-37
A
1007-3639(2015)02-0105-07
2014-09-26
2014-12-09)
湖北省自然科学基金青年项目(2013CFB370)。
朱建华 E-mail:zhujh621@163.com
