BER通路中XRCC1多位点单核苷酸多态性与新疆不同民族喉癌易感性相关性研究
2015-01-04王松胡斌雍军冯娟王玲玲阿依恒曲库尔汗
王松,胡斌,雍军,冯娟,王玲玲,阿依恒·曲库尔汗
新疆医科大学第一附属医院耳鼻咽喉科,新疆 乌鲁木齐 830054
BER通路中XRCC1多位点单核苷酸多态性与新疆不同民族喉癌易感性相关性研究
王松1,胡斌2,雍军3,冯娟3,王玲玲3,阿依恒·曲库尔汗1
新疆医科大学第一附属医院耳鼻咽喉科,新疆 乌鲁木齐 830054
背景与目的:影响肿瘤遗传易感性的修复基因主要存在修复通路碱基切除修复(base excision repair,BER)途径,而X射线交错互补修复基因1(X-ray repair cross complementing group 1,XRCC1)是BER通路中的核心基因。近几年,国内外开展了许多有关基因多态性和喉癌易感性的研究。探讨BER通路DNA修复基因XRCC1多位点单核甘酸多态性与新疆不同民族喉癌易感性关系。方法:采用患者组与对照组的研究方法,选择58例喉癌(经病理证实为鳞状细胞癌)患者和120名体检正常的健康人对照,应用Multiplex SNaPshot技术检测DNA碱基切除修复基因XRCC1的Gln632Gln(rs3547)、Arg399Gln(rs25487)、Arg280His(rs25489)、Arg194Trp(rs1799782)位点单核苷酸多态在患者组和正常对照组中的分布情况。结果:喉癌患者组中XRCC1 Arg280His(rs25489)C/T(杂合型)及T/T(突变型)基因型的比例与对照组比较差异无统计学意义(P>0.05)。喉癌患者组中XRCC1的其余3个位点Gln632Gln(rs3547)C/T(杂合型)及T/T(突变型)基因型、Arg399Gln(rs25487) C/T(杂合型)及T/T(突变型)基因型、Arg194Trp(rs1799782)G/A(杂合型)及A/A(突变型)基因型的比例明显高于对照组(P<0.01)。其中汉、维、哈3个民族患者组Gln632Gln(rs3547)C/T(杂合型)及T/T(突变型)基因型、Arg399Gln(rs25487)C/T(杂合型)及T/T(突变型)基因型、Arg194Trp(rs1799782)G/A(杂合型)及A/A(突变型)基因型比例显著高于对照组(P<0.05),携带(rs3547)C/T及T/T基因型、(rs25487)C/T及T/T基因型、(rs1799782)G/A及A/A基因型个体较携带XRCC1(rs3547)C/C基因型、(rs25487)C/C基因型、(rs1799782)G/G基因型的个体患喉鳞状细胞癌的风险升高了分别为0.96倍、1.74倍、1.39倍;1.47倍、1.32倍、0.77倍,1.49倍、1.51倍、1.56倍。结论:汉、维、哈3个民族的XRCC1 Gln632Gln、Arg399Gln、Arg280His、Arg194Trp位点的单核苷酸多态性可能与喉癌遗传性有关联且有差异,XRCC1基因中的Gln632Gln、Arg399Gln、Arg194Trp位点的突变将导致喉癌的发病风险升高。而XRCC1基因中的Arg280His位点突变与喉癌发病的差异无统计学意义,可能该位点的突变与喉癌发病无关。
碱基切除修复通路;X射线交错互补修复基因;单核苷酸多态性;喉癌;易感性
喉癌是耳鼻咽喉头颈外科常见的恶性肿瘤,其确切的发病机制尚不清楚,国内外研究报道其发病可能为遗传和环境多种危险因素(幽门螺杆菌、吸烟、酗酒)等综合所致[1-2]。DNA修复系统通过不同的修复通路促使DNA中损伤的、不合适的或者错配的碱基恢复原来的特性,以维持遗传物质稳定。碱基切除修复(base excision repair,BER)是DNA修复系统中最主要的一种修复途径,已有研究表明与人类多种恶性肿瘤发病有关[3-6]。X射线交错互补修复基因1(X-ray repair cross complementing group 1,XRCC1)作为通路中一个常见基因,其多态性可改变修复酶的结构从而影响其肿瘤易感性[7]。研究表明,XRCC1位点多态性与多种肿瘤如肺癌、胃癌、淋巴瘤及甲状腺癌等[8-14]的易感性有关。本研究在问卷基础上应用Multiplex SNaPshot技术(多重单碱基延伸反应技术)检测XRCC1多位点单核苷酸多态性在新疆不同民族喉癌患者和健康人群中的分布和遗传变异发生率,探讨基因与环境相互作用,为筛查不同民族易感个体以及最终的个体化防治提供理论依据。
1 资料和方法
1.1 研究对象
采用患者组与对照组1∶2配对方法,选择新疆各大医院耳鼻咽喉科2009年6月—2011年1月,经病理证实为喉鳞状细胞癌患者,为患者组58例,男性49例,女性9例(包括汉族28例,维吾尔族16例,哈萨克族14例),平均年龄(62.00±6.75)岁。按1987年UICC分期标准可分为T1N0M018例,T2N0-1M015例,T3N0-2M017例,T4N0-2M08例;声门型21例,声门上型26例,声门下型7例,分期、分型不明4例。选择同时期体检正常人群120名为对照组,平均年龄(58.00±7.14)岁。喉癌患者组与对照组采用Hardy-weinberg平衡检验及Logistic回归,使上述两组之间有可比性,配对的两组间性别构成比一致,年龄相差在5岁以内。经同意对每位受试者均取外周静脉血约4 mL,同时进行问卷调查,收集研究对象的既往史、个人史、家族史、吸烟史、饮酒史、居住环境、特殊嗜好、饮食习惯、工作环境等资料。采用全血基因组提取试剂盒(天根生化科技北京有限公司提供:血液基因组DNA提取试剂盒离心柱型,型号:DP318-03)。在常温下快速提取血液基因组DNA。
1.2 主要试剂及仪器
全血基因组提取试剂盒购自天根生化科技北京有限公司,DK-8D型电热恒温水槽购自上海精宏实验设备有限公司,凝胶成像仪购自上海培清科技有限公司,Centrifuge5810R购自德国Eppendorf公司,BG-Power 300电泳仪购自北京百晶生物科技有限公司,引物购自上海生工,PCR缓冲液购自日本Takara公司,PCR Marker购自NEW ENGLAND Biolabs,BIOWEST琼脂糖购自上海夏夷实业有限公司,SNaPshot Multiplex购自美国ABI公司,5X Sequencing Buffer购自美国ABI公司,SAP购自美国Promega公司,DNA聚合酶购自德国Qiagen公司。
1.3XRCC1基因Gln632Gln(rs3547)、Arg399Gln(rs25487)、Arg280His(rs25489)、Arg194Trp(rs1799782)多态性的检测
DNA样本取1 μL 1% agarose电泳对其样本进行质量检查以及浓度估计,然后根据估计的浓度将样本稀释到工作浓度5~10 ng/μL。
1.3.1 PCR检测
P C R引物包括r s 1 7 9 9 7 8 2顺义链:3’-CCAGCCCCCTCTACCCTCA-5’,反义链:3’-TTGGCCAGTTCCGTGTGAAG-5’;rs25489顺义链:3’-GAAGGATCTTCCC CAGCTCCTC-5’,反义链:3’-GTTGACCCCC AGTGGTGCTAAC-5’;rs25487顺义链:3’-TTGCCCAGCACAGGATAAGGA-5’,反义链:3’-TGCCAACACCCCCAAGTACAG-5’;rs3547顺义链:3’-ACGGAGGTGCCCAGCATTCTT-5’,反义链:3’-TCGTCCCCGATGGATCTACAGT-5’。
反应体系(10 μL)包含1×GC BufferⅠ(TAKARA),3.0 mm,Mg2+,0.3 mmol/L dNTP,1 U HotStarTaq polymerase(Qiagen Inc.),1 µL样本DNA和1 µL多重PCR引物。多重PCR各引物浓度分别为rs25487F/R 1 µmol/L、rs3547F/R 1.5 µmol/L、rs25489F/R 2 µmol/L、rs1799782F/R 1 µmol/L。
PCR循环程序:95 ℃预变性2 min;11个循环(94 ℃变性20 s,64.5 ℃退火40 s,72 ℃延伸 90 s);24个循环(94 ℃变性20 s,59 ℃退火30 s,72 ℃延伸1.5 min);72 ℃延伸 2 min;4 ℃终延伸。
PCR产物纯化:在10 μL PCR产物中加入1 U SAP酶和1 U Exonuclease I酶,37 ℃温浴1 h,然后75 ℃灭活15 min。
1.3.2 SNaPshot多重单碱基延伸反应检测
延伸引物包括:r s 2 5 4 8 7反义链:3’-C G T C G G C G G C T G C C C T C-5’,3’-rs3547反义链:3’-TTTTTTTTTCTATGG GGTGGTGCCGCA-5’,rs25489顺义链:3’-TTTTTT TTTTTTTGGGGCTGTGGCTGGGGTA-5’,rs1799782反义链:3’-TTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTGGGGGCTC TCTTCTTCAGC-5’。
延伸反应:延伸反应体系(10 μL)包括5 μL SNaPshot Multiplex试剂盒(购自美国ABI公司),2 μL 纯化后多重PCR产物,1 μL延伸引物混合物,2 μL超纯水。延伸引物混合物中各条延伸引物的浓度分别为:rs3547反义链0.8 µmol/L、rs25487SR 0.8 µmol/L、rs25489SF 0.8 µmol/L、rs1799782SR 1.6 µmol/L。
PCR循环程序:96 ℃预变性1 min;28 个循环(96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸30 s);4 ℃延伸。
延伸产物纯化:在10 μL延伸产物中加入1 U SAP酶,37 ℃温浴1 h,然后75 ℃灭活15 min。
延伸产物上3130XL(购自美国ABI公司)测序仪:取0.5 μL纯化后的延伸产物,与0.5 μL Liz120 SIZE STANDARD,9 μL Hi-Di混匀,95 ℃变性5 min后上ABI3130XL测序仪检测。
ABI3130XL测序仪上收集的原始数据用GeneMapper 4.0(美国Applied Biosystems公司)来分析。
1.4 统计学处理
采用SPSS 13.0软件建立数据库并进行统计分析,喉癌患者组中XRCC1的4个位点基因型与对照组位点基因型采用χ2检验,P<0.05为差异有统计学意义。并计算病例组中XRCC1位点基因型(突变型+杂合型)与对照组基因型比值比(OR)及其95%可信区间(95%CI)。
2 结 果
2.1 汉族、维吾尔族、哈萨克族患者3个民族XRCC1多位点的单核苷酸多态性与喉癌易感性关联分析
喉癌患者组中XRCC1 Arg280His(rs25489) C/T(杂合型)及T/T(突变型)基因型的比例与对照组相比差异无统计学意义(P>0.05,表1)。喉癌患者组中XRCC1的其余3个位点Gln632Gln (rs3547) C/T(杂合型)及T/T(突变型)基因型、Arg399Gln(rs25487)C/T(杂合型)及T/T(突变型)基因型、Arg194Trp(rs1799782)G/A(杂合型)及A/A (突变型)基因型的比例明显高于对照组(P<0.01)。其中喉癌患者组Gln632Gln(rs3547) C/T(杂合型)及T/T(突变型)基因型、Arg399Gln(rs25487)C/T(杂合型)及T/T(突变型)基因型、Arg194Trp(rs1799782)G/A(杂合型)及A/A (突变型)基因型比例显著高于对照组(P<0.05),携带(rs3547)C/T及T/T基因型、(rs25487)C/T及T/T基因型、(rs1799782)G/A及A/A基因型个体较携带XRCC1(rs3547)C/C基因型、(rs25487)C/C基因型、(rs1799782)G/G基因型的个体患喉鳞状细胞癌的风险分别升高了0.96、1.74和1.39倍,1.47、1.32和0.77倍,1.49、1.51和1.56倍(表2~4)。
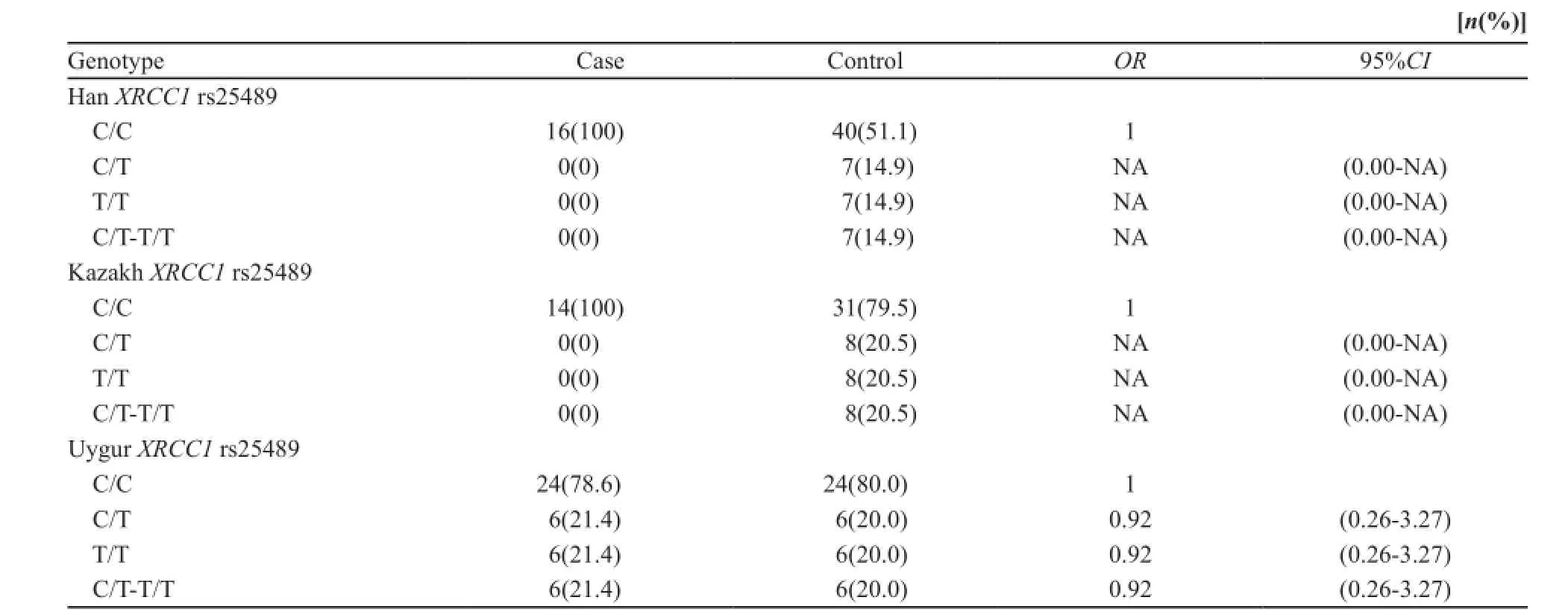
表1 XRCC1位点rs25489单核苷酸多态性与喉癌易感性关联分析Tab. 1 Site rs25489 XRCC1 SNP associated with laryngeal cancer susceptibility analysis
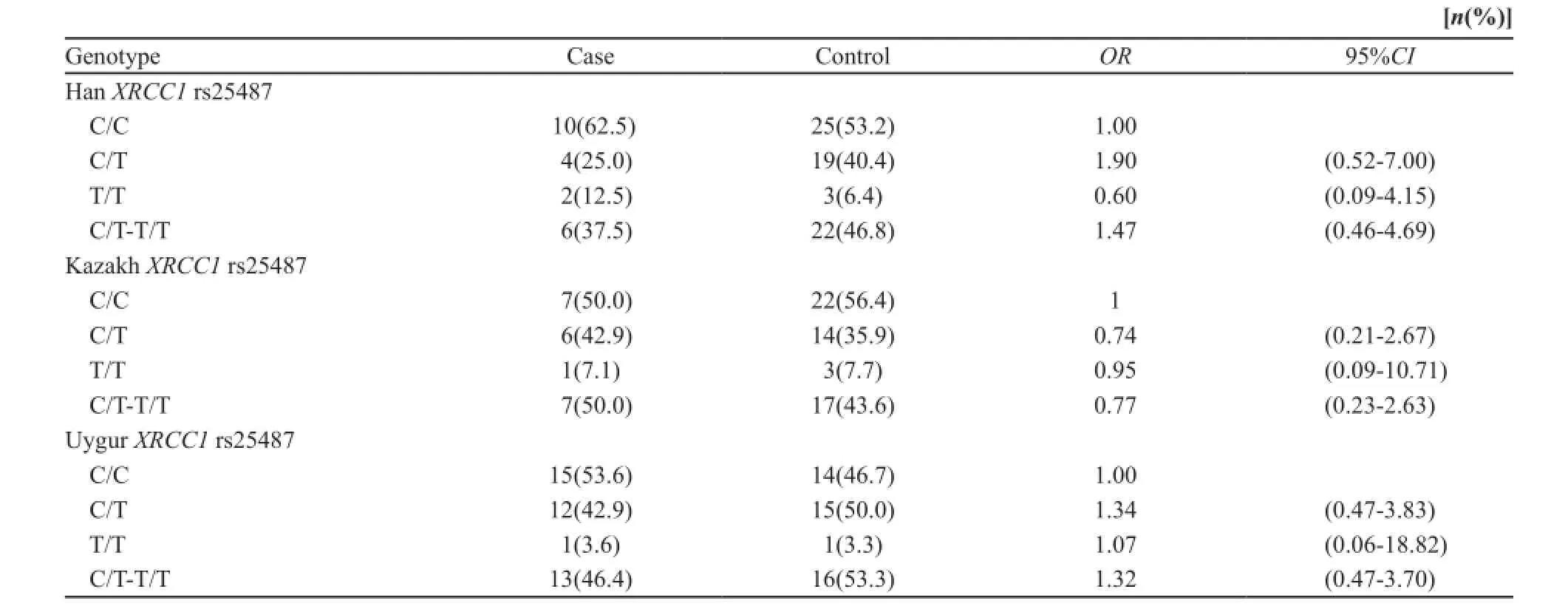
表2 XRCC1位点rs25487单核苷酸多态性与喉癌易感性关联分析Tab. 2 Site rs25487 XRCC1 SNP associated with laryngeal cancer susceptibility analysis
2.2 3个民族的XRCC1多个SNP位点的基因的单倍型分析
对3个民族的XRCC1多个SNP位点做了基因LD图,从图中可以看到,XRCC1在汉族和哈族中,rs25487、rs25489、rs1799782存在连锁,在维族中,rs3547、rs25487、rs25489存在连锁。单倍型分析只针对连锁的位点有意义,所以,进行了上述连锁区域的单倍型分析,其中推导单倍型使用了Phase,进行Logistic回归分析使用了SNPStats软件,以频率最高的类型为参照。单倍型分析并未找到频率较高的单倍型同时有阳性结果。得到的结果中,汉族在XRCC1 SNP位点表现出一定阳性,而维族和哈族均没有,也说明了3个民族的差异性。(图1)。该结果是使用SPSS进行χ2检验。从结果可以看出,汉族和维族或哈族的差异非常大,XRCC1多位点差异有统计学意义。因此,在进行病例对照分析时,需要将3个民族分开进行统计,以避免民族之间本身就存在的频率差异被误认为是病例组和对照组之间的差异(所以,3个民族患者组之间的比较和总体对照组和患者组之间的比较是没有意义的,即使有阳性结果,也极有可能是民族之间本身存在的频率差异导致)。其次,对3个民族,按对照和患者分组的2种情况下性别和年龄的分布是否一致进行了检验,其中,性别是使用SPSS 13.0进行χ2检验,年龄是采用当其为连续的数值变量使用SPSS 13.0统计软件进行t检验。在性别差异检验的结果中,除了哈萨克族病例组和对照组之间比较接近,汉族和维族各自的病例组和对照组之间差异都比较大(P=0.081和P=0.003);在年龄差异的结果中,3个民族各自的病例组和对照组之间的差异非常大(P<0.05)。由此可见,分组之间性别和年龄不是很配对,可在后续的分析中进行性别和年龄的校正,否则如果性别和年龄本身对喉癌有一定影响,如不进行校正,检测到的阳性结果可能只是由于病例组和对照组之间性别年龄不匹配导致,会影响结果的准确性。

表3 XRCC1位点rs3547单核苷酸多态性与喉癌易感性关联分析Tab. 3 Site rs3547 XRCC1 SNP associated with laryngeal cancer susceptibility analysis
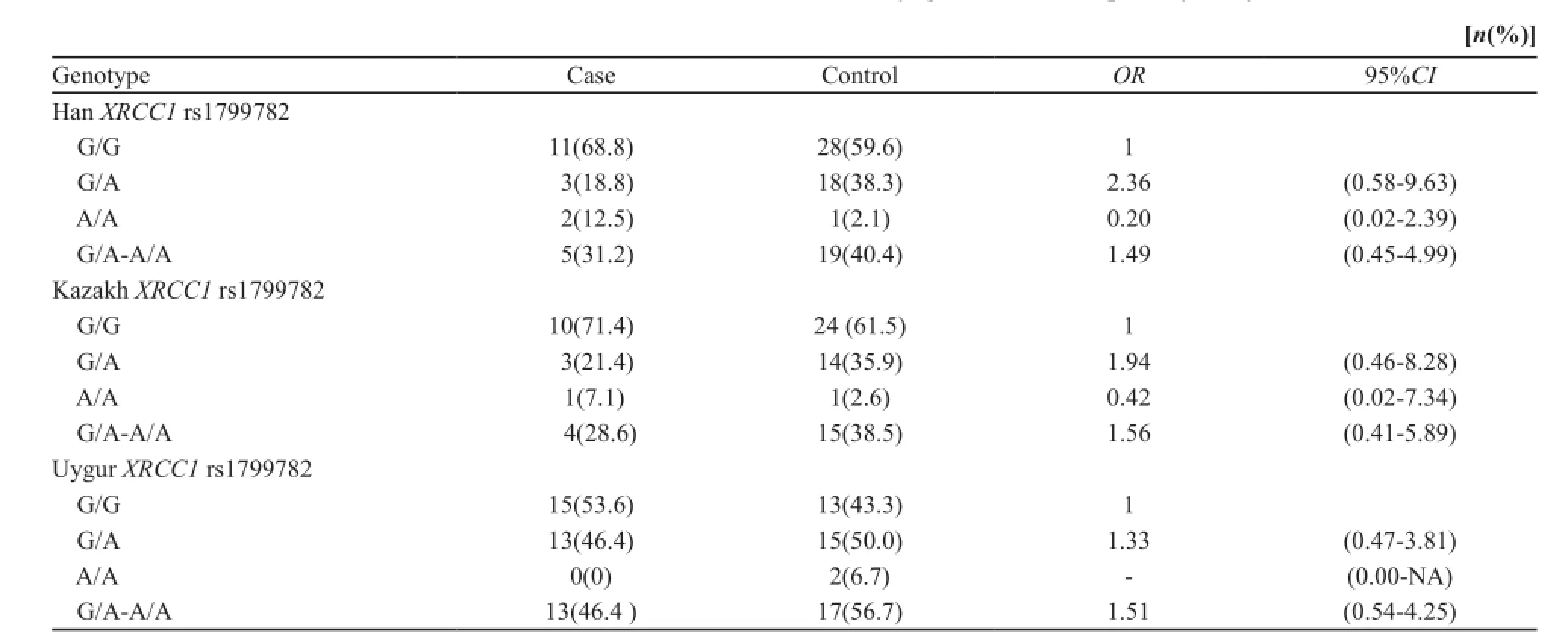
表4 XRCC1位点rs1799782单核苷酸多态性与喉癌易感性关联分析Tab. 4 Site rs1799782 XRCC1 SNP associated with laryngeal cancer susceptibility analysis
2.3 3个民族的XRCC1多个SNP位点胶电泳及单位点分型峰形图分析
用SNaPshot方法对XRCC1 rs25487、rs25489、rs1799782和rs3547位点进行SNP分型试验可得出XRCC1的3个位点rs3547 C/T(杂合型)及T/T(突变型)基因型、rs25487 C/T(杂合型)及T/T(突变型)基因型、rs1799782 G/A(杂合型)及A/ A(突变型)基因型所代表的峰值明显高于野生型(P<0.05),rs25489 C/T基因型与C/C基因型差异无统计学意义。上述XRCC1多个SNP位点胶电泳及单位点分形峰型与分别对各民族修复基因多位点检测结果基本一致(图2)。
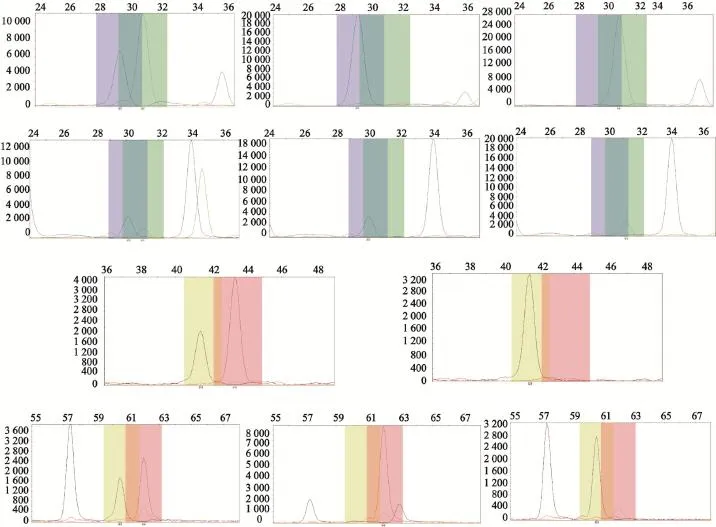
图2 位点胶电泳及单位点分型峰形图Fig. 2 Gel electrophoresis and unit type dotted peak shape
3 讨 论
目前,喉癌发病的确切原因尚不十分清楚,但吸烟及饮酒为喉癌发病的重要危险因素这一结论已得到普遍认可[15-16]。但处于相同或相似的环境条件下的吸烟与饮酒人群,却只有极少数的危险因素暴露者发生喉癌。这一事实提示,除了上述危险因素的影响外,其它因素可能对喉癌也起着重要的作用。基因与环境的共同作用可能才是喉癌以及其它肿瘤的发病原因。
近几年来随着分子遗传学水平的不断发展,对于肿瘤发病的分子遗传机制以及基因-环境的交互作用成为研究的一个热点。基因突变是肿瘤发生、发展的起始阶段,基因的变异可致基因功能表达异常,如DNA修复基因的突变就可能会导致DNA修复能力的改变,从而在不同环境危险因素作用下导致个体间修复能力的差异, 并进一步导致机体DNA修复基因的突变。近年来通过对基因多态性的研究,可以了解到基因多态性在不同人群中的分布,从而帮助我们从遗传学角度认识肿瘤在不同地域、种族中的发病率,从而为进一步阐明肿瘤的发病机制,为预防、治疗肿瘤提供科学依据。
肿瘤是环境因素与遗传因素互相作用导致的一类疾病,是细胞中多种基因突变累积的结果,这些基因突变主要发生在3类基因,即癌基因、抑癌基因和DNA错配修复基因[17-18]。其中绝大多数肿瘤的基因都是体细胞变异,包括突变、扩增、重排、缺失或甲基化状态的改变[19]。一般而言,生物体基因突变的发生有两种原因:一是外源化学物质的长期低浓度刺激致使机体的遗传物质发生了不可逆的变异;另一种原因就是生物群体中不同个体的遗传背景的差异,即基因多态性的存在。基因多态性是指人群染色体中同一个基因座位上的≥2个的等位基因,其在群体中的分布频率至少为1%,即认为该基因座位具有多态性[20]。基因多态性可引起编码氨基酸的改变,进而可使其表达的蛋白质(酶)数量或活性发生改变。因此,在相同或相似环境条件下,由于基因多态性的存在可致不同个体对化学物质的反应能力产生差异。
XRCC1是第一个被分离出的影响细胞对电离辐射敏感性的哺乳动物基因,是一种重要的DNA修复基因,在DNA polB聚合酶、连接酶(Lig Ⅲ)、聚磷酸腺苷-核糖聚合酶(PARP)等的DNA损伤修复过程中起一个支架作用,共同参与BER和单链断裂修复[21]。它广泛参与DNA的损伤修复[22]。本研究主要探讨DNA修复基因XRCC1多位点SNP与喉癌发病风险的关系。
许多文献显示XRCC1多位点基因多态性与肺、胃、肝癌、甲状腺癌等肿瘤发病相关联。余红平等[23]研究表明:DNA碱基切除修复基因XRCC1 Gln399Gln突变纯合子基因型者患肺癌风险增加。卫国荣等[24]对XRCC1密码子194多态性与肺癌易感性的关系进行研究,结果显示:DNA修复基因XRCC1密码子194的多态性可能与肺癌的易感性有关,且在吸烟者中,Trp/Trp基因型可使肺癌发病风险显著提高,提示XRCC1可能通过遗传因素及遗传因素与环境致癌因素的交互作用影响肺癌的危险性。Kowalski等[25]在研究XRCC1多位点的SNP与头颈部鳞状细胞癌结果表明:XRCC1位点Arg194Trp、Arg399Arg突变作为头颈部鳞状细胞癌发病的一个高发危险因素。Audun等[26]研究表明XRCC1中Arg194Trp、Arg280His和Arg399Gln共3个位点突变引起蛋白与BRCT1结构域改变从而引发癌症。同时研究XRCC1中Gln632Gln(rs3547)、Arg399Gln(rs25487)、Arg280His(rs25489)、Arg194Trp(rs1799782)4个位点与喉癌易感性的关系在国内、外还未有相关报道。因此,该文研究了DNA修复基因XRCC1上述位点单核苷酸多态性与新疆不同民族喉癌易感性的关系。
本研究结果显示,喉癌患者组中XRCC1基因的3个位点Gln632Gln(rs3547)C/T(杂合型)及T/T(突变型)基因型、Arg399Gln(rs25487) C/T(杂合型)及T/T(突变型)基因型、Arg194Trp(rs1799782)G/A(杂合型)及A/A(突变型)基因型的比例明显高于对照组(P<0.01),这一结果与Kowalski等[25]在研究XRCC1基因多位点Arg194Trp、Arg399Arg多态性与头颈部鳞状细胞癌中所得出的结果基本一致。且与Audun等[26]研究X R C C 1多位点A rg 1 9 4 Tr p、Arg399Gln突变所致癌症的发生风险的结果一致,但本研究XRCC1 Arg280His位点突变与喉癌发病的差异无统计学意义(P>0.05)。与Audun等[26]研究XRCC1位点Arg280His突变为癌症的发病风险所得出的结果不相符,此阴性结果可能与本研究患者数少有关。
本研究中3个民族患者组Gln632Gln(rs3547) C/T(杂合型)及T/T(突变型)基因型、Arg399Gln(rs25487)C/T(杂合型)及T/T(突变型)基因型、Arg194Trp(rs1799782)G/A (杂合型)及A/A(突变型)基因型比例显著高于对照组(P<0.05),携带(rs3547)C/T及T/T基因型、(rs25487)C/T及T/T基因型、(rs1799782)G/A及A/A基因型个体较携带XRCC1(rs3547)C/C基因型、(rs25487)C/C基因型、(rs1799782)G/G基因型的个体患喉鳞状细胞癌的风险升高了分别为0.96、1.74和1.39倍,1.47、1.32和0.77倍,1.49、1.51和1.56倍。这可能是由于XRCC1上述位点位于BRCT1结构域内,BRCT是DNA修复和细胞周期调控蛋白中蛋白-蛋白结合模块,BRCT结构域在XRCC1中央部分与多聚(ADP-核糖)聚合酶的两个区域相互作用,多聚(ADP-核糖)聚合酶是DNA链断裂修复末端连接所需的多核苷酸激酶。因此,XRCC1多位点多态性可能改变BRCT1结构构象,其编码蛋白活性出现改变,从而导致修复环境因子致DNA损伤的能力降低,因而导致喉癌的发病风险增高。
喉癌的发病可能与我们未曾研究的多基因多位点的SNP有关,Bogela等[27]已对DNA修复基因XRCC1前期的小样本的预实验结果提示在基因型、基因型频率等方面汉族与新疆本地民族维吾尔族和哈萨克族有着很大差异。故准备下一步采用高通量全组基因测序法对罕见基因及位点测定来进一步研究与喉癌的发病风险。由于3个民族长期的隔离有各自的SNP频率和复杂疾病致病因素,所以分析时应该分开进行,且在研究中患者组中XRCC1 Arg280His(rs25489) C/T(杂合型)及T/T(突变型)基因型的比例与对照组与喉癌发病风险差异无统计学意义,两者关系可能需增大样本量进一步研究。本研究患者数较少,无法通过这次的结果来做出结论,待患者数增加需要进一步研究。
[1] GARAVELLO W, TURATI F, BOSETTI C, et al. Family history of cancer and the risk of laryngeal cancer: a casecontrol study from Italy and Switzerland [J]. Cancer, 2012, 130: 665-670.
[2] GONG H L, SHI Y, ZHOU L, et al. Helicobacter pylori infection of the larynx may be an emerging risk factor for laryngeal squamous cell carcinoma [J]. Clin Transl Oncol, 2012, 14: 905-910.
[3] WALLACE S S, MURPHY D L, SWEASY J B, et al. Base excision repair and cancer [J]. Cancer Lett, 2012, 327: 73-89.
[4] DOHERTY J A, SAKODA L C, LOOMIS M M, et al. DNA repair genotype and lung cancer risk in the betacarotene and retinol efficacy trial [J]. Original Article, 2013, 4: 11-34.
[5] MONROY C M, CORTES A C, LOPEZ M, et al. Hodgkin lymphoma risk: Role of genetic polymorphisms and gene-gene interactions in DNA repair pathways [J]. Mol Carcinog, 2011, 50: 825-834.
[6] SJOLUND A, SENEJANI A, SWEASY J, et al. MBD4 and TDG: Multifaceted DNA Glycosylases with ever expanding biological roles [J]. Mutat Res, 2013, 734: 12-25.
[7] ODELL I D, BARBOUR J E, MURPHY D L, et al. Nucleosome disruption by DNA ligase Ⅲ-XRCC1 promotes efficient base excision repair[J]. Mol Cell Biol, 2011, 31: 4623-4632.
[8] ROSZAK A, LIANERI M, JAGODZINSKI P P, et al. Involvement of the XRCC1 Arg399Gln gene polymorphism in the development of cervical carcinoma [J]. Biol Markers, 2011, 32: 274–279.
[9] ROBERTS M R, SHIELDS P G, AMBROSONE C B, et al. Single-nucleotide polymorphisms in DNA repair genes and association with breast cancer risk in the web study [J]. Carcinogenesis, 2011, 32: 1223-1230.
[10] RYU R A, TAE K, MIN H J, et al. XRCC1 polymorphisms and risk of papillary thyroid carcinoma in a Korean sample[J]. Korean Med Sci, 2011, 26: 991-995.
[11] CHIANG F Y, WU C W, HSIAO P J, et al. Association between polymorphisms in DNA base excision repair genes XRCC1, APE1, and ADPRT and differentiated thyroid carcinoma [J]. Clin Cancer Res, 2008, 14: 5919-5924.
[12] XUE H, NI P, LIN B, et al. X-ray repair cross-complementing group 1 (XRCC1) genetic polymorphisms and gastric cancer risk: A Huge review and meta analysis [J]. Am J Epidemiol, 2011, 173: 363-375.
[13] GENG J, ZHANG Q, ZHU C, et al. XRCC1 genetic polymorphism Arg399Gln and prostate cancer risk: a metaanalysis [J]. Urology, 2009, 74: 648-653.
[14] WEI B, ZHOU Y, XU Z, et al. XRCC1 Arg399Gln and Arg194Trp polymorphisms in prostate cancer risk: a meta analysis [J]. Prostate Cancer Prostatic Dis, 2011, 14: 225-231.
[15] PAWLOWSKA E, KATARZYNA J P, RYDAANICZ M, et al. The Cys326 allele of the 8-oxoguanine DNA N-glycosylase 1 gene as a risk factor in smoking and drinking-associated larynx cancer [J]. Medline, 2009, 219: 269-275.
[16] RAMROTH H, DIETZ A, BECHER H, et al. Intensity and inhalation of smoking in the aetiology of laryngeal cancer[J]. Public Health, 2011, 8: 976-984.
[17] RICHARD D W, MICHAEL M, JHON S, et al. Human DNA repair genes[J]. Science, 2001, 291: 1284-1289.
[18] MAKERS H, GENOME J, et al. Maintenance mechanisms for preventing cancer [J]. Nature, 2001, 411: 366-374.
[19] SCHENA M, SHALON D, DAVIS R W, et al. Quantitative monitoring of gene expression patterns with a complementary DNA microarray [J].Science, 1995, 270: 467-470.
[20] YANG Y, TIAN H, ZHANG Z J, et al. Association of the XRCC1 and hOGG1 polymorphisms with the risk of laryngeal carcinoma [J].Medline, 2008, 25(2): 211-213.
[21] KUBO T Y, NASH R A, KLUNG L A, et al. Reconstitution of DNA base excision repair with purified human proteins: interaction between DNA polymerase beta and the XRCC1 protein [J]. EMBOJ, 1996, 15(23): 6662-6670.
[22] YOON S M, HONG Y C, PARK H J, et al. The polymorphism and haplotypes of XRCC1 and survival of non-small-cell lung cancer after radiotherapy[J]. Radiat Oncol Biol Phys, 2005, 63(3): 885-891.
[23] 余红平, 曾小云, 仇小强, 等. DNA修复基因XRCC1单核苷酸多态性与肺癌易感性[J].广西医科大学学报, 2006, 23(3): 355-359.
[24] 卫国荣, 陈传炜,俞顺章, 等. DNA修复基因XRCC1密码子194多态性与肺癌易感性研究[J]. 复旦学报(医学版), 2008, 35(3): 348-352.
[25] KOWALSKI M, PRZYBYLOWSKA K, RUSIN P, et al. Genetic polymorphisms in DNA base excision repair gene XRCC1 and the risk of squamous cell carcinoma of the head and neck [J]. J Exp Clin Cancer Res, 2009, 28: 37-43.
[26] AUDUN H B, KARIN S G, KARIN M G, et al. The region of XRCC1 which harbours the three most common nonsynonymous polymorphic variants, is essential for the scaffolding function of XRCC1[J]. DNA Repair (Amst), 2013, 1: 1-19.
[27] BOGELA A, YALIKUN Y, AYIHEN Q. Study on polymorphism and genetic susceptibility of laryngeal of Arg399GlnXRCC1 gene in different ethnic groups in Xinjiang[J]. J Otolaryngol-Head N, 2013, 1: 10-17.
Studying on BER pathways of XRCC1 site SNP and laryngeal cancer susceptibility of different nations in Xinjiang
WANG Song1, HU Bing2, YONG Jun3, FENG Juan3, WANG Lingling3, AYIHENG Qukuerhan1(Department of Otolaryngology, The First Affiliated Hospital, Xinjiang Medical University, Urumqi Xinjiang 830054, China)
AYIHENG Qukuerhan E-mail: ayhen979@sina.com
Background and purpose:Major repair genes that affect the tumor genetic susceptibility exists in repair pathways base excision repair (BER) approach, X-ray repair cross complementing group 1(XRCC1) gene, respectively is the core of BER pathway. At home and abroad in recent years, has carried out many studies of genetic polymorphism and laryngeal cancer susceptibility. Researching on the base excision repair (BER) pathway of DNA repair gene XRCC1 bases mononuclear nucleotide polymorphism and the relationship between different ethnic groups laryngeal cancer susceptibility in xinjiang.Methods:A case-control study was performed on 58 patient with laryngealsquamous cell carcinoma and 120 random healthy control group. Multiplex SNaPshot technic was used to detect DNA base excision repair gene XRCC1 Gln632Gln (rs3547), Arg399Gln (rs25487), Arg280His (rs25489), Arg194Trp (rs1799782) loci single nucleotide polymorphism distribution in the case group and normal control group.Results:Three sites of the rest of the cases of XRCC1 Gln632Gln (rs3547) C/T (hybrid) and T/T (mutant) genotype, Arg399Gln (rs25487) C/T (hybrid) and T/T (mutant) genotype, Arg194Trp (rs1799782) G/A (hybrid) and A/A (mutant) genotype is notably higher than that of control group (P<0.01). Gln632Gln (rs3547) C/T (hybrid) and T/T (mutant) genotype, Arg399Gln (rs25487) C/T (hybrid) and T/T (mutant) genotype, Arg194Trp (rs1799782) G/A (hybrid) and A/A (mutant) genotype ratio is signifcantly higher than control group (P<0.05) in cases of Han,Uygur and Kazakh nations, carrying (rs3547) C/T and T/T genotype, (rs25487) C/T and T/T genotype, (rs1799782) G/A and A/A genotype individual risk of laryngeal squamous cell carcinoma are added to the 0.96, 1.74 and 1.39 times; 1.47, 1.32 and 0.77 times; 1.49, 1.51 and 1.56 times than XRCC1 (rs3547) C/C genotype, (rs25487) C/C genotype, (rs1799782) G/G genotype.Conclusion:In the 3 nations, XRCC1 Gln632Gln, Arg399Gln, Arg280His and Arg194Trp loci polymorphism may be associated with laryngeal cancer genetic and there are differences, XRCC1 Gln632Gln, Arg399Gln, Arg194Trp locus mutation will lead to an elevated risk of throat cancer. XRCC1 Arg280His locus mutation has no statistically signifcant difference with the onset of throat cancer, may have nothing to do with the onset of laryngeal cancer on the site of mutation.
Base excision repair pathways; X-ray repair cross complementing group 1; SNP; Laryngeal cancer; Susceptibility
10.3969/j.issn.1007-3969.2015.02.007
R739.65
A
1007-3639(2015)02-0119-10
2014-04-29
2014-07-05)
新疆维吾尔自治区自然科学基金项目(2013211A098)。
阿依恒•曲库尔汗 E-mail:ayhen979@sina.com
