E-cadherin/β-catenin影响胰腺癌PANC-1细胞糖酵解效应的实验研究
2015-01-04
复旦大学附属肿瘤医院胰腺肝胆外科,胰腺肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
E-cadherin/β-catenin影响胰腺癌PANC-1细胞糖酵解效应的实验研究
秦毅,梁丁孔,施思,吉顺荣,张波,许文彦,刘江,徐近,倪泉兴,虞先濬
复旦大学附属肿瘤医院胰腺肝胆外科,胰腺肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:钙黏附蛋白E(E-cadherin)低表达与癌细胞的高侵袭转移潜能密切相关,但其与癌细胞葡萄糖代谢的关系鲜见报道。该研究旨在探讨E-cadherin与胰腺癌PANC-1细胞糖酵解效应的关系。方法:通过转化生长因子β(transforming growth factor β,TGF-β)引起E-cadherin低表达、敲减与E-cadherin相互作用的β-连环蛋白(β-catenin)的基因以及过表达E-cadherin等方法,检测PANC-1细胞通过糖酵解效应吸收葡萄糖和生成乳酸能力的变化以及糖酵解通路中关键基因的表达。结果:E-cadherin可以负向调控PANC-1细胞的糖酵解效应,抑制肿瘤细胞吸收葡萄糖和分泌乳酸的能力(P<0.05)。而与其相互作用的β-catenin可以正向调控PANC-1细胞的糖酵解效应,促进葡萄糖的吸收和乳酸的生成,结果差异有统计学意义(P<0.05)。同时糖酵解效应的关键调控分子去乙酰化酶3(sirtuin 3,SIRT3)也可以引起PANC-1细胞中E-cadherin表达的改变。结论:PANC-1细胞中E-cadherin低表达可以引起葡萄糖代谢模式的转化,促进PANC-1细胞的糖酵解效应,同时通过导入糖酵解效应的关键调控分子SIRT3也可以引起E-cadherin表达的改变。这些结果为研究胰腺癌侵袭转移过程中糖代谢模式的转化提供了重要线索,为通过改变糖酵解效应进而影响胰腺癌的侵袭转移潜能提供了干预模式。
钙黏附蛋白E;β-连环蛋白;去乙酰化酶3;糖酵解
肿瘤细胞的高侵袭转移潜能是肿瘤难以被根治和患者死亡的重要原因。肿瘤细胞的侵袭转移是个复杂的生理过程,涉及到细胞与细胞之间以及细胞与细胞外基质的相互作用[1-2]。在肿瘤的侵袭转移过程中,钙黏附蛋白E(E-cadherin)发挥了重要的作用,其转录和蛋白表达水平的下调是肿瘤发生侵袭及转移的重要原因[3]。肿瘤的代谢过程对于维系细胞的基本生理活动起着至关重要的作用[4],但是肿瘤代谢与细胞形态变化和侵袭转移潜能之间的关系报道甚少。
最近的研究表明,在肿瘤细胞发生侵袭及转移的过程中,细胞的代谢模式会发生从线粒体的氧化磷酸化到糖酵解效应的转化[5]。因此,深入了解肿瘤代谢与肿瘤侵袭转移之间的关系,会为了解肿瘤的发生、发展以及干预肿瘤的恶性生物学行为提供重要的线索。本研究通过观察PANC-1细胞中肿瘤侵袭转移的重要标志性分子E-cadherin与肿瘤葡萄糖代谢之间的关系,从一个全新的角度了解肿瘤代谢与肿瘤侵袭转移间的关系,为通过干预代谢进而影响肿瘤的恶性生物学行为提供了重要的线索。
1 材料和方法
1.1 细胞
胰腺癌PANC-1细胞购自美国模式培养物集存库(American Type Culture Collection,ATCC),在含有10%的DMEM培养基中培养,并置于37 ℃、CO2体积分数为5%的培养箱中培养。
1.2 抗体
E-cadherin(ab40772)、β-连环蛋白(β-catenin)(ab32572)、c-myc(ab32072)和乏氧诱导因子1α(hypoxia inducible factor 1 α,HIF1α)(ab51608)抗体购自英国Abcam公司,HA标签抗体购自天根生化科技(北京)有限公司,β-actin内参抗体购自美国Proteintech公司,组蛋白H4抗体购自Cell Signaling Technology公司。
1.3 试剂盒
细胞核抽提试剂盒购自美国Pierce公司,葡萄糖吸收和乳酸生成分析试剂盒购自美国Biovision公司。
1.4 实时定量PCR检测
细胞内总RNA抽提、反转录以及实时定量PCR试剂盒购自天根生化科技(北京)公司。引物序列如下:GLUT1基因顺义链:5’-AACTCTTCAGCCAGGGTCCA-3’,反义链:5’-CACAGTGAAGATGATGAAGAC-3’;HK2基因顺义链:5’-GATTGTCCGTAACATTCTCATCGA-3’,反义链:5’-TGTCTTGAGCCGCTCTGAGAT-3’;Pdk1基因顺义链:5’-CGGATCAGAAACCGACACA-3’,反义链:5’-ACTGAACATTCTGGCTGGTGA-3’;LDHA基因顺义链:5’-GGAGATTCCAGTGTGCCTGT-3’,反义链:5’-GTCCAATAGCCCAGGATGTG-3’;β-actin基因顺义链:5’-AGAGCTA C G A G C T G C C T G A C-3’,反义链:5’-AGCACTGTGTTGGCGTACAG-3’。
1.5 克隆载体构建以及慢病毒颗粒制备
E-cadherin和去乙酰化酶3(sirtuin 3,SIRT3)慢病毒过表达载体构建采用pCDH-CMV-EF1-Puro载体,敲减β-catenin基因的慢病毒载体采用pLKO.1 TRC cloning vector,针对β-catenin的靶序列为TTGTTATCAGAGGACTAAATA(21 bp)。慢病毒的生产采用HEK-293T细胞,转染慢病毒载体以及包装质粒psPAX2和pMD2.G至HEK-293T细胞中,比例为4∶3∶1。转染后48 h收集慢病毒颗粒用于感染目的细胞。
1.6 统计学处理
采用SPSS 18.0统计软件进行统计分析,组间比较采用t检验分析,P<0.05为差异有统计学意义。
2 结 果
2.1 转化生长因子β(transforming growth factorβ,TGF-β)引起E-cadherin表达下调,促进PANC-1细胞的糖酵解效应
PANC-1细胞用TGF-β(10 ng/mL)处理72 h,观察细胞形态变化,发现细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT)形态的改变(图1A、B)。用免疫印迹杂交的方法检测与EMT相关的几个关键指标,E-cadherin水平下调,钙黏附蛋白N(N-cadherin)和波形蛋白水平上升(图1C)。为了初步验证E-cadherin下调是否与肿瘤糖代谢转化相关,首先在蛋白水平上检测了影响代谢的关键分子c-myc和HIF1α的变化。结果发现,TGF-β可以引起c-myc和HIF1α的明显上调,提示PANC-1细胞在发生侵袭转移的过程中,会有糖代谢模式的转化(图1D)。HIF1α作为重要转录因子通过调控糖酵解途径中的代谢酶参与肿瘤细胞乏氧适应,因此,本研究检测了糖酵解途径中的4个HIF1α的靶基因,结果显示,葡萄糖转运蛋白1(glucose transporter 1,GLUT1)、己糖激酶2(hexokinase 2,HK2)、乳酸脱氢酶A(lactate dehydrogenase A,LDHA)和丙酮酸脱氢酶激酶同工酶1(pyruvate dehydrogenase kinase isozyme 1, PDK1)在TGF-β处理后均有明显上升(图1E)。最后,通过检测PANC-1细胞吸收葡萄糖和分泌乳酸的水平发现,TGF-β处理引起的E-cadherin下调确实促进了PANC-1细胞吸收葡萄糖和分泌乳酸的能力(图1F)。实验结果显示,TGF-β引起E-cadherin表达下调可以促进肿瘤细胞以糖酵解方式代谢葡萄糖。
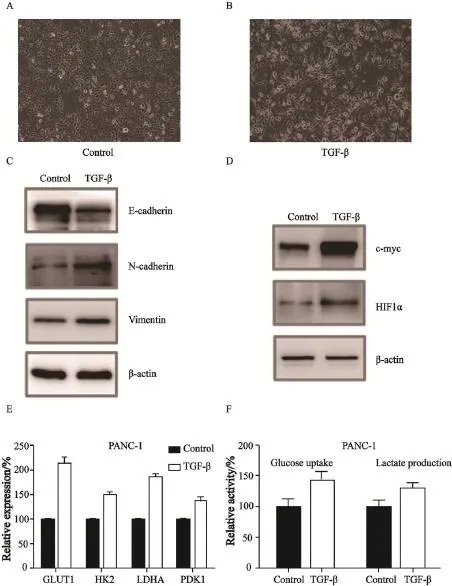
图1 TGF-β处理细胞引起E-cadherin下调,促进PANC-1细胞的糖酵解效应Fig. 1 TGF-β treatment induced E-cadherin down regulation and promoted glycolysis in PANC-1 cells
2.2 敲减β-catenin蛋白的基因抑制PANC-1细胞代谢葡萄糖的能力
β-catenin是与E-cadherin密切相关的分子,参与了肿瘤细胞发生、发展和侵袭转移等多个生理过程。既往的研究提示,E-cadherin的减少同时伴随有β-catenin的核内移位而行使转录因子的功能[6]。因此,本研究通过慢病毒介导的转染shRNA的方法,干扰细胞内β-catenin的表达(图2A),进而检测β-catenin与PANC-1细胞糖酵解的关系。结果发现,干扰β-catenin的表达,可以显著下调代谢关键调控分子c-myc和HIF1α的表达(图2B),同时抑制PANC-1细胞吸收葡萄糖和生成乳酸的能力(图2C),提示β-catenin可以促进PANC-1细胞的糖酵解效应。
2.3 过表达E-cadherin可以抑制PANC-1细胞糖酵解代谢葡萄糖的能力
通过慢病毒介导的转染方式,在PANC-1细胞内过表达E-cadherin,进而观测E-cadherin上调与PANC-1细胞糖酵解的关系。结果发现,细胞内过表达E-cadherin后,可以显著下调关键代谢调控因子c-myc和HIF1α的表达(图3A),同时明显抑制了PANC-1细胞吸收葡萄糖和分泌乳酸的能力(图3B)。通过实时定量PCR的方法发现,糖酵解效应中4个关键基因的表达也受到E-cadherin上调的影响而明显下调(图3C)。实验结果显示,E-cadherin是一种影响代谢的负向调控因子。
2.4 代谢关键调控分子SIRT3影响E-cadherin的表达
SIRT3被认为是一种肿瘤抑制因子,且可以通过抑制糖酵解效应而抑制肿瘤的恶性生物学行为[7]。因此,本研究在细胞内使SIRT3过表达进而观察E-cadherin表达的变化。结果显示,通过慢病毒介导的转染过表达SIRT3后,可以显著上调E-cadherin水平,以及抑制β-catenin在细胞核内的聚集(图4A~C)。进一步的研究发现,TGF-β刺激和β-catenin表达显著减少也可以负向调控SIRT3的表达(图4D、E)。
综上,TGF-β、E-cadherin、β-catenin和SIRT3形成一个反馈回路,介导了胰腺肿瘤细胞侵袭转移和糖代谢模式转化之间的调控(图4F)。
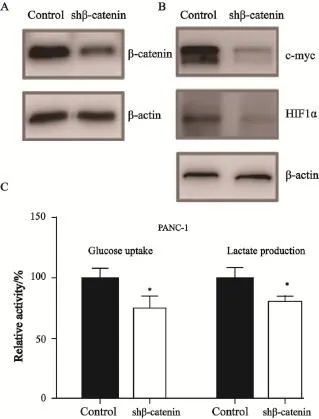
图2 敲减β-catenin的基因抑制PANC-1细胞代谢葡萄糖的能力Fig. 2 Knock-down the gene of β-catenin inhibited glucose utilization in PANC-1 cells
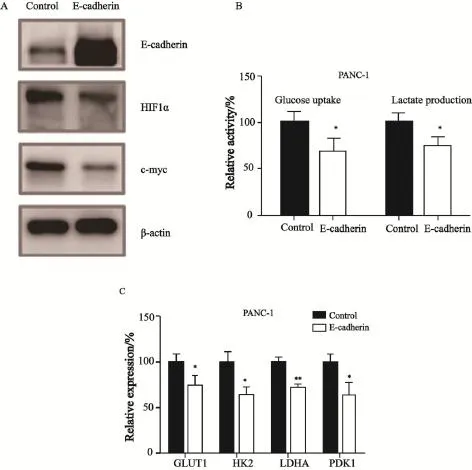
图3 过表达E-cadherin可以抑制PANC-1细胞糖酵解代谢葡萄糖的能力Fig. 3 Over-expression of E-cadherin inhibited glycolysis in PANC-1 cells
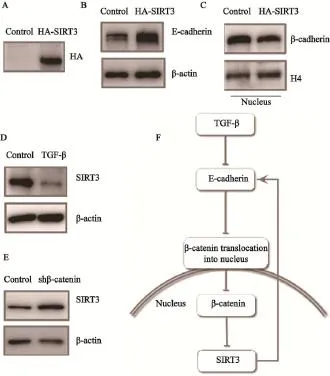
图4 代谢关键调控分子SIRT3影响E-cadherin的表达Fig. 4 Key metabolism regulator SIRT3 influences E-cadherin expression
3 讨 论
肿瘤细胞通过不断地消耗营养物质来维持恶性增殖和侵袭转移所需要的能量和物质[8]。肿瘤细胞所处的乏氧、乏血供的环境限制了其获得能量和物质的来源,因此,肿瘤细胞采用了代谢模式转化的方式来适应这种不利环境,其中尤为重要的是肿瘤细胞对葡萄糖代谢模式的转化。在乏氧环境下,肿瘤细胞通过糖酵解的模式代谢葡萄糖,为其恶性生物学行为提供ATP,以及提供用于合成其它生物大分子的物质。同时,以糖酵解为主的葡萄糖代谢模式会伴随有乳酸的生成,造成肿瘤细胞周围的酸性环境,进而导致细胞基质的不稳定性和降解,为肿瘤细胞的恶性侵袭转移提供条件[9]。因此可以推断,肿瘤细胞代谢与其恶性侵袭转移的能力之间存在着一定的联系,研究肿瘤代谢模式转化与其恶性侵袭转移行为之间的关系有助于通过干预代谢的手段来影响肿瘤的恶性潜能。
在乳腺癌发生EMT转化而引起侵袭转移的过程中,其代谢模式发生了明显的改变,下调糖异生途径的限速酶果糖-1,6-二磷酸酶(FBP1)促进高度侵袭转移的乳腺癌细胞获得代谢优势而更容易维持其恶性潜能[5,10]。同样,在肾透明细胞癌中,FBP1作为肿瘤抑制因子,通过抑制肿瘤细胞的代谢而影响了肾透明细胞癌的恶性潜能。
本研究发现,在胰腺癌细胞PANC-1中,通过TGF-β诱导EMT引起E-cadherin下调,可以明显促进PANC-1细胞糖酵解的能力,同时在PANC-1细胞中过表达E-cadherin后,可以抑制肿瘤细胞代谢葡萄糖的能力。HIF1α和c-myc是肿瘤细胞代谢的关键性调控分子,通过调控代谢途径中的关键酶而影响肿瘤细胞代谢模式的转化[11]。本研究结果提示,TGF-β刺激以及细胞内过表达E-cadherin均可以引起HIF1α和c-myc的改变。本研究发现,TGF-β以及E-cadherin的过表达可以改变SIRT3的蛋白水平,而SIRT3又可以反馈性地引起E-cadherin以及其共轭分子β-catenin的改变。
综上所述,本研究结果报道了胰腺癌细胞中E-cadherin与肿瘤细胞代谢模式转化之间的关系,β-catenin以及SIRT3作为关键性的调控分子参与了该生理过程。这些结果为后续研究肿瘤细胞侵袭转移与糖代谢之间的关系提供了重要的理论线索,同时为通过改变肿瘤细胞的代谢模式而调控侵袭转移潜能提供了依据。
[1] TSAI J H, YANG J. Epithelial-mesenchymal plasticity in carcinoma metastasis [J]. Genes Dev, 2013, 27(20): 2192-2206.
[2] KANG Y, MASSAGUE J. Epithelial-mesenchymal transitions: Twist in development and metastasis [J]. Cell, 2004, 118(3): 277-279.
[3] THIERY J P, ACLOQUE H, HUANG R Y, et al. Epithelialmesenchymal transitions in development and disease [J]. Cell, 2009, 139(5): 871-890.
[4] TEICHER B A, LINEHAN W M, HELMAN L J. Targeting cancer metabolism [J]. Clin Cancer Res, 2012, 18(20): 5537-5545.
[5] DONG C, YUAN T, WU Y, et al. Loss of fbp1 by snailmediated repression provides metabolic advantages in basallike breast cancer [J]. Cancer Cell, 2013, 23(3): 316-331.
[6] ORSULIC S, HUBER O, ABERLE H, et al. E-cadherin binding prevents beta-catenin nuclear localization and betacatenin/lef-1-mediated transactivation [J]. J Cell Sci, 1999, 112: 1237-1245.
[7] FINLEY L W, CARRACEDO A, LEE J, et al. Sirt3 opposes reprogramming of cancer cell metabolism through hif1alpha destabilization [J]. Cancer Cell, 2011, 19(3): 416-428.
[8] CAIRNS R A, HARRIS I S, MAK T W. Regulation of cancer cell metabolism [J]. Nat Rev Cancer, 2011, 11(2): 85-95.
[9] DANG C V. Links between metabolism and cancer [J]. Genes Dev, 2012, 26(9): 877-890.
[10] SCHIEBER M S, CHANDEL N S. Ros links glucose metabolism to breast cancer stem cell and emt phenotype[J]. Cancer Cell, 2013, 23(3): 265-267.
[11] KEITH B, JOHNSON R S, SIMON M C. Hif1alpha and hif2alpha: Sibling rivalry in hypoxic tumour growth and progression [J]. Nat Rev Cancer, 2012, 12(1): 9-22.
The influence of E-cadherin/β-catenin on the glycolysis effect in PANC-1 cells
QIN Yi, LIANG Dingkong, SHI Si, JI Shunrong, ZHANG Bo, XU Wenyan, LIU Jiang, XU Jin, NI Quanxing, YU Xianjun (Department of Pancreas and Hepatobiliary Surgery, Pancreas Cancer Institute, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YU Xianjun E-mail: yuxianjun@fudanpci.org
Background and purpose:Lower expression of E-cadherin is associated with metastasis of cancer cells, however, the correlation between E-cadherin and glucose metabolism has seldom been reported. This article studied the correlation between E-cadherin and glycolysis effect in PANC-1 cells.Methods:Through treatment of transforming growth factor β (TGF-β) in PANC-1 cells to decrease E-cadherin expression, knock-down the gene of E-cadherin interaction protein β-catenin, and overexpressing of E-cadherin, the effects of E-cadherin on the glucose uptake and lactate production ability and on the expression of key glycolytic genes were assessed.Results:E-cadherin negatively regulated the glycolytic effect of PANC-1 cells by inhibiting glucose uptake and lactate production (P<0.05). Moreover, E-cadherin interacting partner β-catenin signifcantly promoted glucose metabolism transformation in PANC-1 cells (P<0.05). Moreover, key glycolysis regulator sirtuin 3 (SIRT3) could lower E-cadherin expression.Conclusion:Lower expression of E-cadherin induced the transformation of glucose metabolism transformation in PANC-1 cells and manipulation of E-cadherin expression level could change the glycolysis effect. Moreover, through maneuver glycolysis process could inhibit high metastatic potential of pancreatic cancer cells.
E-cadherin; β-catenin; Sirtuin3; Glycolysis
10.3969/j.issn.1007-3969.2015.02.001
R735.9
A
1007-3639(2015)02-0081-06
2014-11-15
2015-01-10)
国家自然科学基金(81372651)。
虞先濬 E-mail:yuxianjun@fudanpci.org
