内质网分子蛋白在小鼠腹水型肝癌高、低淋巴道转移株中的表达及意义
2015-01-04张亚楠唐建武
张亚楠,唐建武
1.大连医科大学基础医学院病理学与法医学教研室,辽宁 大连 116044;
2.山东中医药大学基础医学院病理学教研室,山东 济南 250355
内质网分子蛋白在小鼠腹水型肝癌高、低淋巴道转移株中的表达及意义
张亚楠1,2,唐建武1
1.大连医科大学基础医学院病理学与法医学教研室,辽宁 大连 116044;
2.山东中医药大学基础医学院病理学教研室,山东 济南 250355
背景与目的:内质网分子伴侣29(endoplasmic reticulum molecular chaperons 29,ERp29)是一种内质网应激蛋白,其高表达与肿瘤转移相关。本研究旨在探讨ERp29在小鼠腹水型肝癌高、低淋巴道转移株中的表达及与肝癌淋巴道转移的关系。方法:构建小鼠腹水型肝癌细胞株(高转移株Hca-F、低转移株Hca-P)淋巴道转移动物模型,通过免疫组织化学、蛋白质印迹法(Western blot)和流式细胞仪等方法检测ERp29在Hca-F、Hca-P细胞株中的表达情况。结果:免疫组织化学检测结果显示,ERp29在Hca-F、Hca-P中均呈阳性表达,定位于细胞质,部分细胞核也有表达。Western blot检测结果显示,ERp29在Hca-F、Hca-P中的表达吸光度值分别为0.97±0.03和1.17±0.03,ERp29在Hca-F细胞株中的表达(吸光度值)明显低于Hca-P,差异有统计学意义(P<0.01)。流式细胞仪检测结果显示,ERp29在Hca-F细胞株中的相对荧光强度值(375.27±47.33)显著低于Hca-P(623.91±46.80),差异有统计学意义(P<0.01)。结论:ERp29在小鼠腹水型肝癌细胞株Hca-F和Hca-P均有表达,且在Hca-F中表达较低,而在Hca-P中表达较高。ERp29可能与肝癌淋巴道转移密切相关。
内质网分子伴侣29;肝癌;淋巴道转移
肝细胞癌(hepatocellular carcinoma)具有较高的发病率与死亡率,是世界范围内最为常见的恶性肿瘤之一[1]。研究证明,转移和复发是导致肝癌患者预后不良的主要原因[2]。对于许多原发性肿瘤而言,肿瘤细胞转移至局部淋巴结被认为是肿瘤转移的早期信号,淋巴道转移是大多数恶性肿瘤早期转移的共同阶段,但其分子基础和机制尚不清楚。
内质网分子伴侣29(endoplasmic reticulum molecular chaperons 29,ERp29)是一种相对分子质量为29×103的蛋白质,广泛表达于各种组织。近年来,ERp29在肿瘤发生、发展及转移中的作用得到研究者广泛重视,可能成为许多肿瘤新的治疗靶点。
本研究采用免疫组织化学、蛋白质印迹法(Western blot)和流式细胞仪检测ERp29在小鼠腹水型肝癌高淋巴道转移株(Hca-F)和低淋巴道转移株(Hca-P)中的表达,探讨ERp29在肝癌淋巴道转移过程中的作用,为深入了解肿瘤淋巴道转移的机制提供依据。
1 材料和方法
1.1 实验材料
1.1.1 细胞株和实验动物
小鼠肝癌高、低淋巴道转移细胞株Hca-F、Hca-P由大连医科大学病理教研室建立并保存。实验动物为近交系615小鼠,雄性,4~6周龄,体质量18~22 g,由大连医科大学病理教研室繁育并提供[辽实动质字(2000)028号]。
1.1.2 试剂和器材
RPMI-1640培养液、胎牛血清购自美国Gibco公司,ERp29多克隆抗体购自英国Abcam公司,β-actin多克隆抗体购自中国北京博奥森生物技术有限公司,FITC标记山羊抗兔IgG、辣根酶标记山羊抗兔IgG、免疫组化通用型SP试剂盒购自中国北京中杉金桥生物有限公司。
1.2 实验方法
1.2.1 细胞培养
将冻存的Hca-F和Hca-P细胞株复苏,用PBS洗涤,离心(8 000×g),弃上清液,重悬细胞,按每只2×106个细胞(0.2 mL)分别接种到2只615小鼠腹腔内,7 d后无菌条件下抽取腹水0.2 mL,再次分别接种于2只615小鼠腹腔,5 d后无菌条件下抽取非血性腹水。以磷酸盐缓冲液(PBS,pH为7.4)洗涤1次,将细胞置于含10%新生牛血清、80 U/mL庆大霉素、pH为7.2的RPMI-1640培养液中,于37 ℃、CO2体积分数为5%、饱和湿度的条件下培养,以增加细胞数量并去除小鼠腹腔巨噬细胞。
1.2.2 免疫组织化学检测
将培养的Hca-F和Hca-P细胞用PBS洗涤,离心后重悬为1×106个/mL的细胞悬液,涂片,丙酮固定,3%H2O2室温温育15 min,用正常非免疫山羊血清下室温封闭后,加入ERp29多克隆抗体(1∶500),4 ℃温育18 h,滴加生物素标记的山羊抗兔二抗,37 ℃下温育30 min,滴加辣根酶标记的链霉卵白素工作液,在37 ℃下温育30 min,DAB显色,苏木素复染,自来水冲洗返蓝,经梯度乙醇脱水,二甲苯透明,中性树胶封片,镜下观察ERp29在Hca-F和Hca-P细胞中的表达情况。
1.2.3 Western blot法检测ERp29的表达情况
超声破碎法裂解细胞,4 ℃离心30 min取上清液。Bradford比色法测定蛋白质浓度。以12%SDS-PAGE电泳分离后,蛋白质电转移至PVDF膜,用5%TBS/BSA于室温封闭3 h,ERp29多克隆抗体(1∶2 500)、β-actin多克隆抗体(1∶500)与PVDF膜杂交温育,常规免疫染色,DAB显色。实验重复3次。用目的条带与内参(β-actin)条带吸光度值(A)的比值进行比较。
1.2.4 流式细胞仪检测ERp29的表达情况
用1 mL含0.2%Triton X-100和5%血清的PBS重悬Hca-F和Hca-P细胞,PBS洗涤,离心(8 000×g)并重悬为1×106个/mL的细胞悬液,加入ERp29多克隆抗体(1∶500)1 μL,37 ℃作用1 h。PBS洗涤,加入FITC标记的二抗各1 μL,同时以PBS代替一抗作为阴性对照。流式细胞仪进行检测,每管计数10 000个细胞。ERp29蛋白在各细胞中的表达以相对荧光强度(relative fuorescence intensity,RFI)表示,RFI=该样品的几何均数×均值。
1.3 统计学处理
采用SPSS 12.0软件统计包对各组数据进行统计分析。数据以x±s表示。组间均数比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组织化学检测结果
将切片在显微镜下观察,结果ERp29在Hca-F和Hca-P中均有表达,主要表达于细胞质,部分细胞核也有表达(图1)。
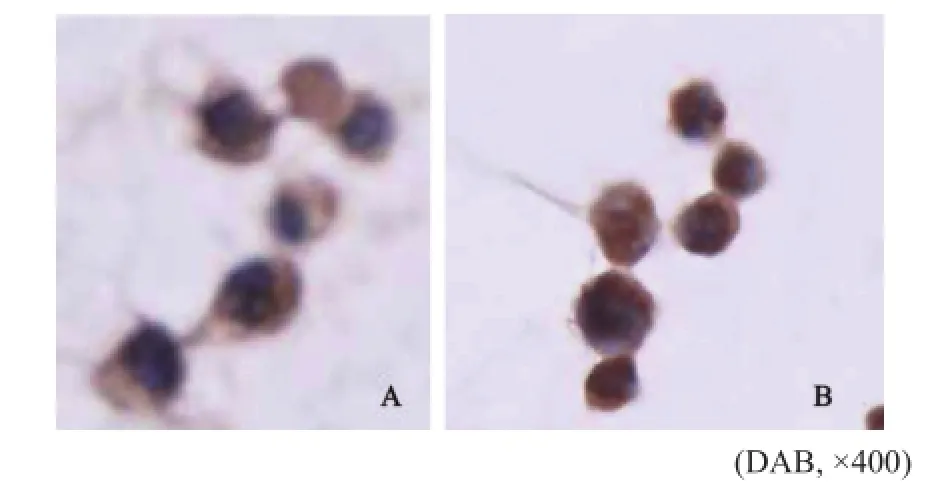
图1 ERp29蛋白在Hca-F和Hca-P细胞中的表达Fig. 1 Expression of ERp29 protein in Hca-F and Hca-P cells
2.2 Western blot检测结果
β-actin条带作为上样量的参照,在相对分子质量为29×103处Hca-F和Hca-P细胞中均出现单一蛋白质条带。ERp29蛋白与β-actin在Hca-F和Hca-P细胞中的A值之比分别为0.97±0.03和1.17±0.03,ERp29蛋白在Hca-F细胞中的表达明显低于Hca-P,差异有统计学意义(P<0.01,图2,表1)。

表1 ERp29蛋白在Hca-F和Hca-P细胞中表达的比较Tab. 1 Expression of ERp29 in Hca-F and Hca-P cells
2.3 流式细胞仪结果
ERp29在Hca-F和Hca-P中的RFI均值分别为375.27±47.33和623.91±46.80,ERp29蛋白在Hca-F细胞中的表达明显低于其在Hca-P细胞中的表达,差异有统计学意义(P<0.01,表1,图3)。
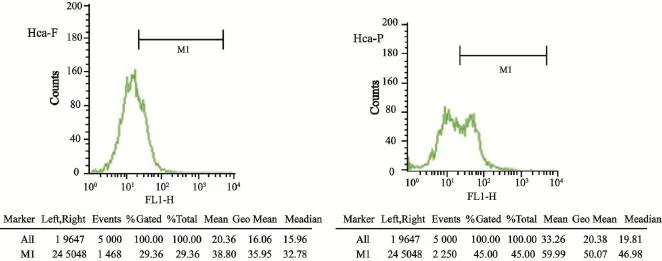
图3 流式细胞仪分析ERp29蛋白在Hca-F和Hca-P细胞中表达Fig. 3 Expression of ERp29 protein in Hca-F and Hca-P cells by flow cytometry
3 讨 论
Hca-F和Hca-P是从小鼠腹水型肝癌细胞H22中筛选出的特异性向淋巴道转移的细胞系,2者具有高度的同源性,但淋巴道转移明显不同。HCa-F细胞接种于615小鼠腋中线皮下淋巴结转移率高于70%,HCa-P细胞的淋巴结转移率则低于30%,具体的机制不详[3-4]。
课题组前期采用荧光差异双向凝胶电泳和质谱技术筛选出小鼠腹水型肝癌淋巴道转移相关的蛋白,发现ERp29蛋白在Hca-P中表达显著升高,是Hca-F表达量的2.63倍[5]。本实验采用免疫组织化学、Western blot及流式细胞仪检测ERp29蛋白在Hca-F和Hca-P中的表达,结果显示,ERp29蛋白在Hca-P中表达高于Hca-F,这与课题组前期的研究结果一致,提示ERp29蛋白可能与小鼠腹水型肝癌淋巴道转移相关。
大量实验表明,ERp29基因在肿瘤中具有抑癌基因的作用。Shnyder等[6]的研究发现,与低转移癌细胞MCF-7相比,ERp29在人乳腺高转移癌细胞MDA-MB-43中表达下降;Bambang等[7]的研究结果显示,与非癌组织相比,乳腺癌组织的ERp29表达下降,并与乳腺癌侵袭性特征相关。桑旭等[8]通过免疫组织化学的方法检测ERp29在胃癌及癌旁组织中的表达,发现胃癌组织中ERp29表达下降,并且ERp29的表达与肿瘤分期及淋巴结转移呈负相关。唐卫文等[9]研究结果发现,食管癌旁组织ERp29呈高表达,食管癌组织ERp29的表达明显下降,而食管癌组织ERp29的表达亦与肿瘤分期及淋巴结转移呈负相关。
然而,ERp29在肿瘤发生、发展与转移中的作用及机制还不明确。ERp29是一种内质网应激蛋白,其功能研究主要定位于参与内质网蛋白质折叠和分泌蛋白的输出的分子伴侣[10]。结合本实验结果我们推测:肿瘤组织内由于血管供应不良等原因,存在低糖、低氧及酸中毒等应激的内环境,造成蛋白质折叠错误增加,引起内质网应激反应,代偿性地导致BiP/GRP78、ERp29表达升高,ERp29与BiP/GRP78形成复合物相互作用激活膜蛋白,用以纠正错误的蛋白质折叠,抑制小鼠腹水型肝癌的淋巴道转移。诱导ERp29的表达可能是肿瘤细胞在不利条件下生存的一种防御机制。但是,目前对ERp29的表达调控未深入研究,ERp29究竟是如何参与肝癌发生、发展及淋巴道转移,以及其在其它肿瘤中的作用等问题,尚需进一步探讨。
[1] PARKIN D M, BRAY F, FERLAY J, et al.Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74-108.
[2] TANG Z Y, YU Y Q, ZHOU X D, et al.Progress and prospects in hepatocellular carcinoma surgery[J]. Ann Chir, 1998, 529(6): 558-559.
[3] HOU L, YING L, YONG H J, et al.Molecular mechanism about lymphogenous metastasis of hepatocarcinoma cells in mice[J]. World J Gastroenterol, 2001, 7(4): 532-536.
[4] 宋琳, 唐建武, 张军, 等.Sorcin在小鼠腹水型肝癌高、低淋巴道转移株中的表达及定位[J]. 临床与病理杂志, 2014, 34(2): 123-128.
[5] 孙成荣, 唐建武, 孙明忠, 等.采用定量蛋白质组学技术筛选小鼠肝癌淋巴道转移相关蛋白[J]. 生物化学与生物物理进展, 2007, 34(8): 856-864.
[6] SHNYDER S D, MANGUM J E, HUBBARD M J. Triplex profiling of functionally distinct chaperones(Erp29/PDI/BiP) reveals marked heterogeneity of the endoplasmic reticulum proteome in cancer[J]. J Proteome Res, 2008, 7(8): 3364-3372.
[7] BAMBANG I F, XU S, ZHOU J, et al.Overexpression of endoplasmic reticulum protein 29 regulates mesenchymalepithelial transition and suppresses xenograft tumor growth of invasive breast cancer cells[J]. Lab Invest, 2009, 89(11):1229-1242.
[8] 桑旭, 张甲, 袁光金, 等.内质网分子伴侣29在胃癌中的表达及临床意义研究[J]. 中华全科医学, 2013, 11(7):1021-1023.
[9] 唐卫文, 郑骏年, 高超.内质网蛋白在食管癌中的表达及其临床意义[J].药学与临床研究, 2012, 20(6):494-498.
[10] BARYSHEV M, SARGSYAN E, MKRTCHIAN S.ERp29 is an essential endoplasmic reticulum factor regulating secretionof thyroglobulin[J]. Biochem Biophys Res Commun, 2006, 340(2):617-624.
The expression and significance of ERp29 in 2 mice hepatocellular carcinoma ascites syngeneic celllines with high and low lymph node metastasis rates
ZHANG Yanan1,2, TANG Jianwu1(1.Department of Pathology and Forensic Medicine, Dalian Medical University, Dalian Liaoning 116044, China; 2.Department of Pathology, Shandong University of Traditional Chinese Medicine, Jinan Shandong 250355, China)
TANG Jianwu E-mail: jianwutang@163.com
Background and purpose:ERp29 belongs to endoplasmic reticulum stress proteins and might play roles in neoplasm metastasis. This study aimed to investigate the expression of ERp29 in Hca-F and Hca-P cells and to elucidate its role in lymphatic metastasis.Methods:Immunohistochemistry, Western blot and fow cytometry analysis were used to detect the expression of ERp29 in Hca-F and Hca-P.Results:The results of immunohistochemistry suggested that ERp29 protein was located at cytoplasm of hepatic cells and some were also detected in the nucleus. The results of western blot suggested that ERp29 had positive expression in Hca-F and Hca-P cells. Its expression in Hca-F cells was apparently lower than that in Hca-P cells. And there was statically different between Hca-F and Hca-P cells (P<0.01). The relative fuorescence intensity of ERp29 protein was signifcantly lower in Hca-F cells (375.27±47.33) than that in Hca-F cells (623.91±46.80) by fow cytometry (P<0.01).Conclusion:The different expression of ERp29 may be related to the potential ability of tumor lymphatic metastasis in Hca-F and Hca-P cells.
Endoplasmic reticulum molecular chaperons 29; Hepatocellular carcinoma; Lymphatic metastasis
10.3969/j.issn.1007-3969.2015.02.003
R735.7
A
1007-3639(2015)02-0095-04
2014-07-05
2014-09-23)
国家自然科学基金面上项目(30572098)。
唐建武 E-mail:jianwutang@163.com
