有机弱酸盐对pH振荡反应的影响
2014-12-31侯玉龙胡道道
侯玉龙,杨 珊,2,胡道道*
(1陕西师范大学 材料科学与工程学院,陕西 西安 710119;2渭南师范学院 化学与生命科学学院,陕西 渭南 714099)

1 实验
1.1 仪器与试剂
PP-50型专业pH计(赛多利斯仪器有限公司),通过RS232接口与计算机连接,使用“串口调试助手”软件采集pH数据.BT100-1L型高精度4通道蠕动泵(保定兰格恒流泵有限公司),HL-2B型数显恒流泵(上海沪西分析仪器有限公司),MP-10C型制冷和加热循环槽(上海一恒科学仪器有限公司).特制的夹套反应器如图1中所示,液体在烧杯中的保留体积V=60mL.
KBrO3、无水 Na2SO3、K4Fe(CN)6·3H2O、浓H2SO4、苯甲酸钠、山梨酸钾和柠檬酸皆为分析纯.用二次蒸馏水分别配制浓度为:[KBrO3]=0.26 mol/L,[Na2SO3]=0.3mol/L,[K4Fe(CN)6]=0.08mol/L,[H2SO4]=0.04mol/L的储备液.储备液进入反应器的初始浓度分别为:[KBrO3]0=0.065mol/L,[Na2SO3]0= 0.075mol/L,[K4Fe(CN)6]0=0.02mol/L,[H2SO4]0=0.01 mol/L.由于Na2SO3溶液很容易变质,最好现配现用,放置3h后则应丢弃[7];K4Fe(CN)6溶液保存在棕色瓶中,防止其见光分解以及氧化[8-9].
1.2 实验方法
使用如图1所示的反应装置进行振荡反应.反应条件为:用恒温水浴控制反应温度为30℃,先向夹套反应器中加入4种储备液各10mL,然后用蠕动泵将4种储备液分别从下端的四个支管持续地送进反应器中,多余的反应液用恒流泵从反应器上端支管导出.控制各溶液的进样流速均为1.21mL/min,电磁搅拌的速率为250r/min,反应体系的pH变化用pH计测试,用计算机每15s记录一组pH-时间(t)数据,绘制pH-t曲线.

图1 实验装置图Fig.1 Experimental setup
研究苯甲酸钠、山梨酸钾以及柠檬酸对BSF体系pH振荡的影响时,保持其他条件不变,用Na2SO3储备液配制一定浓度的苯甲酸钠(或山梨酸钾,或柠檬酸)溶液并代替Na2SO3储备液进行实验.文中标示的物质浓度皆为进入体系后的浓度.
2 结果与讨论
2.1 BSF体系pH振荡基本参数
BSF体系是能够发生大幅、稳定的pH振荡的振荡器,该体系的振荡可以看成如下两个复合反应组成[4]:

其中(a)是H+催化的产生H+的自加速反应,称作正反馈;(b)是消耗H+的慢反应,称作负反馈.由于该体系的振幅及周期与各物种浓度以及物种注入速度密切相关,因此,确立稳定pH振荡参数是本研究的一个基本要求.通过实验,本研究确定了反应条件:30℃、流速1.21mL/min、搅拌速率250r/min.在此条件下,获得了如图2所示的pH振荡曲线,其振荡周期(T)为17.5min,振幅(ΔpH)为3.40(pHmin为3.25,pHmax为6.65).

图2 BSF振荡体系的pH振荡曲线Fig.2 The pH oscillation curve of BSF system
2.2 不同有机弱酸盐存在时的BSF体系pH振荡
由BSF体系pH振荡反应可知,当体系释放H+使pH降低时,若向体系中注入结合H+的物种,pH的降低将必然受到抑制;反之,当体系消耗H+使pH升高时,若向体系中注入释放H+的物种,则pH的升高将受到抑制.表现在pH振荡曲线上即为振幅减小.因此,这种具有抑制pH上升及下降的物种,将抑制BSF体系的pH振荡,其抑制作用大小与所注入物种结合或释放H+的能力有关.以有机弱酸(盐)为例,上述原理可用下面的方程描述:
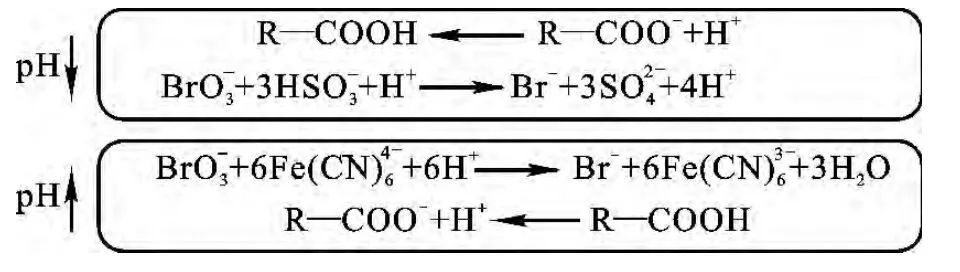
对于有机弱酸(盐)而言,其对pH振荡的抑制作用实际上是其缓冲作用的体现.有机弱酸(盐)的缓冲作用与其pKa有关,最大缓冲范围为pKa±1.基于上述原理,本研究中考察了苯甲酸钠(pKa=4.20)、山梨酸钾(pKa= 4.75)及柠檬酸(pKa1=3.13,pKa2=4.76,pKa3=6.40)等有机弱酸盐对BSF体系pH振荡行为的影响.上述3种有机弱酸盐存在时BSF体系pH振荡曲线示于图3.由图可见,向BSF体系中注入无论何种有机弱酸盐,皆使振幅降低,周期变短,且这种影响随浓度的增加而更加显著.
当向体系中注入苯甲酸钠浓度为5.0×10-4mol/L时,ΔpH 由原来的3.40变为3.22,周期仍为17.5min;当其浓度为1.0×10-2mol/L时,ΔpH=2.09,T=15.8min;当浓度为2.5×10-2mol/L时,ΔpH=0.65,T=14min;当浓度为3.0×10-2mol/L时,振荡完全消失,此时体系pH约5.2,在苯甲酸钠的最大缓冲范围内.

图3 有机弱酸盐在不同浓度下对BSF体系pH振荡的影响Fig.3 Influence of the organic weak acid salts with different concentration on the pH oscillation of BSF system
向体系中注入山梨酸钾时,振幅和周期的变化与注入苯甲酸钠时类似.当山梨酸钾浓度为8×10-3mol/L时,ΔpH=2.32,T=16.45min;当浓度 为 1.4×10-2mol/L 时,ΔpH =1.04,T=15.66min;当浓度达到1.6×10-2mol/L时,振荡几乎消失,此时体系pH约5.6,在山梨酸钾的最大缓冲范围内.
向体系中注入柠檬酸时,振幅及周期均减小.当浓度为2.0×10-4mol/L,ΔpH=3.08,T=17.5 min;当浓度为6.0×10-4mol/L时,ΔpH=2.84,T=16.5min;当浓度1.0×10-3mol/L时,振荡消失,此时体系pH约4.4,接近柠檬酸的pKa2值.

2.3 有机弱酸盐对BSF体系pH振荡的影响规律
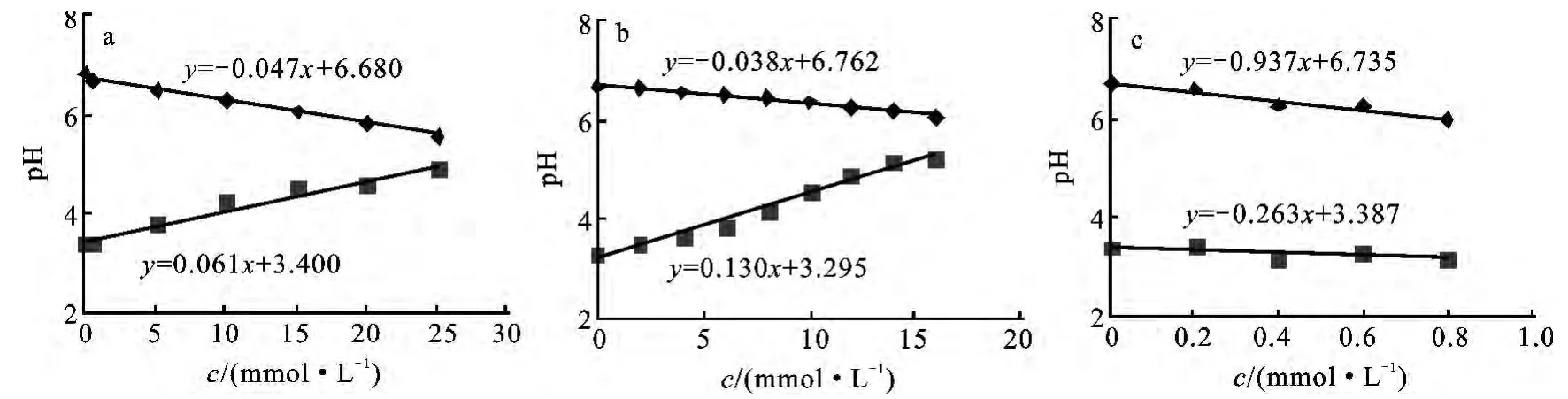
图4 有机弱酸盐浓度对BSF体系pHmax(◆)和pHmin(■)的影响Fig.4 Influence of the organic weak acid salts with concentration on pHmaxand pHminof BSF system
为了有效比较3种弱酸盐对BSF体系pH振荡的影响,图4给出了有机弱酸盐浓度与pH振荡的最大pH (pHmax)和最小pH (pHmin)的关系曲线.由图可见,不同的弱酸盐其浓度与振荡的pHmax和pHmin均具有一定线性关系.在此,不同弱酸盐对振荡反应影响具有类似性,在一定程度上反映了作用机理的相似性.同时,浓度分别与振荡的pHmax和pHmin呈现线性关系,也反映了所涉及弱酸盐对该振荡反应影响具有单一性.事实上,这种现象仅与弱酸盐结合和解离H+的能力相关.随着弱酸盐浓度增加,pHmax和pHmin由pKa决定.从图4可见,与山梨酸钾相比,苯甲酸钠使pHmax下降较显著,pHmin上升相对较弱.不难理解,当pKa较大时,BSF体系达到最小pH值受到的抑制越强,相应的pHmin的升高较为显著;同时,该体系中BSF体系达到最大pH值受到的抑制却越弱,相应的pHmax的下降不甚显著(图4a,4b).但对于具有三个羧基的柠檬酸而言,有4种存在型体 H3Cit、H2Cit-、HCit2-和 Cit3-,在本研究的pH值3.25~6.65范围内时,它们两两之间形成缓冲对,H3Cit仅能脱质子,而H2Cit-和HCit2-则皆具有脱质子和结合质子的能力,Cit3-仅能结合质子,因此,它们对pH振荡的缓冲作用比上述一元酸-碱对的缓冲作用更强,这由图4中曲线斜率的比较可以证明.
以图4中各图pHmax和pHmin的差值对浓度作图,得到图5所示的振幅随弱酸盐浓度变化曲线.由图5可见,不同弱酸盐浓度与振幅具有一定的线性关系,随着弱酸盐浓度增加,振幅逐渐下降.柠檬酸对pH振幅抑制最大,其次为山梨酸钾,最后为苯甲酸钠.对图5中不同弱酸盐浓度对振幅影响差异性的解释与图4类似.柠檬酸、山梨酸钾及苯甲酸钠完全抑制pH 振荡的浓度分别为1.0×10-3mol/L、1.6×10-2mol/L和3.0×10-2mol/L.如前所述,弱酸盐对pH振荡的抑制作用与其pKa密切相关,pKa越大,其抑制pH振荡的能力越强[11].
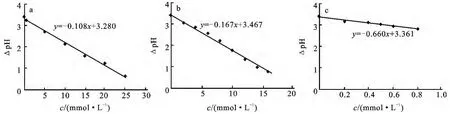
图5 有机弱酸盐浓度对BSF体系pH振幅的影响Fig.5 Influence of the organic weak acid salts with concentration on the amplitude of pH oscillation of BSF system
图6给出了不同浓度有机弱酸盐对BSF体系振荡周期的影响.由图可见,弱酸盐对pH振荡周期具有一定的缩短作用,不同弱酸盐浓度皆与振荡周期具有一定线性关系.从图3所示的pH振荡曲线可见,苯甲酸钠和柠檬酸的加入在加快正反馈过程的同时减缓负反馈过程,因而对振荡周期的影响不大;而山梨酸钾的加入则恰好相反,在加快负反馈过程的同时减缓正反馈过程,因而对振荡周期的影响也不大.同时需指出的是,弱酸盐在一定程度上还具有原盐效应,该效应可由下述方程[12]描述:

图6 有机弱酸盐浓度对BSF体系pH振荡周期的影响Fig.6 Influence of the organic weak acid salts with concentration on period of pH oscillation of BSF system
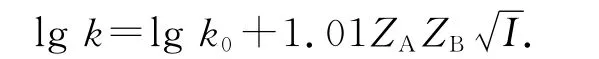
其中ZA和ZB代表反应物A、B所带电荷数,I代表离子强度,k0代表外推至离子强度为0时的反应速率常数.该方程反映了反应速率对离子强度的依赖性.对于BSF体系而言,参与正反馈和负反馈反应的离子均带负电荷,因而离子强度的增大对正、负反馈反应均为正原盐效应,结果导致反应速率均加快,反应周期缩短.因此,从原盐效应而言,弱酸盐的加入将缩短振荡周期.
3 结论
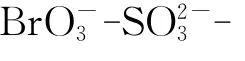
[1]辛厚文.非线性化学[M].北京:中国科学技术大学出版社,1999:1-34.
[2]Poros E,Horvath V,Kurin-Csorgei K,et al.Generation of pH-oscillations in closed chemical systems:method and applications[J].Journal of the American Chemical Society,2011,133(18):7174-7179.
[3]杨珊,侯玉龙,王香爱.三聚氰胺和Vc对BSF体系pH振荡的影响[J].应用化工,2013,42(12):2308-2310,2312.
[4]Tian E,Ma Y,Cui L,et al.Color-oscillating photonic crystal hydrogel[J].Macromolecular Rapid Communications,2009,30(20):1719-1724.
[5]Liu G M,Zhang G Z.Periodic swelling and collapse of polyelectrolyte brushes driven by chemical oscillation[J].Journal of Physical Chemistry B,2008,112(33):10137-10141.
[6]Murase Y,Maeda S,Hashimoto S,et al.Design of a mass transport surface utilizing peristaltic motion of a self-oscillating gel [J].Langmuir,2009,25(1):483-489.
[7]张媛媛.pH 振荡和pH-Ca2+复合振荡反应研究[D].北京:首都师范大学化学系,2009.
[8]Rabai G,Kustin K,Epstein I R.A systematically designed pH oscillator:the hydrogen peroxide-sulfite-ferrocyanide reaction in a continuous-flow stirred tank reactor[J].Journal of the American Chemical Society,1989,111(11):3870-3874.
[9]Aspergěr S.Kinetics of the decomposition of potassium ferrocyanide in ultra-violet light[J].Transactions of the Faraday Society,1952,48(1):617-624.
[10]吉琳,张媛媛,胡文祥,等.碘酸盐-亚硫酸盐-亚铁氰化物反应在CSTR体系中诱导的钙振荡[J].北京理工大学学报,2009,29(7):648-658.
[11]Misra G P,Siegel R A.Ionizable drugs and pH oscillators:buffering effects[J].Journal of Pharmaceutical Sciences,2002,91(9):2003-2015.
[12]Castaneda-AgullóM,Del Castillo L M,Whitaker J R,et al.Effect of ionic strength on the kinetics of trypsin and alpha chymotrypsin[J].Journal of General Physiology,1961,44(6):1103-1120.
