1种细菌型豆豉自然发酵过程中生物胺的变化*
2014-12-16苏悟郑小芬徐睿烜涂婷蒋立文
苏悟,郑小芬,徐睿烜,涂婷,蒋立文
1(湖南农业大学食品科学技术学院,湖南长沙,410128)
2(食品科学与生物技术湖南省重点实验室,湖南长沙,410128)
3(湖南省发酵食品工程技术研究中心,湖南 长沙,410128)
豆豉是经微生物发酵制成的调味副食品,以香诱人、风味独特而深受消费者的真爱。根据制曲发时参与的微生物种类可分为毛霉型、曲霉型、细菌型及脉胞菌型豆豉[1]。水豆豉主要是云、贵、山东一带民间制作的家常豉,其微生物主要是枯草杆菌以及少量的微球菌乳酸菌,其工艺简单,就是将黄豆蒸熟后直接装在袋子或者摊放在稻草上自然发酵,发酵完成后直接拌食。水豆豉自然发酵过程中微生物以细菌为主,发酵过程中易产生生物胺。生物胺是一类含氮低分子质量化合物的总称,按化学结构可分为脂肪族(腐胺、尸胺、精胺、亚精胺)、芳香族(酪胺、苯基乙胺)和杂环类(组胺、色胺)[3]。人体内积累较高数量的生物胺时就会产生毒性作用,其中生物胺中毒性最大的是组胺和酪胺[4]。
发酵食品中过量的生物胺会对机体健康造成不良的影响。YONGMEIL等[5]检测了中国豆酱中的生物胺含量,豆酱中主要含有酪胺、组胺和亚精胺,不同发酵类型品种生物胺有差别,生物胺生成量与样品中氨基酸态氮含量呈现正相关,由此可以看出,可利用的游离氨基酸是微生物代谢产生生物胺的必要条件之一。张建华等[6]检测了纳豆发酵过程中的生物胺,在发酵纳豆样品中检测到亚精胺、精胺、腐胺、酪胺4种生物胺,其中亚精胺的含量占总生物胺的70%左右,与人体有直接毒性的生物胺—酪胺含量低于14 mg/kg,95%以上的生物胺都是对人体没有直接毒性的多聚胺。TANG T等[7]检测了腐乳中生物胺的含量,同时比较了微生物发酵腐乳与酶制腐乳中生物胺含量的差别。腐乳中主要含有色胺、腐胺、组胺和酪胺,其平均含量分别为39.0、34.6、18.2、21.7 mg/kg,β-苯乙胺、亚精胺和精胺含量较低。微生物发酵腐乳中生物胺总量(129.0 mg/kg)低于酶制腐乳(137.7 mg/kg),腐乳中生物胺总量低于安全限量。
目前国内外对于毛霉型、曲霉型豆豉和以纳豆为代表的细菌型豆豉的营养成分和发酵工艺都进行了较深入的研究[8-10],但国内对自然发酵过程中生物胺的变化研究甚少。且目前国际上对食品中的生物胺没有统一的标准,少数国家也只对于食品中的部分生物胺作出了含量限定,现有的各项法规都只对鱼类及其制品中的组胺进行了限定,因此对于食品中生物胺毒性和检测技术的基础研究,和生物胺限量标准的准确评估工作都是具有实际意义的。农村中,许多农户都是将黄豆在自然条件下发酵,直接拌料进行食用,本文以普通黄豆为原料,研究一定温度、一定装载量、不同发酵时间对细菌型豆豉自然发酵过程中生物胺及氨基酸态氮2个指标的影响及其相关性,为食品安全提供参考。
1 材料与方法
1.1 原料与试剂
1.1.1 原料
黄豆、生姜、大蒜、桂皮、八角购于湖南农业大学生鲜市场。
1.1.2 试剂
NaOH,中国医药集团上海化学试剂公司;邻苯二甲酸氢钾,湖南省株洲市化学工业研究所;甲醛,上海化学试剂厂;组胺盐酸盐(himstaminedihydrochloride)、β-苯乙胺(β-phenylethylamine)、酪胺盐酸盐(tyramine hydrochloride)、腐胺(putrescine)、尸胺(cadaverine)、5-羟色胺(serotonin)、精胺(spermidine)、亚精胺(spermine)、色胺盐酸盐(tryptaminehydmchloride),Aldrich 公司;l,7 二氨基庚烷(1,7-diaminoheptane,内标),Acros公司;苯甲胺盐酸盐(benzylamine hydrochloride,内标)、丹磺酰氯(dansylchloride),Sigma公司;甲醇、丙酮,色谱纯;乙醚(重蒸)、正丁醇、氯仿、HCl、三氯乙酸(TCA)、NaCl、NaHCO3、谷氨酸钠(分析纯)、超纯水。
1.2 主要仪器设备
TE212-L电子天平,赛多利斯科学仪器有限公司;HH-数显恒温水浴锅,上海浦东物理化学仪器厂;pHS-25型数显酸度计,中国雷磁仪器有限公司;HJ-1磁力加热搅拌器,江苏医疗仪器厂;DGG-9070A型电热恒温鼓风干燥箱,上海森德实验仪器有限公司;JJ-2组织捣碎匀浆机,上海浦东物理化学仪器厂;高效液相色谱仪HPLC配紫外检测器或二极管阵列检测器;离心机(4 000 r/min),北京医用离心机厂;旋涡混合器 ortex-2genie USA,seinetitic industries,INC,USA;氮气浓缩器(N-EVAPORATOR),OrganomationassociatesINC.USA;Waters高效液相色谱仪e2695配2489紫外检测器,美国沃特斯有限公司;色谱柱 C18柱(250 mm ×4.6 mm,5 μm),GL Sciences;超纯水器B110-B,长沙源科仪实验器材有限公司;微型旋涡混合仪WH-2,上海泸西分析仪器厂有限公司;台式低速离心机TG16,长沙英泰仪器有限公司;多用调速振荡器 HY-4,江苏金坛市医疗仪器厂;氮气吹扫仪MD200,杭州奥盛仪器有限公司;电子分析天平AR2140,奥豪斯国际贸易(上海)有限公司;生化培养箱LRH-300,韶关市泰宏医疗器械有限公司。
1.3 实验方法
1.3.1 细菌型水豆豉制作工艺流程
黄豆→清选→加水浸泡→蒸煮(高压121℃、15 min)→冷却→前发酵(37℃、不同时间)→直接拌料→成品。
1.3.2 试验方法设计
以下操作均为一致的黄豆浸泡条件:泡豆水pH 8.0,泡豆温度常温,豆量∶水量为1∶4(g∶mL),泡豆时间10 h。高压121℃、15 min蒸熟,降温到45℃后,用1 kg的食品级包装袋包装发酵,平整后在包装袋表面扎数个小孔,装豆量800 g,发酵时间72~120 h,发酵温度为37℃,称取发酵样品,按48、72、96、120 h不同发酵时间,测定氨基酸态氮和生物胺含量,每个试验重复3次。
1.4 检测方法
1.4.1 氨基酸态氮的测定[11]
1.4.2 生物胺含量的测定[12]
1.4.2.1 标准溶液的配制及标准曲线制作
各生物胺标准品用0.1 mol/L HCl溶液配制成质量浓度为1 mg/mL的储备液(酪胺盐酸盐和二盐酸组胺需折算掉盐酸盐),分别吸取相同体积的8种生物胺单组分置于同一个容量瓶中,配制成100 mg/L的生物胺标准混合使用液。所有溶液均避光保存于4℃冰箱中。
将混合使用液配制成一定浓度的标准系列,标准系列的浓度为:2.50,5.00,10.00,15.00,25.00,50.00 mg/L。分别吸取0.5 mL生物胺标准系列溶液进行生物胺衍生化。为确定生物胺混合标准品的出峰顺序,配制成40 mg/L的8种单一生物胺标准品,可由生物胺标准品图谱的保留时间来确定每种生物胺。
1.4.2.2 生物胺的提取和衍生
生物胺的提取和衍生依据《GB/T 5009.208-2008食品中生物胺含量的测定》。准确称取绞碎后的豆豉样品10.00 g,置100 mL具塞锥形瓶中,加入20 mL 5%三氯乙酸溶液,和2.0 mL(100 mg/L)内标使用液,混匀,振荡提取60 min,转至50 mL离心管中,3 600 r/min离心10 min,取上清液,置50 mL容量瓶中,连续提取2次,合并上清液,用5%三氯乙酸稀释至刻度,滤纸过滤。
将上述溶液加入适量HaCl至饱和,准确移取该饱和液5.00 mL,置于15 mL离心管中,用0.1 mol/L的NaOH溶液调节pH至12.0,加入5.0 mL正丁醇-三氯甲烷混合液(1+1),涡旋振荡5 min,3 600 r/min离心10 min,取上层有机相,再重复萃取2次,最后一步萃取用分液漏斗分离,合并萃取液,混匀,取3.0 mL萃取液并加入0.2 mL 1 mol/L HCl,混合后40℃水浴下氮气吹干,加入1.0 mL 1mol/L HCl使残留物溶解,待衍生。
取经过提取,净化、萃取后的样液0.5 mL,置于10 mL具塞试管中,加入1.5 mL NaHCO3饱和溶液、1.0 m丹磺酰氯衍生溶液,振荡使混匀。置60℃培养箱中反应30 min,中间振荡2次,取出,分别加入100 μL谷氨酸钠(50 mg/mL饱和 NaHCO3溶液),振荡混匀,60℃中保温15 min。取出,每个试管中加入1 mL超纯水,40℃水浴下用氮气出去丙酮。加入3 mL乙醚,振荡2 min,静置分层后吸取出上层有机相(乙醚层),重复萃取2次,合并乙醚萃取液,氮气吹干,加入1.0 mL甲醇使残留物溶解,振荡混匀,0.22 μm滤膜针头滤器过滤,滤液待测。
样品衍生后,依据《GB/T 5009.208-2008食品中生物胺含量的测定》上机测定。为了使各种生物胺的保留时间缩短,而响应值高,分离度高,改变了色谱条件:将1.5 mL/min流速改为1.0 mL/min,梯度洗脱程序更改情况如表1所示。

表1 梯度洗脱程序表Table 1 Gradient elution program list
1.4.2.3 精密度的测定
取浓度为25.00 mg/L的混合标准溶液衍生样品,平行进样7次,根据测定结果计算相对标准偏差RSD。
1.4.3 对照样品分析
样品来源:购买3个不同品牌商品发酵豆豉测定其中8种生物胺的含量。
生物胺的提取:样品经研磨充分后,取样,用三氯乙酸提取,将试样除脂肪、萃取进行净化,然后进行生物胺的衍生反应,样液待测。
1.4.4 数据处理
所有数据利用Excel表格进行分析。
2 结果与分析
2.1 标准样品和实际样品图谱
40 mg/L单一生物胺衍生物的色谱图如图1、图2所示。
更改了流速和梯度洗脱程序后,浓度为50 mg/L 8种生物胺标准溶液混标的色谱图如图3所示。
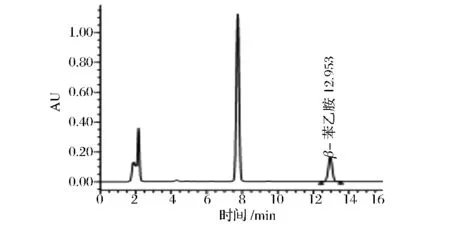
图1 β-苯乙胺衍生物色谱图Fig.1 Beta phenethylamine derivative chromatogram
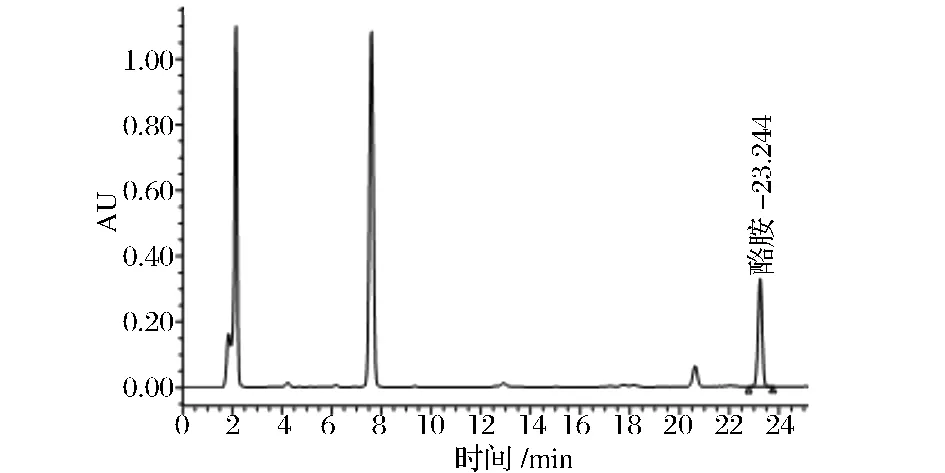
图2 酪胺衍生物色谱图Fig.2 Tyramine derivative chromatogram
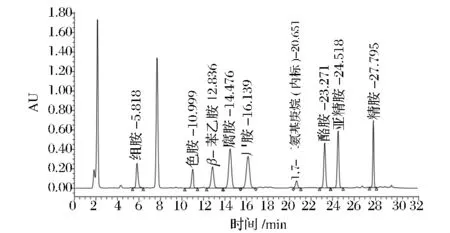
图3 8种生物胺标准色谱图Fig.3 Standard chromatogram of eight kinds of biogenic amine
从图3可以看出,相较国标方法30min所有生物胺衍生物全部洗脱出来,整个梯度洗脱结束为45 min,更改流速和调整洗脱程序后28 min内所有生物胺衍生物被全部洗脱出来,洗脱程序结束时间为32 min,提前了13 min,节省了样品分析时间,在实际检验分析工作中有很重要的意义,且各生物胺衍生物分离效果好,峰形对称,无杂质干扰,因此该流动相梯度是可行的。8种单一生物胺衍生物分析结束后,确定混合标准溶液8种生物胺衍生物的出峰顺序为:组胺、色胺、β-苯乙胺、腐胺、尸胺、酪胺、亚精胺、精胺。
2.2 实验方法的验证
以标准系列溶液的质量(μg)为纵坐标,以各种生物胺和内标的峰面积比为横坐标,绘制标准曲线。8种生物胺的保留时间、回归方程和相关系数见表2。
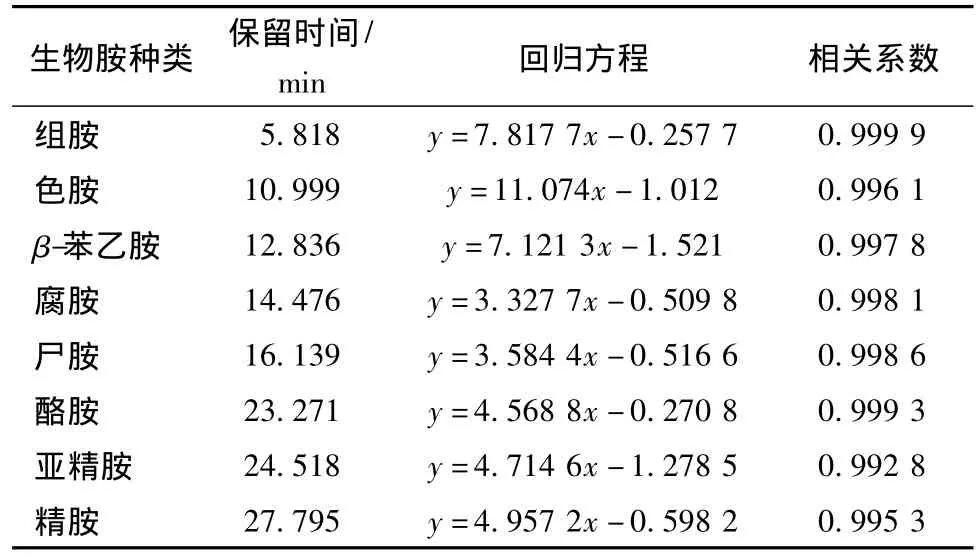
表2 8种生物胺的保留时间、回归方程和相关系数Table 2 Retention time,the regression equation and correlation coefficient of 8 kinds of biogenic amine
检测方法的验证结果见表2。由表2可以看出,8种生物胺的含量在2.5~50 mg/L时,其回归方程R2大于等于0.992 8,可以满足生物胺检测的需求。
2.3 精密度
8种生物胺精度度试验结果见表3。
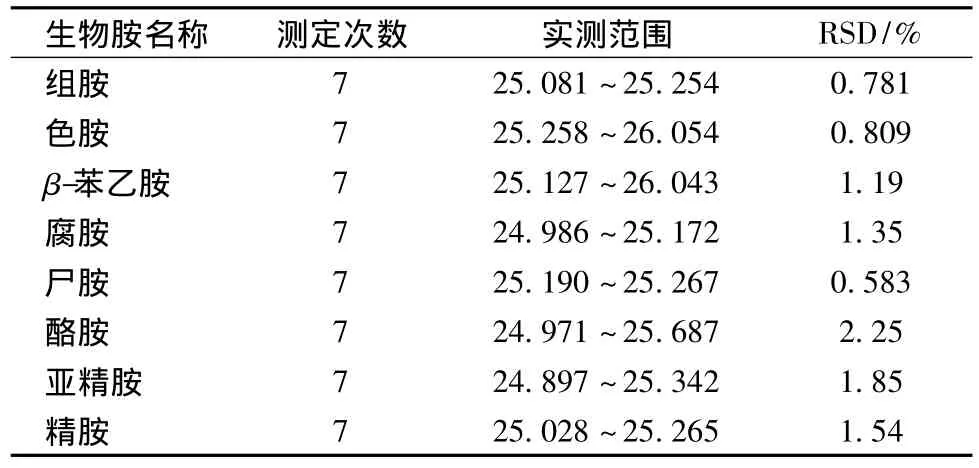
表3 精密度试验结果Table 3 precision test results
2.4 前发酵过程中生物胺的变化

表4 生物胺含量测定结果(37℃)Table 4 Biogenic amine content determination results
上表为最适发酵条件下,选取不同时间梯度对豆豉中生物胺含量的测定结果,从发酵豆豉中共检测到8种生物胺。所有样品中均含有β-苯乙胺含量、尸胺、腐胺、酪胺、亚精胺、精胺。不同样品中生物胺种类及总量均有差异。由表4可知,发酵水豆豉中生物胺含量的显著差异与原料装载量、发酵或储存时间有关。
提取上表中酪胺、尸胺、组胺的数据绘制成折线图,与不同发酵时间氨基酸态氮含量进行比对,见图4~图7。
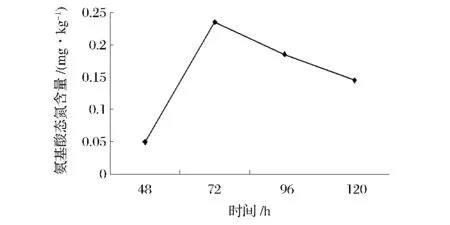
图4 氨基酸态氮含量变化曲线Fig.4 The curves of amino acid nitrogen content
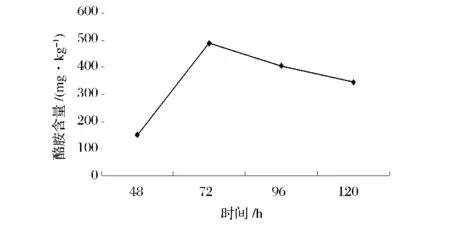
图5 酪胺含量变化曲线Fig.5 The curves of tyramine content
从图4~图7可以发现,从发酵48h起,豆豉中氨基酸态氮含量存在着先大幅增加再缓慢下降的趋势,由于是自然发酵,所以随着时间延长细菌繁殖,可能有脱羧酶的微生物参加,而导致氨基酸态氮出现后期下降的现象。

图6 尸胺含量变化曲线Fig.6 The curves of cadaverine content
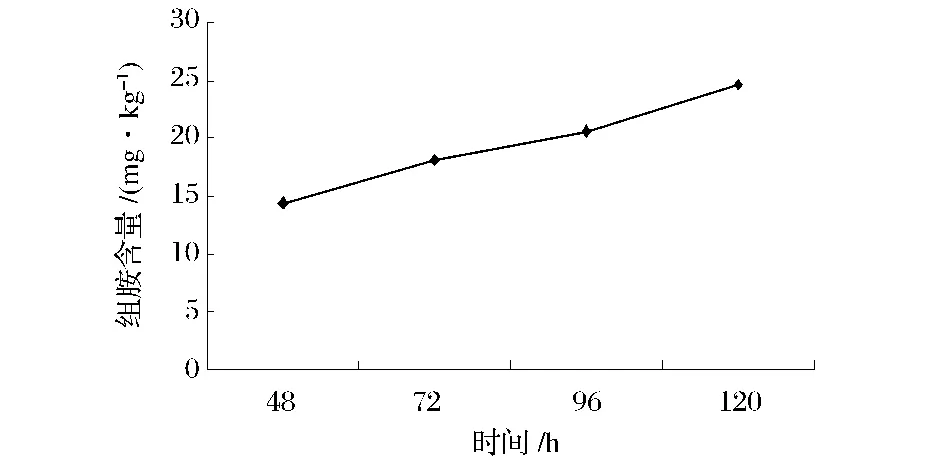
图7 组胺含量变化曲线Fig.7 The curves of histamine content
豆豉中酪胺的含量与氨基酸态氮的含量变化存在着一致性,这也从一定程度上反映了和验证了之前关于氨基酸态氮是生物胺产生的条件之一的说法。发酵初期豆豉中的游离氨基酸含量越高,产生生物胺的可能性就越大。而尸胺含量在发酵72 h随着氨基酸态氮含量的增加达到最高值,之后骤降到相对稳定的较低值。组胺含量从发酵48 h起逐渐上升,虽然没有在含量上明显表现出和氨基酸态氮的一致性,但是其含量的上升可能消耗了游离氨基酸而导致了氨基酸态氮后期的缓慢下降,因此细菌性豆豉自然发酵过程中要控制发酵时间,不然可能会因为组胺生成造成安全隐患。
2.5 对照材料中生物胺的含量
3个样品中生物胺的含量测定结果如表5所示。
根据表5数据可知,所测定样品中均未检出精胺和亚精胺。腊八豆含有4种生物胺,但是含量较低;豆鼓的生物胺含量较低,种类少,油辣椒豆豉生物胺含量最少,仅含有少量的色胺。色胺能够引起高血压,然而许多国家都没有对色胺制定限量标准[14]。
与自然发酵细菌性豆豉工艺比较,豆豉、腊八豆一般采用接种米曲霉或者毛霉发酵,加上均有油炸或炒制工艺和其他配料,这类产品中生物胺的含量较低。

表5 几种发酵豆制品样品中生物胺的含量Table 5 Biogenic amine content in several fermented soy products
3 结论
细菌型豆豉发酵过程中的发酵时间、装载量以及发酵温度对氨基酸态氮的含量有着直接的影响,而氨基酸态氮是生物胺生成的条件之一。豆豉发酵过程中产生的对人体危害较大的组胺和酪胺都与氨基酸态氮的含量有一定相关性,从发酵48 h起,豆豉中酪胺的含量与氨基酸态氮的含量都存在着先大幅增加再缓慢下降的趋势。但是总体来说,细菌型豆豉发酵过程中的生物胺均在国家规定的最大范围之内(组胺50~100 mg/kg,酪胺100~800 mg/kg),理论上对人体不具有生理危害,但也应注意,由于组胺含量一直处于上升趋势,细菌型豆豉自然发酵过程中要控制发酵时间,不然可能会因为组胺生成造成安全隐患,豆豉发酵过程中也应优化其发酵条件来抑制生物胺的生成,进一步降低其含量。
[1] 李祥.细菌型豆豉生产的研究[J].中国调味品,1999(10):14-17.
[2] 尹召军陈卫平张凤英.细菌型豆豉生理活性物质的研究进展[J].中国粮油学报,2011,26(3):119-123.
[3] 李志军 吴永宁 薛长湖.生物胺与食品安全[J].食品与发酵工业,2004,30(10):84-91.
[4] Bodmer S,Imark C,Kneubuhl M.Biogenic amines in foods:histamine and food processing[J].Inflammation Research,1999,48(6):296-300.
[5] LU Yong-mei,CHEN Xiao-hong,JIANG Mei,et al.Biogenic amines in Chinese soy sauce[J].Food Control,2009,20(6):593-597.
[6] 张建华,沈翔,等.纳豆发酵过程中的生物胺[J].上海交通大学学报:农业科学版,2007,25(1):1-5.
[7] TANG T,QIAN K,SHI T,et al.Monitoring the contents of biogenic amines in sufu by HPLC with SPE and pre-column derivatization[J].Food Control,2011,22(8):1 203-1 208.
[8] Arunsri L,Craig D,David O.Volatile compounds in Bacillus-fermented soybeans[J].Journal of the Science of Food and Agriculture.2001,81(5):525-529.
[9] Ashenafi B,Busse M.Growth of Bacillus cereus in fermenting tempeh made from various beans and its inhibition by Lactobacillus plantarum [J].Applied Bacteriology,1991,70(4):329-333.
[10] 蒋立文,夏波.浏阳豆豉发酵微生物的初步研究[J].中国酿造,2004(12):11-12.
[11] 韩雅珊,食品化学实验指导[M].北京:北京农业大学出版社,1992:6-10.
[12] GB/T 5009.208-2008,食品中生物胺含量的测定[S].
[13] 张自强.豆豉纤溶酶高产菌株的筛选及酶学性质的研究[D].南宁:广西大学,2005.
[14] 蔡成岗,张慧,王智敏,等.食品中生物胺及其检测方法研究进展[J].食品研究与开发,2009,30(10):153-156.
