3种食用菌固态发酵降解杜仲半纤维素、纤维素和木质素*
2014-12-16化雪艳李硕唐克华刘文柱
化雪艳,李硕,唐克华,刘文柱
(吉首大学林产化工工程湖南省重点实验室,湖南张家界,427000)
杜仲(Eucommia ulmoides Oliver)又名木棉(木草图经),是杜仲科杜仲属多年生落叶乔木,为我国特有的药用植物,国家二级保护植物[1];其皮和叶中含有多种药用成分,如绿原酸[2]、黄酮[3]、桃叶珊瑚苷[4],以及多种维生素、氨基酸,丰富的铁、钙、钾、锌、镁、硒等矿物元素。具有降血压、抗衰老[5]、增加肝脏细胞活性、恢复肝脏功能、增强肾细胞、通便、促进新陈代谢、增强血液循环、增强机体免疫力等药理作用[6];对高血压,高血脂,心血管病,肝脏病,腰、关节痛,哮喘,肾虚,便秘,脱发,老年综合症均有显著疗效[7],对肥胖治疗亦有效果[8]。
中药材及其药渣[9-10]常被用来栽培食用菌。杜仲早已用来栽培食用菌:杜仲木耳[11]含有绿原酸、京尼平苷、京尼平苷酸等活性成分;杜仲香菇[13-14]口感鲜美,营养成分丰富。杜仲叶渣[19-20]栽培食用菌,生长良好且有较好的生物学效率。本试验以杜仲叶渣及杜仲皮为基质,研究3种食用菌固态发酵对原料的半纤维素、纤维素和木质素的降解规律。
1 材料与仪器
1.1 材料与试剂
金针菇、猴头菇,购自华中农业大学菌种实验中心;平菇,由本研究团队从杜仲叶渣废弃物上自然生长的平菇子实体采取组织分离与纯化制备;杜仲叶渣,张家界市恒兴生物科技有限公司提供;杜仲皮,购自慈利县景龙桥乡药材商。
中性洗涤剂[15],蒽酮试剂,地衣酚试剂[22],均按规范配制。葡萄糖,木糖,HCl、H2SO4等试剂均为分析纯。
1.2 仪器与设备
日立U-3900分光光度计,日立高新技术公司;HH型数显电热恒温水浴锅,江苏金坛金城国胜实验仪器厂;JA2003电子天平,上海良平仪表仪器有限公司;SM-52电热高压灭菌锅,日本 YAMATO公司;BCM-1000A生物洁净工作台,苏净集团安泰公司;YB-1000A型高速多功能粉碎机,上海力箭机械有限公司。
2 实验方法
2.1 菌种制备
固体菌种:PDA培养基[23],将购买或自行组织分离培养的菌种扩繁2次,然后无菌接种到PDA固体培养瓶中。
液体菌种:不加琼脂的PDA培养基,分装于锥形瓶中,灭菌,静置冷却,接种固体菌种,置于摇床以80 r/min的振荡速度培养10 d,再接种到固态发酵培养瓶时滤取菌丝球,然后无菌接种。
2.2 培养基制作
杜仲皮的预处理:杜仲皮洗净,阳光下曝晒2 d,粉碎,过2 mm样品筛,去掉杜仲胶及粗颗粒,备用。
杜仲叶渣烘晒结合干燥至轻捏即碎,轻度粉碎成小块(不必太细)。称取干燥粉碎杜仲叶渣,按照每份杜仲叶渣的总质量,分别加入其总质量分数1%的KH2PO4和Ca(OH)2,2%蔗糖,以及2%的石膏粉,搅拌混匀。加入自来水,反复揉搓搅匀,然后以塑料膜覆盖4~6 h,用前根据经验微调整基质水分在50% ~65%。基质装入洗净烘干的培养瓶中时,要求装料的松、紧适度,每瓶的装料量尽可能保持一致。将装料完毕的培养瓶放入高压灭菌锅,121℃灭菌60 min,冷却后无菌接入菌种。每种食用菌接种30瓶,放入培养室,室温培养。
2.3 固态发酵产物制备
2.3.1 杜仲叶渣发酵产物
对叶渣培养瓶接入菌种进行培养,每日观察菌丝长势,及时挑出杂菌污染培养瓶。待菌丝满瓶(以菌丝穿透瓶内基质底部为标准)后,记录培养时间,隔15天后第1次取样,不同菌种的满瓶培养瓶随机取4瓶,掏出其培养物并置烘箱以50~60℃烘至恒重,粉碎,过40目筛,保存备用。第2次、第3次培养物的取样,分别较前一次的取样时间延长15 d,取样方式及处理方法均同。
2.3.2 杜仲皮发酵产物
将不同菌类的固体菌种和液体菌种分别接入装有杜仲皮基质的培养瓶,观察菌丝长势,及时挑出杂菌污染培养瓶。待菌丝满瓶后,记录培养时间,隔20天后取样,每类菌的液体、固体菌种培养瓶每次各取4瓶,样品的后续处理方法同叶渣发酵培养产物的。
2.4 纤维素、半纤维素和木质素质量分数测定
参照王玉万的定量分析方法,即:中性洗涤剂法、2 mol/L HCl水解法、体积分数72%H2SO4水解法、地衣酚比色定糖法和蒽酮比色定糖法,综合应用。
2.4.1 纤维素、半纤维素质量分数测定的标准曲线
2.4.1.1 木糖标准曲线
称取0.100 g在90℃烘至恒重的木糖,溶于少量蒸馏水,移至1 000 mL容量瓶中,定容,得质量浓度为100 μg/mL的标准液。此标准液以蒸馏水稀释后得到质量浓度分别为 0、5、10、15、20、25 μg/mL 的稀释液。在刻度试管中加入2 mL标准液的稀释液与8 mL地衣酚试剂,混匀后在沸水浴中保持20 min,冷水快速冷却至室温,扫描波长并测定吸光度,同时做空白试验。扫描显示在666 nm处有最大吸收波长。以木糖检测浓度(Y1)为横坐标,666 nm处的吸光度(X1)为纵坐标,作标准曲线,标准曲线方程:Y1=0.045 3 X1+0.052 7,R12=0.999 6。
2.4.1.2 葡萄糖标准曲线
称取0.200 g在90℃烘至恒重的葡萄糖,溶于蒸馏水,移至1 000 mL容量瓶中,定容,制得质量浓度为200 μg/mL的标准液。适当稀释后,得到质量浓度为0、10、20、40、60、80、100、200 μg/mL 的标准稀释液。在试管中加入2 mL标准稀释液,蒽酮试剂8 mL,混匀后放入沸水浴中加热10 min,冷水快速冷却,在620 nm处测定吸光度,同时做空白。以葡萄糖检测浓度(Y2)为横坐标,620nm的吸光度(X2)为纵坐标,作标准曲线,标准曲线方程:Y2=0.005 7 X2+0.118 6,R22=0.999 5。
2.4.1.3 半纤维素、纤维素、木质素质量分数
各种固态发酵样品按步骤处理,参照标准曲线制作方法程序测定其吸光度。依据木糖标准曲线方程计算出糖含量,乘系数0.9即得所测定样品中的半纤维素的质量。依据葡萄糖标准曲线方程计算出糖含量,乘系数0.9即得所测定样品中的纤维素的质量。木质素的质量是根据灰化前、后的质量差所得。
半纤维素、纤维素、木质素在样品中所占的质量计算:
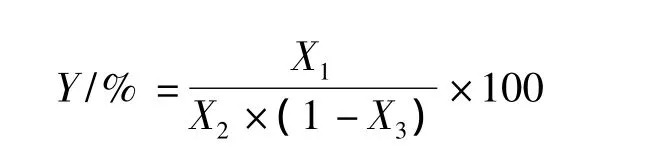
其中:Y,半纤维素(或纤维素,或木质素)含量,mg/g;X1,样品中的半纤维素(或纤维素,或木质素)质量,mg;X2,样品质量,g;X3,样品的含水量,%。每次试验前均测定。
3 结果
3.1 杜仲叶渣及杜仲皮的纤维素、半纤维素和木质素含量
依据公式和标准曲线方程,计算得到杜仲叶渣的半纤维素、纤维素和木质素质量分数分别是:9.83、39.00和164.67 mg/g,即杜仲叶渣中木质素含量>纤维素含量>半纤维素含量,与文献[18]报道一致;杜仲皮的半纤维素、纤维素和木质素含量分别是:32.30、108.31 和44.67 mg/g。
3.2 杜仲叶渣和杜仲皮固态发酵的菌丝满瓶时间
表1为按方法培养的猴头菇、金针菇和平菇发酵杜仲叶渣和杜仲皮的菌丝满瓶时间。

表1 三种食用菌固态发酵杜仲的菌丝满瓶培养时间/dTable 1 Full culturing time of hypha of three edible fungus/d
由表1可看出,3种食用菌在杜仲叶渣上生长时,平菇生长速度最快,金针菇次之,猴头菇满瓶时间最长。经观察,猴头菇在菌丝萌发阶段生长缓慢,但菌丝满瓶后,呈快速生长。液体菌种和固体菌种在杜仲皮基质上生长时,猴头菇液体菌种发酵的菌丝满瓶时间比固体菌种发酵的提高4 d,存在较显著差异;金针菇、平菇的液体菌种与固体菌种发酵的菌丝满瓶时间差距在2 d之内,差异不显著。而一般情况下应该是液体菌种满瓶时间较短,也可能与装瓶时装料较紧,菌种萌发之后因透气性较差导致的吃料或前进速度受到明显影响。
3.3 三种食用菌对杜仲叶渣半纤维素、纤维素和木质素的发酵降解规律
3种食用菌对杜仲叶渣半纤维素、纤维素和木质素的固态发酵降解比较见图1、图2和图3。
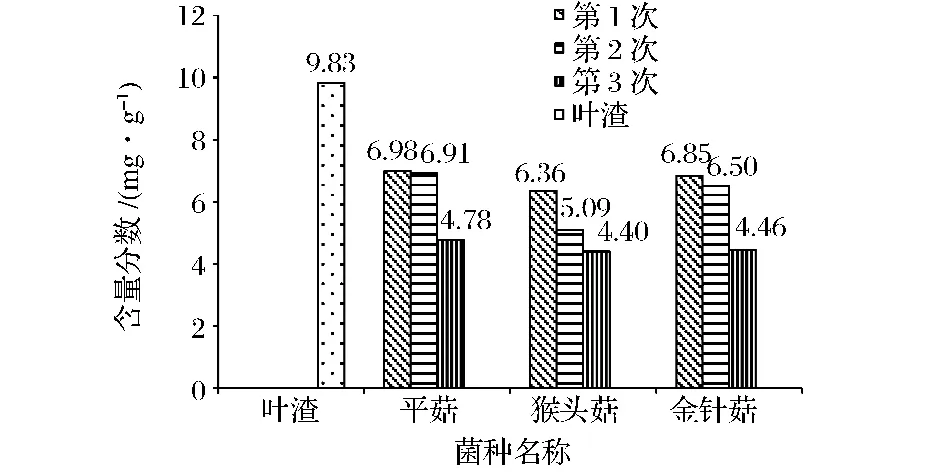
图1 杜仲叶渣培养基质的半纤维素含量变化Table 1 The variation on the mass fraction of hemicellulose in the culture medium of the leaves residual of Eucommia ulmoides Oliver
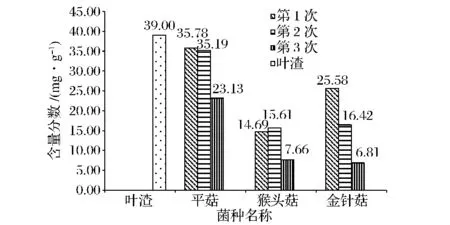
图2 杜仲叶渣培养基质的纤维素含量变化Table 2 The variation on the mass fraction of cellulose in the culture medium of the leaves residual of Eucommia ulmoides Oliver
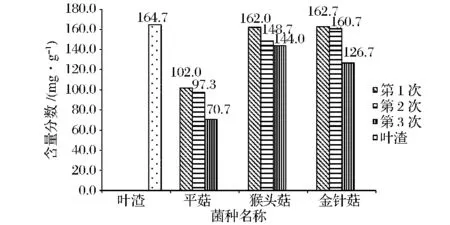
图3 杜仲叶渣培养基质的木质素含量变化Table 3 The variation on the mass fraction of lignin in the culture medium of the leaves residual of Eucommia ulmoides Oliver
从图1、图2及图3可知,杜仲叶渣经过平菇、猴头菇、金针菇的固态发酵,其半纤维素、纤维素和木质素均有一定程度的降解。菌株不同,对半纤维素、纤维素、木质素的降解规律也是不同的[19]。
杜仲叶渣基质经过一段的发酵,其中半纤维素、纤维素和木质素的降解效率如表2所示。

表2 杜仲叶渣基质中半纤维素、纤维素和木质素的降解效率Table 2 The degradation percent of hemicellulose,cellulose and lignin in the culture medium of the leaves residual of Eucommia ulmoides Oliver
对杜仲叶渣半纤维素的降解,随着发酵时间延长,猴头菇呈明显加快态势,而平菇、金针菇对其的降解呈较缓慢变化趋势;3种食用菌中,猴头菇最终可使55.29%的半纤维素降解,其生长利用杜仲叶渣半纤维素的能力稍强于金针菇和平菇的。对杜仲叶渣纤维素的降解利用,猴头菇与金针菇的利用能力基本相当,都能利用80%左右,而平菇只能利用40.70%。对杜仲叶渣木质素的降解利用,平菇远比金针菇和猴头菇的能力强,这与文献[20]报道平菇对木质素有特异性降解结论相符。鞠洪波[21]研究云杉木质素及纤维素降解时发现,金针菇对纤维素的降解能力较强,对木质素的降解能力较弱,这与本试验结果一致。总体而言,猴头菇发酵中优先利用杜仲叶渣的半纤维素和纤维素,金针菇则优先利用杜仲叶渣的纤维素,而平菇是优先利用杜仲叶渣的木质素和纤维素。
3.4 固体菌种和液体菌种对杜仲皮发酵降解的差异
3种食用菌的固体菌种和液体菌种固态发酵降解杜仲皮半纤维素、纤维素和木质素的含量变化情况如图4、图5和图6。

图4 杜仲皮培养基质的半纤维素含量变化Table 4 The variation on the mass fraction of hemicellulose in the culture medium of the bark of Eucommia ulmoides Oliver
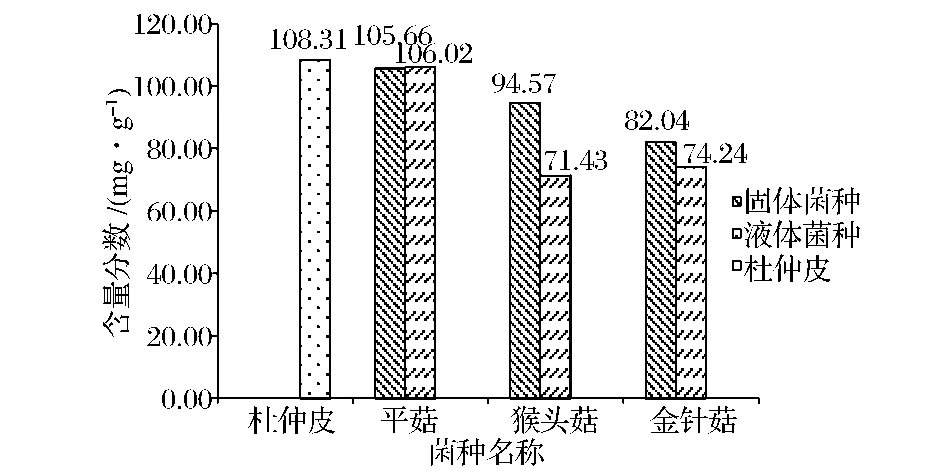
图5 杜仲皮培养基质的纤维素含量变化Table 5 The variation on the mass fraction of cellulose in the culture medium of the bark of Eucommia ulmoides Oliver
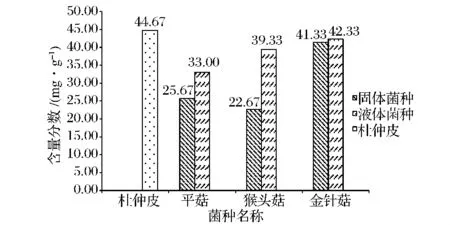
图6 杜仲皮培养基质中木质素含量变化Table 6 The variation on the mass fraction of lignin in the culture medium of the bark of Eucommia ulmoides Oliver
经过每种食用菌不同类菌种的固态发酵,杜仲皮中这三者的含量均有下降。

表3 固体与液体菌种对杜仲皮基质中半纤维素、纤维素和木质素的降解效率/%Table 3 The degradation efficiency of hemicellulose,cellulose and lignin in the culture medium of the bark of Eucommia ulmoides Oliver/%
根据表3可知,固体菌种和液体菌种对半纤维素、纤维素和木质素的降解幅度是有差别的,其中,差别最大的是猴头菇菌种。除木质素外,半纤维素、纤维素基本均是固体菌种的降解率小于液体菌种的,这主要是因为液体菌种流动性强,可覆盖在培养料表面及不同深度。由于杜仲皮中纤维素和木质素所占比例较大,综合而言,平菇、猴头菇固体菌种较适于发酵降解杜仲皮的木质素,猴头菇、金针菇的液体菌种较适于皮的纤维素发酵降解,3种菇的2类菌种对皮的半纤维素发酵降解能力差异较小。
4 结论
3种食用菌以杜仲叶渣和杜仲皮为培养基质进行固态发酵时,平菇对杜仲叶渣和皮的木质素有较特异的降解作用,金针菇、猴头菇对杜仲叶渣和皮的纤维素利用能力较强,而且金针菇、猴头菇的液体菌种发酵降解纤维素的能力显著优于固体菌种的。
有研究表明,食用菌的菌丝体成分与子实体成分相当或者高于子实体[22-23]。因此,杜仲叶渣和皮的半纤维素、纤维素、木质素成分,通过固态发酵有明显的降解,并转化为食用菌菌丝体营养成分,有效地改善了做药材的杜仲叶渣和皮的食用性能。
[1] 潘亚磊,翟远坤,武祥龙.杜仲活性成分的提取及分离纯化方法研究进展[J].化学与生物工程,2012,29(2):1-5.
[2] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:154.
[3] Hye Young Kim,Byung Ho Moonb,Hak Ju Lee,et al.Flavonol glycosides from the leaves of Eucommia ulmoides O.with glycation inhibitory activity[J].Journal of Ethnopharmacology,2004,94(2):227-230.
[4] 郑杰,刘端,赵肃清.杜仲叶桃叶珊瑚苷的酶法提取及其抑菌活性[J]. 中药材,2012,35(2):304-306.
[5] HSIEH C L,YEN G C.Antioxidant actions of Du-zhong(Eucommia ulmoides Oliv.)toward oxidant damage in biomolecules[J].Life Sciences,2000,66(15):1 387-1 400.
[6] 马清钧,王淑玲.常用中药现代研究与临床[M].天津:天津科技翻译出版公司,1995:596-599.
[7] 郭莹.一种新型杜仲冲剂的生产工艺研究[D].西北农林科技大学,2011.
[8] LEE G W,YOON H C,BYUN S Y.Inhibitory effect of Eucommia ulmoidesOliveron adipogenic differentiation through proteome analysis[J].Enzyme and Microbial Technology,2004,25(6/7):632-638.
[9] 张振宇,田雪梅,宋爱荣.六种食用菌中药渣固体发酵及其粗多糖对NK细胞活性的影响[J].食用菌学报,2010,7(3):46-50.
[10] 陈合,赵燕,陈明,等.利用中药渣培养灵芝菌及生物活性成分的研究[J].食品工业科技,2006,27(10):58-60,63.
[11] 一种培育功能型杜仲木耳的生产方法[P].中国.CN102523934A.2012-07-04
[12] 黄文豪,董儒贞,梁臣,等.杜仲枝、叶栽培功能型杜仲香菇技术[J].食用菌,2012(3):45-46.
[13] 卢成英,钟以举.杜仲叶渣栽培食用菌研究初报[J].中国林副特产,2000(3):3-4.
[14] 贺榆霞,贺建超,李峻志,等.杜仲叶渣栽培平菇试验初报[J].陕西农业科学,2011(1):33-34.
[15] GB/T 20806-2006.饲料中中性洗涤纤维(NDF)的测定[S].
[16] 王玉万,徐文玉.木质纤维素固体基质发酵物中半纤维素、纤维素和木素的定量分析程序[J].微生物学通报,1987,14(2):81-84.
[17] 方中达.植病研究方法[M].北京:中国农业出版社,1998:46.
[18] 张康健.中国杜仲次生代谢物[M].北京:科学出版社,2002:278.
[19] 贺新生,杨朝惠,赵春花.三种白腐菌对木质纤维素降解规律的初步研究[J].纤维素科学与技术,2012,20(1):33-38.
[20] Ander P,Eriksson K E.Selective degradation of wood component white-rot fungi[J].Physiol Plant,1977,59(1):239-248.
[21] 鞠洪波.9种食用菌对云杉木质素及纤维素降解的研究[J]. 林业科技,2008,33(3):22-24.
[22] 饶毅萍,陈洁辉,张冰娜.平菇菌丝体与子实体营养成分的分析比较[J].生物学杂志,2011,28(3):94-96.
[23] 席亚丽,王治江,王晓琴,等.荷叶离褶伞子实体、菌丝体和发酵液营养成分比较分析[J].食品科学,2010,31(6):155-157.
